El objetivo de este estudio es describir los hallazgos de una evaluación odontológica protocolizada en pacientes con síndrome de Sjögren primario (SSp) atendidos en las consultas de reumatología de la Comunidad de Madrid.
MétodosEstudio descriptivo multicéntrico en el que se incluyeron pacientes con SSp clasificados según criterios del consenso Europeo-Americano de 2002. Se recogieron datos demográficos, clínicos y serológicos. Se realizó una exploración oral, se recogió el flujo salival y el índice de caries CAOD. Los pacientes rellenaron la escala visual analógica para xerostomía, el cuestionario Oral Health Impact Profile-14 y un cuestionario de salud oral.
ResultadosSe reclutaron 61 pacientes. El 98% fueron mujeres y la edad media fue de 57 años. El 52,5% presentaban signos orales patológicos (flujo salival no estimulado/sialografía/gammagrafía de glándulas salivales) y el 90,2% antiRo/antiLa+. El 92% de los pacientes referían xerostomía y un 61% hiposialia. Treinta y cinco pacientes presentaron lesiones de la mucosa oral. El índice CAOD fue de 16,97±7,93 y la escala visual analógica para la xerostomía fue de 46,69±14,43. Los resultados del Oral Health Impact Profile-14 fueron de 23,13±14,16. Los pacientes con signos orales patológicos obtuvieron una puntuación en el Oral Health Impact Profile-14 significativamente mayor (p=0,03), al igual que los pacientes con afectación del sistema nervioso periférico (p=0,001).
ConclusionesLa prevalencia de xerostomía en esta cohorte de pacientes con SSp fue muy elevada y el 61% de los enfermos presentaron hiposialia. Más de la mitad de los pacientes sufrieron lesiones orales. La salud oral presentó un impacto negativo en la calidad de vida de los pacientes con SSp, siendo mayor en aquellos pacientes con signos orales objetivos patológicos y en los que presentaban afectación del sistema nervioso periférico.
The aim of this study is to describe the findings of a protocolised odontological evaluation of patients with primary Sjögren's syndrome (pSS) treated in rheumatology units in the Community of Madrid.
MethodsMulticentric descriptive study in which pSS patients classified according to the American-European consensus of 2002 criteria were included. We collected the demographic, clinical and serological data of each patient. A complete oral examination was performed and salivary flow and the CAOD caries index were collected. The patients completed the visual analogue scale for xerostomia, the Oral Health Impact Profile-14 questionnaire and an oral health questionnaire.
ResultsSixty-one patients were recruited. Ninety-eight percent were women and the mean age of the patients was 57 years. Pathological oral signs (unstimulated salivary flow/salivary glands sialography/scintigraphy) were present in 52.5% of the patients, anti-Ro/anti-La were positive in 90.2%. Ninety-two percent of the patients reported xerostomia and 61% of the patients suffered from hyposialia. Thirty-five patients presented oral mucosa lesions. CAOD index was 16.97±7.93 and visual analogue scale for xerostomia was 46.69±14.43. The results of the OHIP-14 questionnaire were 23.13±14.16. Patients with pathological oral signs obtained a significantly higher Oral Health Impact Profile-14 score (P=.03). We also found that patients with peripheral nervous system involvement obtained a significantly higher Oral Health Impact Profile-14 score (P=.001)
ConclusionsThe presence of xerostomia in this cohort of pSS patients was high and hyposialia was present in 61% of the patients. Oral lesions appeared in more than half of the subjects. Oral health had a negative impact on the quality of life of patients with pSS, being higher in those with pathological objective oral signs and in those with peripheral nervous system involvement.
El síndrome de Sjögren primario (SSp) es una enfermedad autoinmune sistémica crónica y progresiva, que afecta típicamente a las glándulas lagrimales y salivales, entre otros órganos. Característicamente, se produce una infiltración linfoplasmocitaria glandular que origina la destrucción progresiva de las mismas, con la consiguiente disminución de la secreción inmunomediada y la aparición de sequedad ocular (xeroftalmia) y oral (xerostomía), aunque también afecta a otras mucosas y órganos internos1.
Debido a su cronicidad y progresión, presenta un impacto importante tanto a nivel físico como social y psicológico, aumentando la morbilidad del paciente. La disfunción oral provoca la alteración del gusto, el habla y la alimentación, además de dolor, depresión, fatiga y alteraciones del sueño que conlleva el deterioro del estado de salud global del paciente2.
En la actualidad no existe un protocolo estandarizado de derivación y colaboración multidisciplinar en el manejo y tratamiento de la boca seca en el paciente con SSp. El objetivo del estudio EPOX-SSp fue obtener una caracterización lo más precisa y completa posible del estado bucal del paciente con SSp y del impacto que la salud oral tiene en la calidad de vida de estos enfermos. Describimos las características clínicas de la boca seca, las complicaciones asociadas, el daño acumulado, la gravedad del síndrome seco oral y la calidad de vida del paciente en relación con la salud oral.
Material y métodosDiseñoSe ha realizado un estudio descriptivo de prevalencia multicéntrico, en el que han participado 13 servicios de reumatología hospitalarios de la Comunidad de Madrid y el Departamento de Especialidades Clínicas Odontológicas de la Facultad de Odontología de la Universidad Complutense de Madrid. La fase de reclutamiento se llevó a cabo en el periodo comprendido entre junio de 2015 y marzo de 2017.
PacientesSe incluyeron pacientes con SSp clasificados según los criterios del consenso Europeo-Americano (EA) de 20023 que fueran atendidos en el sistema público y privado de salud de la Comunidad de Madrid en los servicios hospitalarios de la especialidad de reumatología.
Criterios de selecciónLos criterios de inclusión fueron pacientes con SSp que cumplieran los criterios de clasificación EA de 2002, sujetos mayores de edad en plenas facultades para participar en la recogida de datos y pacientes que pudieran acudir a la consulta del servicio de odontología participante.
Selección y reclutamiento de los centrosSe invitó a participar a todos los centros hospitalarios con atención especializada en reumatología de la Comunidad de Madrid.
Reclutamiento de los pacientesSe invitó a participar a aquellos pacientes que cumplían los criterios de inclusión.
CodificaciónSe designó un código para cada centro y otro para cada paciente (el número consecutivo de los pacientes incluidos en cada centro, que iría precedido del código del centro)
Recogida de datosEn cada servicio de reumatología se asignó un responsable del estudio que fue además el encargado de recoger los datos demográficos mínimos y características básicas del SSp de los pacientes. Los datos médicos relacionados con el SSp se obtuvieron de la historia clínica y por entrevista con el paciente durante la consulta.
El reumatólogo entregaba al paciente 2 formularios. El primero recogía los datos demográficos y características del SSp del paciente reclutado y codificado, recogidos por el reumatólogo. El segundo formulario detallaba las instrucciones para que el paciente pudiera ponerse en contacto con la secretaría del servicio de Odontología participante. En este documento, además, se incluían las normas y condiciones que el paciente debía cumplir para acudir de forma correcta a su cita. Completado el estudio, al paciente se le entregaba un informe de salud oral con sus resultados y se le orientaba sobre posibles actuaciones a llevar a cabo. El paciente entregaba el formulario que había rellenado el reumatólogo al odontólogo responsable.
Registro de datosTodos los datos de los pacientes, tanto los aportados por el reumatólogo como los datos referentes al estudio, se almacenaron en una única base de datos en el Departamento de Especialidades Clínicas Odontológicas, Facultad de Odontología, Universidad Complutense de Madrid, bajo la supervisión de la investigadora principal del estudio en este departamento. El análisis estadístico de los datos se llevó a cabo mediante el programa informático SPSS versión 22.0 para Windows. Para ello se ha cumplido con las normas de protección de datos que mantiene la confidencialidad de los datos de acuerdo a la normativa vigente (RD 1720/2007 que desarrolla la Ley Orgánica 15/1999, de 13 de diciembre, de Protección de Datos de Carácter Personal).
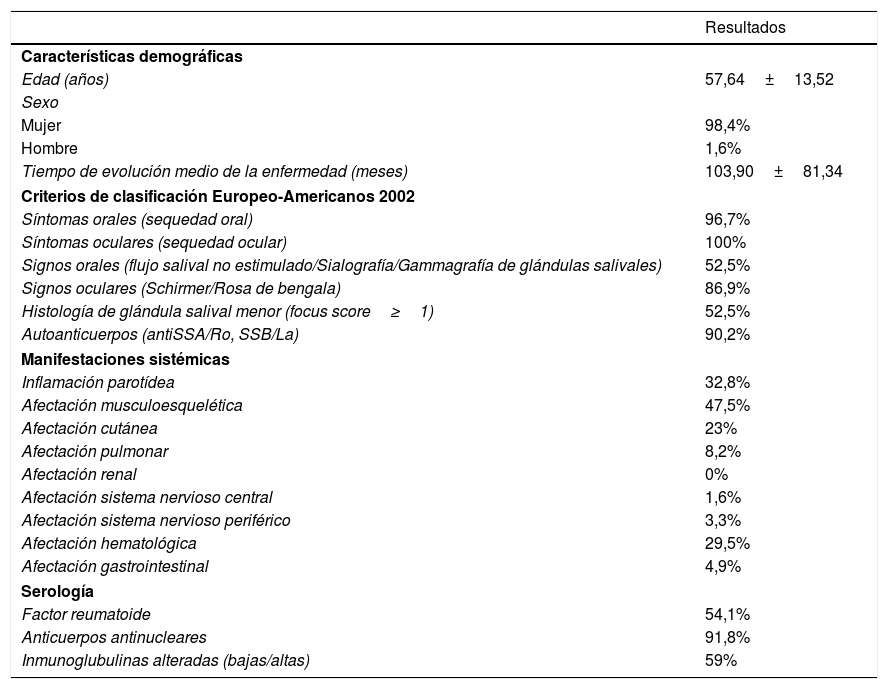
Mediciones y variablesEl objetivo fundamental del estudio es obtener una caracterización lo más precisa y completa posible de manifestaciones orales, complicaciones y calidad de vida del paciente respecto a su salud oral, por lo que no se definió una variable de desenlace principal concreta en este estudio. Para la descripción de los pacientes se incluyeron datos sociodemográficos. También se recogió información sobre los diferentes aspectos que permiten caracterizar la enfermedad, incluyendo la presencia de cada uno de los criterios de clasificación de 2002, la presencia de manifestaciones sistémicas y alguna de las características serológicas más típicas del SSp (tabla 1). El examen protocolizado odontológico que se realizó al paciente se resume en la tabla 2. La recogida del FSNE (flujo salival no estimulado) y FSE (flujo salival estimulado) se realizó en base a las normas establecidas4.
Características sobre el síndrome de Sjögren primario
| Resultados | |
|---|---|
| Características demográficas | |
| Edad (años) | 57,64±13,52 |
| Sexo | |
| Mujer | 98,4% |
| Hombre | 1,6% |
| Tiempo de evolución medio de la enfermedad (meses) | 103,90±81,34 |
| Criterios de clasificación Europeo-Americanos 2002 | |
| Síntomas orales (sequedad oral) | 96,7% |
| Síntomas oculares (sequedad ocular) | 100% |
| Signos orales (flujo salival no estimulado/Sialografía/Gammagrafía de glándulas salivales) | 52,5% |
| Signos oculares (Schirmer/Rosa de bengala) | 86,9% |
| Histología de glándula salival menor (focus score≥1) | 52,5% |
| Autoanticuerpos (antiSSA/Ro, SSB/La) | 90,2% |
| Manifestaciones sistémicas | |
| Inflamación parotídea | 32,8% |
| Afectación musculoesquelética | 47,5% |
| Afectación cutánea | 23% |
| Afectación pulmonar | 8,2% |
| Afectación renal | 0% |
| Afectación sistema nervioso central | 1,6% |
| Afectación sistema nervioso periférico | 3,3% |
| Afectación hematológica | 29,5% |
| Afectación gastrointestinal | 4,9% |
| Serología | |
| Factor reumatoide | 54,1% |
| Anticuerpos antinucleares | 91,8% |
| Inmunoglubulinas alteradas (bajas/altas) | 59% |
Evaluación odontológica protocolizada
| Resultados, % SSp | |
|---|---|
| Anamnesis dirigida | |
| Ingesta de fármacos xerostomizantes (antidepresivos tricíclicos, antiparkinsonianos, fenotiacinas, benzodiacepinas, anticolinérgicos, antihipertensivos, antihistamínicos, antipsicóticos, ansiolíticos, anticonvulsionantes, antiheméticos, anoréxicos, broncodilatadores, descongestionantes, relajantes musculares, analgésicos narcóticos, antiartríticos, sedantes y diuréticos) | 26,7% |
| Presencia de prótesis removible | 21,3% |
| Sensación de boca seca | 91,8% |
| Comienzo de la sensación de boca seca (meses) | 98,26±102,01 |
| Presencia o no de los siguientes síntomas | |
| Glosodinia | 32,8% |
| Disfagia | 39,3% |
| Disgeusia | 34,4% |
| Pruebas complementarias | |
| Pacientes con flujo salival no estimulado disminuido | 60,7% |
| Pacientes con flujo salival estimulado disminuido | 55,7% |
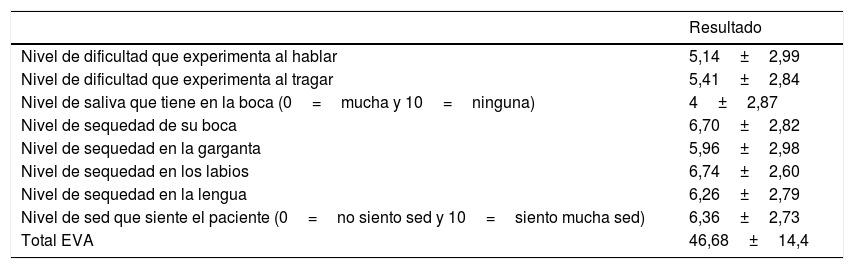
El grado de severidad o intensidad de xerostomía que percibía el paciente se graduó mediante la escala visual analógica (EVA) para la xerostomía, que está compuesta por 8 ítems5; el paciente refleja en esta escala las molestias que le origina la sequedad oral: 0, no origina molestias y 10 le origina las peores molestias imaginables. Las líneas son de 10cm. La suma total del valor de los ítems puede variar entre 0-80. Los valores más cercanos al cero son los más próximos a la normalidad y cuanto más se acercan al 10, indicarán un peor estado del paciente (tabla 3).
Escala visual analógica (EVA) para la xerostomía
| Resultado | |
|---|---|
| Nivel de dificultad que experimenta al hablar | 5,14±2,99 |
| Nivel de dificultad que experimenta al tragar | 5,41±2,84 |
| Nivel de saliva que tiene en la boca (0=mucha y 10=ninguna) | 4±2,87 |
| Nivel de sequedad de su boca | 6,70±2,82 |
| Nivel de sequedad en la garganta | 5,96±2,98 |
| Nivel de sequedad en los labios | 6,74±2,60 |
| Nivel de sequedad en la lengua | 6,26±2,79 |
| Nivel de sed que siente el paciente (0=no siento sed y 10=siento mucha sed) | 6,36±2,73 |
| Total EVA | 46,68±14,4 |
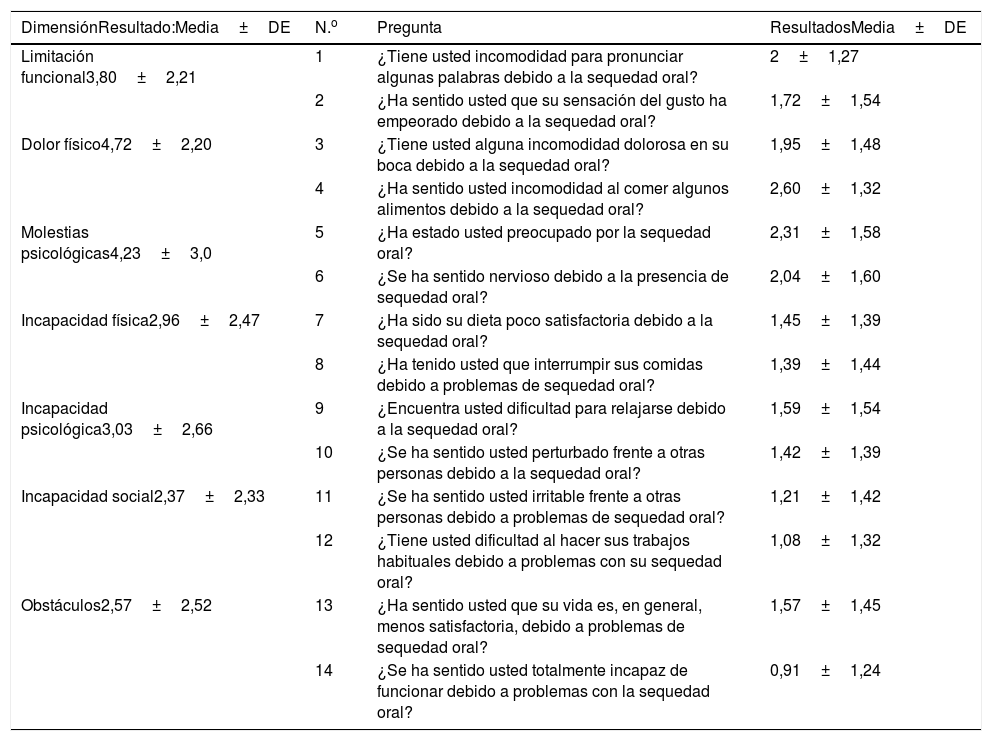
Para conocer el impacto en la calidad de vida en relación con la salud oral se utilizó el índice Oral Health Impact Profile 14 (OHIP-14), versión validada al español6. El OHIP-14 es un cuestionario que se presenta en forma de 14 ítems o preguntas. El paciente debe responder las preguntas en función de la frecuencia en que le suceden; para ello tiene que asignar una puntuación a estas 14 situaciones que se agrupan en 7 dimensiones (con 2 preguntas cada una) denominadas limitación funcional, dolor físico, malestar psicológico, incapacidad física, psicológica, social y minusvalía. Las respuestas se codifican en una escala tipo Likert de 4 puntos estableciéndose como 0=nunca, 1=casi nunca, 2=ocasionalmente/algunas veces, 3=frecuentemente, 4=muy frecuentemente/casi siempre. El valor de la dimensión varía entre 0-8 (suma de los 2 ítems) y el valor total del test varía entre 0-56 (tabla 4). En nuestro caso dicha escala fue aplicada solo al problema que causaba la xerostomía o sensación de boca seca en su salud oral. Los valores más cercanos a 0 nos indican una mejor calidad de vida, por lo tanto la calidad de vida en relación con la salud oral será peor cuanto más se acerque a 56.
Escala OHIP-14 para xerostomía
| DimensiónResultado:Media±DE | N.o | Pregunta | ResultadosMedia±DE |
|---|---|---|---|
| Limitación funcional3,80±2,21 | 1 | ¿Tiene usted incomodidad para pronunciar algunas palabras debido a la sequedad oral? | 2±1,27 |
| 2 | ¿Ha sentido usted que su sensación del gusto ha empeorado debido a la sequedad oral? | 1,72±1,54 | |
| Dolor físico4,72±2,20 | 3 | ¿Tiene usted alguna incomodidad dolorosa en su boca debido a la sequedad oral? | 1,95±1,48 |
| 4 | ¿Ha sentido usted incomodidad al comer algunos alimentos debido a la sequedad oral? | 2,60±1,32 | |
| Molestias psicológicas4,23±3,0 | 5 | ¿Ha estado usted preocupado por la sequedad oral? | 2,31±1,58 |
| 6 | ¿Se ha sentido nervioso debido a la presencia de sequedad oral? | 2,04±1,60 | |
| Incapacidad física2,96±2,47 | 7 | ¿Ha sido su dieta poco satisfactoria debido a la sequedad oral? | 1,45±1,39 |
| 8 | ¿Ha tenido usted que interrumpir sus comidas debido a problemas de sequedad oral? | 1,39±1,44 | |
| Incapacidad psicológica3,03±2,66 | 9 | ¿Encuentra usted dificultad para relajarse debido a la sequedad oral? | 1,59±1,54 |
| 10 | ¿Se ha sentido usted perturbado frente a otras personas debido a la sequedad oral? | 1,42±1,39 | |
| Incapacidad social2,37±2,33 | 11 | ¿Se ha sentido usted irritable frente a otras personas debido a problemas de sequedad oral? | 1,21±1,42 |
| 12 | ¿Tiene usted dificultad al hacer sus trabajos habituales debido a problemas con su sequedad oral? | 1,08±1,32 | |
| Obstáculos2,57±2,52 | 13 | ¿Ha sentido usted que su vida es, en general, menos satisfactoria, debido a problemas de sequedad oral? | 1,57±1,45 |
| 14 | ¿Se ha sentido usted totalmente incapaz de funcionar debido a problemas con la sequedad oral? | 0,91±1,24 |
El test para valorar el manejo habitual de la higiene oral, hábitos relacionados con la salud oral y xerostomía del paciente constó de 16 preguntas (tabla 5). Se calculó el índice CAO, que es el número de dientes cariados (C), ausentes (A) y obturados (O) por individuo en dentición permanente, y el índice CAOD para lo cual se realizó el sumatorio de los valores CAO de cada individuo y se dividió por el total de individuos incluidos en el estudio7. Se consideran solo 28 dientes. Es un índice fundamental que se realiza para cuantificar la prevalencia de problemas dentales en una población.
Manejo de la xerostomía
| Pregunta | Sí (%) | No (%) |
|---|---|---|
| ¿Usted fuma? | 13,1 | 86,9 |
| ¿Usted bebe alcohol? | 21,3 | 78,7 |
| ¿Enjuaga su boca con soluciones salinas o bicarbonato? | 9,8 | 90,2 |
| ¿Cepilla sus dientes al menos 2 veces al día? | 90,2 | 9,8 |
| ¿Sabe cómo cepillar correctamente sus dientes? | 96,7 | 3,3 |
| ¿Utiliza pasta de dientes fluorada? | 80,3 | 19,7 |
| ¿Utiliza una pasta de dientes específica para la xerostomía? | 31,1 | 67,2 |
| ¿Utiliza colutorios? | 50,8 | 49,2 |
| ¿Utiliza colutorios específicos para la xerostomía? | 23 | 77 |
| ¿Utiliza seda dental o cepillos interproximales? | 50 | 50 |
| ¿Toma muchos dulces? | 23,3 | 76,7 |
| ¿Toma bebidas gasificadas o con azúcar: coca-cola, refrescos, zumos…? | 23,3 | 76,7 |
| ¿Acude periódicamente (al menos una vez al año) al dentista? | 73,3 | 26,7 |
| ¿Bebe al menos 2 litros de agua al día? | 70 | 30 |
| ¿Utiliza chicles o caramelos? | 55 | 45 |
| ¿Utiliza algún fármaco para su sequedad oral? | 15 | 85 |
Se utilizó estadística descriptiva para describir las características clínicas y analíticas de los pacientes. Las variables categóricas se muestran en número y porcentaje, y las variables cuantitativas en media±desviación estándar. Se utilizó la t de student para estudiar la asociación entre la puntuación del índice OHIP-14 y las características de los pacientes con SSp. Se han considerado valores estadísticamente significativos p≤0,05. Se utilizó el programa SPSS 22.0 para Windows.
Aspectos éticosEl presente estudio se ha desarrollado de acuerdo con la Declaración de Helsinki y sus revisiones posteriores. Cuando el paciente reunía los criterios de selección, se le proponía su participación y se le explicaba y proporcionaba la hoja informativa correspondiente. Una vez leída esta información y aclaradas las dudas, se le pedía que completara y firmara, por duplicado, el consentimiento informado. Una copia de este se entregaba al paciente y otra se guardaba en el centro del investigador. Todos los pacientes firmaron el consentimiento informado como requisito indispensable para su inclusión en el estudio.
Los servicios de reumatología participantes asignaron un código de identificación a cada uno de sus pacientes para mantener la confidencialidad de los datos de acuerdo a la normativa vigente (RD 1720/2007 que desarrolla la Ley Orgánica 15/1999, de 13 de diciembre, de Protección de Datos de Carácter Personal). El fichero con los datos identificativos de los pacientes se guarda y es responsabilidad del investigador de cada centro. Los responsables del manejo de datos y el comité científico no tienen acceso a ningún dato identificativo de paciente.
El proyecto obtuvo la aprobación del Comité de Ética del centro del investigador principal, en este caso, el Comité de Ética del Hospital de La Paz.
ResultadosDe un total de 67 pacientes reclutados en 13 centros hospitalarios, se han analizado a 61 que cumplían todos los criterios de inclusión. El 52,5% de los pacientes presentaba signos orales patológicos (flujo salival no estimulado/sialografía/gammagrafía de glándulas salivales), el 90,2% de los individuos eran antiRo/antiLa+, el 91,8% ANA+ y el 54% de los sujetos presentaban afectación sistémica. Los datos demográficos, las variables relacionadas con los criterios de clasificación EA de 2002, las manifestaciones clínicas y serológicas de la enfermedad se resumen en la tabla 1.
El 91,8% de los pacientes referían xerostomía, un 60,7% de los pacientes sufrían hiposialia comprobada con el FSNE y un 55,7% comprobada con el FSE. Treinta y cinco pacientes (57,4%) presentaron lesiones de la mucosa oral. La lesión más frecuente fue la candidiasis oral (11,5%), de las lesiones asociadas a candida un 71,3% fueron candidiasis subprótesis. Un 8,2% de los enfermos presentaron lengua fisurada y un 13,1% lesiones traumáticas. El índice CAOD fue 16,97±7,93. La xerostomía percibida por el paciente registrada mediante la EVA de xerostomía fue de 46,68±14,4; los resultados de cada una de las preguntas se describen en la tabla 3. La calidad de vida relacionada con la salud oral registrada mediante el índice OHIP-14 total fue de 23,13±13, las dimensiones con mayor puntuación fueron dolor físico (4,72±2,2) y el malestar psicológico (4,23±3). Las puntuaciones de cada dimensión se han reflejado en la tabla 4. El porcentaje de pacientes que emplea cada uno de los elementos de manejo de la xerostomía se expone en la tabla 5.
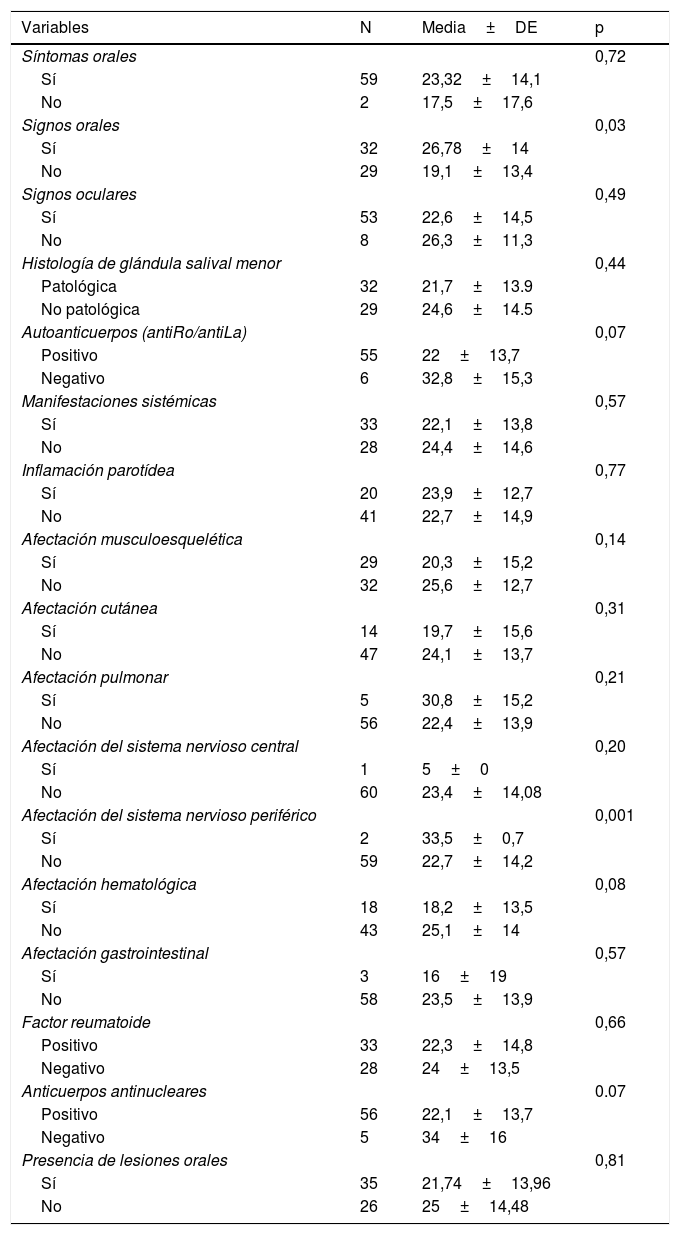
En el análisis de asociación, hemos encontrado que los 32 pacientes con signos orales patológicos obtuvieron una puntuación en el OHIP-14 significativamente mayor (26,78±14) que los pacientes sin signos orales patológicos (19,1±13,4) (p=0,03), al igual que los 2 pacientes con afectación del sistema nervioso periférico frente a los que no tenían esta alteración (33,5±0,7 vs. 22,7±14, p=0,001). Los pacientes seronegativos (6 pacientes antiRo/antiLa y 5 sujetos ANA) tendieron a presentar un OHIP-14 mayor que los seropositivos (antiRo/antiLa 32,8 vs. 22, p=0,07; ANA 34 vs. 22,1; p=0,07). Aunque no alcanzó significación estadística, los pacientes con lesiones orales obtuvieron una puntuación en el índice OHIP-14 menor que los que no presentaban lesiones orales (21,74±13,96 vs. 25±14,48; p=0,81) (tabla 6).
Puntuación del índice OHIP-14 en el paciente con SSp
| Variables | N | Media±DE | p |
|---|---|---|---|
| Síntomas orales | 0,72 | ||
| Sí | 59 | 23,32±14,1 | |
| No | 2 | 17,5±17,6 | |
| Signos orales | 0,03 | ||
| Sí | 32 | 26,78±14 | |
| No | 29 | 19,1±13,4 | |
| Signos oculares | 0,49 | ||
| Sí | 53 | 22,6±14,5 | |
| No | 8 | 26,3±11,3 | |
| Histología de glándula salival menor | 0,44 | ||
| Patológica | 32 | 21,7±13.9 | |
| No patológica | 29 | 24,6±14.5 | |
| Autoanticuerpos (antiRo/antiLa) | 0,07 | ||
| Positivo | 55 | 22±13,7 | |
| Negativo | 6 | 32,8±15,3 | |
| Manifestaciones sistémicas | 0,57 | ||
| Sí | 33 | 22,1±13,8 | |
| No | 28 | 24,4±14,6 | |
| Inflamación parotídea | 0,77 | ||
| Sí | 20 | 23,9±12,7 | |
| No | 41 | 22,7±14,9 | |
| Afectación musculoesquelética | 0,14 | ||
| Sí | 29 | 20,3±15,2 | |
| No | 32 | 25,6±12,7 | |
| Afectación cutánea | 0,31 | ||
| Sí | 14 | 19,7±15,6 | |
| No | 47 | 24,1±13,7 | |
| Afectación pulmonar | 0,21 | ||
| Sí | 5 | 30,8±15,2 | |
| No | 56 | 22,4±13,9 | |
| Afectación del sistema nervioso central | 0,20 | ||
| Sí | 1 | 5±0 | |
| No | 60 | 23,4±14,08 | |
| Afectación del sistema nervioso periférico | 0,001 | ||
| Sí | 2 | 33,5±0,7 | |
| No | 59 | 22,7±14,2 | |
| Afectación hematológica | 0,08 | ||
| Sí | 18 | 18,2±13,5 | |
| No | 43 | 25,1±14 | |
| Afectación gastrointestinal | 0,57 | ||
| Sí | 3 | 16±19 | |
| No | 58 | 23,5±13,9 | |
| Factor reumatoide | 0,66 | ||
| Positivo | 33 | 22,3±14,8 | |
| Negativo | 28 | 24±13,5 | |
| Anticuerpos antinucleares | 0.07 | ||
| Positivo | 56 | 22,1±13,7 | |
| Negativo | 5 | 34±16 | |
| Presencia de lesiones orales | 0,81 | ||
| Sí | 35 | 21,74±13,96 | |
| No | 26 | 25±14,48 |
En este trabajo presentamos una cohorte de pacientes con SSp con xerostomía en un porcentaje muy elevado de los casos (91,8%), hiposialia objetivada en el FSNE en más de la mitad de los individuos, con una intensidad elevada de sequedad oral según la EVA para xerostomía, complicaciones como glosodinia, disfagia y disgeusia en un tercio de los pacientes y lesiones orales en más de la mitad de los sujetos. Este grupo presentó, además, un deterioro dental elevado y un impacto negativo en la calidad de vida en relación con la salud oral objetivados en los índices CAOD y OHIP-14, respectivamente.
La incidencia de xerostomía en la población general se estima alrededor de un 20% en los mayores de 60 años, y es un importante indicador de SSp8. En los pacientes con SSp la prevalencia de xerostomía es mucho mayor que en la población general como muestran los resultados de nuestra cohorte (91,8%). La intensidad de los síntomas orales percibida por el paciente en este estudio se recogió mediante una EVA para xerostomía, obtuvo un valor total medio de 46,69. En un reciente estudio publicado por Fernández-Martínez et al.9 realizado en pacientes con SSp encontraron valores de la EVA total cercanos a los nuestros aunque algo menores (41,5), mientras que en su grupo control sano los valores fueron de 10. Otros trabajos recogen el grado de xerostomía en pacientes con SSp con escalas diferentes, como Tashbayev et al.10 en Oslo, que evalúan el SXI-D (Summated Xerostomia Inventory-Dutch Version). Incluyeron a 34 pacientes con SSp y a un grupo control de 32 pacientes sanos. Demostraron mayor severidad de la sequedad oral de forma significativa en los pacientes con SSp comparado con el grupo control sano (media del score: 12,1 vs. 5,94). El índice de CODS (Clinical Oral Dryness Score index)≥5 fue alcanzado en el 62% de los pacientes con SSp comparado con el 0% del grupo control sano.
Uno de los criterios de clasificación del SSp es la disminución del flujo salival3. La mayoría de los expertos coinciden en considerar como anormal un FSNE<0,1mL/min y FSE<0,7mL/min11, valores que han sido considerados en este trabajo. Más de la mitad de los pacientes en nuestra cohorte presentaron hiposialia (el 60,7% de FSNE y el 55,7% de FSE). El porcentaje de pacientes con FSNE disminuido de nuestro estudio es menor que el publicado en otros trabajos como en el de Enger et al.12 en Noruega, que publica un FSNE disminuido en el 81% de los 177 pacientes con SSp evaluados o del realizado por López-Jornet y Camacho-Alonso13 en España, que encuentran un FSNE disminuido en el 90,91% de los casos de su cohorte (33 pacientes con SSp y 11 con síndrome de Sjögren [SS] secundario). Estas variaciones pueden deberse al tiempo de evolución y al tratamiento que los pacientes están recibiendo para su enfermedad, y posiblemente también, a la hora de la toma del flujo salival, que en muchos casos no está especificada en los trabajos.
La saliva presenta importantes funciones, no solo como agente lubricante, sino también como agente protector de infecciones, caries y alteraciones de la mucosa oral. Aunque en sí misma no es una enfermedad, la xerostomía puede alterar la calidad de vida del paciente14,15. En ocasiones no se manifiesta hasta que se ha perdido el 50% del volumen de saliva normal y suele aparecer cuando hay afectación multiglandular. La sequedad oral prolongada provoca dificultad en el habla, en la masticación, en la deglución16, disminuye la retención de las prótesis dentales removibles17 y provoca lesiones orales. En nuestra cohorte el 32,8% de los pacientes presentó glosodinia, el 39,3% disfagia y el 34,4% disgeusia. En el estudio anteriormente citado de Enger et al.12, describen que el 49% de los pacientes referían disminución del sentido del gusto, el 33,8% experimentaban infecciones fúngicas de repetición y el 64% ronquera. Debido a su sequedad oral, el 35% presentaban miedo a acudir a cenar en las celebraciones, el 62% referían comer despacio, el 85% precisaban levantarse por la noche y el 72% refería dificultad en el habla.
Para medir la calidad de vida en relación con la salud oral en nuestro estudio hemos utilizado el índice de OHIP-14. Este índice es utilizado frecuentemente en odontología para valorar cómo las alteraciones orales y los diferentes tratamientos odontológicos influyen en la calidad de vida de los pacientes. Fue desarrollado por Slade y Spencer en 199718 para valorar si la condición oral es un componente de importancia en los distintos aspectos de la vida de las personas como son las funciones sociales, psicológicas, biológicas, la incomodidad, disfunción e incapacidad. En nuestro caso los valores alcanzados fueron de 23,13. Existen estudios previos que también utilizan esta herramienta como el de Enger et al.12, que publica un valor medio del índice OHIP-14 de 12,7. Este autor encuentra, además, que los pacientes con SSp con altos niveles en este índice dieron puntuaciones más bajas a las 5 subescalas del SF-36 (cuestionario de salud general). En 2017 Rusthen et al.19 observaron que los enfermos con SSp (31 pacientes) presentan de forman significativa menor score olfativo y gustatorio que los controles (33 individuos), mayor disgeusia, ageusia e hipogeusia, anosmia o hipoanosmia, lengua ardiente y halitosis. La media del OHIP-14 fue significativamente mayor en los pacientes con SSp (16,2 vs. 2,7) y se relacionó positivamente con disgeusia, halitosis y lengua ardiente, lo que indica que la afectación oral tiene un marcado impacto en la calidad de vida general de los pacientes con SSp. Estos autores no analizan, como en nuestro caso, la variabilidad en la puntuación del OHIP-14 en función de las distintas características del paciente con SSp. Como ya se ha comentado, en nuestra cohorte hemos encontrado un impacto negativo significativamente mayor en la calidad de vida relacionada con la salud oral medida por OHIP-14 en aquellos pacientes en los que se demuestra hiposialia con la prueba del FSNE y/o afectación glandular según criterios de clasificación EA del 2002 en la sialografía o gammagrafía de glándulas salivales. También hemos encontrado una puntuación significativamente mayor del OHIP-14 en aquellos pacientes con afectación del sistema nervioso periférico.
Existen una serie de signos clínicos asociados a la hiposialia como la presencia de labios secos y fisurados y la lengua saburral, eritematosa y fisurada. Es común también encontrar una saliva de aspecto filante, queilitis angular, lesiones traumáticas y aftas20. En una reciente revisión sistemática realizada por nuestro grupo de trabajo sobre la prevalencia de lesiones orales en pacientes con SS21, se concluyó que los pacientes con SS sufren más lesiones orales que los pacientes sin esta enfermedad. Además, se observó que los tipos de lesiones orales más frecuentemente descritos en la literatura en los pacientes con SS fueron la queilitis angular, la glositis atrófica, las ulceraciones orales recurrentes y las fisuras del dorso lingual. En nuestra cohorte el 57,4% de los pacientes presentaron lesiones orales, siendo las más frecuentes la candidiasis, la lengua fisurada y las lesiones traumáticas, por lo que nuestros resultados coinciden con la mayoría de los estudios.
Una de las principales complicaciones de la hiposialia es un mayor índice de caries. Esto se debe a una disolución de los tejidos duros dentarios por los ácidos producidos por la placa dental. A mayor índice de caries mayor pérdida de dientes y mayor número de dientes restaurados22,23. El índice CAOD medio de los pacientes con SSp de nuestro estudio fue de 16,97, por lo que más de la mitad de los dientes estaban ausentes, cariados o restaurados, lo que muestra un deterioro dental elevado. Un resultado algo mayor que el nuestro encuentran Le Gall et al.24 en 31 pacientes con SSp. El CAOD en su cohorte fue de 20,3, significativamente mayor que en el grupo control. La evaluación dental e índice de caries se recogen en el estudio de Pedersen et al.25 con el índice DMFS (Decayed, Missed, Filled Surfaces, superficies dentales deterioradas, perdidas, rellenas); los pacientes con SSp (20 pacientes) presentaron un índice DMFS significativamente más alto que los controles sanos (20 individuos). Otros autores, Olate et al.26, utilizan el índice de COPD (suma los dientes permanentes cariados, perdidos, obturados, incluyendo las extracciones indicadas, entre el total de individuos examinados) y obtienen un valor de 7 (considerado alto) en sus 35 pacientes con SS. Estas variaciones en el índice CAOD pueden deberse al tiempo de evolución de la enfermedad y a la higiene del paciente. Si comparamos con población adulta sana existen algunos estudios realizados en India y Nepal que muestran cómo el CAOD varía entre 4,49 y 5,1 en población con edades comprendidas entre los 20 y 56 años27,28.
Una de las limitaciones de este trabajo es el tamaño muestral. Dado que no se alcanzaba el número esperado, se comentó con todos los investigadores participantes el ampliar el periodo de inclusión de pacientes establecido inicialmente. Después de ampliar dicho periodo, tampoco se alcanzo el número esperado. Creemos que la dificultad en el reclutamiento se ha debido a la complicación que supone para el enfermo desplazarse a otro centro diferente al centro sanitario de procedencia, teniendo previamente, que ser el propio sujeto el que concertara la cita un día distinto al de su revisión con el reumatólogo. Otra de las limitaciones de este estudio es la ausencia de registro de otras comorbilidades, como la hipertensión arterial o la diabetes mellitus, que hayan podido influir también en la aparición de alteraciones orales como la xerostomía y/o hiposialia y la presencia de lesiones orales.
ConclusionesEn nuestra cohorte de pacientes con SSp de práctica clínica habitual se ha demostrado un elevado porcentaje de pacientes con xerostomía (91,8%) y en el 61% de los individuos se objetivó hiposialia. La mitad de los sujetos presentaron lesiones orales, las más frecuentes fueron las infecciones por cándida, alteraciones linguales y lesiones traumáticas. El desarrollo de una vida cotidiana normal también se vio deteriorado debido a la aparición de dificultad en el habla y en la alimentación de los pacientes. La aparición de caries y pérdida de dientes dio lugar a un índice CAOD elevado. La alteración de la salud oral en estos enfermos tuvo un impacto negativo en las funciones sociales, psicológicas, biológicas y la calidad de vida de los pacientes con SSp como muestra el OHIP-14, impacto que resulta mayor si el paciente presenta hiposialia y/o afectación glandular objetivada en sialografía y/o gammagrafía de glándulas salivales y en pacientes con afectación del sistema nervioso periférico. Creemos, por lo tanto, que la disponibilidad de este grupo homogéneo de pacientes puede facilitar la utilización estandarizada de diferentes herramientas de diagnóstico y de evaluación de la xerostomía en el paciente con SSp, lo que redundará en una mayor uniformidad del manejo multidisciplinar clínico y terapéutico del SSp en los servicios de odontología y reumatología.
FinanciaciónEste proyecto se ha financiado gracias a la Beca SORCOM (Sociedad Madrileña de Reumatología)-MSD convocatoria 2015.
Puntos clave- •
Los pacientes con SSp desarrollan lesiones orales y deterioro dental.
- •
La salud oral presenta un impacto negativo en la calidad de vida de los pacientes con SSp.
Los autores declaran no tener conflictos de interés.
A la Sociedad de Reumatología de la Comunidad de Madrid (SORCOM).
Gonzalo Hernández Vallejo (Departamento de Especialidades Clínicas Odontológicas, Facultad de Odontología, Universidad Complutense de Madrid), M. Ángeles Blázquez (Hospital Severo Ochoa, Madrid), Cristina Bohórquez (Hospital Príncipe de Asturias, Madrid), Gema Bonilla (Hospital La Paz, Madrid), Tatiana Cobo (Hospital Infanta Sofía, Madrid), Jesús García Vadillo (Hospital La Princesa, Madrid), Jorge Juan González Martín (Hospital San Chinarro, Madrid), Oscar Illera (Hospital Infanta Sofía, Madrid), Leticia Lojo (Hospital Infanta Leonor), Francisco Javier López Longo (Hospital Gregorio Marañón), Sheila Melchor (Hospital Doce de Octubre), María Teresa Navío (Hospital Infanta Leonor), Laura Nuño (Hospital La Paz), María Carmen Ortega (Hospital Infanta Elena), Diana Peiteado (Hospital La Paz), Sheila Recuerdo (Hospital Fundación Jiménez Díaz), Patricia Richi (Hospital Infanta Sofía, Madrid), Ana Rodríguez (Hospital Ramón y Cajal, Madrid), Martina Steiner (Hospital Infanta Sofía, Madrid), Marta Valero (Hospital San Chinarro, Madrid).