Con la instauración de las clínicas de artritis de reciente comienzo se valoran pacientes cada vez más precozmente en el curso de su enfermedad, por lo que un porcentaje importante de éstos aún no puede clasificarse dentro de un diagnóstico específico según los criterios de clasificación del American College of Rheumatology (ACR). En estos pacientes con artritis indiferenciada (AI) incluso más importante que establecer un diagnóstico es distinguir entre aquéllos que desarrollarán una artritis persistente y/o erosiva y, por tanto, serán candidatos a recibir tratamiento precoz con fármacos modificadores de la enfermedad (FAME) aunque no cumplan los criterios de clasificación del ACR, y los que tendrán un cuadro autolimitado. Los marcadores serológicos junto con las características clínicas en el momento de la presentación, integrados en modelos clínicos predictivos, son los instrumentos con los que actualmente cuenta el clínico para poder identificar a estos pacientes. Algunos estudios han demostrado las ventajas del tratamiento precoz en la AI.
With the establishment of early arthritis clinics, patients can now be increasingly attended early in the course of their disease. This means that a significant proportion of these patients cannot be classified into a specific diagnosis using the traditional American College of Rheumatology (ACR) classification criteria. In these patients with undifferentiated arthritis (UA), even more important than assigning a diagnosis is the need to distinguish between patients who will develop a persistent and/or erosive disease and will be candidates for prompt treatment with disease-modifying antirheumatic drugs (DMARD), and patients in whom the disease is self limiting. Serologic markers in combination with clinical features at presentation, integrated into predictive models, are the tools currently available to the clinician for identifying these patients. Several studies have demonstrated the advantages of early treatment in UA.
Con el término de artritis indiferenciada (AI) se denomina a los pacientes con artritis que aún no pueden clasificarse dentro de un diagnóstico específico de acuerdo con los criterios de clasificación del American College of Rheumatology (ACR). Aunque esta denominación engloba también a pacientes en los que la artritis no es necesariamente de inicio, ha sido a raíz de la puesta en marcha de las clínicas de artritis de reciente comienzo cuando esta entidad ha ido adquiriendo progresivamente mayor relevancia. En la práctica clínica se ha visto que la artritis de reciente comienzo muy a menudo es indiferenciada1–18 y que los criterios de clasificación del ACR, en particular los criterios propuestos para la artritis reumatoide (AR), poseen poco valor discriminatorio durante los primeros meses de la enfermedad5,8,11,18–21.
La artritis de reciente comienzo puede evolucionar a una AR o a otra enfermedad articular inflamatoria bien definida, resolverse espontáneamente o persistir indiferenciada. Esta variabilidad en su evolución justifica la necesidad de desarrollar instrumentos de evaluación que permitan distinguir precozmente entre aquellos pacientes con AI que desarrollarán una artritis persistente y/o erosiva y los que tendrán un cuadro autolimitado.
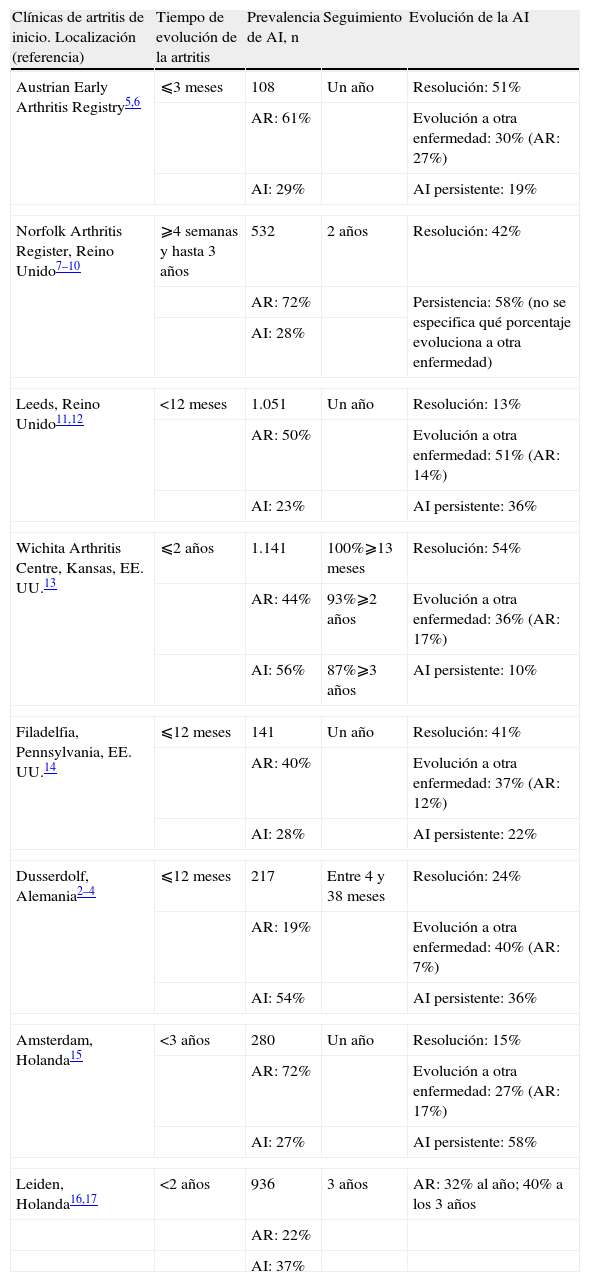
Prevalencia de la artritis indiferenciadaLa prevalencia de la AI en las cohortes de artritis de reciente comienzo varía entre un 23 y un 56% de los casos2–18. Esta variabilidad se explica en parte porque los criterios de inclusión de cada cohorte son muy heterogéneos y no hay un consenso en cuanto a la definición del tiempo de evolución. La mayoría de los autores limitan el término de artritis de reciente comienzo a los pacientes con menos de un año de evolución a partir del primer cuadro de inflamación articular clínicamente detectable, aunque hay trabajos que incluyen a pacientes con hasta 3 años de evolución. En la tabla 1 se resumen las características demográficas y los criterios de inclusión de las principales cohortes de artritis de reciente comienzo y se especifica la prevalencia de AI.
Prevalencia y pronóstico de la artritis indiferenciada en las principales cohortes de artritis de reciente comienzo
| Clínicas de artritis de inicio. Localización (referencia) | Tiempo de evolución de la artritis | Prevalencia de AI, n | Seguimiento | Evolución de la AI |
| Austrian Early Arthritis Registry5,6 | ⩽3 meses | 108 | Un año | Resolución: 51% |
| AR: 61% | Evolución a otra enfermedad: 30% (AR: 27%) | |||
| AI: 29% | AI persistente: 19% | |||
| Norfolk Arthritis Register, Reino Unido7–10 | ⩾4 semanas y hasta 3 años | 532 | 2 años | Resolución: 42% |
| AR: 72% | Persistencia: 58% (no se especifica qué porcentaje evoluciona a otra enfermedad) | |||
| AI: 28% | ||||
| Leeds, Reino Unido11,12 | <12 meses | 1.051 | Un año | Resolución: 13% |
| AR: 50% | Evolución a otra enfermedad: 51% (AR: 14%) | |||
| AI: 23% | AI persistente: 36% | |||
| Wichita Arthritis Centre, Kansas, EE. UU.13 | ⩽2 años | 1.141 | 100%⩾13 meses | Resolución: 54% |
| AR: 44% | 93%⩾2 años | Evolución a otra enfermedad: 36% (AR: 17%) | ||
| AI: 56% | 87%⩾3 años | AI persistente: 10% | ||
| Filadelfia, Pennsylvania, EE. UU.14 | ⩽12 meses | 141 | Un año | Resolución: 41% |
| AR: 40% | Evolución a otra enfermedad: 37% (AR: 12%) | |||
| AI: 28% | AI persistente: 22% | |||
| Dusserdolf, Alemania2–4 | ⩽12 meses | 217 | Entre 4 y 38 meses | Resolución: 24% |
| AR: 19% | Evolución a otra enfermedad: 40% (AR: 7%) | |||
| AI: 54% | AI persistente: 36% | |||
| Amsterdam, Holanda15 | <3 años | 280 | Un año | Resolución: 15% |
| AR: 72% | Evolución a otra enfermedad: 27% (AR: 17%) | |||
| AI: 27% | AI persistente: 58% | |||
| Leiden, Holanda16,17 | <2 años | 936 | 3 años | AR: 32% al año; 40% a los 3 años |
| AR: 22% | ||||
| AI: 37% | ||||
AI: artritis indiferenciada; AR: artritis reumatoide.
Tanto las cohortes de artritis de reciente comienzo de Europa como las de Norteamérica ponen de manifiesto que la AI es muy frecuente y que los reumatólogos ven casi tantas AI de reciente comienzo como AR de inicio.
Cómo mejorar el diagnóstico diferencial en los pacientes con artritis de reciente comienzo: papel de las pruebas de laboratorio, de la tipificación de antígenos de histocompatibilidad y de las técnicas de imagen en la valoración de la artritis indiferenciadaEl porcentaje de artritis de reciente comienzo que se clasifica como AI depende en parte de que el estudio diagnóstico realizado sea más o menos completo. Se sabe que una proporción de los enfermos con AI acabará cumpliendo criterios de una enfermedad identificable, generalmente una AR o una espondiloartropatía. Su detección precoz podría mejorarse con la introducción en la evaluación inicial de estos pacientes de algunas pruebas complementarias añadidas a los exámenes básicos habituales. Aunque no hay un consenso sobre cuál debe ser el estudio mínimo que debe realizarse antes de clasificar a una artritis como indiferenciada, éste debería incluir al menos anamnesis detallada, exploración física meticulosa, pruebas analíticas (incluido un hemograma), parámetros bioquímicos estándares, determinación del factor reumatoide (FR) y de los anticuerpos antinucleares junto con sus especificidades, así como un estudio radiológico (incluida una radiografía de pelvis en busca de sacroilitis si se sospecha una espondiloartropatía).
Papel de las pruebas de laboratorioLos anticuerpos contra péptidos cíclicos citrulinados (anti-CCP) deben incluirse en la evaluación inicial de los pacientes con AI. Estos anticuerpos tienen una sensibilidad para el diagnóstico de la AR similar a la del FR, aunque tienen mayor especificidad y sólo aparecen entre el uno y el 3% de las personas sanas22. Al igual que el FR, los anti-CCP pueden preceder a la aparición de la enfermedad durante varios años y su presencia se relaciona con la gravedad de ésta. Los anti-CCP y el FR coexisten en la mayoría de los pacientes, por tanto, su determinación en los pacientes con FR positivo sólo tiene una utilidad pronóstica22,23. En cambio, son especialmente útiles para confirmar la sospecha diagnóstica en los enfermos con AR seronegativa, si bien cabe destacar que en este grupo sólo son positivos en alrededor de un tercio de los casos24–29.
La utilidad diagnóstica de otros anticuerpos dirigidos contra proteínas citrulinadas, como los anticuerpos antivimentina citrulinada, los anticuerpos antifilagrina citrulinada de rata o los anticuerpos dirigidos contra fibrinógeno citrulinado, de momento no parece ser muy superior a la utilidad diagnóstica que ofrecen los anti-CCP y, además, su producción es técnicamente más compleja. Los anticuerpos antivimentina citrulinada parecen identificar a pacientes con mayor potencial de enfermedad erosiva30.
Un porcentaje de los enfermos con AI de reciente comienzo (en particular los pacientes con oligoartritis) suele tener una artritis reactiva, a pesar de no tener un antecedente claro de infección. Así lo demuestran varios estudios que han documentado datos de exposición bacteriana previa mediante cultivos, serologías o pruebas de ADN entre el 30 y el 50% de los casos de oligoartritis indiferenciada de reciente comienzo31–33. En este grupo de pacientes, es obligatorio investigar de forma exhaustiva el antecedente de infección mediante cultivos (heces, orina, exudado uretral, exudado faríngeo y de cualquier supuesto foco infeccioso) y serologías.
Papel de la tipificación de antígenos de histocompatibilidadLos genes involucrados en el desarrollo de AR y otras enfermedades autoinmunes poseen en términos generales un bajo valor predictivo del desarrollo de enfermedad. Por esta razón, la tipificación de antígenos de histocompatibilidad (HLA) no suele realizarse de forma sistemática en la evaluación inicial de los pacientes con AI de reciente comienzo. No obstante, puede ser útil estudiar los alelos HLA de clase ii (DR y DQ). Se ha demostrado que la presencia del epítopo compartido (secuencia repetida de aminoácidos en la tercera región hipervariable del alelo DRB1) duplica el riesgo de que se desarrolle una AR en los estudios poblacionales, una asociación que es también más intensa en individuos con anticuerpos anti-CCP34,35. La asociación de los alelos HLA-DRB1 a la AR es hasta la fecha la única asociación sólidamente demostrada en todos los grupos étnicos estudiados.
Más recientemente, se ha sugerido otro modelo en el que los loci DQB1 y DQA1 determinan la susceptibilidad a AR, mientras que determinados alelos DRB1 que codifican la secuencia DERAA (por presentar ese dominio aminoacídico común en la región hipervariable 3) protegen del desarrollo de AR34,36–38. En este modelo de protección de la AR, conocido como «modelo RAP» (rheumatoid arthritis protection), los alelos que predisponen a la AR son DQB1*0301, DQB1*0302, DQB1*0303, DQB1*0304, DQB1*0401 y DQB1*0402 combinados con DQA1*0301 o DQA1*0302 y DQB1*0501 combinado con DQA1*0101 o DQA1*0104.
Estos estudios demuestran que la tipificación HLA, incluidos el epítopo compartido, los alelos DQ y la secuencia DERAA, puede ser de utilidad en la AI de reciente comienzo.
Por último, cabe destacar que en los pacientes en los que se sospecha una espondiloartropatía se suele determinar el HLA-B27, aunque no se ha demostrado de forma concluyente que esta prueba incremente la rentabilidad diagnóstica39.
Papel de las pruebas de imagenTanto la ecografía como la resonancia magnética (RM) y la tomografía computarizada han demostrado mayor sensibilidad que la radiografía simple en la detección precoz de erosiones40. Además, la RM permite la detección precoz de edema óseo, que se ha demostrado que es un marcador predictivo de la aparición de erosiones. Histológicamente, el edema óseo se corresponde con áreas de osteítis40. Asimismo, la RM puede tener un papel importante en el diagnóstico de la AR y en el diagnóstico diferencial de las AI de reciente comienzo, si bien estas 2 aplicaciones están aún pendientes de validación.
Algunos autores plantean el interrogante de si la detección de alteraciones articulares evaluadas por RM de la mano puede incluirse como criterio del ACR para la AR. De hecho, hay al menos 2 estudios24,41 que han demostrado que su inclusión como criterio de imagen incrementa de forma significativa la sensibilidad de los criterios del ACR. Sugimoto et al41 propusieron como criterio diagnóstico de AR la presencia de hipercaptación articular bilateral en carpos y/o metacarpofalángicas y/o interfalángicas proximales que evalúa la RM de manos tras la administración de contraste paramagnético. En este estudio, realizado en 50 pacientes con artralgias de manos, este criterio de imagen mostró una especificidad del 94% y una sensibilidad del 96% para confirmar el diagnóstico de AR, de manera que su inclusión incrementó la sensibilidad de los criterios del ACR del 77 al 96%.
Nuestro grupo, en un estudio en el que comparamos la utilidad diagnóstica de los anti-CCP y de la RM para confirmar el diagnóstico de AR en una cohorte de pacientes con artritis de reciente comienzo que cumplían al menos 3 de los 4 criterios clínicos del ACR, en ausencia de FR, nódulos o erosiones, propuso como criterio diagnóstico de AR la presencia de sinovitis con erosiones óseas o edema óseo en la RM de manos (carpos, metacarpofalángicas o interfalángicas proximales)24. La aplicación de este criterio mostró una especificidad del 78% y una sensibilidad del 100% para el diagnóstico de AR.
Por otra parte, es posible que la RM sea también de utilidad en el diagnóstico diferencial de las AI de reciente comienzo. En otro trabajo hemos demostrado que el estudio detallado de las alteraciones anatómicas y su localización (sinovitis, entesitis, patrones de edema óseo y de afección tendinosa) en la RM de mano permite diferenciar entre AR y artropatía psoriásica en fases tempranas de la enfermedad (tiempo de evolución inferior a un año), ya que estas enfermedades presentan diferentes patrones de lesión articular42.
Aunque parece prometedor, el papel de la RM en el diagnóstico de la AR y en el diagnóstico diferencial de las AI de reciente comienzo es aún incierto, por lo que no se puede recomendar su utilización sistemática con este fin. No obstante, esta técnica puede ser útil en casos seleccionados cuando se considere que su información puede ser de relevancia clínica.
Presentación clínica de la artritis indiferenciada: características generalesAl comparar pacientes con AI con pacientes con AR de inicio se ha visto que la AI a menudo inicia de forma más aguda que la AR. El número de articulaciones afectadas (en particular el número de articulaciones tumefactas) habitualmente es menor que en la AR, hay menor deterioro de las articulaciones de las manos y menor afectación articular simétrica. La oligoartritis y la monoartritis, sobre todo de grandes articulaciones, es frecuente y aparece hasta en un 40% de los pacientes en el momento del inicio y tras un seguimiento más prolongado. Además, la duración de la rigidez articular matutina a menudo es menor y la incapacidad funcional evaluada mediante el HAQ (Health Assessment Questionnaire 'Cuestionario de evaluación de la salud') o mediante la fuerza de prensión suele ser significativamente menor3,5,9,13,14,18. La respuesta de fase aguda, medida mediante la velocidad de sedimentación globular o mediante la proteína C reactiva, puede ser parecida o inferior a la respuesta observada en la AR.
Si se considera únicamente a los pacientes con AI persistente, los datos disponibles indican que, en términos generales, esta entidad parece tener un mejor pronóstico que la AR. Estos pacientes tienen una afectación articular crónica y un deterioro de la capacidad funcional, pero no parecen tener una enfermedad erosiva significativamente progresiva. En comparación con los pacientes con AR de duración parecida, los enfermos con AI tienen menos articulaciones afectadas, menos probabilidades de presentar erosiones radiológicas, necesitan con menos frecuencia tratamiento con glucocorticoides o fármacos modificadores de la enfermedad (FAME), presentan una mejor capacidad funcional evaluada mediante el HAQ y menores tasas de invalidez laboral1.
Pronóstico de la artritis indiferenciadaEl pronóstico en los pocos estudios que aportan datos específicos sobre la evolución de la AI demuestra que del 13 al 54% de los pacientes entra espontáneamente en remisión, del 27 al 51% de los enfermos evoluciona a una AR o a otra enfermedad articular inflamatoria bien definida de acuerdo con los criterios del ACR y del 19 al 58% de los pacientes mantiene una actividad persistente de la enfermedad, pero continúa siendo una AI (tabla 1)2–18. Como se puede comprobar, la variabilidad en los porcentajes es muy alta, lo que se explica debido a la distinta composición de las cohortes (fundamentalmente porque algunas incluyen también pacientes con monoartritis) y debido a diferencias en el tiempo de seguimiento (la proporción de AI disminuye conforme aumenta la duración de la enfermedad, porque al final se desarrolla una artritis clasificable en parte de los pacientes con AI). Con todo, es importante destacar que en la mitad de las series5–10,13,14 entre un 40 y un 50% de las AI entra en remisión espontáneamente, por lo que muchos autores confieren a esta entidad un pronóstico relativamente benigno.
En aquellos casos en los que la AI cumple criterios de una enfermedad identificable, se ha visto que la AR es el diagnóstico final más frecuente durante el seguimiento en los pacientes con poliartritis (entre un 7 y un 40% de los casos de AI evoluciona a una AR definida durante el primer año de evolución), mientras que en aquéllos con afección oligoarticular el diagnóstico más frecuente es el de espondiloartropatía. Respecto a la monoartritis indiferenciada, un estudio reciente43 ha puesto de manifiesto que entra en remisión en el 50% de los casos, generalmente durante el primer año de evolución y tras una o varias infiltraciones con glucocorticoides; en el 50% restante persiste como monoartritis indiferenciada o progresa a oligoartritis o a poliartritis; siendo las espondiloartropatías y la AR los diagnósticos finales más frecuentes durante el seguimiento.
Como ya se ha comentado con anterioridad, la pregunta fundamental a la que se enfrenta el clínico cuando atiende a pacientes con AI se relaciona con la determinación del pronóstico y, en particular, si la artritis del paciente remitirá o persistirá, siendo menos importante la cuestión de si acabará cumpliendo o no los criterios de AR o de otra artritis definida en el futuro, puesto que esta distinción no tiene ninguna trascendencia a la hora de decidir si se tiene que administrar tratamiento con FAME44 o no.
En los últimos años los reumatólogos han aprendido que la AR produce daño articular y erosiones desde los primeros meses de evolución. Hay pruebas suficientes que demuestran que si se espera a que un paciente cumpla los criterios de clasificación de AR para iniciar un tratamiento con FAME, para entonces ya se habrá producido un daño articular irreversible. Por este motivo es mucho más importante predecir la persistencia de la artritis que determinar quién cumplirá alguna vez los criterios del ACR para AR. Por otra parte, la urgencia por iniciar el tratamiento no es una justificación para tratar de forma innecesaria a un porcentaje significativo de enfermos con un cuadro que va a autolimitarse.
Factores predictivos de actividad persistenteLos estudios de cohortes de artritis de reciente comienzo, incluidas AR y AI, han identificado varias características clínicas y varias características de laboratorio que parecen ser de utilidad para predecir qué pacientes presentan un riesgo elevado de tener artritis persistente y/o erosiva o desarrollar AR u otra artropatía definida5,9–14,29,45–50. De las variables que se han evaluado en los modelos multivariantes, los predictores más sólidos parecen ser la presencia de autoanticuerpos específicos de la AR (particularmente el FR y los anti-CCP), la duración de los síntomas al momento del diagnóstico, el estado funcional basal evaluado mediante el HAQ (mayor o igual que uno sobre 3 en la visita inicial), un número elevado de articulaciones tumefactas al inicio de la enfermedad, la poliartritis con afección no sólo de manos sino también de pies, así como la afectación precoz de grandes articulaciones, la elevación de los reactantes de fase aguda (fundamentalmente de la proteína C reactiva), la presencia del epítopo compartido y la presencia de erosiones al momento de la presentación.
Respecto a la duración de la artritis, Quinn et al describieron en una cohorte de pacientes con AI de las manos de menos de un año de evolución, que el mejor predictor de artritis persistente un año después es la persistencia de la inflamación a las 12 semanas de seguimiento11. Dentro de los estudios de laboratorio, se ha observado que la presencia de anticuerpos anti-CCP es también mejor predictor de una futura AR que el propio FR con una odds ratio (OR) de 3818.
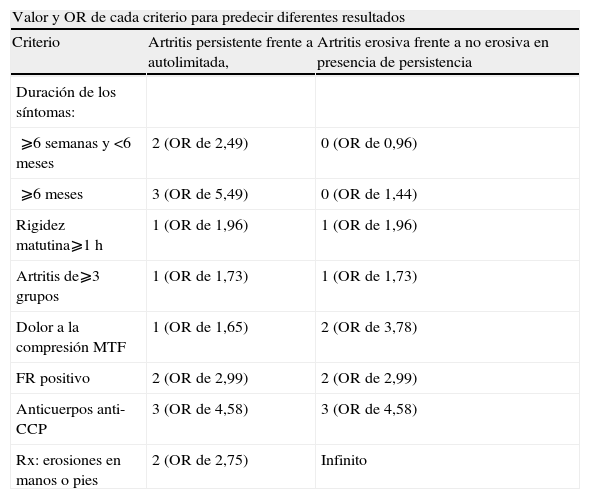
Un paso adelante a la hora de enfocar el pronóstico han sido los intentos por elaborar un modelo predictivo que integre toda esta información. El grupo de la Universidad de Leiden lleva años trabajando en el desarrollo de un modelo clínico que permita predecir la evolución de una artritis de reciente comienzo. En un primer intento, Visser et al46 publicaron un modelo para estimar la probabilidad de que los pacientes con artritis de reciente comienzo desarrollen una enfermedad autolimitada, persistente no erosiva o persistente destructiva. Estos criterios se basan en 7 variables clínicas cuya ponderación varía según el desenlace clínico; la ecuación obtenida permite estimar la probabilidad de padecer o no el desenlace en la primera visita (tabla 2). Las variables con mayor poder para diferenciar una artritis autolimitada de una artritis persistente fueron la duración de los síntomas (OR de 2,49 si es ⩾6 semanas y OR de 5,49 si es ⩾6 meses) y los anticuerpos anti-CCP (OR de 4,58) y las variables con mayor poder para diferenciar una artritis erosiva de una artritis no erosiva fueron nuevamente los anti-CCP (OR de 4,58) y la compresión bilateral de las articulaciones metatarsofalángicas (OR de 3,78).
Modelos predictivos de evolución de la artritis de reciente comienzo: Visser et al propusieron este modelo para estimar la probabilidad del desarrollo de una artritis autolimitada, persistente no erosiva o persistente destructiva en los pacientes con artritis de reciente comienzo
| Valor y OR de cada criterio para predecir diferentes resultados | ||
| Criterio | Artritis persistente frente a autolimitada, | Artritis erosiva frente a no erosiva en presencia de persistencia |
| Duración de los síntomas: | ||
| ⩾6 semanas y <6 meses | 2 (OR de 2,49) | 0 (OR de 0,96) |
| ⩾6 meses | 3 (OR de 5,49) | 0 (OR de 1,44) |
| Rigidez matutina⩾1h | 1 (OR de 1,96) | 1 (OR de 1,96) |
| Artritis de⩾3 grupos | 1 (OR de 1,73) | 1 (OR de 1,73) |
| Dolor a la compresión MTF | 1 (OR de 1,65) | 2 (OR de 3,78) |
| FR positivo | 2 (OR de 2,99) | 2 (OR de 2,99) |
| Anticuerpos anti-CCP | 3 (OR de 4,58) | 3 (OR de 4,58) |
| Rx: erosiones en manos o pies | 2 (OR de 2,75) | Infinito |
| Valor de la suma de todos los criterios para predecir diferentes resultados | |||
| Artritis persistente frente a autolimitada | Artritis erosiva frente a no erosiva en presencia de persistencia | ||
| Valor total | Probabilidad de persistencia | Valor total | Probabilidad de erosiones |
| 0 | 0,18 | 0 | 0,10 |
| 1 | 0,15 | 1 | 0,16 |
| 2 | 0,23 | 2 | 0,25 |
| 3 | 0,34 | 3 | 0,38 |
| 4 | 0,46 | 4 | 0,52 |
| 5 | 0,59 | 5 | 0,66 |
| 6 | 0,71 | 6 | 0,78 |
| 7 | 0,80 | 7 | 0,86 |
| 8 | 0,87 | 8 | 0,92 |
| 9 | 0,92 | 9 | 0,95 |
| 10 | 0,95 | ∞ | 1 |
| 11 | 0,97 | ||
| 12 | 0,98 | ||
| 13 | 0,99 | ||
Anti-CCP: anticuerpos contra péptidos cíclicos citrulinados; FR: factor reumatoide; MTF: metatarsofalángicas; OR: odds ratio 'oportunidad relativa'; Rx: radiografía.
En el caso de la predicción de erosiones, el tiempo de enfermedad tuvo un valor limitado (OR de 1,44 si es ⩾6 meses). El área bajo la curva (ABC) ROC del modelo fue de 0,84 para distinguir entre enfermedad autolimitada y enfermedad persistente y de 0,91 para distinguir entre enfermedad persistente no erosiva y enfermedad persistente destructiva (cabe recordar que valores de ABC entre 0,5 y 0,7 indican baja exactitud de la prueba diagnóstica, valores entre 0,7 y 0,9 pueden ser útiles para algunos propósitos y que valores superiores a 0,9 indican exactitud alta).
Desde un punto de vista operativo, una manera más práctica de enfocar el pronóstico es simplificar el desenlace a si el paciente evolucionará a una AR o no. Por esto, este mismo grupo, sobre la base del análisis de los datos de su cohorte de 570 pacientes con AI de reciente comienzo, elaboró un modelo nuevo que permite predecir qué pacientes evolucionarán a AR con variables fáciles de obtener en la práctica clínica47. El modelo recoge 9 variables; a cada una de estas variables se le adjudica una puntuación, oscilando el rango de puntuación total del modelo entre 0 y 14 (tabla 3). Al igual que en el modelo de Visser, el riesgo de desarrollo de una AR aumenta conforme mayor es la puntuación obtenida. En el estudio original, el 84% de los pacientes con una puntuación total mayor o igual que 8 evolucionó a una AR, porcentaje que ascendió al 100% cuando la puntuación fue mayor o igual que 11. En cambio, no se desarrolló la enfermedad en el 91% de los enfermos con una puntuación menor o igual que 6 (tabla 3). En el grupo de pacientes con una puntuación total entre 6 y 8 (24% de los casos), cerca del 50% desarrollaron AR, lo que indica que no es posible hacer ninguna previsión fiable en este subgrupo. El ABC ROC del modelo fue de 0,89. Los autores proponen tomar como referencia a la hora de decidir la indicación de tratamiento 2 puntos de corte: administrar tratamiento si la puntuación total es mayor o igual que 8 (valor predictivo positivo del 84%) y no iniciar tratamiento si ésta es menor o igual que 6 (valor predictivo negativo del 91%).
Modelos predictivos de evolución de la artritis de reciente comienzo: Van Der Helm-Van Mil et al propusieron este modelo para estimar la probabilidad de desarrollo de artritis reumatoide en los pacientes con artritis indiferenciada de reciente comienzo
| Puntuación para cada variable | |
| Variable | Puntuación |
| 1) ¿Cuál es la edad? (multiplicar por 0,02) | |
| 2) Sexo femenino | Un punto |
| 3) Patrón de afección articular | |
| 0,5 puntos |
| 0,5 puntos | |
| Un punto | |
| 1,5 puntos | |
| 4) Evaluación de la rigidez articular matutina por el pacientes en una escala visual analógica de 0 a 100mm | |
| De 26 a 90mm | Un punto |
| >90mm | 2 puntos |
| 5) Número de articulaciones dolorosas | |
| De 4 a 10 | 0,5 puntos |
| ⩾11 | Un punto |
| 6) Número de articulaciones tumefactas | |
| De 4 a 10 | 0,5 puntos |
| ⩾11 | Un punto |
| 7) Valor de la PCR | |
| De 5 a 50mg/l | 0,5 puntos |
| ⩾51mg/l | Un punto |
| 8) FR positivo | Un punto |
| 9) Anticuerpos anti-CCP positivos | 2 puntos |
| Riesgo de progresión a AR en función de la puntuación total obtenida | ||
| Puntos de corte | No progresión a AR (%) | Progresión a AR (%) |
| ⩽6 | 91 | 9 |
| >6 y <8 | 52 | 48 |
| ⩾8 | 16 | 84 |
| ⩾11 | 0 | 100 |
*La puntuación total puede oscilar entre 0 y 14 puntos.
Anti-CCP: anticuerpos contra péptidos cíclicos citrulinados; AR: artritis reumatoide; FR: factor reumatoide; PCR: proteína C reactiva.
Este modelo (propuesto por Van Der Helm-Van Mil et al) ha sido recientemente validado en otras 3 cohortes europeas de AI de reciente comienzo y en una cohorte canadiense51,52. En estos estudios, el valor predictivo positivo (probabilidad de que el paciente tenga realmente AR) cuando la puntuación total fue mayor o igual que 8 osciló entre el 93 y el 100% en las diferentes cohortes evaluadas, mientras que el valor predictivo negativo (probabilidad de que el paciente no tenga AR) cuando la puntuación total fue menor o igual que 6 osciló entre el 83 y el 86%. Los datos de estos estudios de validación externa refrendan la exactitud diagnóstica de este modelo y avalan su inclusión en la práctica diaria como método cómodo y económico que ayuda a reducir la incertidumbre asociada a esta determinada situación clínica.
Tratamiento: ¿cuándo, cómo y hasta cuándo tratar una artritis indiferenciada?Recientemente, la EULAR (European League Against Rheumatism) elaboró un documento de consenso para el tratamiento de la artritis de reciente comienzo. Este documento fue elaborado por un comité de expertos y propone 12 recomendaciones basadas en la evidencia existente44. La quinta de estas recomendaciones aconseja administrar tratamiento con FAME tan pronto como sea posible en aquellos pacientes en los que hay riesgo de desarrollo de artritis persistente y/o erosiva, incluso si aún no satisfacen los criterios de clasificación establecidos para las enfermedades reumatológicas inflamatorias. Queda, pues, refrendada la idea de que lo fundamental en la valoración de las AI es la determinación del pronóstico y, en particular, predecir si la artritis del paciente remitirá o persistirá; siendo menos importante la cuestión de si acabará cumpliendo o no los criterios de AR o de otra artritis definida en el futuro.
En el apartado anterior se han revisado los instrumentos con los que actualmente cuenta el clínico para poder distinguir entre aquellos pacientes en los que se desarrollará una artritis persistente y/o erosiva y, por tanto, serán candidatos para recibir tratamiento precoz con FAME aunque no cumplan los criterios de clasificación del ACR y los que tendrán un cuadro autolimitado.
Así pues, hoy en día no es correcta la estrategia de «esperar y ver» en las AI, tratando únicamente antiinflamatorios no esteroideos (AINE) a todos los pacientes y observando la historia natural de la enfermedad durante períodos largos de tiempo a la espera de la aparición de los distintos desenlaces. Con este tratamiento, en muchas ocasiones se pierde la oportunidad de modificar el curso de la enfermedad. Tampoco es aceptable una terapia uniforme administrando FAME a todos los pacientes en el momento de la presentación, ya que se tratará de forma innecesaria a un porcentaje significativo de enfermos en los que el cuadro va a autolimitarse.
Conviene destacar que, aunque la evidencia en la que se sustenta esta recomendación de la EULAR provienen sobre todo de la experiencia acumulada en la AR, hay algunos ensayos clínicos de tratamiento preestructurado en cohortes de AI que demuestran la ventaja de la intervención precoz.
Quinn et al11 realizaron un estudio abierto en 110 pacientes con AI de manos de menos de un año de evolución. Los enfermos se trataron de acuerdo con un protocolo predefinido que inicialmente incluía AINE en monoterapia añadiéndose sucesivamente glucocorticoides en caso de ineficacia (una dosis de 120mg de metilprednisolona por vía intramuscular si el número de articulaciones tumefactas era superior o igual a 5; si eran menos de 5 se administraban infiltraciones de metilprednisolona con una dosis máxima de 140mg) y finalmente FAME. Con esta pauta, al final de un período de seguimiento de 12 meses un 72% de los pacientes había precisado tratamiento con glucocorticoides y un 30% de los pacientes seguía tratamiento con FAME (sulfasalazina, metotrexato [MTX] o hidroxicloroquina); sólo un 13% de los pacientes alcanzó la remisión. El retraso en el inicio de los FAME fue de 7,6 meses. El mejor predictor de artritis persistente al año de evolución fue la persistencia de la inflamación a las 12 semanas de seguimiento. Estos resultados cuestionan el supuesto pronóstico benigno de la AI y demuestran que el control inicial rápido de la sinovitis reduce el riesgo de progresión futura y apoya indirectamente el empleo precoz de FAME.
La pauta de glucocorticoides empleada en este ensayo viene avalada por un estudio previo realizado por el mismo grupo de autores, esta vez en la cohorte de artritis de reciente comienzo en Leeds50. En este ensayo se incluyó a 63 pacientes con artritis leve de inicio (afectando 2 o más articulaciones y con una duración inferior a los 12 meses). Se definió enfermedad leve a aquella que presentaba las siguientes características: a) duración de los síntomas inferior a los 3 meses, independientemente del patrón de la enfermedad; b) enfermedad asimétrica, o c) afectación simétrica de las articulaciones metacarpofalángicas, pero con un índice de gravedad pronóstico bajo atendiendo a predictores de mal pronóstico, funcionales y radiológicos. Los pacientes se trataron según un protocolo predefinido que incluía la administración precoz de una dosis única de glucocorticoides por vía intramuscular (120mg de metilprednisolona u 80mg de metilprednisolona si el sujeto pesaba menos de 60kg) o glucocorticoides intraarticulares en los casos en los que había 3 o menos articulaciones afectadas y AINE a demanda. Al final de un período de seguimiento de 6 meses la artritis persistió en el 78% de los pacientes, pero un 22% de los enfermos había alcanzado la remisión completa. Estos datos evidencian la posibilidad de que, al menos en un subgrupo de pacientes, el tratamiento precoz y enérgico con glucocorticoides puede alterar el desenlace en las fases iniciales de la artritis. Ningún paciente con FR y epítopo compartido entró en remisión. Es importante destacar que también una duración de la enfermedad superior a las 12 semanas fue el mejor predictor de enfermedad persistente a los 6 meses en este estudio (para la AR y la AI).
El potencial de los glucocorticoides para alterar el desenlace de la artritis está siendo también evaluado en un ensayo clínico multicéntrico. Este ensayo clínico, llamado SAVE (Stop Arthritis Very Early), incluye a 389 pacientes con AI de menos de 16 semanas de evolución. A todos los pacientes se les prescriben AINE y reciben aleatorizadamente una dosis de glucocorticoides por vía parenteral (120mg de metilprednisolona por vía intramuscular) o placebo. La variable de desenlace principal en el estudio es el porcentaje de pacientes en remisión clínica sin tratamiento al final de un período de seguimiento de 52 semanas. Los resultados preliminares de este ensayo se han dado a conocer en el último Congreso Americano de Reumatología53. Sólo un 13,3% de los pacientes incluidos ha alcanzado la remisión y no se han observado diferencias significativas entre los grupos (el 12,1% en el grupo tratado con metilprednisolona y el 14,1% en el grupo placebo). Tampoco se han observado diferencias significativas en el porcentaje de pacientes que han precisado tratamiento con FAME (el 50,3 frente al 56,7%), ni en el porcentaje de pacientes que han cumplido los criterios de clasificación de AR (el 45,1 y el 50,7%, respectivamente).
Aunque en las primeras 2 semanas de seguimiento los pacientes tratados con metilprednisolona tuvieron una mejoría estadísticamente significativa en varios parámetros clínicos (número de articulaciones tumefactas, evaluación del dolor, evaluación global de la enfermedad, duración de la rigidez articular matutina y puntuación del DAS28 [Disease Activity Score]), este efecto beneficioso desapareció rápidamente durante el seguimiento. Estos datos indican que el tratamiento con dosis altas de glucocorticoides en las fases iniciales de la artritis únicamente aporta un alivio sintomático transitorio, pero no es capaz de alterar de forma sustancial su desenlace.
Recientemente se han publicado los resultados del estudio PROMPT (The Probable rheumatoid arthritis: Methotrexate versus Placebo Treatment), un estudio multicéntrico aleatorizado, doble ciego de metotrexato (MTX) frente a placebo en 110 pacientes con AI de menos de 2 años de evolución54. Aunque son pacientes con AI, la población está sesgada puesto que se trata de pacientes con sospecha clínica de AR, pero que no cumplen los criterios del ACR de 1987: el FR era positivo en aproximadamente un tercio de los pacientes, los anticuerpos anti-CCP estaban presentes en el 21% de los casos y un 5% tenían erosiones radiológicas.
En la primera fase del estudio que duró 12 meses, los pacientes recibieron tratamiento con MTX o placebo y también mantuvieron los AINE. El grupo tratado con MTX recibió una dosis inicial de 15mg semanales por vía oral con visitas periódicas cada 3 meses aumentándose la dosis en 5mg en cada visita si el DAS28 era superior a 2,4 puntos (hasta un máximo de 30mg semanales). Al cabo de 12 meses de tratamiento, éste se suspendió en los 2 grupos y se prolongó el tiempo de seguimiento hasta los 30 meses. La variable de desenlace principal en el estudio fue el cumplimiento de los criterios del ACR de 1987 para AR y como variable de desenlace secundaria se valoró la progresión del daño radiológico tras los primeros 18 meses. Cuando un paciente del grupo placebo cumplía estos criterios se lo trataba con MTX.
Al final del período de seguimiento, la proporción de enfermos que cumplían criterios del ACR para AR fue del 53% en el grupo placebo y del 40% en el grupo tratado con MTX (razón de riesgo = 1,7; p = 0,04). No se observaron diferencias en la proporción de pacientes que entraron en remisión (el 15% en el grupo MTX y el 13% en el grupo placebo). Sin embargo, en el grupo tratado con MTX los pacientes cumplieron los criterios del ACR para AR más tardíamente que los pacientes tratados con placebo; esta diferencia fue estadísticamente significativa.
A los 18 meses de evolución la mayoría de los enfermos no presentaba todavía daño radiológico. No obstante, del grupo de enfermos con progresión radiológica, el 30% de los pacientes se trató con MTX frente al restante 70% que se trató con placebo (p=0,046), lo que indica un cierto efecto beneficioso del MTX. El análisis por subgrupos de pacientes demostró que este efecto beneficioso del MTX fue mayor en los pacientes con anticuerpos anti-CCP positivos, puesto que la progresión a AR se observó en el 93% de los casos tratados con placebo y sólo se observó en el 67% de los casos tratados con MTX (p<0,001). En cambio, en los pacientes sin anticuerpos anti-CCP, la progresión a AR fue infrecuente y no se observaron diferencias significativas entre grupos en ninguna de las variables analizadas. Los resultados de este estudio demuestran que el tratamiento durante un año con MTX en pacientes con AI no evita la progresión a AR ni tampoco parece inducir un número significativamente mayor de remisiones, aunque sí tiene un efecto beneficioso al retrasar la progresión a AR y al daño radiológico. Su eficacia es mayor en los pacientes con anticuerpos anti-CCP positivos.
Con posterioridad al estudio PROMPT, Saleem et al55 han publicado los resultados de un ensayo similar realizado en este caso con infliximab (IFX). También es un ensayo aleatorizado y de doble ciego de IFX frente a placebo en 17 pacientes con AI activa de menos de 12 años de evolución, en los que había fracasado un tratamiento previo con una dosis de 120mg de metilprednisolona por vía intramuscular. Los pacientes recibieron placebo o IFX en monoterapia en una dosis de 3 mg/kg en las semanas 0, 2, 6 y 14. En caso de persistencia de la artritis al final de la semana 14, en ambos grupos se instauraba tratamiento con MTX. La variable de desenlace principal en el estudio fue el porcentaje de pacientes en remisión clínica en la semana 26 y el cumplimiento de los criterios del ACR de 1987 para AR. Al final del período de seguimiento de 26 semanas, sólo 3 pacientes habían alcanzado la remisión clínica (2 pacientes del grupo tratado con IFX y un pacientes del grupo placebo). Aunque en el estudio comparativo entre grupos los pacientes tratados con IFX presentaron mayor mejoría en la duración de la rigidez articular matutina, en el número de articulaciones dolorosas y tumefactas y en la puntuación del HAQ, no se observaron diferencias significativas en las puntuaciones del DAS28. En la semana 52, el 100% de los pacientes tratados con IFX y el 71% de los pacientes tratados con placebo cumplían criterios de AR. En el grupo tratado con IFX los enfermos cumplieron los criterios del ACR para AR más tardíamente que los pacientes tratados con placebo; esta diferencia no fue estadísticamente significativa. Aunque el bajo número de pacientes incluidos limita las conclusiones de este estudio, los resultados preliminares demuestran que el tratamiento con antagonistas del factor de necrosis tumoral α en monoterapia en pacientes con AI aporta un alivio sintomático temporal, pero no evita la progresión a AR.
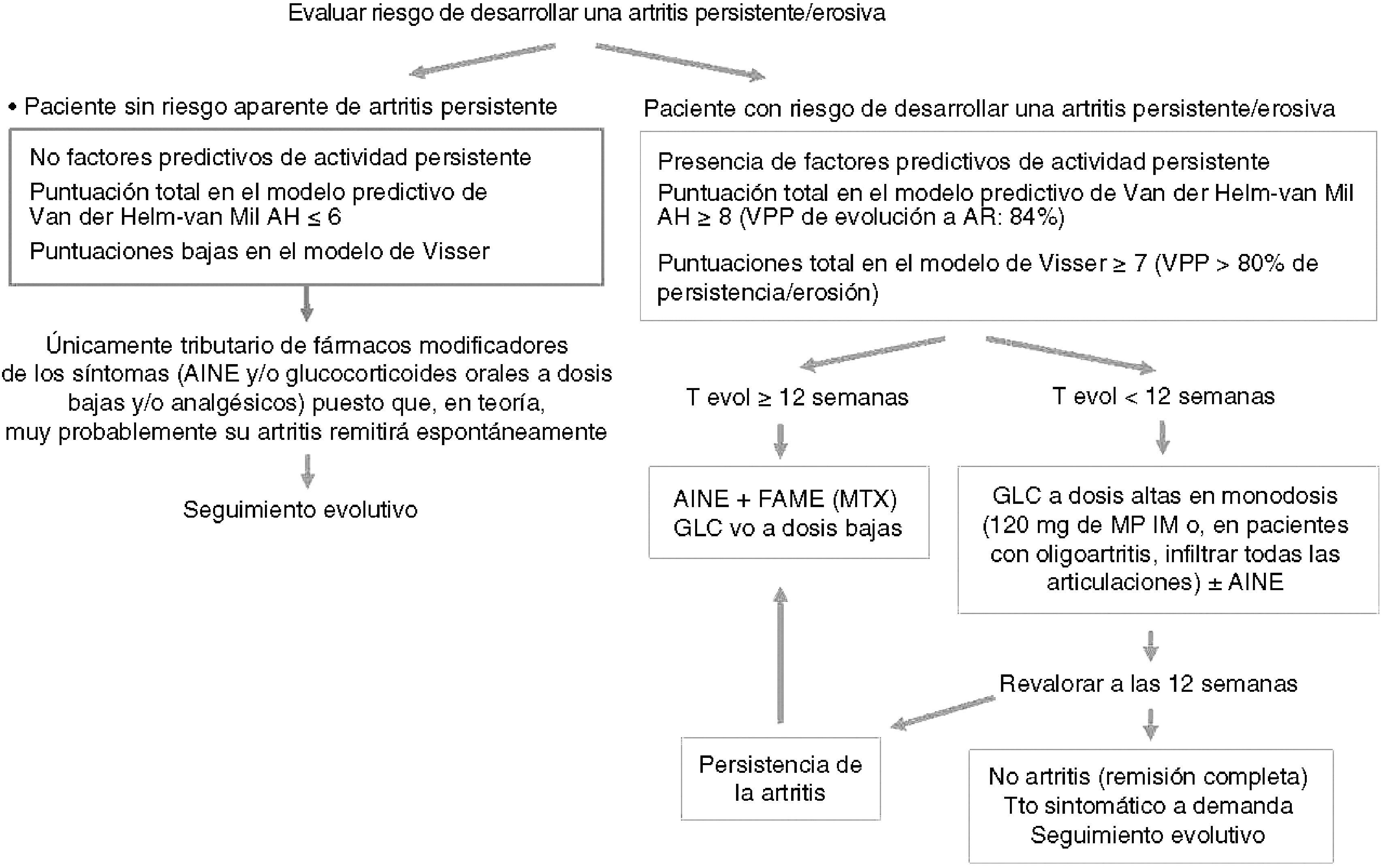
Después de revisar las pruebas existentes llega el momento de intentar diseñar una guía de actuación terapéutica para los pacientes con AI de reciente comienzo (fig. 1). Si un paciente aparentemente no tiene riesgo de desarrollar una artritis persistente/erosiva, únicamente será candidato de tratamiento sintomático puesto que, en teoría, muy probablemente su artritis remitirá espontáneamente. Por el contrario, aquellos pacientes con presencia de factores predictivos de actividad persistente, con una puntuación total en el modelo de Visser mayor o igual que 7 (Valor Predictivo Positivo de persistencia o erosión superior al 80%) o una puntuación en el modelo de Van Der Helm-Van Mil et al mayor o igual que 8 (Valor Predictivo Positivo de evolución a AR del 84%), precisan de una intervención precoz. Si el tiempo de evolución de la artritis es superior a las 12 semanas, se debe iniciar tratamiento con AINE a demanda y FAME, preferentemente MTX (como otras alternativas hay evidencia de eficacia con sulfasalazina e hidroxicloroquina, aunque probablemente la leflunomida sea también una alternativa eficaz, como sucede en la AR). Además, por extrapolación con la AR de reciente comienzo, podría ser recomendable la utilización en estos enfermos de glucocorticoides por vía oral en dosis bajas por su efecto como tratamiento modificador de la enfermad en combinación con el FAME.
En los pacientes con un tiempo de evolución inferior a las 12 semanas, una opción a valorar podría ser la administración de una dosis alta de glucocorticoides (120mg de metilprednisolona por vía intramuscular o, en pacientes con oligoartritis, infiltración en todas las articulaciones afectadas) basándonos en su posible efecto modificador de la enfermedad. De acuerdo con los estudios realizados por el grupo de la Universidad de Leeds11,50, con esta estrategia se puede inducir la remisión en un porcentaje de estos pacientes, si bien la eficacia de esta medida no se ha confirmado en el estudio SAVE53. Estos pacientes se deben revalorizar en la semana 12 y, en caso de persistencia de la artritis, administrar el tratamiento con FAME y fármacos modificadores de los síntomas (AINE o glucocorticoides en dosis bajas) como se ha comentado anteriormente. El límite de las 12 semanas también se sustenta en los estudios del grupo de la Universidad de Leeds que han demostrado que la persistencia de los síntomas durante más de 12 semanas hace improbable la autolimitación de la artritis11,50.
Esta guía de actuación no deja de ser una propuesta del autor a título orientativo con la intención de ayudar a reducir la incertidumbre asociada a esta determinada situación clínica. Por tanto, está abierta a las críticas y es susceptible de modificaciones conforme aumente el conocimiento en el tratamiento de esta entidad.
Respecto a la duración del tratamiento, los resultados del estudio PROMPT y del estudio de Saleem et al54,55 parecen indicar que el tratamiento con FAME en los pacientes con AI persistente y/o erosiva se debe mantener durante un tiempo prolongado, al igual que sucede en la AR. El planteamiento de estos estudios se sustenta en la «ventana de oportunidad terapéutica» que parece haber en la AR. Se ha demostrado que en algunos pacientes las alteraciones analíticas específicas de la enfermedad, como la presencia de anticuerpos anti-CCP, pueden preceder en el tiempo al inicio de las manifestaciones clínicas. También se ha demostrado que cuanto antes se inicia el tratamiento en la AR mejor es la respuesta, por lo que, teóricamente, un tratamiento intensivo en las primeras semanas o meses de evolución de la artritis, cuando ésta aún es indiferenciada, puede inducir una remisión prolongada y efectiva de ésta y evitar su progresión a AR definida. Sin embargo, los resultados de ambos ensayos no confirman esta hipótesis tan ambiciosa, por lo que quizás el concepto de «ventana de oportunidad terapéutica» deba seguir planteándose en términos más realistas, como aquel estadio de la enfermedad en la que el tratamiento precoz produce una mejoría clínica significativa y un retraso, e incluso una detención, del daño radiológico, sin llegar a conseguir su curación.