La enfermedad renal terminal (ERT) por nefritis lúpica (NL) se presenta en el 10-30% de los pacientes. Inicialmente, el lupus eritematoso sistémico (LES) fue una contraindicación para el trasplante renal (TR). En la actualidad, la supervivencia del injerto a largo plazo sigue siendo motivo de controversia. El objetivo del estudio fue comparar la supervivencia del TR en los sujetos con LES con otras causas de ERT.
MétodosSe incluyó a todos los pacientes con TR en sujetos con LES, de una cohorte retrospectiva en 2 centros de trasplante. Se realizó un grupo de comparación con otras etiologías de ERT en una relación 2:1 emparejados por edad, sexo y año del trasplante. La supervivencia se evaluó por el método de Kaplan-Meier y por el modelo de riesgos proporcionales de Cox.
ResultadosSe incluyó a 25 sujetos con LES. La probabilidad de supervivencia en los sujetos con LES al año, 5 y 10 años fue del 92, el 66 y el 66%, respectivamente, la cual no difirió del grupo de comparación (p=0,39). En el análisis multivariante no existió una diferencia significativa en la supervivencia del injerto entre los 2 grupos (hazard ratio=1.95, IC del 95%, 0,57-6,61; p=0,28). La recurrencia de la NL fue del 8% y no se relacionó con la pérdida del injerto. El rechazo agudo fue la única variable asociada con la pérdida del injerto en los sujetos con LES (HR 16,5, IC del 95%, 1,94-140,1, p=0,01).
ConclusionesEl riesgo de pérdida del injerto renal en los sujetos con LES fue similar al de los sujetos con otras causas de ERT.
End-stage renal disease (ESRD) due to lupus nephritis (LN) occurs in 10%-30% of patients. Initially systemic lupus erythematosus (SLE) was a contraindication for kidney transplantation (KT). Today, long-term graft survival remains controversial. Our objective was to compare the survival after KT in patients with SLE or other causes of ESRD.
MethodsAll SLE patients who had undergone KT in a retrospective cohort were included. Renal graft survival was compared with that of 50 controls, matched for age, sex, and year of transplantation. Survival was evaluated by the Kaplan-Meier test and the Cox proportional hazards model.
ResultsTwenty-five subjects with SLE were included. The estimated 1-year, 2- and 5-year survival rates for patients with SLE were 92%, 66% and 66%. Renal graft survival did not differ between patients with SLE and other causes of ESRD (P=.39). The multivariate analysis showed no significant difference in graft survival between the two groups (hazard ratio, HR=1.95, 95% confidence interval [CI] 0.57-6.61, P=.28). The recurrence rate of LN was 8% and was not associated with graft loss. Acute rejection was the only variable associated with graft loss in patients with SLE (HR=16.5, 95% CI 1.94-140.1, P=.01).
ConclusionsRenal graft survival in SLE patients did not differ from that reported for other causes of ESRD.
Se estima que durante el desarrollo de su enfermedad el 60% de los sujetos con lupus eritematoso sistémico (LES) presentarán algún grado de nefritis1. A pesar de que en las últimas décadas han mejorado el tratamiento y el pronóstico de la nefritis lúpica (NL), aproximadamente entre el 10 y el 30% de los pacientes desarrollan enfermedad renal terminal (ERT)1–3, los cuales requieren terapia de sustitución renal.
Inicialmente, el LES fue considerado una contraindicación para el trasplante renal (TR) debido a la alta probabilidad de recurrencia de la NL (RNL) y a la alta morbilidad; esta opinión cambió en 1975 cuando el Advisory Committe to the Renal Transplantation Registry of the American College of Surgeons (ACS) y el National Institute of Health (NIH) concluyeron que el TR en el lupus era exitoso y con resultados similares a los obtenidos con las causas más frecuentes de ERT4; a partir de entonces, el TR comenzó a ser considerado como una opción de tratamiento razonable.
En la NL se considera que las diferencias étnicas/raciales constituyen un factor determinante de los resultados. Las mujeres con ascendencia hispana y afroamericana tienen un mayor riesgo de progresión a ERT cuando se comparan con las caucásicas5. El nivel socioeconómico bajo, la raza afroamericana y los sujetos de origen hispano/latinoamericano tienen un mayor riesgo de pérdida del injerto renal6,7. Los afroamericanos tienen una menor supervivencia del injerto renal cuando se comparan con los hispanos, especialmente por una mayor tasa de rechazo en los injertos de donador cadavérico7. En sujetos de países latinoamericanos, los estudios observacionales que han comparado la supervivencia del injerto con otras causas de ERT reportan una supervivencia del injerto similar a los grupos de comparación8–10, y en un estudio en Brasil que incluyó en su mayoría sujetos caucásicos (91%) reportó una mejor supervivencia del injerto en el grupo con LES11.
En los centros de trasplante la frecuencia de TR en pacientes con LES varía entre el 0,01 y el 5,5% de todos los TR9,12–16. La supervivencia del injerto es un tema de gran interés debido a que el pronóstico a largo plazo del injerto y la tasa de RNL siguen siendo motivo de controversia4,17,18. El objetivo del estudio fue comparar la supervivencia del injerto renal en los pacientes trasplantados por NL con otras causas de ERT.
MétodosEstudio de cohorte retrospectiva. Se incluyó a los pacientes que cumplieran los criterios de clasificación de LES del colegio Americano de Reumatología19 y que se les realizó un TR por NL en 2 hospitales de tercer nivel de atención, en el periodo comprendido entre el 1 de enero de 1991 y el 31 de mayo del 2010 en el Centro Médico Nacional (CMN) Siglo XXI (CMN SXXI), y durante el periodo de enero de 2003 a diciembre del 2014 en el CMN «La Raza». La pérdida del injerto fue definida por la necesidad de diálisis o una creatinina > 5mg/dl en 2 determinaciones. Se excluyó a los pacientes con diabetes o trasplantados por otra enfermedad autoinmune. Para evaluar si la sobrevida difirió de otras causas de ERT, se seleccionaron 2 controles por cada paciente con LES, elegidos de forma aleatoria de la base de datos de pacientes con TR, pareados por edad, género y fecha de trasplante.
Análisis estadísticoLos resultados obtenidos se presentan en forma del número absoluto de casos y su porcentaje (n [%]) para las variables categóricas, y la media con su desviación estándar (media±DE) para las variables continuas con distribución normal, y la mediana con su rango intercuartil (RIQ) para las variables continuas que no siguen esa distribución. Para la comparación de las variables categóricas de acuerdo con el grupo de estudio, se emplearon la prueba de la ji-cuadrado de Pearson o la prueba exacta de Fisher. La sobrevida del injerto se analizó con el método de Kaplan-Meier y las curvas de sobrevida se compararon con la prueba log-rank. Para analizar las variables que influyen en la tasa de pérdida del injerto en función del tiempo se empleó el modelo de riesgos proporcionales de Cox, que controló las covariables que se consideran probables factores de confusión: estado de la enfermedad (LES frente a control), tipo del trasplante, edad al trasplante, tiempo de diálisis, trombosis postrasplante, rechazo agudo, nefropatía crónica del injerto y el tratamiento inmunosupresor empleado. La validez de cada modelo se evaluó con el supuesto de riesgos proporcionales a lo largo del tiempo por el método de los residuales de Shoenfield. Se consideró un valor estadísticamente significativo cuando el valor de p fue ˂ 0,05. El análisis estadístico fue realizado con el programa estadístico Stata-13 (StataCorp. 2013. Stata Statistical Software: Release 13. College Station, TX: StataCorp LP).
ResultadosCaracterísticas de la población estudiadaDurante el periodo de estudio se realizaron 1.749 trasplantes de riñón en el CMN SXXI, 13 fueron en pacientes con LES (0,8%) y se eliminaron 4 casos debido a información incompleta; en el CMN «La Raza» se realizaron 16 trasplantes renales en sujetos con LES. La muestra final fueron 25 pacientes con LES, 5 de los cuales fueron LES de inicio juvenil; el primer trasplante se realizó en 1993 y el último en el 2014.
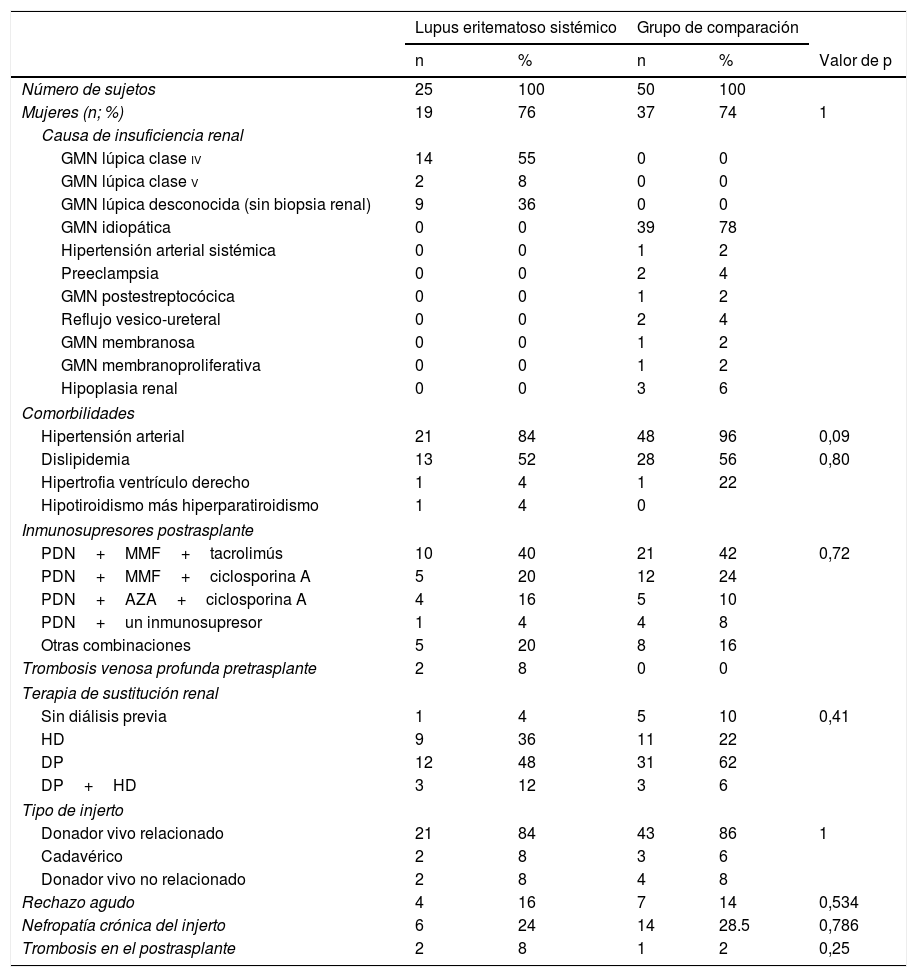
La mediana de la edad en el momento del diagnóstico de LES fue 20,5 años (RIQ 8 años; mínimo 10 y máximo 50). La mayor parte de los pacientes fueron del mujeres (19 [76%]), la mediana de la edad al momento del trasplante fue de 27 años (RIQ 13; mínimo 20, máximo 52). Al comparar las características generales entre los grupos estudiados, no se observaron diferencias significativas (tabla 1). La mediana del tiempo de duración de la terapia de sustitución de la función renal fue de 24 meses (RIQ 36; mínimo 0, máximo 72) en el grupo con LES y 26,5 meses (RIQ 27; mínimo 0, máximo 95) en el grupo de comparación; esta diferencia no fue estadísticamente significativa (p=0,67). El tipo de sustitución renal previa al trasplante más frecuente en ambos grupos fue la diálisis peritoneal.
Características demográficas de pacientes con trasplante renal debido a nefritis lúpica y otras causas de enfermedad renal terminal
| Lupus eritematoso sistémico | Grupo de comparación | ||||
|---|---|---|---|---|---|
| n | % | n | % | Valor de p | |
| Número de sujetos | 25 | 100 | 50 | 100 | |
| Mujeres (n; %) | 19 | 76 | 37 | 74 | 1 |
| Causa de insuficiencia renal | |||||
| GMN lúpica clase iv | 14 | 55 | 0 | 0 | |
| GMN lúpica clase v | 2 | 8 | 0 | 0 | |
| GMN lúpica desconocida (sin biopsia renal) | 9 | 36 | 0 | 0 | |
| GMN idiopática | 0 | 0 | 39 | 78 | |
| Hipertensión arterial sistémica | 0 | 0 | 1 | 2 | |
| Preeclampsia | 0 | 0 | 2 | 4 | |
| GMN postestreptocócica | 0 | 0 | 1 | 2 | |
| Reflujo vesico-ureteral | 0 | 0 | 2 | 4 | |
| GMN membranosa | 0 | 0 | 1 | 2 | |
| GMN membranoproliferativa | 0 | 0 | 1 | 2 | |
| Hipoplasia renal | 0 | 0 | 3 | 6 | |
| Comorbilidades | |||||
| Hipertensión arterial | 21 | 84 | 48 | 96 | 0,09 |
| Dislipidemia | 13 | 52 | 28 | 56 | 0,80 |
| Hipertrofia ventrículo derecho | 1 | 4 | 1 | 22 | |
| Hipotiroidismo más hiperparatiroidismo | 1 | 4 | 0 | ||
| Inmunosupresores postrasplante | |||||
| PDN+MMF+tacrolimús | 10 | 40 | 21 | 42 | 0,72 |
| PDN+MMF+ciclosporina A | 5 | 20 | 12 | 24 | |
| PDN+AZA+ciclosporina A | 4 | 16 | 5 | 10 | |
| PDN+un inmunosupresor | 1 | 4 | 4 | 8 | |
| Otras combinaciones | 5 | 20 | 8 | 16 | |
| Trombosis venosa profunda pretrasplante | 2 | 8 | 0 | 0 | |
| Terapia de sustitución renal | |||||
| Sin diálisis previa | 1 | 4 | 5 | 10 | 0,41 |
| HD | 9 | 36 | 11 | 22 | |
| DP | 12 | 48 | 31 | 62 | |
| DP+HD | 3 | 12 | 3 | 6 | |
| Tipo de injerto | |||||
| Donador vivo relacionado | 21 | 84 | 43 | 86 | 1 |
| Cadavérico | 2 | 8 | 3 | 6 | |
| Donador vivo no relacionado | 2 | 8 | 4 | 8 | |
| Rechazo agudo | 4 | 16 | 7 | 14 | 0,534 |
| Nefropatía crónica del injerto | 6 | 24 | 14 | 28.5 | 0,786 |
| Trombosis en el postrasplante | 2 | 8 | 1 | 2 | 0,25 |
AZA: azatioprina; DP: diálisis peritoneal; HD: hemodiálisis; MMF: ácido micofenólico; PDN: prednisona.
En los sujetos con LES la procedencia del injerto en su mayoría (84%) fue de un donador vivo relacionado, ningún caso presentó actividad del LES en el momento del trasplante ni infección por el virus de la hepatitis C. Ningún paciente tenía un síndrome antifosfolipidíco (SAF) secundario; en 7 de los 25 sujetos se realizó por lo menos una determinación de anticuerpos antifosfolípidos (AAF) y en todos fueron negativos. La prednisona (92%), el ácido micofenólico (76%) y el tacrolimús (48%) fueron los inmunosupresores más frecuentemente empleados en el postrasplante. En el grupo de comparación se presentó una mayor frecuencia de hipertensión arterial sistémica (96% vs. 84%, p=0,09). La mediana del tiempo del seguimiento postrasplante fue de 34 meses (RIQ 27) para los sujetos con LES y de 36 meses (RIQ 48) para los sujetos del grupo de comparación.
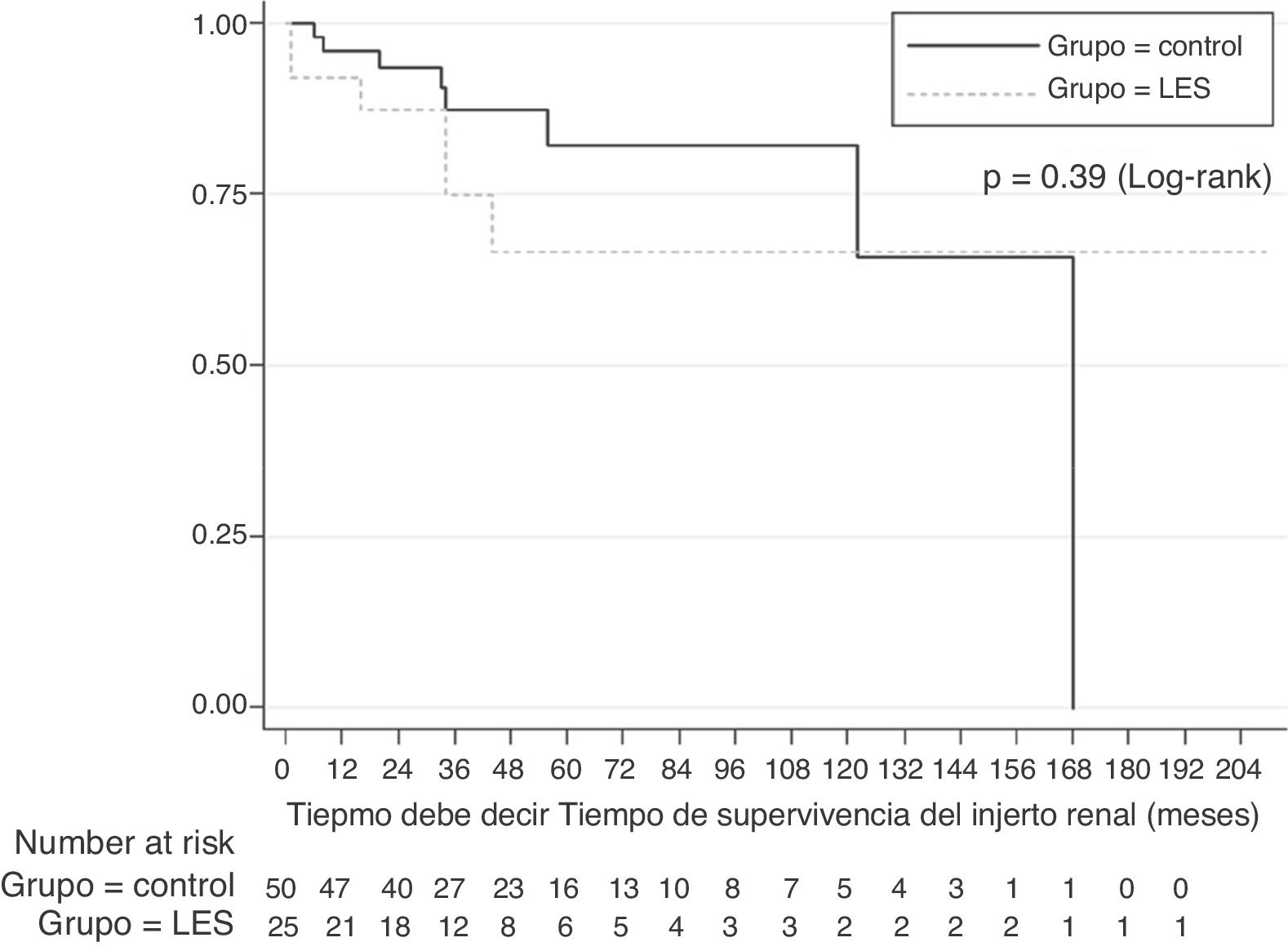
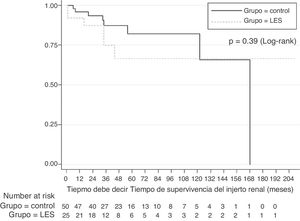
Desenlaces del injerto renalLa probabilidad de supervivencia estimada mediante el método de Kaplan-Meier (fig. 1) al comparar a los sujetos con NL y los controles al año (92% frente al 95%), 2 años (87% frente al 85%), 5 años (66% frente al 87%) y 10 años (66% frente al 65%) fue similar. La prueba de log-rank no demostró una diferencia significativa en la supervivencia a lo largo del tiempo (p=0,39). La proporción de supervivencia ajustada por defunción, estimada al año, 5 y 10 años fue del 93, el 72 y el 72%, respectivamente, en el grupo de NL, y del 97, el 83 y el 66%, respectivamente, en el grupo de comparación. En el análisis multivariante no existió una diferencia significativa en la supervivencia del injerto entre los 2 grupos (hazard ratio [HR]=1,95, IC del 95%, 0,57-6,61; p=0,28).
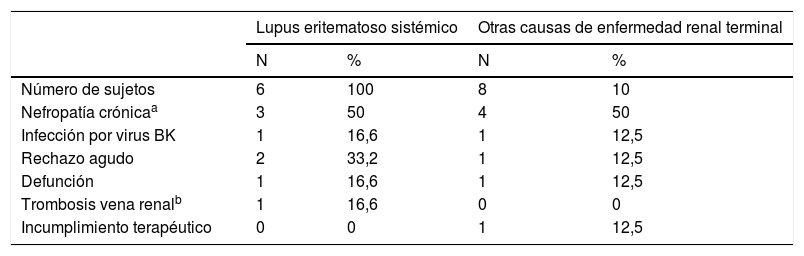
Al comparar el grupo de sujetos con LES y el grupo control no se documentó una diferencia estadísticamente significativa en la pérdida del injerto (6 [24%] vs. 8 [16%], OR 1,65 [IC del 95%, 0,5-5,44], p=0,53]), la frecuencia del rechazo agudo (4 [16%] vs. 7 [14%], OR 1,17 [IC del 95%, 0,3-4,45], p=0,81) y de nefropatía crónica del trasplante (6 [24%] vs. 15 [30%], OR 0.73 [IC del 95%, 0,24-2,21], p=0,78) y defunciones (2 [8%] vs. 2 [4%], OR 2,08 [IC del 95%, 0,27-15,7], p=0,59]). Las causas asociadas a la pérdida del injerto por grupo se muestran en la tabla 2. Como protocolo de la institución, la disfunción temprana o tardía del injerto ameritó biopsia diagnóstica para establecer cambios en el esquema inmunosupresor o detectar disfunción del injerto por otras causas; en el grupo de LES se presentaron 12 casos y 18 en el grupo control.
Causas asociadas a la pérdida del injerto renal en el grupo nefritis lúpica y otras causas de enfermedad renal terminal
En el análisis de la cohorte de los sujetos con LES, el año en el que se realizó el trasplante no influyó de forma significativa en la frecuencia de pérdida del injerto (0 pérdidas en 2 TR entre 1990-1999, 3 en 10 TR entre 2000-2009 y 3 de 7 TR entre 2010-2015, p=0,65). El número de haplotipos compartidos entre el donador y el receptor no se asoció a la pérdida del injerto (p=0,19) en el análisis de los 9 pacientes en que se disponía la información (2 con pérdida y 7 sin pérdida del injerto). De los 4 pacientes (16%) con LES que presentaron episodios de rechazo agudo, un paciente presentó rechazo vascular agudo junto con trombosis venosa del injerto, un paciente presentó rechazo agudo grado IA y 3 presentaron rechazo agudo grado IIA de la clasificación de Banff. Los desenlaces de estos sujetos fueron: un sujeto desarrolló nefropatía crónica del injerto, uno continuó con un injerto renal funcional y otro presentó RNL. El caso que presentó rechazo vascular agudo junto con trombosis de la vena renal a los 6 días del trasplante fue tratado con pulsos de metilprednisolona y timoglobulina, no se logró evitar la pérdida del injerto; esta paciente tenía el antecedente de trombosis venosa profunda previo al trasplante sin AAF y recibía anticoagulación perioperatoria.
En 2 sujetos (8%) se documentó por biopsia renal RNL tipo difusa en el injerto. Una paciente presentó proteinuria en rangos nefróticos debido a NL clase iv de la clasificación de la International Society of Nephrology/Renal Pathology Society (ISN/RPS), la cual fue tratada con incremento de la dosis de glucocorticoides y de los inmunosupresores, lográndose remisión de la actividad sin producir pérdida del injerto. La otra paciente se trató con ciclofosfamida por vía intravenosa con remisión de la NL; sin embargo, posteriormente desarrolló nefropatía crónica del injerto, y finalmente pérdida del injerto a los 16 meses del trasplante.
En la cohorte de sujetos con LES en el modelo multivariante el tiempo de diálisis (HR 0,99, IC del 95%, 0,96-1,03, p=0,95), el tipo de injerto (HR 1,38, IC del 95%, 0,42-4,57, p=0,59), la presencia de LES de inicio juvenil (HR 2,34, IC del 95%, 0,32-16,88, p=0,39), la nefropatía crónica del injerto (HR 1,25, IC del 95%, 0,22-6,93, p=0,79) y la RNL (HR 2,14, IC del 95%, 0,24-18,42, p=0,48) no predijeron la pérdida del injerto. El modelo que mejor explicó la pérdida del injerto en los sujetos con LES estuvo conformado por las variables rechazo agudo (HR 16,5, IC del 95%, 1,94-140,1, p=0,01), empleo de ácido micofenólico (HR 0,3, IC del 95%, 0,04-2,31, p=0,25) y ciclosporina A (HR 0,22, IC del 95%, 0,02-2,01, p=0,18); estas 2 últimas variables con efecto protector aunque sin lograr significación estadística.
DiscusiónEn nuestro estudio, la supervivencia global del injerto evaluada mediante las curvas de Kaplan-Meier demostró que la tasa de supervivencia fue similar al grupo de comparación. Sin embargo, después del ajuste para posibles factores de confusión, los receptores con LES demostraron un incremento del riesgo del 95% de pérdida del injerto en comparación con el grupo control, aunque esta diferencia no fue estadísticamente significativa, lo cual podría ser debido a la baja potencia estadística del estudio, y se requiere un estudio futuro con mayor número de sujetos para descartar esta posibilidad. La importancia del ajuste de las posibles variables confusoras radica en que el riesgo puede cambiar al incluirlas en el análisis. En el estudio de Chelamcharla et al.20, se encontró una mejor supervivencia del injerto en los sujetos con LES en el análisis de Kaplan-Meier; sin embargo, el análisis multivariado demostró un peor resultado. Por el contrario, Ward21 encontró en el análisis univariado un riesgo de pérdida del injerto significativamente mayor en los sujetos con LES, pero el riesgo fue similar en el análisis multivariado.
La mayoría de los estudios que comparan la supervivencia entre los sujetos con LES con otras causas de enfermedad renal reportan una supervivencia similar entre los grupos3,10,22–29, en tanto que otros reportan una menor supervivencia del injerto y tasas ligeramente más altas de rechazo del injerto en los sujetos con LES13,20,30,31. Esta discordancia puede ser debida tanto por la población incluida, a que los tiempos de seguimiento son distintos, a la heterogeneidad en la selección de los grupos de comparación (controles históricos, la inclusión o no de diabéticos, glomerulonefritis distintas del LES o todas las causas de ERT sin LES), como por el año de publicación. La supervivencia a 2 años en 1975 era del 66%4; en la década de los noventa, la sobrevida al año, 5 y 10 años fue del 68-81,7%, el 45,9-80% y el 18,5%, respectivamente13; en la última década, se ha incrementado al 89,5-100%, el 67-93% y el 57-86%13,18,24, respectivamente. La supervivencia a 15 y 20 años es del 62-733,24,28 y el 33-52%20,24, respectivamente.
En los estudios con sujetos latinoamericanos la supervivencia del injerto es similar a los grupos de comparación8,9. En sujetos colombianos, la supervivencia reportada es del 92-96% al año, el 82-83% a los 5 años y el 71% a 15 años8,10; del 94% al año, el 74-79,9% a los 5 años y el 73% a los 10 años en sujetos mexicanos32; y del 93% al año, el 80-90,9% a los 5 años y el 68-85,7% a los 10 años en sujetos de Brasil11,17,18. La RNL varía entre el 0 y el 54% en los estudios3,18,33; este amplio rango puede ser debido a la etnicidad y si la biopsia se hace por protocolo o por indicación clínica. La recurrencia clínicamente significativa en los estudios se encuentra entre el 2 y el 19%4,6,22,23,29, y por protocolo entre el 30 y el 54%3,28. En países latinoamericanos, la RNL de acuerdo con el país de estudio fue: México del 4-7,4%9,32, Colombia del 3%8,10 y Brasil del 0-11%11,18. Aunque la RNL aumenta el riesgo de fracaso del injerto, solo del 2-7% de las pérdidas del injerto son atribuibles a esta, en comparación con el 43% atribuible al rechazo29,31,34. Al igual que en nuestros resultados, el rechazo agudo es un factor que se asocia de forma significativa a la pérdida del injerto en los sujetos con LES, aunque el riesgo de rechazo agudo no es distinto del riesgo del grupo de comparación8,32. La frecuencia del rechazo agudo en pacientes con LES varía entre los estudios; algunos reportan una mayor tasa28,35, otros reportan una frecuencia similar al grupo de comparación3,20,21,30 y, por el contrario, Yu et al.23 reportaron una menor frecuencia.
En los pacientes con LES aún existe controversia de cuáles son los factores asociados a la pérdida del injerto renal, los más frecuentemente descritos son: ser un receptor más joven, no recibir terapia de inducción, tener una terapia inmunosupresora con 2 fármacos, múltiples transfusiones de sangre, mayor índice de comorbilidad, mayor peso corporal, la raza afroamericana del donante o del receptor, donador cadavérico, el tiempo en diálisis, un menor número de haplotipos compartidos, el consumo de tabaco, la presencia de rechazo agudo, la falta de cumplimiento con la terapia, la trombosis de la arteria o vena renal y el retraso en la función del injerto1,3,13,17,22,24,30,31,34. Por el contrario, el uso de ácido micofenólico, tacrolimús y la ausencia de AAF parecen estar relacionados con una mejor supervivencia del injerto renal22. La persistencia de alteraciones serológicas (dsDNA elevados y/o hipocomplementemia) en el momento del TR no se asocia a la pérdida del injerto36.
Al igual que en otras etiologías de IRT, la causa principal de pérdida del injerto es la nefropatía crónica del injerto (8-35%)8,23,37,38. En nuestro estudio, un paciente en tratamiento con ciclosporina después del trasplante presentó toxicidad por ciclosporina, un factor de riesgo de nefropatía crónica del injerto39, con mejoría de la función renal con su suspensión y no desarrolló nefropatía crónica.
Similarmente a lo descrito9,15,18,32, no se encontró asociación entre la pérdida del trasplante y el tiempo de diálisis. En la práctica clínica, el momento óptimo del trasplante es motivo de controversia. En general, la mayoría de los autores recomiendan iniciar diálisis antes del trasplante y esperar hasta que el LES se encuentre en remisión completa de 6 a 12 meses9,14,23, especialmente entre los pacientes con progresión rápida a IRT, para verificar que no ocurra una recuperación espontánea de la función renal40. Por el contrario, otros estudios han demostrado un mejor resultado en los pacientes con menor tiempo en diálisis22,29,41 y sin diálisis previa4,33,39.
Debido a que los eventos trombóticos suelen resultar en la pérdida del injerto, por la ausencia de vasos colaterales, la presencia de AAF es una preocupación por el riesgo de trombosis. En algunos estudios se ha descrito un mayor riesgo de trombosis en sujetos con LES9,15,27,28,42,43, en tanto que en otros la trombosis como una causa de fallo del injerto no es diferente de los controles3,20,44. En nuestro estudio, una paciente con LES con AAF negativos en 3 ocasiones y sin morbilidad obstétrica presentó trombosis de la vena renal; el diagnóstico de SAF no se puede descartar en su totalidad por 2 razones: podría existir la posibilidad de presentar anticuerpos dirigidos contra fosfolípidos o cofactores que no se evalúan en la práctica clínica (protrombina, fosfatidiletanolamina, anexina v o el complejo vimentina/cardiolipina) que pueden ocasionar el conocido SAF seronegativo45; por otra parte, se ha descrito el caso de 2 sujetos que presentaron pérdida repetitiva del injerto renal por complicaciones trombóticas con AAF negativos, los cuales fueron positivos antes del 3 trasplante22. Los AAF pueden desempeñar un papel en la pérdida temprana del injerto, por lo cual se recomienda su detección sistemática y repetición en el tiempo en el período pretrasplante4,18,22.
El perfil del paciente con LES que somete a TR difiere de las otras causas de ERT, especialmente porque son más jóvenes, predomina en mujeres y tienen menos comorbilidades3. A pesar de las controversias planteadas previamente, el TR puede ser la mejor alternativa de sustitución de la función renal debido a que ofrece una supervivencia significativamente mejor que la diálisis peritoneal o hemodiálisis3,4,46,47, el pronóstico a 10 años es equiparable al de otras etiologías de ERT, puede ofrecer una mejor calidad de vida en comparación con la diálisis, así como un menor costo en el largo plazo6.
Nuestros resultados deben interpretarse con reserva debido a sus limitaciones, las cuales incluyen: un número reducido de casos, el diseño retrospectivo de nuestro análisis y que en la revisión de los registros clínicos no se pudieron obtener en todos los casos los factores de riesgo descritos. Sin embargo, consideramos útil la descripción de los desenlaces del TR en nuestra población, ya que nuestros resultados son consistentes con los de los estudios previos. No obstante, se considera necesario realizar estudios futuros en los cuales se lleve el registro sistemático de los factores de riesgo mencionados para poder realizar un análisis de forma prospectiva.
Consideraciones éticasEl estudio se realizó conforme a los lineamientos éticos de investigación en seres humanos. Contó con aprobación de los comités locales de ética e investigación de ambos hospitales, con los registros: R-2014-3501-4 y R-2011-3601-75.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.