Los antagonistas del TNF (tumor necrosis factor ‘factor de necrosis tumoral’) han significado un gran avance en el tratamiento de la artritis reumatoide (AR) desde su introducción a finales de la década de 1990. El desarrollo de producto ha sido similar para los 3 anti-TNF licenciados en la actualidad para el tratamiento de la AR: etanercept, infliximab y adalimumab. Los primeros estudios se centraron en los pacientes con enfermedad activa y refractaria a varios tratamientos modificadores de la enfermedad, por lo que se han obtenido diferencias muy significativas frente a placebo o metotrexato (MTX) en los índices de mejoría del American College of Rheumatology (ACR). Los ensayos en los pacientes no tratados con MTX muestran una diferencia menos notable entre los anti-TNF y el MTX, que se hace más significativa para la combinación de MTX con anti-TNF. En este manuscrito se analizan los resultados de los estudios de registro de los anti-TNF así como otros índices de mejoría, como calidad de vida, reducción del riesgo cardiovascular, efectividad mantenida en el tiempo y progresión de lesiones articulares. También se plantea la posibilidad de tratar con dosis menores a las autorizadas para AR y se analiza la afección de mal pronóstico de los pacientes refractarios a MTX, que actualmente es la indicación para el uso de anti-TNF en AR según el consenso de la Sociedad Española de Reumatología.
Anti-TNF drugs have represented a great advancement in the treatment of rheumatoid arthritis since their introduction in the late 1990s. The development of these products has been very similar for etanercept, infliximab and adalimumab, the 3 approved TNF blockers for the treatment of RA. The first studies centered their attention on patients with active disease and refractory to several disease modifying treatments, finding very significant differences when compared to placebo or methotrexate in the ACR improvement scores. Trials in patients who had not been previously treated with methotrexate show less differences between anti-TNF and methotrexate, but becomes more significant when the two drugs are used combined. In this manuscript we analyze the results of the registry of anti-TNF studies with regard to other improvement indexes such as quality of life, reduction in cardiovascular risk, maintained efficacy through time and progression of joint erosions. We also contemplate the possibility of using lower doses than those authorized for rheumatoid arthritis and analyze factors related to a poor prognosis in patients refractory to methotrexate, which is currently the indication for the use of anti-TNF in RA accordiong to the SER consensus.
El conocimiento de los mecanismos moleculares del proceso inflamatorio en la artritis reumatoide (AR) ha permitido encontrar unas dianas terapéuticas que están cambiando las expectativas de los pacientes.
En la actualidad se dispone de fármacos capaces de actuar en el proceso inmune en varios niveles, el bloqueo de citocinas, la coestimulación de las células T o la eliminación de las subpoblaciones de células B.
Desde hace una década se dispone de moléculas capaces de inhibir la acción del TNF (tumor necrosis factor ‘factor de necrosis tumoral’), una citocina que desempeña un papel especialmente relevante en la génesis del proceso inflamatorio.
El TNF ejerce su acción mediante unos receptores de diferente peso molecular (p75 y p55) que se sitúan en la membrana celular y se desprenden como mecanismo regulador de la inflamación al inhibir competitivamente la unión del TNF a la membrana. El etanercept une 2 receptores de p75 al fragmento c de una inmunoglobulina G humana, de forma que es capaz de unirse a 2 moléculas de TNF y evitar su acción sobre los receptores de membrana. Otro mecanismo de inhibición es mediante anticuerpos específicos contra el TNF, que pueden ser de origen quimérico (infliximab) o humano (adalimumab). A finales de la década de 1990 comenzaron a aparecer los primeros resultados de pacientes con AR tratados con fármacos anti-TNF. Inicialmente se estudió el efecto de los anti-TNF en pacientes muy activos y refractarios a varios fármacos modificadores de la enfermedad (FAME) en los que se observó una mejoría muy significativa. Posteriormente se ha investigado el comportamiento de los anti-TNF en formas de inicio, aunque en estos pacientes las diferencias no son tan notorias como en las formas establecidas.
El criterio de mejoría ACR es el más comúnmente utilizado en los primeros estudios; posteriormente se han usado otras herramientas para valorar la mejoría inducida por estos fármacos, como calidad de vida, actividad de la enfermedad, supervivencia del fármaco o progresión radiológica.
Después de una década de utilización en pacientes con AR se puede decir que el uso del anti-TNF ha supuesto un cambio en la evolución de la enfermedad y una mejora en las expectativas de los pacientes. En este artículo se revisan los datos de eficacia del anti-TNF que se han publicado.
Revisión de los datos de eficacia- 1.
Eficacia medida por mejoría ACR
En este apartado resulta esencial para el análisis conocer los criterios de selección de pacientes, respecto al tiempo de evolución y si son pacientes refractarios a metotrexato (MTX).
Los criterios de inclusión del estudio inicial de Moreland1 exigían al menos 10 articulaciones inflamadas, 12 articulaciones dolorosas y el fracaso de hasta 4 FAME previos. Tras retirar los FAME durante un mes como período de lavado, se comparan 3 dosis de etanercept (0,25; 2 o 16mg/m2) frente a placebo durante 3 meses. En este estudio destaca la rápida reducción del número de articulaciones afectadas y los porcentajes de mejoría ACR, con diferencias significativas entre las 2 dosis superiores de etanercept y la dosis inferior (0,25mg/m2), con resultados similares al grupo de placebo. El ACR 20 y el ACR 50 fueron del 75% para la dosis superior frente al 14% del grupo placebo, pero con la dosis intermedia se obtuvo un 46%. Tras suspender a los 3 meses el tratamiento con etanercept, los recuentos de articulaciones inflamadas y dolorosas volvían a los valores previos. En el estudio anterior, sólo del 27 al 40% de los pacientes había recibido MTX; en los estudios posteriores de etanercept e infliximab, los criterios de inclusión seleccionaron pacientes con AR activa —definida como más de 6 articulaciones inflamadas y dolorosas— y pacientes refractarios2–5. Estos estudios utilizan placebo más MTX como comparador frente al grupo de anti-TNF, que se administra solo o asociado a MTX. En el estudio ARMADA6 este diseño se siguió posteriormente con adalimumab.
La efectividad se mide en estos estudios con diferentes herramientas, probablemente de las que los porcentajes de mejoría ACR 20, ACR 50 y ACR 70 eran el foco de atención de los lectores; todos se mostraban más eficaces que placebo con pequeñas diferencias, pero no es posible deducir una mayor efectividad por la heterogeneidad de los pacientes. Se suele decir que las gráficas del ACR muestran un patrón del 60, 40 y 20 como regla mnemotécnica para los ACR 20, ACR 50 y ACR 70.
De acuerdo con la teoría de la «ventana de oportunidad», se ha evaluado la acción de anti-TNF en AR de inicio; aunque no hay un criterio fijo a la hora de decidir qué tiempo se considera AR de inicio, la característica común de estos pacientes era no haber recibido MTX y tener una evolución menor de 3 años.
En el estudio ASPIRE7, el infliximab incluye pacientes con AR de menos de 3 años de evolución y enfrenta 2 dosis de infliximab (3 o 6mg/kg con MTX en escalada a 20mg semanales) frente a MTX más placebo durante un año. Los valores ACR en los 3 grupos fueron superiores a los que se obtuvieron en la AR refractaria a MTX, sólo hubo diferencia estadística entre el grupo de placebo y la dosis de 3mg/kg en el ACR 20.
En el estudio PREMIER8 se compararon 3 grupos de tratamiento: adalimumab en dosis de 40mg cada 2 semanas, MTX en dosis de 20mg por semana y la combinación de ambos durante 2 años. En este estudio se analizó ACR 20, ACR 50, ACR 70 y ACR 90, en todos los casos con diferencias a favor de la combinación, pero los datos para el MTX son similares o superiores a los datos para el adalimumab.
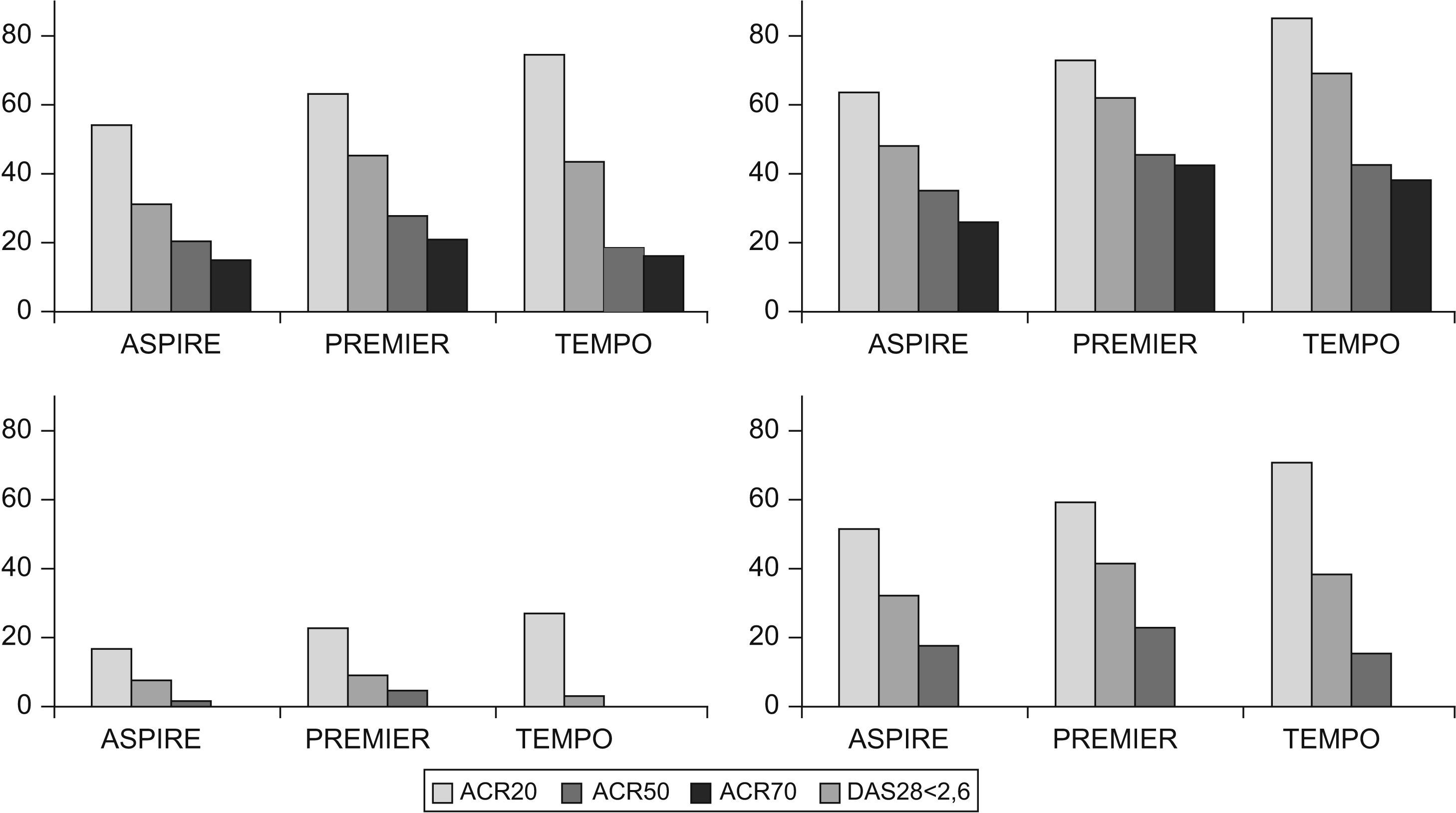
En el estudio ERA9, se compararon 2 dosis de etanercept de 10 y 25mg frente a MTX en escalada hasta 20mg semanales. No se encontraron diferencias en los porcentajes de mejoría del ACR entre las 2 dosis de etanercept y MTX. En la figura 1 se observan las diferencias analizadas en los estudios en los pacientes que no utilizaron MTX y aquellos pacientes refractarios; pueden observarse unas diferencias más acusadas en éstos últimos en cuanto a mejoría ACR.
Figura 1.Efecto del tratamiento previo con metotrexato (MTX) sobre la mejoría ACR alcanzada. En las gráficas superiores se muestran los porcentajes ACR obtenidos en pacientes no tratados previamente con MTX, en los estudios ASPIRE (infliximab en dosis de 3mg/kg), PREMIER (adalimumab en dosis de 40mg cada 2 semanas) y TEMPO (etanercept en dosis de 25mg 2 veces por semana). A la izquierda se encuentra la mejoría obtenida en los pacientes tratados sólo con MTX y a la derecha se encuentra la combinación de MTX con antifactor de necrosis tumoral (anti-TNF). En las gráficas inferiores se ven los resultados para monoterapia de MTX frente a MTX con anti-TNF en los estudios ATTRACT (infliximab en dosis de 3mg/kg), DE019 (adalimumab en dosis de 40mg cada 2 semanas) y etanercept en dosis de 25 mg, 2 veces por semana más MTX. Las diferencias en la eficacia obtenida en pacientes refractarios a MTX son superiores a las que se observan en los pacientes que no han recibido este fármaco. anti-TNF: antifactor de necrosis tumoral; MTX: metotrexato.
(0,18MB).El estudio COMET incluyó pacientes hasta con 2 años de evolución. y enfrentó un grupo con etanercept en dosis de 50mg por semana más MTX hasta 20mg. Este esquema se mantuvo durante un año y en el segundo año se crearon 4 ramas de tratamiento: la mitad de los que estaban con etanercept más MTX pasaron a etanercept en monoterapia y el resto continúuó con la combinación, mientras que los que estaban con MTX se dividieron en monoterapia de MTX o combinación con etanercept. Se han publicado los resultados del primer año10. Los resultados de este estudio muestran unos valores ACR para la rama de MTX similares a los obtenidos con la combinación de MTX más anti-TNF en los pacientes refractarios a MTX y la combinación con etanercept es significativamente superior, con ACR 20 del 85,9 frente al 67,1%, con ACR 50 del 70,7 frente al 49%, con ACR 70 del 48,4 frente al 28,4% y con ACR 90 del 14,1 frente al 9,5%.
Los estudios con anti-TNF en los pacientes que no habían recibido MTX muestran en general una eficacia ACR similar para MTX y anti-TNF (etanercept o adalimumab) y sólo la combinación resulta más eficaz. Otra cosa sucede cuando se analizan los datos de progresión radiológica, claramente favorable a la combinación en todos los estudios que la contemplan, como se verá posteriormente. En la figura 1 se observan las diferencias que se encontraron en los estudios en los pacientes que no utilizaron MTX y aquellos pacientes refractarios, pueden observarse unas diferencias más acusadas en éstos últimos en cuanto a mejoría ACR.
- 2.
Inducción de remisión
La remisión de la AR se asimila a la obtención de un ACR 70 o un DAS28 (Disease Activity Score) inferior a 2,6. De forma similar a lo que ocurre con la mejoría ACR, el fracaso con MTX marca las diferencias. En los estudios con pacientes refractarios a MTX se obtuvo ACR 70 entre el 10 (estudio ATTRACT) y el 27% (estudio ARMADA); en cambio, cuando se trata de pacientes no expuestos a MTX el ACR 70 llega al 48% en el estudio COMET. La refractariedad a MTX tiene más relevancia que el tiempo de evolución en el porcentaje de ACR 70, como se demuestra en el estudio TEMPO que incluye pacientes con una media de 6,8 años de evolución de la AR que no habían recibido MTX y consigue un 43% de ACR 70.
En los estudios realizados con pacientes que no habían usado MTX, las ramas de tratamiento con MTX obtienen ACR 70 entre el 19 y el 21%, similar a las cifras que se consiguen con la combinación de MTX con anti-TNF en pacientes refractarios a MTX.
- 3.
Eficacia persistente
Se dispone de estudios que demuestran la persistencia de la efectividad de etanercept y adalimumab a largo plazo. El etanercept tiene experiencia de hasta 10 años de tratamiento13,14 en 1.272 pacientes incluidos en los estudios de registro, con 714 AR establecidas y 558 AR de inicio. A los 10 años, continuó en tratamiento un 48% de los pacientes con ACR 20, ACR 50 y ACR 70 en el 75, 47 y 28%, respectivamente; la causa de retirada fueron los efectos adversos en un 23% y la falta de eficacia en el 21%.
El adalimumab dispone de un seguimiento de 7 años para 1.469 pacientes incluidos en los estudios de registro15 (ARMADA, STAR, DE019, DE005 y DE037). Un 60% de los pacientes continuaba en tratamiento después de 7 años.
Tras 7 años el ACR 20 fue del 65%, el ACR 50 fue del 43% y el ACR 70 fue del 26%, con un 34% de pacientes con DAS 28 inferior a 2,6.
- 4.
Mejoría de la calidad de vida
A las pocas semanas de iniciar el tratamiento con anti-TNF se observó una mejoría en el número de articulaciones inflamadas y dolorosas, y una reducción de los parámetros de inflamación como reactantes de fase aguda. De forma paralela a esto, siempre se produce una mejoría en la calidad de vida que puede medirse con diferentes herramientas clínicas: el cuestionario HAQ autoaplicado que explora la capacidad del paciente para realizar las labores cotidianas, por su facilidad de uso respecto a otros métodos como el cuestionario de salud SF-36, es la herramienta más utilizada para medir la calidad de vida13. En el estudio ARMADA6 se obtuvieron diferencias significativas en la reducción del DAS con las 3 dosis utilizadas de adalimumab (20, 40 y 80mg cada 2 semanas) respecto a placebo desde la semana 12; en los estudios equivalentes de etanercept a infliximab, se obtuvieron resultados similares.
La posibilidad de mantener el trabajo es un índice de calidad de vida asociado a una situación clínica más favorable. En un estudio se comparó el efecto sobre la capacidad de mantener el empleo en 239 pacientes tratados con etanercept respecto a un grupo control de 259 pacientes no tratados con anti-TNF. El 71% de los pacientes tratados con etanercept mantuvo el empleo al año del tratamiento frente al 55% del grupo control14. El infliximab y el adalimumab tienen datos igualmente favorables respecto al mantenimiento de la capacidad laboral en los pacientes con AR de inicio y AR establecida6,15.
- 5.
Detención de las lesiones radiológicas
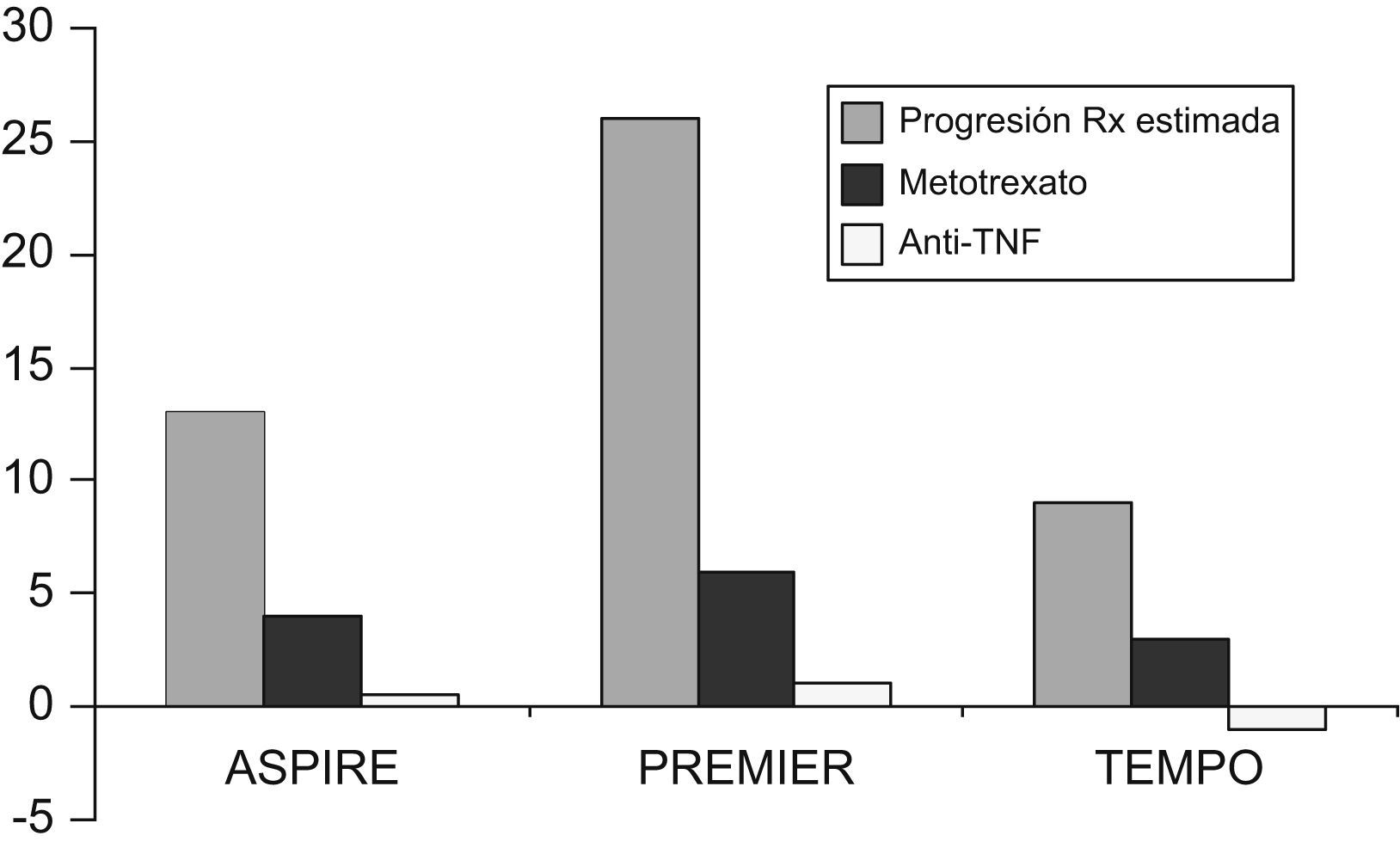
Cuando se ha analizado la respuesta de los 3 anti-TNF en artritis no tratadas previamente con MTX, las diferencias respecto a MTX han sido menores de lo esperado en los pacientes que no se trataron con MTX, sin que se obtuviera significación estadística en los porcentajes de mejoría ACR, salvo la asociación entre anti-TNF y MTX. Sin embargo, en todos los análisis realizados en los estudios ERA y PREMIER8,9, se observaron diferencias significativas con los 3 anti-TNF en cuanto a la progresión de las lesiones radiológicas. Estas diferencias son aun mayores para la combinación de MTX con anti-TNF en los estudios de adalimumab o etanercept; el estudio ASPIRE no tiene rama de tratamiento con infliximab sin MTX7–9. La combinación de etanercept con MTX consiguió reducir el recuento total por debajo del valor inicial tanto en pacientes no refractarios a MTX como en pacientes con AR de inicio o en pacientes con AR establecida10,11. En la figura 2 puede observarse la diferente progresión radiológica obtenida en los pacientes que no habían recibido MTX.
Figura 2.Datos sobre progresión radiológica en los pacientes no tratados previamente con (metotrexato) MTX. Datos procedentes de los estudios ASPIRE (infliximab en dosis de 3mg/kg más MTX), PREMIER (adalimumab en dosis de 40mg cada 2 semanas más MTX) y TEMPO (etanercept en dosis de 25 mg 2 veces por semana más MTX). Si en estos estudios la diferencia en ACR es menos expresiva que en los pacientes refractarios a MTX, la progresión radiológica es favorable en todos los casos a los pacientes tratados con antifactor de necrosis tumoral más MTX. anti-TNF: antifactor de necrosis tumoral; MTX: metotrexato.
(0,07MB).En el caso de los pacientes con enfermedad establecida refractaria a MTX, también se observaron diferencias a favor de la combinación de MTX con anti-TNF en todos los casos. Resulta significativo que dentro del estudio ATTRACT los pacientes que no obtienen mejoría ACR 20 se observe una menor progresión radiológica en los tratados con infliximab12.
La radiología convencional ha sido tradicionalmente la herramienta utilizada para cuantificar la progresión de las lesiones osteocartilaginosas inducidas por el fenómeno inflamatorio. Actualmente se dispone de métodos capaces de detectar de forma más precoz estas lesiones, como la resonancia magnética (RM) y la ecografía articular con Power Doppler.
La RM es capaz de detectar edema óseo y sinovitis de forma precoz, mientras que la radiografía convencional no es capaz de encontrar lesiones. Su alto coste y la imposibilidad de estudiar un gran número de articulaciones limitan su uso en la práctica diaria. En los pacientes con artritis de inicio se pueden observar diferencias significativas en la presencia de sinovitis y erosiones entre los pacientes tratados con MTX frente a la combinación con infliximab y MTX al año de tratamiento16. La imagen de sinovitis puede mostrar con la RM reducción a las 6 semanas de iniciar el tratamiento con etanercept17.
La ecografía se perfila progresivamente como una herramienta capaz de detectar cambios precoces en la articulación inflamada, con sensibilidad al cambio inducido por los tratamientos. Además de los factores económicos, la disponibilidad en la propia consulta y la capacidad de explorar múltiples articulaciones la convierten en un examen complementario muy útil en Reumatología. En un estudio realizado sobre 376 pacientes con AR que iban a iniciar tratamiento con anti-TNF, se midieron datos clínicos y parámetros ultrasónicos en 278 de éstos. Las gráficas de reducción de DAS 28 y DAS 28 modificado ultrasónico, que contempla la existencia de sinovitis, líquido sinovial y señal Power Doppler, muestran un comportamiento similar con curvas paralelas. La reducción de los parámetros ultrasónicos se aprecia desde el primer mes de tratamiento. Los autores concluyen la utilidad del método de ultrasonografía Power Doppler como predictor de progresión radiológica.
- 6.
Reducción del riesgo cardiovascular
Una de las complicaciones de las enfermedades inflamatorias crónicas es la aterogénesis acelerada, con las complicaciones cardiovasculares como principal causa de mortalidad en la AR18–20. La producción de arteriopatía está en relación con la actividad inflamatoria de la enfermedad, medida por parámetros clínicos y reactantes de fase aguda, de forma que puede considerarse la arteriopatía como una manifestación extraarticular de la AR.
La medición del tamaño de la íntima en la zona de la carótida es un índice que se ha aceptado como prueba de aterosclerosis subclínica21 y permite establecer situaciones de riesgo en los pacientes con AR, correlacionada con el aumento de la proteína C reactiva, las citocinas, las moléculas de adhesión, el tabaquismo y la edad de aparición22. El tratamiento con FAME así como con anti-TNF condiciona una regresión del grosor de la íntima en la zona de la carótida23,24 y una reducción del riesgo cardiovascular inducido por la AR. En un estudio multicéntrico con más de 4.000 pacientes con AR en 15 países, la prevalencia global de episodios cardiovasculares fue del 9,3%, con infarto de miocardio en el 3,2% e ictus en el 1,9%. Los tratamientos prolongados con MTX, sulfasalacina, leflunomida y anti-TNF se asociaron a una reducción del riesgo en la calidad de vida25.
- 7.
Reducción de la dosis
Hasta ahora se han visto datos de eficacia de anti-TNF en AR que no hacen otra cosa que apoyar la sensación que tienen los clínicos desde que empezaron a usarse estos fármacos en los pacientes con AR moderada o grave. En los estudios de registro se han utilizado dosis diferentes de anti-TNF; en el caso de etanercept se ha probado con dosis de 10 o 25mg 2 veces por semana y 50mg en una dosis por semana, con infliximab se han probado dosis de 3, 5, 6 y 10mg/kg de peso cada 4 a 8 semanas, y con adalimumab se ha probado con 20, 40 y 80mg por semana o cada 2 semanas. En el caso del etanercept la dosis que se utiliza en la indicación del tratamiento para la AR es la máxima, pero si se analiza el estudio ERA9, ambas dosis (10 y 25mg) tienen respuesta clínica. En el estudio ARMADA con la dosis de 20mg se obtiene respuesta ACR 20 significativamente superior a placebo. No hay estudios con infliximab en dosis inferiores a 3mg/kg cada 8 semanas que esté autorizada para el tratamiento de la AR.
Hay escasa experiencia de reducción de dosis en pacientes en tratamiento con anti-TNF, pero se han publicado series pequeñas de pacientes con etanercept o con adalimumab en los que, una vez alcanzada una mejoría suficiente medida por ACR 50 o DAS 28 inferior a 2,6 (después de al menos 6 meses de tratamiento), se reduce la frecuencia de etanercept a una dosis semanal26. Con adalimumab también hay descripciones con reducción de dosis27, pero sólo en la guía clínica de prescripción de anti-TNF de la Sociedad Británica de Reumatología se contempla la posibilidad de reducir la dosis de anti-TNF de forma no sistemática y como opción para considerar en pacientes en remisión clínica28. En nuestro hospital es práctica habitual intentar reducir la dosis de etanercept o adalimumab en pacientes en remisión clínica, si bien es cierto que el porcentaje de casos que admiten la reducción de etanercept es de un 15%.
Hay argumentos a favor y en contra de la reducción de dosis. Entre los argumentos a favor se encuentran el coste, los posibles efectos secundarios, la variabilidad farmacocinética interindividual y lo que se ha llamado «efecto techo». En estudios de registro con infliximab no se observa más eficacia con 10mg/kg que con 3mg/kg, algo parecido pasa con adalimumab en dosis de 0,5 frente a 1, 3 y 5mg/kg5,29. Entre los argumentos en contra se encuentra el desconocimiento de la capacidad para evitar la destrucción articular, la aterogénesis o las complicaciones sistémicas.
En el estudio ERA la detención del índice de Sharp a 2 años es del 51% para MTX, del 53% para etanercept en dosis de 10mg y del 63% para etanercept en dosis de 25mg; en el caso de infliximab se vio cómo frenaba la progresión radiológica en pacientes sin respuesta clínica12. En cualquier caso, el argumento de la variabilidad farmacocinética individual es bien conocido en el caso de MTX, ya que todos tienen experiencia con pacientes que requieren dosis muy diferentes para controlarse, desde 7,5 hasta 25mg semanales.
Los fármacos anti-TNF se han mostrado eficaces en los pacientes con AR activa moderada o grave. Las diferencias frente a placebo son más notorias cuando se habla de enfermedad refractaria a MTX que si se contemplan los pacientes que aún no han utilizado MTX, habitualmente formas más iniciales o con menor actividad inflamatoria. En los estudios de registro se encuentran porcentajes de mejoría de ACR 20, ACR 50 y ACR 70 similares en los 3 fármacos licenciados en la actualidad para AR, en general siguen un patrón del 20, 40 y 60% para ACR 20, ACR 50 y ACR 70, respectivamente. En la AR no tratada con MTX se obtienen porcentajes de ACR superiores, pero la diferencia con los AR tratados con MTX es menor y sólo se obtiene mejoría significativa con la combinación de MTX más anti-TNF, especialmente en lo referente a detención de la progresión radiológica.
Un metaanálisis reciente de Alonso et al30 permite comparar los diferentes resultados obtenidos en los estudios sobre fármacos anti-TNF en la AR. En las recomendaciones del consenso de la Sociedad Española de Reumatología para el uso de los tratamientos biológicos en la AR se considera su uso en pacientes refractarios a TNF, salvo si hay factores de mal pronóstico o se trata de pacientes con actividad inflamatoria especialmente alta, con factores de riesgo positivos y antipéptico cíclico citrulinado (anti-PCC+) a altas diluciones, con compromiso de articulaciones de manos o nódulos, entre otros marcadores de mala evolución.
La mejoría inducida por el anti-TNF se puede evidenciar mediante la mejoría de la ACR, la inducción de remisión, la calidad de vida, la reducción del riesgo cardiovascular y la detención de las lesiones articulares medida por radiografía convencional, ecografía o RM. Se dispone de un seguimiento hasta de 10 años de los pacientes incluidos en los estudios de registro de etanercept y adalimumab, lo que da idea de la duración del efecto beneficioso así como de la supervivencia del fármaco.
Hay muy poca experiencia sobre la posibilidad de reducir la dosis de anti-TNF en los pacientes que alcanzan remisión, pero probablemente será uno de los aspectos a estudiar en los próximos años.
Puede decirse que la actividad persistente a pesar de MTX se comporta como un marcador de mal pronóstico, al igual que la refractariedad a anti-TNF. Si se analizan los resultados con un segundo tratamiento biológico, anti-TNF, rituximab o abatacept en pacientes refractarios a MTX con los obtenidos en pacientes refractarios a TNF, se observan porcentajes de mejoría ACR más bajos31.