Las manifestaciones extraglandulares del síndrome de Sjögren primario (SSp) acontecen en más del 50% de los pacientes. Las manifestaciones pulmonares ocurren en un 10% de los pacientes con SSp1. Presentan afectación subclínica un 50% de los pacientes, sin embargo la enfermedad pulmonar sintomática ocurre en el 10%. La enfermedad pulmonar intersticial es la afectación más común2–4. La enfermedad pulmonar quística es mucho menos frecuente. Esta complicación se caracteriza por focos de densidad pulmonar disminuida con paredes definidas y adelgazadas (espesor de pared menor de 4mm) y un diámetro de longitud mayor a 1cm5. A continuación se presentan los casos de 3 pacientes con enfermedad pulmonar quística asociada a SSp. Todos ellos cumplían los Criterios de Clasificación Americano-Europeo 2002 para el diagnóstico de síndrome de Sjögren (SS)6.
Se presentan los casos de 3 pacientes con SS primario, en los que se realizó el diagnóstico mediante TACAR de tórax de enfermedad pulmonar quísticaasociada junto a enfisema pulmonar centrolobulillar de predominio en campos superiores en 2 de los 3 pacientes que se presentansin encontrar asociación con otras enfermedades pulmonares. Si bien no se realizó un abordaje desde el punto de vista histológico, realizado en otros estudios publicados hasta la fecha.
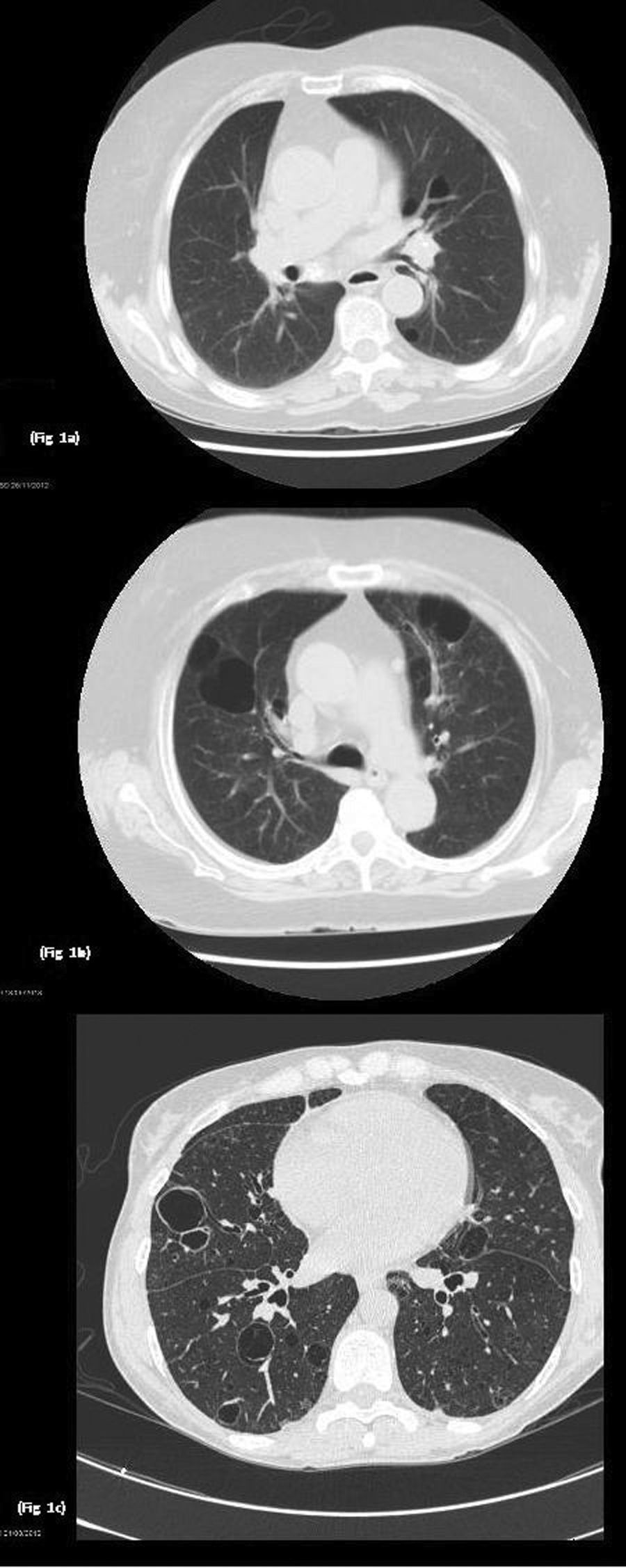
Paciente 1Mujer de 74 años diagnosticada de SSp de 18 años de evolución. Presentó manifestaciones extraglandulares tales como, vasculitis tipo PAN. En las pruebas de laboratorio desatacó hipergammaglobulinemia, anticuerpos anti-Ro y anti-La positivos. En tratamiento con azatioprina 50mg/día vía oral. Durante el seguimiento presentó disnea grado funcional II. Se realizaron pruebas funcionales respiratorias que fueron normales, la tomografía axial de tórax de alta resolución (TACAR) evidenció enfisema pulmonar centrolobulillar de predominio en lóbulos superiores e imágenes quísticas de paredes finas de predominio en campos inferiores (fig. 1a). Se mantuvo el mismo tratamiento sin presentar variaciones de dichas lesiones pulmonares en los sucesivos controles.
Imágenes TACAR: a) Se observa enfisema centrolobulillar e imágenes quísticas; b) Lesiones pulmonares quísticas bilaterales, algunas de ellas con septos en su interior, bronquiectasias por tracción en ambos lóbulos inferiores, áreas de enfisema pulmonar centrolobulillar y paraseptal y tractos fibróticos, y c) Se evidencian múltiples imágenes quísticas pulmonares de pared fina bilaterales.
Mujer de 46 años con diagnóstico de SSp de 20 años de evolución y mieloma IgA kappa. Como manifestaciones extraglandulares había presentado anemia, vasculitis leucocitoclástica, así como poliartritis y parotidomegalia. En tratamiento con hidroxicloroquina (HCQ) 200mg/día, pilocarpina 15mg/día vía oral y rituximab cada 6 meses. En las pruebas de laboratorio destacó aumento de reactantes de fase aguda, anemia y linfopenia, así como hipergammaglobulinemia con elevación de IgG y componente monoclonal IgA kappa. El factor reumatoide (FR), así como los anticuerpos anti-Ro y anti-La, fueron positivos. Durante el seguimiento presentó disnea de grandes esfuerzos. Se realizaron pruebas funcionales respiratorias, evidenciándose alteración de la ventilación restrictiva leve con ligera disminución de la DLCO, el TACAR de tórax puso de manifiesto lesiones pulmonares quísticas bilaterales, algunas de ellas con septos en su interior, de predominio en bases, bronquiectasias por tracción en ambos lóbulos inferiores, áreas de enfisema pulmonar centrolobulillar y paraseptal en lóbulos superiores junto a opacidades lineales y tractos fibróticos en ambas bases pulmonares (fig. 1b). Se mantuvo el mismo tratamiento, sin evidenciarse cambios de dichas lesiones quísticas en sucesivos controles.
Paciente 3Mujer de 78 años con diagnóstico de SSp primario de 15 años de evolución, y amiloidosis cutánea. Las manifestaciones eran predominantemente glandulares (xerostomía y xeroftalmía), sin presentar manifestaciones extraglandulares, en tratamiento con HCQ 200mg/día vía oral. En las pruebas de laboratorio destacó reactantes de fase aguda elevados, hipergammaglobulinemia policlonal IgG, FR, anticuerpos anti-Ro y anti-La positivos. Durante el seguimiento refirió disnea de moderados esfuerzos por lo que se solicitaron pruebas funcionales respiratorias que evidenciaron alteración de la ventilación restrictiva leve con grave disminución de DLCO. En el TACAR de tórax (fig. 1c) se evidenciaron múltiples imágenes quísticas pulmonares de pared fina bilaterales, no se observan nódulos ni áreas de afectación del espacio aéreo, sin cambios en controles sucesivos.
La enfermedad quística pulmonar es una entidad poco frecuente y raramente se asocia a enfermedad inflamatoria autoinmune. La prevalencia de quistes pulmonares en SSp varía entre el 12 al 30% del conjunto de manifestaciones pulmonares, pudiendo presentarse sin otros hallazgos radiológicos o en asociación con áreas de atenuación en vidrio deslustrado7-9. Se han planteado 2 mecanismos como hipótesis para la formación de dichos quistes pulmonares, ambos de los cuales implican la infiltración de linfocitos productores de inmunoglobulinas: un mecanismo de válvula, que causa cambios quísticos en la zona alveolar dilatada como resultado de la inflamación crónica y la infiltración linfoplasmocítica en las regiones periféricas; y la destrucción de la pared alveolar, en el que la infiltración linfoplasmocítica directa de los alvéolos destruye las estructuras alveolares y crea áreas quísticas. Siendo la implicación de ambos mecanismos el escenario más probable7,8,10. Se han publicado pocos casos de quistes pulmonares asociados a SSp, la mayoría son vistos de forma concomitante con otras enfermedades como neumonitis linfoide intersticial, proceso linfoproliferativo y amiloidosis pulmonar11,12. Como hallazgo característico común destacar la elevación de velocidad de sedimentación globular con hipergammaglobulinemia, presente en los tres casos, reflejo directo de la hiperactividad linfocitaria de la enfermedad. Comparados con los casos publicados no se diferencian en cuanto a hallazgos radiológicos característicos10, si bien se ha informado de una asociación significativa con la seropositividad para anti SSB/La y trastornos linfoproliferativos clonales que no hemos identificado en nuestros pacientes7.