Las vasculitis primarias de grandes vasos: la arteritis de células gigantes (ACG) y la arteritis de Takayasu (AT) son enfermedades inflamatorias crónicas que afectan principalmente las arterias elásticas de gran calibre. En la actualidad hay escasas evidencias que permitan conocer cuál es el mejor tratamiento en cuanto a eficacia y seguridad, así como la mejor estrategia para mantener la remisión y mejorar el pronóstico debido a que casi no hay estudios controlados sobre el tópico, por lo que en la mayoría de los casos el tratamiento se basa en el juicio del clínico. Los glucocorticoides e inmunosupresores están indicados si hay una clara evidencia de actividad. El enfoque tradicional consiste en el uso de glucocorticoides a dosis inmunosupresoras para el manejo de los episodios de actividad inflamatoria, seguido de inmunosupresores citotóxicos (metotrexato, azatioprina, ciclofosfamida o micofenolato de mofetilo) para mantener la remisión y disminuir el tiempo en corticoterapia. En fechas recientes, y dado el papel patogénico potencial del factor α de necrosis tumoral en estos padecimientos, hay reportes alentadores del uso de inhibidores de esta citocina en el tratamiento de pacientes refractarios al enfoque tradicional. Las lesiones que dejan como secuela oclusión o estenosis vascular habitualmente no son reversibles con el tratamiento médico, por lo que en ocasiones requieren de tratamiento quirúrgico (angioplastia o bypass), el cual debe realizarse solo cuando la actividad de la enfermedad esté controlada de forma adecuada.
Large vessels vasculitis: Giant cells arteritis (GCA), and Takayasu's arteritis (TA) are a pair of systemic chronic inflammatory diseases characterized by specific involvement of large caliber, elastic-layered arteries. Presently, and derived from the paucity of clinical controlled trials approaching the issue, the management of GCA and TA is largely based on the clinical judgment of the treating physician. Glucocorticoids and immunosuppressive drugs are used when clear evidence of inflammatory activity is observed. The traditional management approach is to start with systemic glucocorticoid therapy at immunosuppressive dose, followed by cytotoxic immunosuppressive drugs (methotrexate, azatioprine, cyclophosphamide or mycofenolate mofetil) aimed at maintaining remission and decreasing corticosteroid therapy time. Recently, based on the potential pathogenic role of tumor necrosis factor α in these diseases, a series of reports addressing the benefic effect of αTNF-blockers in patients who have been resistant to the traditional management approach have been published. Non- reversible vascular lesions (such as occlusion or stenosis) may require surgical treatment (stent or bypass), however this must be done only when a complete control of the inflammatory activity has been reached.
Las vasculitis primarias de grandes vasos - arteritis de células gigantes (ACG) y la arteritis de Takayasu (AT) - son enfermedades inflamatorias crónicas que afectan principalmente las arterias elásticas de gran calibre. Aunque algunos autores consideran que ambas enfermedades podrían ser el espectro de una misma enfermedad, existen diferencias demográficas y en las manifestaciones vasculares que obligan a clasificarlas de manera separada1.
La ACG afecta arterias de mediano y gran calibre sobre todo en vasos del cráneo y en especial la arteria temporal. Se presenta con mayor frecuencia en países occidentales en población caucásica. La edad de inicio es en pacientes mayores de 50 años con mayor afección en mujeres (2 a 3:1). Los síntomas clásicos son: cefalea, fiebre, polimialgia reumática, dolor en cuero cabelludo, pérdida visual y claudicación de la mandíbula.
La AT afecta principalmente grandes vasos como la aorta y sus ramas principales, así como las coronarias y arterias pulmonares. La inflamación y subsecuente proliferación de la íntima causan lesiones estenóticas u oclusivas, mientras que las lesiones que causan destrucción de las capas elástica y muscular causan dilataciones vasculares o aneurismas. Aunque su distribución es mundial, es más frecuente en Japón, Asia, África y Latino-América que en Norte América y Europa. Afecta con mayor frecuencia a mujeres menores de 40 años con una mayor incidencia entre los 10 y 24 años de edad. La relación mujer: hombre es de 8:1. Las principales manifestaciones clínicas son fiebre, pérdida de peso, artralgias, claudicación de extremidades afectadas, disminución o pérdida de pulsos, carotidinia, cefalea, amaurosis, diplopía, falla renal, eventos vasculares cerebrales, insuficiencia cardiaca, infarto agudo de miocardio y rotura de aneurismas2–5.
El diagnóstico de estas enfermedades suele retrasarse debido a lo inespecífico de los síntomas y a que no existen marcadores de laboratorio fiables que permitan valorar la actividad de la enfermedad; tampoco se han validado adecuadamente las diferentes técnicas de imagen disponibles actualmente. Lamentablemente no hay estudios controlados para tratar de ponderar el efecto del tratamiento, la raza y otros factores sobre el pronóstico de estos pacientes. Cabe señalar que con el uso de glucocorticoides e inmunosupresores se alcanzan índices de remisión altos pero también hay una alta frecuencia de recaídas sobre todo al iniciar la disminución de las dosis de los glucocorticoides3–18.
TratamientoDebido a que casi no hay estudios controlados sobre el tratamiento en las vasculitis de grandes vasos, no hay suficiente evidencia que permita conocer cuál es el mejor tratamiento en cuanto a eficacia y seguridad y la mejor estrategia para mantener la remisión y mejorar el pronóstico. En la mayoría de los casos el tratamiento se basa en el juicio del clínico.
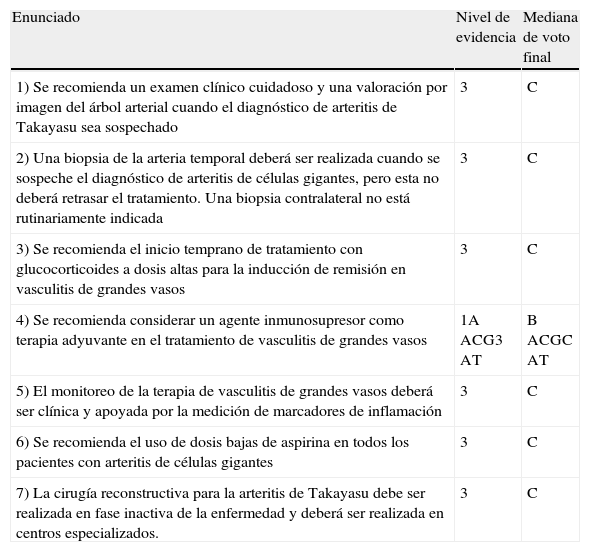
Recientemente el European League Against Rheumatism (EULAR) publicó recomendaciones para el manejo de vasculitis de grandes vasos basándose en una revisión sistemática de la literatura y un consenso de expertos (tabla 1). Son 7 recomendaciones, las cuales tienen un nivel de evidencia bajo pues solo hay estudios descriptivos y por lo tanto los grados de recomendación no son mayores de C19. En general el uso de glucocorticoides (GC) e inmunosupresores están indicados si hay una clara evidencia de actividad.
Recomendaciones para el manejo de vasculitis de grandes vasos del European League Against Rheumatism (EULAR)
| Enunciado | Nivel de evidencia | Mediana de voto final |
| 1) Se recomienda un examen clínico cuidadoso y una valoración por imagen del árbol arterial cuando el diagnóstico de arteritis de Takayasu sea sospechado | 3 | C |
| 2) Una biopsia de la arteria temporal deberá ser realizada cuando se sospeche el diagnóstico de arteritis de células gigantes, pero esta no deberá retrasar el tratamiento. Una biopsia contralateral no está rutinariamente indicada | 3 | C |
| 3) Se recomienda el inicio temprano de tratamiento con glucocorticoides a dosis altas para la inducción de remisión en vasculitis de grandes vasos | 3 | C |
| 4) Se recomienda considerar un agente inmunosupresor como terapia adyuvante en el tratamiento de vasculitis de grandes vasos | 1A ACG3 AT | B ACGC AT |
| 5) El monitoreo de la terapia de vasculitis de grandes vasos deberá ser clínica y apoyada por la medición de marcadores de inflamación | 3 | C |
| 6) Se recomienda el uso de dosis bajas de aspirina en todos los pacientes con arteritis de células gigantes | 3 | C |
| 7) La cirugía reconstructiva para la arteritis de Takayasu debe ser realizada en fase inactiva de la enfermedad y deberá ser realizada en centros especializados. | 3 | C |
ACG: arteritis de células gigantes. AT: arteritis de Takayasu.
El nivel de evidencia 1A es de metaanálisis de ensayos clínicos controlados, el 1B es de al menos un ensayo clínico controlado, el 2A es de al menos un ensayo clínico sin aleatorización, 2B es de al menos un estudio cuasi-experimental, el 3 es de estudios descriptivos y el 4 es de reportes de comités de expertos y/o experiencia clínica de autoridades respetadas. La fuerza de recomendación A se da cuando hay evidencia categoría 1, la B se da cuando hay evidencia de categoría 2 o recomendaciones extrapoladas de evidencia de categoría 1, la C se da cuando la evidencia es de categoría 3 o son recomendaciones extrapoladas de evidencia categoría 1 o 2, y la D es evidencia de categoría 4 o recomendaciones extrapoladas de evidencia categoría 2 o 3 (adaptado de la referencia 19).
Los pacientes con ACG con actividad de la enfermedad presentan frecuentemente cefalea asociada con síntomas constitucionales, claudicación de la lengua y mandíbula y hasta en un 30% alteraciones visuales que pueden causar ceguera. Ante la sospecha de ACG deben iniciarse GC a dosis altas con el objetivo de evitar nuevos eventos isquémicos. Para la inducción a la remisión se utilizan dosis de prednisona de 40 a 60mg por 4 semanas y posteriormente un esquema de reducción. En pacientes con pérdida visual reciente se pueden utilizar bolos de metilprednisolona (1g al día por 3 días), seguidos de prednisona 40 o 60mg al día por 4 semanas para continuar con el esquema de reducción hasta lograr una dosis de mantenimiento de 10 a 15mg. Aunque no hay suficiente evidencia, aparentemente el uso de los GC puede prevenir la pérdida visual si se utilizan oportunamente. Los síntomas que se resuelven más rápidamente son la fiebre, cefalea y claudicación mandibular (en días a semanas), pero la claudicación de extremidades puede tardar meses en mejorar y la pérdida visual puede ser permanente20–23. La toma de biopsia de la arteria temporal no debe retrasar el tratamiento con GC17. El uso de terapia en días alternos con GC no está recomendado, ya que no permite un adecuado control de la enfermedad24. Suele haber recaídas sobre todo cuando la dosis de prednisona es menor a 10mg al día. Se recomienda además el uso de aspirina a dosis bajas para ayudar a prevenir eventos isquémicos cardiovasculares y cerebrovasculares25. Para el mantenimiento puede utilizarse metotrexate en dosis de 7,5 a 15mg a la semana como ahorrador de GC y para disminuir el riesgo de recaídas, aunque no se disminuyen los eventos adversos asociados a GC26. También puede utilizarse azatioprina a dosis de 150mg al día (2 a 2,5mg/kg/día), reportándose un efecto benéfico a las 52 semanas de uso27. En cuanto al uso de biológicos, en un ensayo clínico aleatorizado, multicéntrico se empleó infliximab (5mg/kg) versus placebo en 44 pacientes que habían logrado la remisión con uso de GC; a las 22 semanas la proporción de pacientes con recaídas fue similar en ambos grupos (57 vs 50%, p=0,65) y no permitió ahorrar GC28. En otro estudio doble ciego, placebo controlado se utilizó etanercept y GC en un grupo pequeño de pacientes con ACG, reportándose buena respuesta en el 50% de los pacientes con uso del biológico y solo del 22,2% en el grupo placebo (sin diferencia significativa) y permitió disminuir la dosis de GC de forma más rápida29. El uso de otros biológicos como adalimumab y rituximab solo se han utilizado en casos aislados por lo que la evidencia para apoyar su uso es muy limitada.
Tratamiento de la ATEs difícil determinar actividad de la enfermedad en AT, pero la presencia de carotidinia o dolor en otros vasos sanguíneos, así como nuevos soplos o pérdida de pulsos y la elevación de reactantes de fase aguda como VSG, PCR o plaquetas, pueden ser indicadores clínicos de actividad, aunque en algunas ocasiones la enfermedad puede tener actividad subclínica. El objetivo del tratamiento es lograr y mantener la remisión, aunque en la AT no está bien definido cuando hay remisión. En cuanto al tratamiento quirúrgico, este debe realizarse solo cuando la actividad de la enfermedad esté controlada de forma adecuada20.
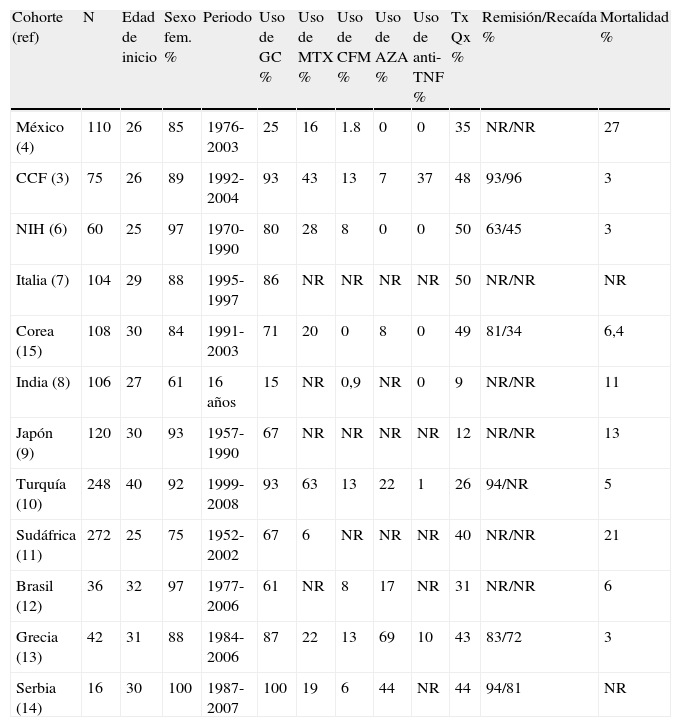
Aunque no hay estudios controlados, en la mayoría de las series se utilizan dosis altas de GC (0,5 a 1mg/kg/dia o 40-60mg/día de prednisona o equivalente) por 4 semanas y posterior esquema de reducción (uso de GC del 15-100%). No está clara la utilidad de los bolos de metilprednisolona en estos pacientes y depende del juicio clínico su uso en AT. Una vez controlados los síntomas de actividad y con la normalización de los reactantes de fase aguda, se inicia el descenso de los GC de 2,5 a 5mg por semana hasta llegar a 10mg/día y de 1mg/semanal hasta la suspensión o la presencia de una recaída. En caso de recaída se incrementa la dosis de prednisona a 10mg sobre la última dosis efectiva y si no estaba tomando un inmunosupresor, se agrega azatioprina o metotrexate. En el estudio de Park et al se encontró que los pacientes que utilizaron GC tuvieron remisión con mayor frecuencia (90,5 vs 58,8%, p= 0,004), mientras que con el uso de inmunosupresores también hubo una tendencia mayor a la remisión, pero no fue estadísticamente significativa15. Utilizando solo GC se logra la remisión del 20 al 60%, por lo que del 40 al 80% requieren de la adición de inmunosupresores para conseguir la remisión o para mantenerla. Los inmunosupresores también permiten ahorrar GC30. Los más utilizados en diversas series de pacientes son: (tabla 2).
Comparación de datos clínicos, demográficos y de tratamiento en cohortes de pacientes con arteritis de Takayasu.
| Cohorte (ref) | N | Edad de inicio | Sexo fem. % | Periodo | Uso de GC % | Uso de MTX % | Uso de CFM % | Uso de AZA % | Uso de anti-TNF % | Tx Qx % | Remisión/Recaída % | Mortalidad % |
| México (4) | 110 | 26 | 85 | 1976-2003 | 25 | 16 | 1.8 | 0 | 0 | 35 | NR/NR | 27 |
| CCF (3) | 75 | 26 | 89 | 1992-2004 | 93 | 43 | 13 | 7 | 37 | 48 | 93/96 | 3 |
| NIH (6) | 60 | 25 | 97 | 1970-1990 | 80 | 28 | 8 | 0 | 0 | 50 | 63/45 | 3 |
| Italia (7) | 104 | 29 | 88 | 1995-1997 | 86 | NR | NR | NR | NR | 50 | NR/NR | NR |
| Corea (15) | 108 | 30 | 84 | 1991-2003 | 71 | 20 | 0 | 8 | 0 | 49 | 81/34 | 6,4 |
| India (8) | 106 | 27 | 61 | 16 años | 15 | NR | 0,9 | NR | 0 | 9 | NR/NR | 11 |
| Japón (9) | 120 | 30 | 93 | 1957-1990 | 67 | NR | NR | NR | NR | 12 | NR/NR | 13 |
| Turquía (10) | 248 | 40 | 92 | 1999-2008 | 93 | 63 | 13 | 22 | 1 | 26 | 94/NR | 5 |
| Sudáfrica (11) | 272 | 25 | 75 | 1952-2002 | 67 | 6 | NR | NR | NR | 40 | NR/NR | 21 |
| Brasil (12) | 36 | 32 | 97 | 1977-2006 | 61 | NR | 8 | 17 | NR | 31 | NR/NR | 6 |
| Grecia (13) | 42 | 31 | 88 | 1984-2006 | 87 | 22 | 13 | 69 | 10 | 43 | 83/72 | 3 |
| Serbia (14) | 16 | 30 | 100 | 1987-2007 | 100 | 19 | 6 | 44 | NR | 44 | 94/81 | NR |
AZA: azatioprina; CCF: Cleveland Clinic Foundation; CFM: ciclofosfamida; GC: glucocorticoides; MTX: metotrexato; NIH: National Institutes of Health; NR: no reportado; Tx Qx: tratamiento quirúrgico.
La azatioprina a dosis de 2 a 2,5mg/kg/día (utilizada del 7 al 69%); el metotrexate a dosis de 7,5 a 25mg una vez a la semana (utilizado del 6 al 63%); Ciclofosfamida a dosis de 2mg/kg/día (utilizada del 1 al 13%) y mofetil micofenolato a dosis de 2g al día (en menos del 10%)3,4,6–15.
La remisión se logra en más del 80% en la mayoría de las series, pero las recaídas son muy frecuentes (34-96%). La duración de la remisión es variable con una media de duración de 22 meses3. En la cohorte de Cleveland solo se logró la remisión sostenida por más de 6 meses y con dosis de prednisona menores de 10mg en el 28%. Se documentó al menos una recaída en 27/28 (96%) pacientes que habían logrado la remisión. La mayoría de las recaídas ocurrieron mientras el paciente estaba tomando el tratamiento inmunosupresor (63%); la mediana de la dosis de prednisona al momento de la prednisona fue de 10mg/dia3. En el estudio y de Park et al no se encontraron variables asociadas con recaídas y no hubo diferencias significativas con el uso de GC e inmunosupresores en la aparición de nuevas lesiones vasculares por angiografía en el seguimiento de los pacientes15. Los países que utilizaron con menor frecuencia el tratamiento con glucocorticoides e inmunosupresores así como el tratamiento quirúrgico como México, Sudáfrica y la India también tuvieron una mayor mortalidad aunque esto podría tener implicaciones étnicas y socio-económicas3,4,6–15. En casos de pacientes refractarios al tratamiento convencional, el uso de agentes biológicos podría ser benéfico. Debido a que el factor de necrosis tumoral (TNF) es necesario en la formación de granulomas, parece lógico el uso de fármacos anti-TNF en la AT. En un estudio retrospectivo que incluyó 25 pacientes con AT refractaria a tratamiento (definida como falla en lograr la remisión con menos de 10mg/día de prednisona y al menos un agente inmunosupresor). Se estudiaron 21 pacientes tratados con infliximab (4-10mg/kg cada 4-8 semanas) y 9 pacientes con etanercept (25-50mg dos veces por semana), de los cuales 5 pacientes fueron cambiados a infliximab. En 6/9 (67%) de los pacientes con etanercept y en 18/21 (86%) de los pacientes con infliximab se logró una remisión completa o parcial. De forma global se logró la remisión y suspensión de la prednisona en 15 pacientes (60%) y se logró bajar la dosis de prednisona a menos de 10mg/día en otros 7 pacientes (28%). Las recaídas se presentaron en 3/6 (50%) de pacientes con etarnecept y en 12/18 (67%) de pacientes con infliximab. Muchos pacientes requirieron de escalamiento de la dosis para mantener la remisión. En cuanto a seguridad se presentaron 4 eventos adversos que incluyeron: un caso de histoplasmosis, un caso con cáncer de mama, un paciente con elevación de transaminasas y otro con náusea, diarrea e hipertensión. En diferentes series se ha reportado el uso de anti-TNF del 1 al 37%. Aun son necesarios estudios controlados para definir la utilidad de los anti-TNF en el tratamiento de la AT3,20,31,32.
Tratamiento concomitante: se recomienda el uso de bifosfonatos y suplementos de calcio para evitar la osteoporosis inducida por GC. El uso de dosis bajas de aspirina y agentes antiplaquetarios están recomendados para prevenir la formación de trombos en vasos con daño endotelial. Debido a que más del 70% de los pacientes con AT tienen hipertensión relacionada con coartación atípica o con afección renovascular, se recomienda un adecuado control con agentes antihipertensivos como calcio antagonistas, beta-bloqueadores y diuréticos20,33.
Tratamiento quirúrgico: las lesiones oclusivas o estenóticas habitualmente no son reversibles con el tratamiento médico, por lo que en ocasiones requieren de tratamiento de revascularización. Las intervenciones vasculares están indicadas cuando hay enfermedad cerebrovascular secundaria a la estenosis de vasos cervicocraneales; enfermedad arterial coronaria, insuficiencia aórtica de moderada a severa; coartación de la aorta; hipertensión renovascular, claudicación y aneurismas con riesgo de ruptura o disección30. La intervenciones vasculares deben realizarse cuando la enfermedad está inactiva y en centros especializados para obtener mejores resultados. El hazard ratio (HR) de restenosis posterior a un procedimiento en pacientes con enfermedad estable es de 0,3 y el HR en pacientes con uso de GC e inmunosupresores después del procedimiento es de 0,4. En pacientes con enfermedad activa hay restenosis en el 44,7% y solo en el 12% en aquellos con enfermedad inactiva. La frecuencia de restenosis en pacientes con tratamiento combinado, tratamiento solo con GC y sin tratamiento fue de 8,3, 40 y 50%, respectivamente3,20. En las series de casos se ha reportado el uso de tratamiento quirúrgico de 9 a 50% de los casos. En las cohortes de los Estados Unidos la angioplastia se realizó del 18,3 -54% y bypass en el 13-57%. La angioplastia está indicada cuando hay estenosis de más de 70% del diámetro normal del vaso o el gradiente del pico sistólico es de más de 50mm a través de la lesión aórtica. Tiene un éxito inicial en más del 90%, sin embargo, la restenosis puede presentarse hasta en 20 a 30% de los casos en un lapso de 3,5 a 13,6 meses y solo el 56% de las angioplastias son exitosas en el primer intento. Al parecer el uso de stents es más eficaz que la dilatación con balón con restenosis de 8 vs 46%3,33. Min et al reportan un estudio con 25 pacientes en los que se realizaron 58 procedimientos (19 solo con angioplastia y 39 con stents), en el que los pacientes con actividad recibieron tratamiento inmunosupresor antes del procedimiento. Se obtuvo éxito en el 90% de los casos y solo hubo restenosis en el 17% a los 23,7±18,4 meses34. En otro estudio en 20 pacientes que estaban usando GC, aspirina y ticlopidina antes del procedimiento (angioplastia percutánea), el procedimiento fue exitoso en 19/20 (95%) y solo hubo restenosis en 2 casos (10%)35. Recientemente se ha descrito el uso de stents impregnados con medicamentos inmunosupresores/antiproliferativos como el sirolimus que pueden disminuir la proliferación de la íntima y el riesgo de restenosis en pacientes con enfermedad arterial coronaria, pero se desconoce su utilidad en AT, pero podrían ser útiles30. En estudios de cohorte el bypass ha tenido mejores resultados que la angioplastia. A los 3 años, solo el 25% de las angioplastias no han requerido una reintervención comparado con el 68% de los bypass. En un estudio de seguimiento a 10 años la persistencia de éxito después de un bypass fue de 88% en carótida, de 64% en subclavia, de 100% en aorta, de 68% en renal y de 67% en mesentérica. Los aneurismas anastomóticos fueron vistos en el 13,8% de los casos en 20 años3,36. En el estudio de Kerr et al de 50 procedimientos de bypass realizados en 23 pacientes hubo restenosis en el 24% de los casos. En 14/37 (36%) de los pacientes en los que se utilizaron implantes sintéticos en el bypass tuvieron restenosis y solo 1/11 (9%) de los que utilizaron un implante de vaso autólogo tuvieron restenosis6. En la cohorte de Cleveland de 31 procedimientos de bypass hubo restenosis en 11 casos (35%) en una mediana de seguimiento de 11 meses3.
Embarazo en pacientes con AT: esta enfermedad afecta a mujeres jóvenes en edad reproductiva, pero no se ha encontrado evidencia de que el embarazo incremente la actividad de la enfermedad o haya mal pronóstico en el embarazo. Se ha reportado una tendencia no significativa a mayor frecuencia de abortos. También se ha reportado un incremento en el retardo del crecimiento intrauterino en el 20 a 50% de los casos, el cual se asocia a hipertensión descontrolada o a afección aórtica extensa con hipoperfusión uterina. También suele estar aumentada la frecuencia de cesáreas sobre todo por exacerbación de la presión arterial37.
PronósticoEn ACG las complicaciones neuro-oftálmicas son frecuentes y si bien no inciden en la sobrevida, sí lo hacen en la calidad de vida. Hasta en el 26% de los casos pueden tener alteraciones visuales y la mitad de estos últimos tener ceguera. En el 91,7% la pérdida visual permanente se debe a neuritis óptica isquémica anterior. La pérdida visual puede ser unilateral en el 73,1% y bilateral en el 26,9%. En el 27% de los casos puede haber afección de grandes arterias con presencia de estenosis, aneurismas y/o disección aórticos. En un estudio longitudinal de 168 pacientes la sobrevida fue similar entre los pacientes con y sin complicaciones vasculares, excepto cuando había disección aórtica, con una sobrevida media de 1 año38.
En AT, la mortalidad reportada por diferentes series es de 3 a 27%. La mortalidad es a consecuencia de las complicaciones cardiovasculares como la insuficiencia cardiaca, el infarto agudo de miocardio, rotura de aneurisma, enfermedad vascular cerebral, trombosis y falla renal. La supervivencia a cinco y 10 años es de 90-96% y 84-87%, respectivamente3,39,40.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.