Los pacientes con formas graves de artritis psoriásica (APs) habitualmente requieren tratamiento con agentes biológicos. Un mayor conocimiento de este subgrupo de pacientes permite una mejor toma de decisiones en la práctica clínica real.
MétodosEstudio observacional retrospectivo, multicéntrico. Se incluyó a todos los pacientes mayores de 16 años diagnosticados de APs en tratamiento con terapias biológicas desde el 1 de enero de 2011 hasta el 31 de diciembre del 2015.
ResultadosRecibieron terapias biológicas 604 pacientes con APs. El etanercept fue el tratamiento más utilizado. En su mayoría eran pacientes con el subtipo periférico y cumplían criterios de remisión clínica. Un 32% presentaba HLA-B27 positivo, que se asociaba a subtipos de APs axial.
La prevalencia de tuberculosis tratada previa fue del 5,9% y el 23% de los pacientes recibió quimioprofilaxis por tuberculosis latente. Tuvieron sustitución protésica 24 pacientes. La prótesis de cadera fue la más frecuente. Fueron tratados por trastornos afectivos 94 casos. El diagnóstico de fibromialgia fue establecido en 11, mayormente en mujeres. El 6,6% de los casos tuvieron episodios de infecciones graves; las infecciones respiratorias fueron las más frecuentes. Se detectaron 16 tumores (2,9%). El cáncer de próstata y los tumores ginecológicos fueron los más frecuentes. Al igual que ocurría con las infecciones, a mayor edad, mayor riesgo de presentar tumor.
ConclusionesDescribimos las características epidemiológicas y de seguridad en vida real de una cohorte multicéntrica gallega de pacientes con APs en tratamiento biológico.
Patients with severe forms of psoriatic arthritis (PsA) usually require treatment with biological agents. A greater knowledge of this subgroup of patients and their treatment enables better decision making in real clinical practice.
MethodsLongitudinal, multicentric observational study. We included all patients older than 16 years diagnosed with PsA in treatment with biological therapies from January 1, 2011 to December 31, 2015 treated in 6 Galician hospitals.
ResultsSix hundred and fourpatients with PsA received biological therapies. Etanercept was the most used biological treatment. The average time of follow-up was 2.5 years and 67.9% were being treated with the first biological treatment. They were mostly patients with the peripheral subtype and met the criteria for clinical remission. Thirty-two percent had positive HLA-B27 and it was associated with axial PA subtypes.
The prevalence of tuberculosis treated previously was 5.9%, and 23% of patients received chemoprophylaxis for latent tuberculosis. Twenty-four patients had undergone a prosthetic replacement. Hip prosthesis was the most frequent. Ninety-nine cases were treated for affective disorders. A diagnosis of fibromyalgia was established in 11 cases mostly women. Of the cases, 6.6% had episodes of serious infections, with respiratory infections being the most frequent. Sixteen tumours were detected (2.9%). Prostate cancer and gynaecological tumours were the most frequent. As with infections, the greater the age the greater the risk of presenting a tumour.
ConclusionsWe describe the epidemiological and safety characteristics in real life of a Galician multicentre cohort of patients with psoriatic arthritis under biological treatment.
La artritis psoriásica (APs) es una enfermedad inflamatoria crónica multifactorial que repercute negativamente en la calidad de vida de los pacientes. Por su complejidad, desde la descripción original de Moll y Wright en la década de los 70 con la definición de 5patrones de afectación articular1, se han propuesto distintas clasificaciones para su detección y diagnóstico precoz. La más utilizada es la del Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (grupo GRAPPA), basada en unos criterios simples y altamente específicos de la enfermedad con un sistema de puntos para su clasificación2; esta es la clasificación conocida como criterios CASPAR (ClASsification criteria for Psoriatic ARthritis).
En función de la respuesta al tratamiento y del impacto sobre la calidad de vida establecemos 3subgrupos de APs: leve, moderada y grave3. En estas formas graves, los pacientes requieren tratamiento con fármacos modificadores de la enfermedad (FAME) y agentes anti-TNF u otras terapias biológicas y habitualmente presentan limitaciones para las principales actividades del día a día.
Desde el punto de vista clínico, existen 5grandes áreas de manifestaciones características de la APs: la artritis periférica, vertebral, dactilitis, entesitis y las cutáneo-ungueales4. Estas manifestaciones pueden presentarse de forma aislada o confluir en su conjunto en un único paciente. Existe, además, una creciente percepción de que la APs va más allá de la afectación cutánea y articular, y que presenta una serie de comorbilidades asociadas5. La obesidad, diabetes, enfermedad cardiovascular, hepatotoxicidad, síndrome metabólico, malignidad y los trastornos afectivos ansiedad/depresión contribuyen sustancialmente al incremento de la morbimortalidad de estos pacientes. Además, el tratamiento, incluyendo las terapias biológicas, también podría asociarse a efectos adversos, como la aparición de infecciones graves o tumores5,6. Los efectos adversos más frecuentes descritos con terapias biológicas son infecciones del tracto respiratorio superior, cefalea, aumento de las enzimas hepáticas e infecciones, en general. No existe una evidencia sólida de que el riesgo general de malignidad en pacientes con psoriasis tratados con fármacos biológicos sea mayor que en aquellos tratados con FAME. Los datos actualmente disponibles indican que no hay un incremento en el riesgo de cáncer, exceptuando los carcinomas cutáneos y, quizá, el melanoma5. Especial mención merecen el riesgo y la potencial gravedad de la tuberculosis en pacientes en tratamiento con agentes biológicos7. En todo paciente candidato al tratamiento, y una vez descartada la presencia de tuberculosis, es necesario realizar un seguimiento y despistaje de tuberculosis durante la terapia y también un tiempo tras suspenderla7.
El tratamiento de la APs con agentes biológicos no es reciente. Sin embargo, estos agentes terapéuticos siguen en fase de «nueva medicación» y, por ello, el objetivo del presente estudio es describir aquellos pacientes con APs tratados con fármacos biológicos y sus complicaciones en nuestra comunidad, además de resaltar sus características epidemiológicas y clínicas, sus manifestaciones articulares, su relación con el antígeno B27 y las comorbilidades o acontecimientos adversos asociados.
MétodosSe trata de un estudio observacional longitudinal retrospectivo, multicéntrico. Todos los pacientes dieron su consentimiento informado para el estudio. Los datos recogidos fueron anonimizados según un código alfanumérico para preservar la absoluta confidencialidad. Este estudio fue aprobado por el Comité Ético de Investigación de Santiago-Lugo. Código de Registro: 2015/671.
PacientesSe incluyó a todos los pacientes mayores de 16 años diagnosticados de APs según criterios CASPAR2 que estuvieran en tratamiento con terapias biológicas desde el 1 de enero de 2011 hasta el 31 de diciembre del 2015, en 6 hospitales gallegos (HULA, CHUO, CHUP, CHUVI, CHUF y CHUAC), los cuales atienden a una población de 1.746.509 (aproximadamente un 60% del total de la población gallega mayor de 16 años). La consideración de la gravedad de la enfermedad y la indicación de la terapia biológica estaban basadas en el manejo clínico por parte del médico y las recomendaciones SER8.
VariablesLos datos de los pacientes fueron obtenidos de la historia clínica, bien en papel o electrónica, de los distintos hospitales donde fueron atendidos. Se diseñó una base de datos, que denominamos Base de datos Luis Sueiro, en la que se recogieron las características demográficas (edad, sexo), clínicas (formas periférica, axial o mixta), presencia de factor reumatoide, HLA-B27 y los tratamientos pasados y actuales. Además, se recogió el antecedente de enfermedad tuberculosa al inicio del tratamiento.
Durante el seguimiento se recogieron los siguientes eventos adversos de forma específica: 1) las infecciones graves de cualquier localización —definida como aquella infección que requirió asistencia hospitalaria y antibioterapia intravenosa al menos durante 24 h—, 2) neoplasias, 3) prótesis y 4) atención en una unidad de salud mental por depresión y ansiedad.
Análisis estadísticoSe realizó el análisis descriptivo de cada una de las variables a estudio. Para las variables continuas se utilizaron como medida de tendencia central la media y desviación típica, o la mediana y el rango intercuartil. Las variables nominales y ordinales se expresaron como valores absolutos y proporciones. Se estimaron intervalos de confianza con la fórmula de Score (Wilson) corregida9. Para la comparación entre variables cualitativas se utilizó el test de la chi-cuadrado (test de Fisher cuando fuera preciso) y para las variables cuantitativas se utilizó la t de Student, el ANOVA, la U de Mann-Whitney o el test de Kruskal-Wallis. Se estimaron las tasas de incidencia por 100 pacientes/año para los eventos adversos. Los datos fueron analizados mediante el paquete estadístico SPSS 17.0 y los intervalos de confianza de las estimaciones con OpenEpi (disponible en http://www.openepi.com).
ResultadosUn total de 2.310 personas (1.284 hombres, 55,6%) cumplieron criterios CASPAR para el diagnóstico de APs durante el periodo de estudio. Los pacientes con APs que recibieron terapias biológicas fueron 604, según la siguiente distribución por centro: HULA 111 (18,3%), CHUO 60 (9,9%), CHUVI 117 (19,4%), CHUP 72 (11,9%), CHUF 44 (7,4%) y CHUAC 200 (33,1%). El etanercept fue el tratamiento biológico más frecuentemente utilizado (42%), seguido del adalimumab (36%).
El 47% de los pacientes recibían la terapia biológica en monoterapia, independientemente del tipo de terapia utilizado (p=0,600). La combinación con FAME era menos frecuente entre pacientes con formas axiales (14,3%; p=0,001) y más frecuente entre mujeres (59,0%; p=0,039). De los que recibían FAME concomitante, el metotrexato (41,8%) y la leflunomida (11,2%) eran los más frecuentes. Este dato no mostraba diferencias significativas entre los hospitales participantes en el el estudio.
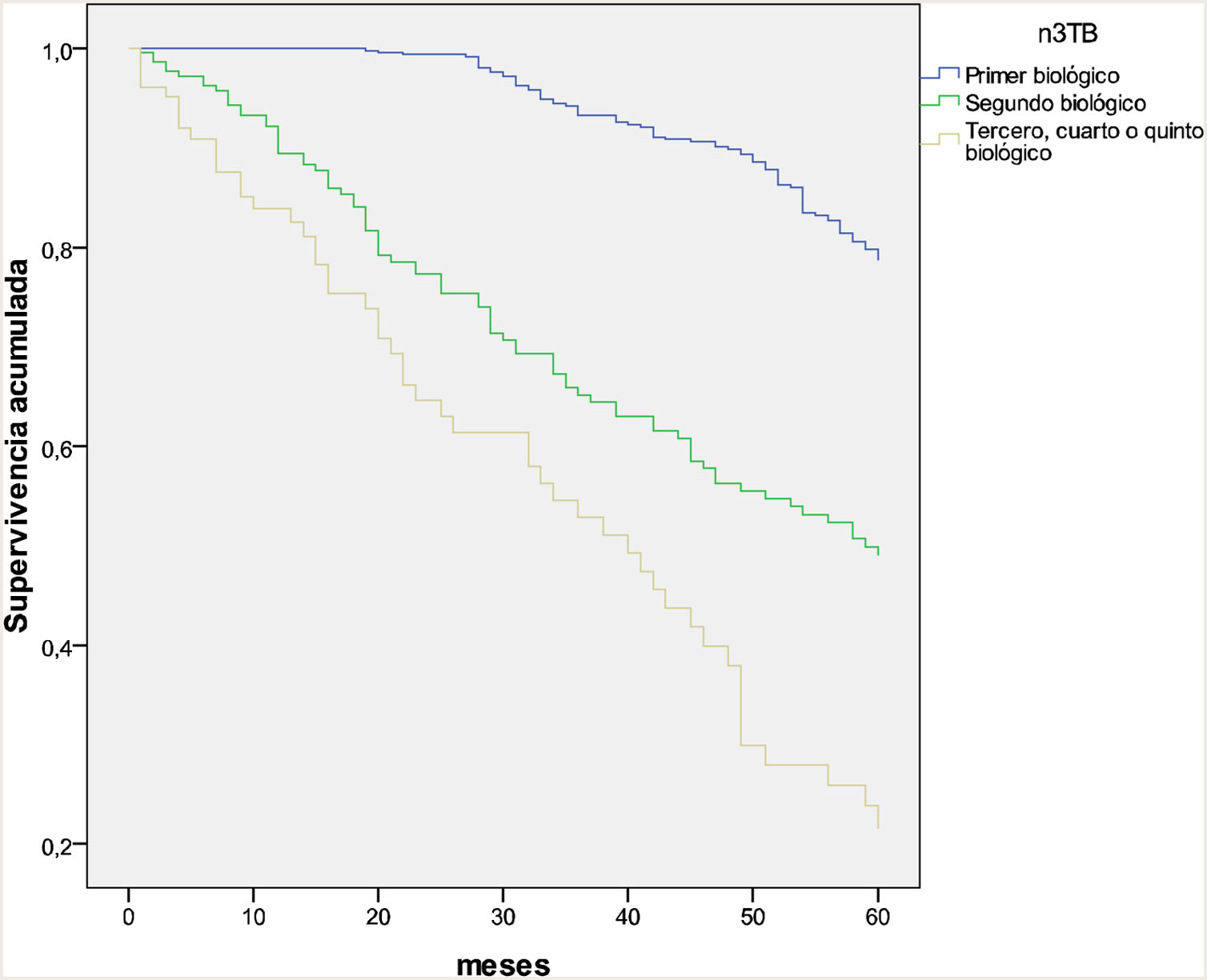
El 49% de los pacientes llevaban con terapia biológica entre 1 y 5 años, y el 30,4% entre 6 y 10 años. El 67,9% se encontraban en tratamiento con el primer biológico; la ineficacia (83,5%) fue el primer motivo de cambio a un segundo biológico. En la curva de supervivencia a 5 años que compara el primer biológico (naive), segundo biológico y tercero o más de 3 biológicos se encuentra una diferencia claramente significativa entre ambas curvas (p<0,001) (fig. 1). Según la opinión del médico que ofreció la asistencia sanitaria a estos pacientes, la mayoría de los casos (74,1%) se encontraban en remisión total.
La terapia biológica estaba optimizada en el 33% de los casos; de forma significativa el golimumab fue el menos optimizado (p=0,001). El 61,4% de los pacientes llevaban menos de 5 años en terapia biológica; este grupo fue el de menor porcentaje de optimización (p<0,0001).
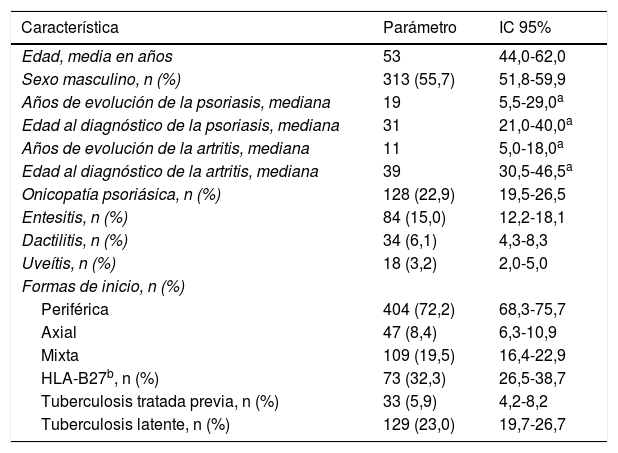
Características epidemiológicasLa tabla 1 muestra las características de los pacientes incluidos y su estimación en la población gallega. En general, se trata de una muestra con edades medias, distribución similar por sexos, de larga evolución de la psoriasis y de la artritis, las cuales aparecieron por lo general en torno a los 30-40 años. La artritis era de tipo periférico en su mayoría, acompañada en un cuarto de los casos de onicopatía y, menos frecuentemente, de entesitis, dactilitis o uveítis. El HLA-B27 se había determinado en 226 pacientes, fue positivo en 73 (32%) y se asociaba a subtipos de APs con afectación axial (p=0,006).
Estimación de parámetros poblacionales de los pacientes con artritis psoriásica al inicio del tratamiento con terapias biológicas (Galicia, 2011-2015)
| Característica | Parámetro | IC 95% |
|---|---|---|
| Edad, media en años | 53 | 44,0-62,0 |
| Sexo masculino, n (%) | 313 (55,7) | 51,8-59,9 |
| Años de evolución de la psoriasis, mediana | 19 | 5,5-29,0a |
| Edad al diagnóstico de la psoriasis, mediana | 31 | 21,0-40,0a |
| Años de evolución de la artritis, mediana | 11 | 5,0-18,0a |
| Edad al diagnóstico de la artritis, mediana | 39 | 30,5-46,5a |
| Onicopatía psoriásica, n (%) | 128 (22,9) | 19,5-26,5 |
| Entesitis, n (%) | 84 (15,0) | 12,2-18,1 |
| Dactilitis, n (%) | 34 (6,1) | 4,3-8,3 |
| Uveítis, n (%) | 18 (3,2) | 2,0-5,0 |
| Formas de inicio, n (%) | ||
| Periférica | 404 (72,2) | 68,3-75,7 |
| Axial | 47 (8,4) | 6,3-10,9 |
| Mixta | 109 (19,5) | 16,4-22,9 |
| HLA-B27b, n (%) | 73 (32,3) | 26,5-38,7 |
| Tuberculosis tratada previa, n (%) | 33 (5,9) | 4,2-8,2 |
| Tuberculosis latente, n (%) | 129 (23,0) | 19,7-26,7 |
En cuanto al riesgo de complicaciones, la prevalencia de tuberculosis tratada previa fue del 5,9% de los casos (mujeres 4,8%; hombres 6,7%). Entre los diferentes hospitales y de forma significativa, la menor incidencia ocurrió en el CHUO (p=0,041). Según las recomendaciones de la SER6 y tras haber realizado screening de tuberculosis, el 23% de los pacientes (21,7% mujeres; 23,9% hombres) fue tratado con quimioprofilaxis. Al analizar su incidencia por hospitales, el CHUVI fue el centro con la incidencia más baja (12,9%; p<0,001). Tres pacientes en tratamiento biológico desarrollaron enfermedad tuberculosa activa a lo largo del periodo del estudio.
Complicaciones de la enfermedadEl tiempo medio de seguimiento fue de 2,5 años. El número total de pacientes/año de seguimiento fue de 1.510.
La tabla 2 muestra las tasas de incidencia de las complicaciones estudiadas. Entre estas complicaciones, 24 pacientes tuvieron una sustitución protésica (5,2% mujeres y 3,5% hombres); fue el CHUO el de mayor número de prótesis. Las prótesis de cadera fueron las más frecuentes (18 casos), seguidas de las de rodilla (12 casos) y de una prótesis de codo.
Tasa de incidencia de las complicaciones de los pacientes con APs en tratamiento con terapia biológica (Galicia, 2011-2015)
| Evento adverso | n | Incidencia por 100 pacientes/año | IC 95% |
|---|---|---|---|
| Prótesis articular | 24 | 1,7 | 1,1-2,5 |
| Trastornos afectivos | 85 | 6,1 | 4,9-7,4 |
| Infecciones graves | 37 | 2,6 | 1,9-3,7 |
| Neoplasias | 16 | 1,1 | 0,7-1,8 |
Habían sido remitidos a la unidad de salud mental 96 casos (16,4%), que fueron diagnosticados y tratados por depresión y ansiedad. El diagnóstico de fibromialgia fue establecido en 11 casos (3,5%), de forma mayoritaria en mujeres (mujeres 6,6%; hombres 1,1%; p<0,01).
Durante el tratamiento biológico tuvieron lugar 37 episodios de infecciones graves (6,6%): las infecciones respiratorias fueron las más frecuentes, seguidas de las infecciones de los tejidos blandos y de la infección complicada del tracto urinario. En el análisis de regresión, la edad avanzada fue la variable estadísticamente significativa asociada a infección. La edad de los pacientes sin infección grave fue de 52,91 años (IC 95%: 51,83-53,99) y con infección grave 58,44 años (IC 95%: 54,15-62,74; p=0,012; odds ratio1.037; IC 95%: 1,008-1,066).
También en este periodo de estudio se detectaron 16 tumores (2,9%). El cáncer de próstata (6 casos) y los tumores ginecológicos (3 casos) fueron los más frecuentes. Además, se observaron 2 cánceres de vejiga, 2 tumores cerebrales y un cáncer de lengua. En el análisis de regresión con distintas covariables el único factor asociado estadísticamente significativo fue la edad. La edad de los pacientes sin neoplasia fue de 53,08 años (IC 95%: 52,02-54,15) y con neoplasia de 63,40 años (IC 95%: 56,25-70,55; p=0,012; odds ratio: 1.073; IC 95%: 1,015-1,134).
DiscusiónEn este estudio hemos descrito la población con APs que recibe tratamiento con terapias biológicas y las principales complicaciones de la enfermedad o del tratamiento. Estos pacientes fueron estratificados en la categoría de APs grave para artritis periférica, enfermedad cutánea, afectación axial, entesitis y dactilitis de acuerdo con los criterios propuestos por Ritchlin et al.3. La novedad del estudio reside en que se trata de un estudio multicéntrico de pacientes con APs grave y que representa a la mayoría de la población gallega atendida.
Aproximadamente un cuarto de los pacientes con APs gallegos se encuentra en tratamiento con terapias biológicas en la actualidad. En el registro International Psoriasis and Arthritis Research Team (IPART), con un total de 7 centros participantes, hasta el año 2008 se incluía un total de 1.671 pacientes con APs, el porcentaje de pacientes en tratamiento con terapia biológica fue 18,4%. La edad media de estos pacientes fue de 46 años (DE 13)10. En el Consorcio de Reumatólogos Investigadores de Norte América (Estudio CORRONA), de un total de 2.426 pacientes incluidos hasta el año 2008 con APs, el porcentaje de pacientes con terapia biológica fue de 56,2%11. La edad media de estos pacientes fue 54 años (DE 13). En el estudio IPART la relación hombre/mujer fue 53/47 y en el CORRONA, 49/51. Cabe destacar la similitud de estos datos en relación con los hallazgos de nuestro estudio.
La prevalencia de entesitis y dactilitis en nuestra cohorte (15% y 6%) fue inferior a la descrita previamente. En el registro sueco de APs precoz se describe la presencia de dactilitis en un 25% en mujeres y en el 35% en varones12. Mease et al., en el registro CORRONA, encuentran una prevalencia de 27% de entesitis y 15% de dactilitis, inferiores al registro sueco13. La baja prevalencia de entesitis y dactilitis en nuestro registro podría explicarse por hallarse infraestimadas, al tratarse de un estudio retrospectivo, y al infradiagnóstico debido a la dificultad diagnóstica. Sin embargo, la distribución de las formas clínicas es similar a otros registros, con el subtipo poliarticular como el más frecuente6,14.
En nuestro registro, un 68% de los pacientes continuaban con el primer tratamiento biológico. En el registro de terapias biológicas de la Sociedad Española de Reumatología (BIOBADASER) en el que se incluía a 570 pacientes con APs, el 73% continuaban con el primer tratamiento anti-TNF a los 3 años15. Estudios posteriores han evaluado la supervivencia del tratamiento anti-TNF en pacientes con APs, con resultados similares. En el registro británico y en el registro danés de terapias biológicas, se describe una persistencia del tratamiento con el primer anti-TNF del 75% y del 60%, respectivamente16,17. Asimismo, un estudio multicéntrico australiano en APs publicado recientemente describe una supervivencia del tratamiento con biológicos en monoterapia del 75,1% a los 24 meses18. La principal causa de suspensión del primer tratamiento biológico fue la pérdida de eficacia, al igual que en estudios previos17-19.
Durante el periodo de seguimiento se detectaron 16 tumores en 604 pacientes (2,9%), los más frecuentes de los cuales fueron el cáncer de próstata y los tumores ginecológicos. Diversos estudios han evaluado la incidencia de cáncer en APs. Rohekar et al. estimaron la incidencia de neoplasia en 665 pacientes con APs, comparado con la incidencia de cáncer histórica de Toronto, y objetivaron 68 neoplasias en 665 pacientes (10,2%), sin diferencias con la población control20. Los tumores más frecuentemente detectados fueron cáncer de mama, pulmón y próstata. Es reciente un estudio observacional del registro británico de terapias biológicas que evaluó la incidencia de cáncer en una cohorte de pacientes con APs severa en tratamiento biológico21. Los resultados muestran 34 neoplasias en una población de 709 pacientes con APs, en los que la mayoría de los cánceres eran tumores cutáneos no melanoma, sin diferencias en el riesgo global de malignidad con respecto a la población general. Estudios posteriores muestran hallazgos similares, sin evidenciar un incremento de riesgo de neoplasia en pacientes con APs respecto a la población general ni con pacientes con artritis reumatoide22-25. Al igual que en nuestro estudio, una mayor edad se ha asociado con un mayor riesgo de tumores22,25,26.
El estudio presenta varias limitaciones. La primera, debida al diseño del estudio, la recogida de los datos se realizó de forma retrospectiva, con el consiguiente riesgo de sesgos en la selección de pacientes y en la recogida de datos, pues en la mayoría de estos casos no se recogieron índices de actividad. También, al tratarse de distintos centros y no haber consensuado ningún protocolo de trabajo, hay diferencias en la manera en que se evalúa a estos pacientes. Además, debido a su comercialización posterior, el número de pacientes con golimumab y certolizumab era menor. Por otra parte, la ausencia de grupo control limita la interpretación de los resultados.
En conclusión, nuestro estudio describe características epidemiológicas, datos de eficacia y seguridad en la práctica clínica habitual de una cohorte multicéntrica gallega de pacientes con APs en tratamiento biológico. Dicho estudio representa una importante fuente de información epidemiológica del comportamiento en vida real de la enfermedad, así como de supervivencia y seguridad a largo plazo del tratamiento con terapia biológica.
FinanciaciónEste estudio no fue financiado. Fue realizado con recursos propios.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores quieren manifestar su agradecimiento al Dr. Alfredo Willisch, reumatólogo del Hospital Universitario de Ourense, por su colaboración en la elaboración y revisión de este manuscrito. También quieren agradecer a la Sociedad Gallega de Reumatología el apoyo ofrecido a este proyecto.