Hay un interés creciente en el estudio de los anticuerpos antifosfolípidos (aPL) no criterio, incluyendo anticuerpos contra el dominio 1 de la B2 glicoproteína 1 (anti-D1 B2GP1) y anticuerpos antifosfatidilserina/protrombina (PS/PT).
ObjetivosNuestro objetivo fue analizar un panel de aPL convencionales y no criterio en una cohorte de pacientes con lupus eritematoso sistémico (LES) y síndrome antifosfolípido primario (SAF), para describir si hay diferencias en los títulos de aPL entre los grupos, y evaluar asociaciones clínicas incluyendo el riesgo de eventos recurrentes con aPL novedosos.
MetodologíaEstudio observacional que evaluó los anticuerpos anti-D1 B2GP1 y anti-PS/PT de manera basal. Los anticuerpos anti-D1 B2GP1 se evaluaron a través de inmunoanálisis por quimioluminiscencia. Los anticuerpos anti-PS/PT, anticardiolipinas (aCL) y anti-B2GP1 fueron evaluados por técnicas de ELISA. Finalmente, los pacientes fueron seguidos en el tiempo para identificar nuevos eventos trombóticos.
ResultadosSe incluyeron 133 pacientes con LES y 23 pacientes con SAF primario. Las principales manifestaciones de SAF fueron TVP (27%), morbilidad obstétrica (22%) y trombosis arterial (10,1%). Los títulos de anticuerpos anti-PS/PT IgM fueron 46,5 (20,6-127) vs. 21,9 (11,2-39,2) U/ml, p<0,001, en pacientes con SAF primario vs. LES con SAF secundario, respectivamente. Los anti-D1 B2GP1, anti-PS/PT IgG e IgM se asociaron con manifestaciones trombóticas y no trombóticas. Durante el seguimiento, los anticuerpos IgG B2GP1 se relacionaron con un riesgo acumulativo significativo de trombosis.
ConclusionesSe encontraron diferencias estadísticamente significativas en títulos séricos de aPL no criterio en pacientes con SAF primario vs. pacientes con LES y SAF secundario. Si los títulos de aPL no criterio son útiles para diferenciar entre SAF primario y SAF secundario, se requieren más análisis en otras poblaciones para poder confirmar si los títulos de aPL no criterio.
There is an increasing interest in the study of non-criteria antiphospholipid antibodies (aPL) including antibodies targeting domain 1 of the B2 glycoprotein 1 (anti-D1 B2GP1) and antibodies anti phosphatidylserine/ prothrombin (PS/PT).
ObjectivesOur aim was to analyze a panel of conventional and non-criteria aPL in a cohort of patients with systemic lupus erythematosus (SLE) and primary antiphospholipid syndrome (APS), to describe if there are differences in aPL titers among groups, to evaluate clinical associations including risk of recurrent events of novel aPL.
MethodsObservational study that evaluated at baseline antibodies against anti-D1 B2GP1 and anti PS/PT. Anti-D1 B2GP1 antibodies were tested using a chemiluminescent immunoassay. IgG and IgM anti PS/PT, aCL and anti B2GP1 by ELISA techniques. Therefore, patients were followed in order to identify new thrombotic events.
Results133 patients with SLE and 23 with primary APS patients were included. Main APS manifestations were DVT (27%), obstetric morbidity (22%) and arterial thrombosis (10.1%). IgM anti PS/PT antibodies levels were (20.6 - 127) vs 21.9 (11.2 - 39.2) U/ml, p<0.001 in primary APS vs SLE with APS, respectively. Anti-D1 B2GP1, IgG and IgM anti PS/PT were associated with thrombotic and non-thrombotic manifestations. During follow-up, IgG B2GP1 were related with a significant cumulative risk of thrombosis.
ConclusionsWe found significant differences in serum titers of non-criteria aPL among patients with primary APS vs SLE with APS. Whether non-criteria aPL antibodies titers are useful to differentiate patients with primary and secondary APS requires further analysis in other populations.
Los anticuerpos antifosfolípido (aPL) son una familia heterogénea de anticuerpos que están dirigidos contra fosfolípidos y proteínas fijadoras de fosfolípidos. Actualmente, los marcadores serológicos convencionales para síndrome antifosfolípido (SAF) incluyen anticoagulante lúpico (AL) y anticuerpos anticardiolipinas (aCL) usando ensayos de fase sólida1. Hay un interés creciente en nuevos aPL, especialmente anticuerpos contra el dominio 1 de la B2 glicoproteína 1 (anti-D1 B2GP1) y anticuerpos antifosfatidilserina/protrombina (PS/PT), entre otros. Los aPL novedosos pueden otorgar información adicional en la estratificación del riesgo, e identificar pacientes con determinaciones persistentemente negativas de aPL convencionales, también conocidos como pacientes con SAF seronegativo2.
El SAF se define como primario o asociado con una enfermedad autoinmune subyacente. El SAF primario se presenta en pacientes en los que no hay evidencia clínica ni de laboratorio de otra condición. Por otro lado, el SAF asociado o secundario se puede relacionar con otras enfermedades, más comúnmente lupus eritematoso sistémico (LES)1.
La evaluación del perfil de aPL tiene implicaciones diagnósticas y ayuda para la estratificación del riesgo. La triple positividad de aPL se ha asociado con alto riesgo de un primer evento trombótico y de recurrencia de los mismos3,4, y es un factor de riesgo independiente asociado con complicaciones gestacionales tales como una menor tasa de nacidos vivos, una mayor tasa de restricción del crecimiento intrauterino (RCIU), abrupcio de placenta, entre otros5.
Los anticuerpos anti-D1 B2GP1 y anti-PS/PT IgG/IgM fueron significativamente más altos en pacientes con SAF que aquellos sin SAF6. Un estudio italiano de pacientes con SAF primario7 encontró que varias características clínicas y serológicas se asociaban con altos títulos de anticuerpos anti-PS/PT. Los títulos de anticuerpos anti-PS/PT IgG e IgM fueron significativamente mayores en pacientes con trombosis y morbilidad obstétrica que en aquellos con trombosis o morbilidad obstétrica solas. Otro estudio de pacientes con SAF, quienes se encontraban buscando la concepción, encontró que los anticuerpos anti-PS/PT estaban significativamente asociados con complicaciones tardías del embarazo, RCIU y preeclampsia. Además, los títulos de anticuerpos anti-PS/PT IgG tuvieron una correlación inversa estadísticamente significativa con el peso neonatal al momento del parto8. Una revisión sistemática encontró que la medición de rutina de anticuerpos anti-PS/PT (isotipos IgG e IgM) podría ser útil para establecer el riesgo trombótico en pacientes con trombosis previa o LES9.
Los anticuerpos anti-D1 B2GP1 se han asociado con episodios trombóticos, incluyendo trombosis venosas y arteriales10,11, y se han encontrado en títulos altos en pacientes con múltiples positividades de aPL12,13.
A la fecha, no es clara la significación de los títulos de aPL, especialmente los aPL novedosos, en pacientes con SAF primario. El objetivo de este estudio fue analizar un panel de aPL, tanto convencionales como novedosos en pacientes con LES y SAF primario, describir las diferencias de los títulos de aPL en ambos grupos, y evaluar las asociaciones clínicas de aPL novedosos, incluyendo el riesgo de eventos recurrentes.
MétodosPoblación de estudioEste estudio observacional incluyó una evaluación clínica y la determinación serológica de autoanticuerpos de base, en pacientes con LES y SAF primario; luego de esto, se realizó un seguimiento prospectivo. El diagnóstico de LES se realizó de acuerdo con los criterios de clasificación (1982/1997) del American College of Rheumatology (ACR)14 y el de SAF, de acuerdo con los criterios de Sidney15. El SAF primario se definió de acuerdo a los criterios propuestos por Piette et al.16. Se excluyeron pacientes con cáncer activo o con enfermedad protrombótica diferente al SAF.
Se reclutaron pacientes ≥ 18 años del Departamento de Reumatología, Medicina Interna y la Clínica de Anticoagulación, en el Hospital San Vicente Fundación, Medellín, Colombia: un centro de referencia de tercer nivel, entre marzo 2015 y marzo 2017, con seguimiento hasta marzo 2019.
Se realizó una revisión sistemática de los registros médicos para variables demográficas, criterios relacionados con aPL, y manifestaciones no criterio. Se registraron eventos trombóticos arteriales y venosos. Los eventos arteriales incluyeron: infarto del miocardio (incluyendo procedimientos vasculares para infarto de miocardio), angina pectoris y ataques cerebrovasculares. Los eventos venosos registrados fueron trombosis venosa profunda (TVP) y tromboembolia pulmonar (TEP). Solo se registró el primer evento incidente. La morbilidad obstétrica se registró de acuerdo a los criterios de Sidney para SAF15.
Se obtuvo consentimiento informado escrito de los pacientes para participar. El presente estudio se desarrolló en concordancia con la Declaración de Helsinki. El protocolo del estudio fue aprobado por el comité de ética del Hospital San Vicente Fundación, dentro del proyecto «Biomarcadores en lupus eritematoso sistémico» (Acta número 10-2015).
Los pacientes fueron seguidos para nuevos eventos trombóticos o eventos relacionados con SAF hasta la ocurrencia de un evento o la última visita. Se registraron todas las terapias anti-trombóticas utilizadas durante el seguimiento, incluyendo antagonistas de la vitamina K y anticoagulantes orales directos.
Determinación de anticuerposLos anticuerpos anti-D1 B2GP1 fueron determinados a través de un inmunoanálisis de quimioluminiscencia QUANTA Flash® (Beta2)GP1-Domain 1 (Inova Diagnostics, San Diego, CA, EE. UU.). Los anticuerpos anti-PS/PT IgG e IgM se analizaron a través de ELISA QUANTA Lite (Inova Diagnostics, San Diego, Ca, EE. UU.). Los aCL (IgG e IgM) y anti-B2GP1 (IgG e IgM) se midieron al mismo tiempo a través de técnicas de ELISA (QUANTA Lite®, Inova Diagnostics). Para detectar el AL, se utilizaron recomendaciones internacionalmente aceptadas, utilizando veneno de víbora de Russel diluido y tiempo parcial de tromboplastina activada (TTPa) como métodos de tamizaje17. Los anticuerpos mencionados fueron determinados únicamente en el momento de inclusión de los pacientes.
Análisis estadísticoLos análisis estadísticos se realizaron en el software SPSS® (IBM SPSS® versión 23.0, Inc., Chicago, IL, EE. UU.) y GraphPad Prism versión 7.0 (GraphPad Software, San Diego, CA, EE. UU.). Los títulos séricos de anti-D1 B2GP1 y anti-PS/PT se compararon entre pacientes con LES y con SAF primario, y entre pacientes con LES y SAF vs. pacientes con SAF primario. Además, los títulos séricos de anticuerpos se compararon entre pacientes con LES sin trombosis, LES con trombosis y SAF primario. Se utilizaron el test de Chi-cuadrado y la prueba U de Mann-Whitney o Kruskall-Wallis para comparar variables dicotómicas y continuas, respectivamente. Además, para variables continuas con distribución no normal, se utilizó la prueba de rango de Wilcoxon. Se utilizó el test de correlación de Spearman para buscar correlaciones entre aPL (aCL, anti-PS/PT y anti-B2GP1). El tamaño de la correlación se interpretó como muy alto, alto, moderado, bajo, y despreciable de acuerdo a los valores entre 0,9-1,00, 0,7-0,89, 0,5-0,69, 0,3-0,49, 0-0,29, respectivamente. Por último, se utilizó el análisis de Kaplan-Meier de tiempo al evento para determinar factores de riesgo para eventos trombóticos durante el seguimiento.
ResultadosCaracterísticas de los pacientesDe una cohorte inicial de 173 pacientes, los datos clínicos completos y muestras de suero estaban disponibles en 156 pacientes (133 con LES y 23 con SAF primario).
Las características demográficas, clínicas y serológicas de base de todos los pacientes, aquellos con LES y con SAF primario se muestran en la tabla 1. La edad media fue de 33,9±12,8 años, y el 86% fueron mujeres: 77% fueron de raza mestiza y 22% afro-latinoamericanos. Las principales manifestaciones criterio de SAF en el total de la cohorte fueron TVP (27%), morbilidad obstétrica (22,9%) y trombosis arterial (10,1%). Las principales manifestaciones no criterio fueron trombocitopenia (31,6%), valvulopatía (21,5%) y convulsiones previas (12,1%). Serológicamente, el AL fue positivo en el 55,9% de los pacientes, aCL IgG en el 30%, aCL IgM en el 17%, B2GP1 IgG en el 24% y B2GP1 IgM en el 14,5% de los pacientes. La positividad de nuevos aPL fue: anti-PS/PT IgG (33%), PS/PT IgM (40%) y anti-D1B2GP1 (19,9%). Una quinta parte de los pacientes fueron doble positivos para AL+cualquier aCL y el 8,3% fueron triple positivos para aPL convencionales (AL+cualquier aCL+cualquier B2GP1). Veintisiete por ciento de los pacientes con LES tenían historia de trombosis. Dado que incluimos pacientes que cumplían los criterios de Sidney para SAF, ninguno tenía una única positividad para nuevos aPL con aPL convencionales negativos.
Características clínicas y serológicas
| Cohorte total | SAF primario | LES sin SAF | LES con SAF | |
|---|---|---|---|---|
| Características clínicas | N=156 | N=23 | N=88 | N=45 |
| Sexo (femenino), % | 86 | 82 | 84 | 93 |
| Edad actual (años±DE) | 33,9±12,8 | 41,1±16,4 | 30,4±10,4 | 36,6±13,1 |
| Manifestaciones criterio | ||||
| Trombosis previa (arterial y/o venosa), % | 35,7 | 86,4 | 0 | 70,0 |
| Trombosis venosa profunda, % | 27 | 54,5 | 0 | 59,0 |
| Tromboembolia pulmonar, % | 9,8 | 21,0 | 0 | 23,0 |
| Trombosis arterial, % | 10,1 | 40,0 | 0 | 14,0 |
| Morbilidad obstétrica, % | 22,9 | 54,5 | 0 | 51,0 |
| Manifestaciones no criterio | ||||
| Valvulopatía, % | 21,5 | 28,6 | 0 | 8,3 |
| Trombocitopenia, % | 31,6 | 42,8 | 23,0 | 41,0 |
| Convulsiones, % | 12,1 | 4,8 | 5,0 | 25,0 |
| Livedo reticularis, % | 6,7 | 19,0 | 6,0 | 2,3 |
| Manifestaciones serológicas | ||||
| aPL clásicos | ||||
| Anticoagulante lúpico positivo, % | 55,9 | 60,9 | 34,0 | 65,0 |
| IgG aCL positivo, % | 30,0 | 60,0 | 26,0 | 30,0 |
| IgM aCL positivo, % | 17,0 | 40,0 | 10,0 | 12,0 |
| IgG B2GP1 positivo, % | 24,0 | 55,0 | 15,0 | 27,0 |
| IgM B2GP1 positivo, % | 14,5 | 30,0 | 6,7 | 12,0 |
| Doble positivo (AL+cualquier aCL) | 19,9 | 43,5 | 6,3 | 18,0 |
| Triple positivo (AL+cualquier aCL+cualquier B2GP1) | 8,3 | 0 | 2,8 | 7,5 |
| Nuevos aPL | ||||
| Anti-D1 B2GP1 positivo, % | 19,9 | 43,0 | 9,6 | 26,0 |
| IgG anti-PS/PT positivo, % | 33,0 | 60,0 | 16,0 | 51,0 |
| IgM anti-PS/PT positivo, % | 40,0 | 75,0 | 36,0 | 42,0 |
aPL: anticuerpos antifosfolípido; DE: desviación estándar; LES: lupus eritematoso sistémico; SAF: síndrome antifosfolípido.
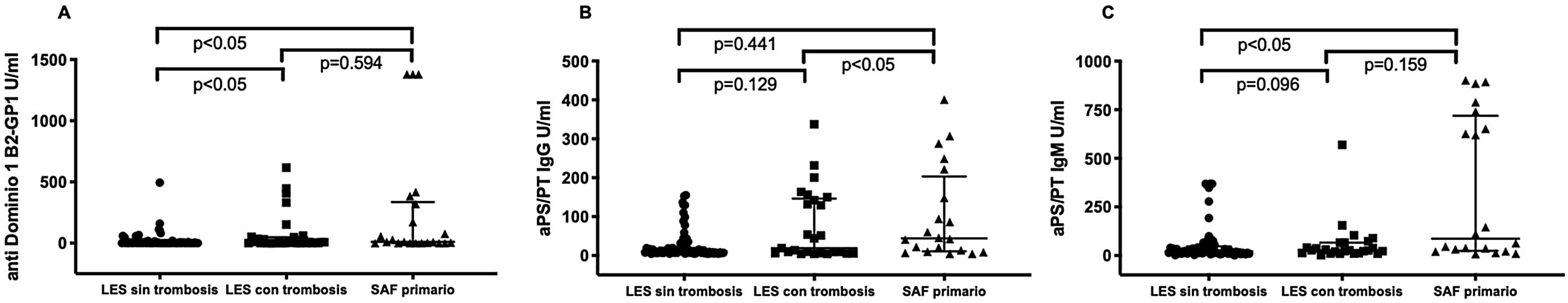
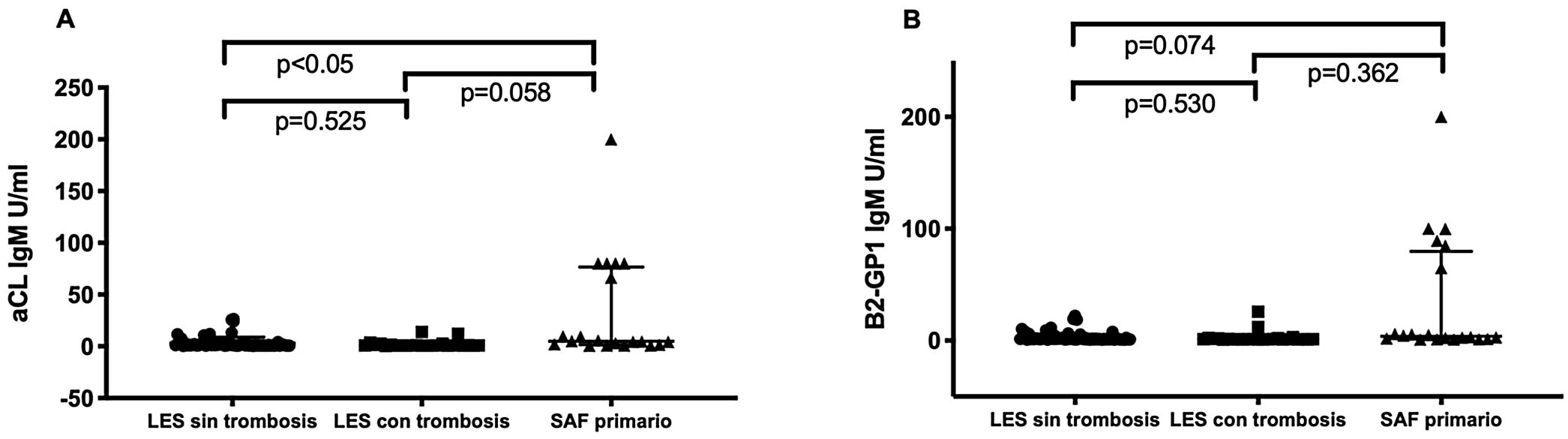
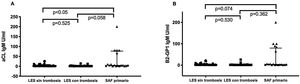
Los pacientes con SAF primario tuvieron títulos significativamente mayores de ciertos nuevos aPL que los pacientes con LES sin SAF. Los pacientes con SAF primario tuvieron títulos significativamente mayores de anti-PS/PT IgG e IgM que los pacientes con LES y SAF (46,5 [20,6-127] vs. 21,9 [11,2-39,2] mediana rango intercuartílico [RIQ]) U/ml, p<0,001 en pacientes con SAF primario vs. LES y SAF, respectivamente. No se observaron diferencias estadísticamente significativas en los títulos de anti-D1 B2GP1, 0 (0-8) vs. 5 (0-53) mediana (RIQ) U/ml, p=0,163 entre ambos grupos (fig. 1). Los pacientes con SAF primario y trombosis tuvieron títulos significativamente mayores de aCL IgM y B2GP1 IgM que los pacientes con LES y SAF y que los pacientes con LES sin SAF (fig. 2).
Los títulos de anticuerpos anti-PS/PT (IgG e IgM) fueron significativamente mayores en pacientes con triple positividad para aPL clásicos. No se observó diferencia en los títulos de anti-D1 B2GP1 en pacientes con o sin triple positividad (datos no presentados), y tampoco se observaron diferencias significativas en los títulos de nuevos aPL en pacientes solo con TVP vs. pacientes solo con trombosis arterial.
Los anti-D1 B2GP1 se asociaron estrechamente con trombosis previa (tanto arterial como venosa), odds ratio (OR): 4,90; intervalo de confianza (IC): 95%: 2,0-11,7; TVP (OR: 5,0; IC 95%: 2,1-11,9) y trombocitopenia (OR: 4,3; IC 95%: 1,8-10,3). Los anti-PS/PT IgG se asociaron estrechamente con trombosis previa, TVP, trombocitopenia y morbilidad obstétrica, mientras que los anti-PS/PT IgM se asociaron con trombosis previa y trombocitopenia (tabla 2).
Desempeño clínico de ensayos de anticuerpos anti-D1 B2GP1 y anti-PS/PT IgG e IgM en pacientes con características de SAF (tanto SAF primario como LES con SAF)
| Anti-D1 B2GP1 positiva (%) | Anti-D1 B2GP1 negativa (%) | OR | IC 95% | Valor de p | |
|---|---|---|---|---|---|
| Trombosis (cualquiera arterial o venosa) | 65,5 | 34,5 | 4,9 | 2,0-11,7 | <0,001 |
| TVP | 55,2 | 44,8 | 5,0 | 2,1-11,9 | <0,001 |
| Trombocitopenia | 58,6 | 41,4 | 4,3 | 1,8-10,3 | <0,001 |
| IgG anti-PS/PT positiva (%) | IgG anti-PS/PT negativa (%) | OR | IC 95% | Valor de p | |
|---|---|---|---|---|---|
| Trombosis (cualquiera arterial o venosa) | 54,8 | 22,9 | 4,0 | 1,7-9,3 | <0,001 |
| TVP | 60,6 | 24,1 | 5,2 | 1,3-20,8 | <0,001 |
| Trombocitopenia | 26,5 | 4,9 | 7,0 | 1,9-24,7 | <0,001 |
| Morbilidad obstétrica | 64,7 | 22 | 6,4 | 2,0-20,0 | <0,001 |
| IgM anti-PS/PT positiva (%) | IgM anti-PS/PT negativa (%) | OR | IC 95% | Valor de p | |
|---|---|---|---|---|---|
| Trombosis (cualquiera arterial o venosa) | 52,8 | 32,1 | 2,3 | 1,0-5,2 | 0,034 |
| Trombocitopenia | 26,5 | 4,9 | 7,0 | 1,9-24,7 | <0,001 |
IC 95%: intervalo de confianza del 95%; LES: lupus eritematoso sistémico; OR: odds ratio; SAF: síndrome antifosfolípido primario; TVP: trombosis venosa profunda.
Se observó una correlación positiva entre los anticuerpos anti-D1 B2GP1 y anti-PS/PT IgG (r=0,651; p=0,0001), B2GP1 IgG (r=0,604; p=0,0001) y aCL IgG (r=0,645; p=0,0001). Se observaron correlaciones moderadas-fuertes previamente conocidas entre aPL convencionales (tabla 3).
Correlación entre aPL nuevos y convencionales
| Anti-D1 B2GP1 | IgG anti-PS/PT | IgM anti-PS/PT | IgG B2GP1 | IgM B2GP1 | IgG aCL | IgM aCL | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Rho | Valor de p | Rho | Valor de p | Rho | Valor de p | Rho | Valor de p | Rho | Valor de p | Rho | Valor de p | Rho | Valor de p | |
| Anti-D1 B2GP1 | 1 | — | 0,651 | 0,0001 | 0,548 | 0,0001 | 0,604 | 0,0001 | 0,346 | 0,0001 | 0,645 | 0,0001 | 0,445 | 0,0001 |
| IgG IgM anti-PS/PT | 0,651 | 0,0001 | 1 | — | 0,552 | 0,0001 | 0,554 | 0,0001 | 0,324 | 0,0001 | 0,657 | 0,0001 | 0,334 | 0,0001 |
| IgM IgM anti-PS/PT | 0,548 | 0,0001 | 0,552 | 0,0001 | 1 | — | 0,504 | 0,0001 | 0,412 | 0,0001 | 0,592 | 0,0001 | 0,523 | 0,0001 |
| IgG B2GP1 | 0,604 | 0,0001 | 0,554 | 0,0001 | 0,504 | 0,0001 | 1 | — | 0,0001 | 0,822 | 0,0001 | 0,592 | 0,0001 | |
| IgM B2GP1 | 0,346 | 0,0001 | 0,324 | 0,0001 | 0,412 | 0,0001 | 0,496 | 0,0001 | 1 | — | 0,456 | 0,0001 | 0,822 | 0,0001 |
| IgG aCL | 0,675 | 0,0001 | 0,657 | 0,0001 | 0,592 | 0,0001 | 0,822 | 0,0001 | 0,456 | 0,0001 | 1 | — | 0,542 | 0,0001 |
| IgM aCL | 0,445 | 0,0001 | 0,334 | 0,0001 | 0,523 | 0,0001 | 0,592 | 0,0001 | 0,823 | 0,0001 | 0,542 | 0,0001 | 1 | — |
aPL: anticuerpos antifosfolípido.
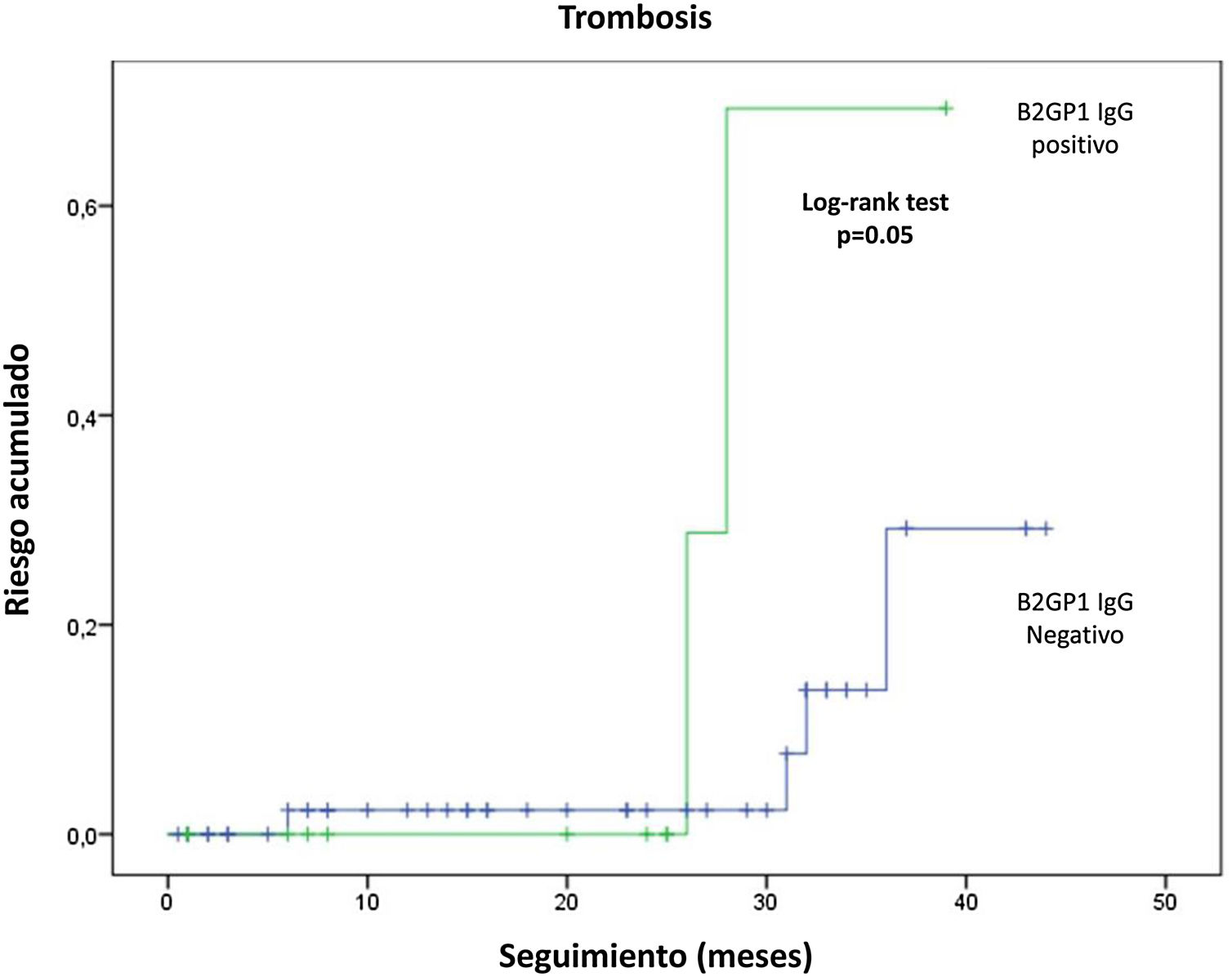
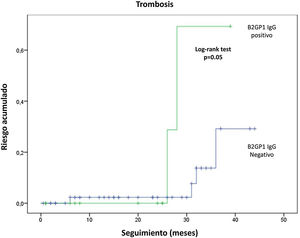
Se tuvo acceso al seguimiento en 91 pacientes. El tiempo medio de seguimiento fue de 20,6±13,8 meses (rango: 1-46 meses). Ocho de 91 pacientes (8,8%) tuvieron nuevos eventos trombóticos (6 TVP y 2 trombosis arteriales), 5 de los cuales ocurrieron a pesar de terapia anticoagulante (4 con antagonistas de vitamina K y uno con dabigatrán). Se observaron 6 episodios de trombocitopenia y 2 pérdidas fetales nuevas. En general, el AL se relacionó con trombocitopenia recurrente (12,9 vs. 0%; p=0,049) y los anticuerpos anti-B2GP1 IgG con trombosis recurrente (28 vs. 7%; p=0,022) y trombosis arterial (6,7 vs. 0%; p=0,05). En el análisis de supervivencia, los anticuerpos anti-B2GP1 se relacionaron significativamente con el riesgo acumulado de trombosis (fig. 3). No se observó relación entre aPL no criterio o triple positividad y la recurrencia. Tampoco se observaron sangrados de relevancia clínica (mayor o menor).
DiscusiónNuestros resultados muestran diferencias significativas en los títulos de anti-PS/PT entre pacientes con SAF primario y pacientes con LES y SAF. Además, se encontraron asociaciones fuertes entre nuevos aPL con manifestaciones criterio (trombosis y morbilidad obstétrica) y no criterio tales como trombocitopenia.
La información sobre el rol diferencial de nuevos aPL es limitada. En un estudio chino de pacientes con SAF primario (n=101), SAF secundario (n=140) y controles, incluyendo pacientes sin trombosis (n=161) y controles sanos (n=39), los títulos séricos de anti-PS/PT IgG e IgM fueron significativamente mayores en pacientes con SAF primario y SAF secundario comparados con pacientes con trombosis sin SAF, con morbilidad obstétrica sin SAF, con LES sin trombosis y controles sanos. Sin embargo, los niveles de anti-PS/PT IgG o IgM no fueron significativamente diferentes entre pacientes con SAF primario y SAF secundario18.
Los aPL no criterio, incluyendo anti-B2GP1 IgA, anti-D1 B2GP1 y anti-PS/PT se han propuesto como marcadores útiles en pacientes con SAF seronegativo (pacientes con manifestaciones clínicas de SAF aunque con resultados negativos de aPL convencionales)19.
Aunque los nuevos aPL no son medidos usualmente en la práctica clínica diaria, algunos estudios han sugerido que son útiles como pruebas complementarias para identificar pacientes con SAF seronegativos para los aPL convencionales20,21. Sin embargo, dado que no incluimos ningún caso de SAF seronegativo, este posible valor diagnóstico adicional no fue evaluado en el presente estudio.
El SAF primario es una entidad bien reconocida, progresando a LES u otras enfermedades autoinmunes en solo el 0,6-11% de los pacientes. En 2005, en un estudio de cohorte multicéntrico que incluyó 128 pacientes con SAF primario, reportamos que alrededor del 8% de los pacientes cumplían criterios de LES luego de una media de seguimiento de 9 años22. En una cohorte europea de 1.000 pacientes con SAF, luego de un seguimiento de 10 años, solo 3/531 pacientes (0,6%) inicialmente diagnosticados como SAF primario fueron reclasificados como LES23. En otro estudio multicéntrico europeo de 115 pacientes con SAF, se reportó que solo 13 (11%) desarrollaron una franca enfermedad autoinmune, 7 pacientes desarrollaron LES, 2 síndrome de Sjögren y 4 enfermedad indiferenciada del tejido conectivo luego de un seguimiento de 18 años24. Un estudio reciente de 100 pacientes franceses con SAF primario encontró que ninguno desarrolló LES luego de una mediana de seguimiento de hasta 12 años25.
Múltiples marcadores de enfermedad no son exclusivos de sus enfermedades más representativas, pero los títulos altos suelen ser un distintivo de cada enfermedad. Por ejemplo, los pacientes con vasculitis asociada a ANCA suelen tener títulos más altos de ANCA que los pacientes con otras enfermedades inflamatorias positivas para ANCA, incluyendo pacientes con enfermedad inflamatoria intestinal o LES26.
A pesar de un seguimiento breve en nuestro estudio, alrededor del 9% de los pacientes tuvieron nuevos episodios trombóticos, en algunos casos en pacientes con anticoagulación oral. En particular, los pacientes positivos para anticuerpos anti-B2GP1 IgG tuvieron un mayor riesgo de recurrencia. La triple positividad de aPL como marcador de mayor riesgo de recurrencia fue reportado hace más de 10 años por Pengo et al.3. Un estudio reciente reportó una mayor tasa de eventos trombóticos en aquellos pacientes con anti-PS/PT IgG positivos27 y Abu-Zeinag et al.28 reportaron que el 18% de los pacientes desarrollaron un evento trombótico luego de 48 meses de seguimiento, especialmente aquellos con una enfermedad autoinmune subyacente, sin embargo, como en nuestro estudio, no documentaron relación con la positividad de AL o la triple positividad.
No hay consenso para la monitorización de los títulos de aPL durante el seguimiento y sobre el impacto de los niveles de aPL. Recientemente, Khawaja et al.29, describieron que la presencia de aCL y, en menor proporción, AL, puede ser negativa luego de eventos trombóticos en pacientes con LES. Por otro lado, Nuri et al.30, encontraron una reducción significativa de los títulos de aPL en pacientes con SAF primario expuestos a hidroxicloroquina (HCQ) en comparación con aquellos sin HCQ, y una potencial reducción en la incidencia de la recurrencia de trombosis arterial en pacientes con SAF primario tratados con HCQ.
Nuestro estudio tiene algunas limitaciones:
- -
Primero, solo medimos los aPL en el momento de la inclusión al estudio y, por lo tanto, no podemos determinar si los títulos de anti-D1 B2GP1 y anti-PS/PT cambiaron en el tiempo.
- -
Segundo, se incluyó un número relativamente bajo de pacientes con SAF primario comparados con aquellos con LES mas SAF, pero en la misma proporción (1:4) que usualmente se ve en la práctica clínica entre SAF primario y SAF asociado a LES. A pesar de dicho número relativamente bajo de casos, pudimos reportar que los títulos séricos de anti-PS/PT fueron el doble de altos en pacientes con SAF primario que en aquellos con LES y SAF. Sin embargo, algunas de dichas diferencias fueron no estadísticamente significativas, aunque con mayor tendencia de títulos elevados de anti-D1 B2GP1 en pacientes con SAF primario. Si bien el hallazgo estadísticamente significativo se redujo a anticuerpos anti-PS/PT y aCL, hay una diferencia numérica de los títulos de anticuerpos anti-D1 B2GP1 a favor de los pacientes con SAF primario. No obstante, el hallazgo pudo ser no significativo por el tamaño de muestra reducido. Esto va en concordancia con nuestros resultados de títulos altos de otros anticuerpos no criterio.
- -
Tercero, se encontró una prevalencia alta para la positividad de AL comparado con otras cohortes. Esto puede ser debido a, en parte, el lugar de reclutamiento de muchos pacientes con SAF primario, que venían de la clínica de anticoagulación luego de una prueba de AL confirmatorio positivo.
- -
Cuarto, no pudimos identificar pacientes con SAF seronegativo, debido a que todos los pacientes se clasificaron como SAF de acuerdo con el criterio de al menos un aPL clásico en el momento del reclutamiento. El periodo del estudio fue relativamente corto, pero a pesar de ello pudimos identificar nuevos episodios trombóticos. Finalmente, la mayoría de nuestros pacientes fueron de raza mestiza y, por lo tanto, nuestros hallazgos no son necesariamente generalizables a otras poblaciones.
En conclusión, para nuestro conocimiento, este es el primer estudio que describe diferencias en títulos séricos de nuevos aPL en pacientes con SAF primario o LES con SAF. Esto puede generar hipótesis en el rol diferencial de nuevos aPL en pacientes tanto con SAF primario como SAF secundario relacionado con enfermedades autoinmunes sistémicas. Si los títulos de anti-D1 B2GP1 y/o anti-PS/PT son útiles en discriminar entre pacientes con SAF primario o secundario requiere análisis posteriores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los anticuerpos anti-D1 B2GP1 fueron amablemente proporcionados por INOVA/Werfen Colombia. Los autores agradecen a Munther A. Khamashta y David Buss, por su revisión crítica del contenido de este manuscrito. También agradecemos a Sandra M. Osorno y Angela Loaiza (Dinámica IPS, Colombia) por apoyarnos con el manejo de las muestras y el análisis de aCL y anticuerpos anti-B2GP1.