Analizar la seguridad del uso concomitante de antiinflamatorios no esteroideos (AINE) con esteroides en pacientes con enfermedad reumática.
MétodosRevisión sistemática. Se definió una estrategia de búsqueda bibliográfica sensible en MEDLINE (desde 1961), EMBASE (desde 1980) y Cochrane Library hasta diciembre del 2007, definiendo la población (sujetos con enfermedad reumática en tratamiento con esteroides) y la intervención (tratamiento concomitante con AINE) y definiendo como resultados variables de seguridad (toxicidad gastrointestinal, renal y cardiovascular). Se seleccionaron ensayos clínicos y estudios de cohortes de calidad.
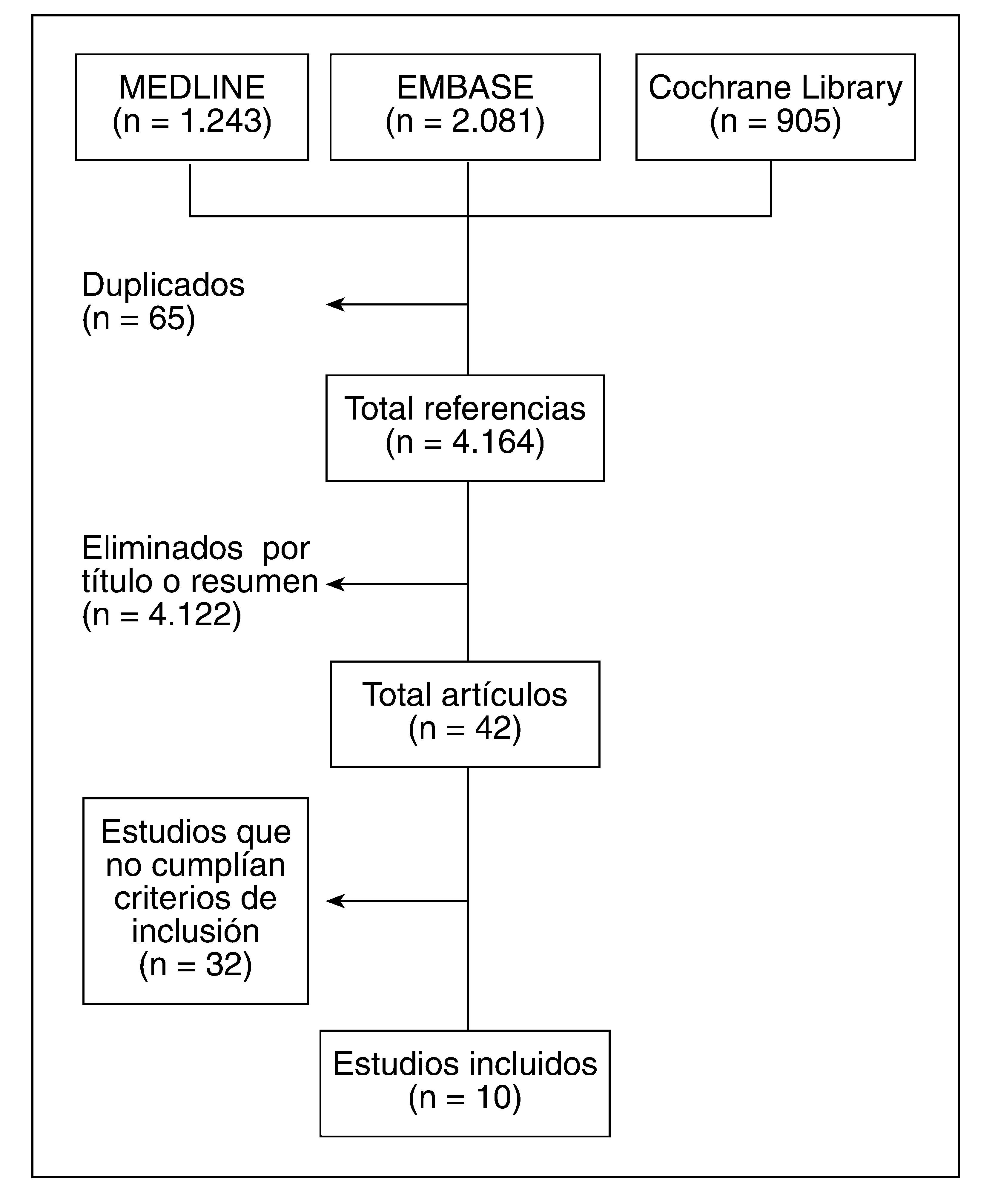
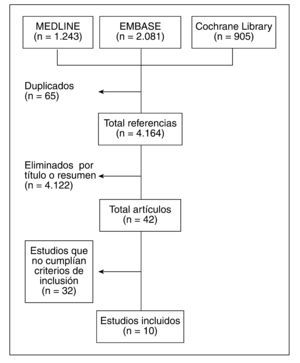
ResultadosSe recuperaron 4.164 estudios, de los que 42 se analizaron en detalle; finalmente se incluyeron 10 en los análisis, 6 de los cuales fueron ensayos clínicos y 4, estudios de cohortes prospectivos, que incluyeron a más de 20.000 pacientes.
ConclusionesEl uso concomitante de AINE y esteroides a dosis bajas en pacientes con enfermedad reumática no parece que incremente el riesgo de eventos adversos gastrointestinales.
To analyze the safety of combining nonsteroidal anti-inflammatory drugs (NSAID) and steroids.
MethodsA systematic review following a sensitive search strategy was performed. All articles published in MEDLINE (since 1961), EMBASE (since 1961), and Cochrane Library, up to December 2007 were examined. Selection criteria: the population (subjects with musculoskeletal diseases on steroids), the intervention (concomitant use of NSAID), and outcomes related to drugs safety (gastrointestinal, renal, and cardiovascular toxicity). Titles and abstracts of retrieved articles meeting inclusion criteria from the search were reviewed. Only randomized controlled trials (RCT) or high quality cohort studies with a control group were included.
ResultsOf a total of 4164 references retrieved, 42 were analyzed in detail, and 10 were finally included, 6 RCT and 4 prospective cohort studies, which included more than 20 000 patients.
ConclusionsThe use of NSAID and low dose of steroids in patients with musculoskeletal diseases does not seem to increase the risk of gastrointestinal adverse events.
El uso de fármacos antiinflamatorios no esteroideos (AINE) es muy frecuente en la población con enfermedades reumáticas.
Es bien conocida la relación de los AINE con las complicaciones gastroduodenales (ulcus, hemorragia, perforación)1, aunque también se ha visto que existen factores de riesgo independientes asociados a estas complicaciones digestivas en consumidores de AINE, como la edad avanzada, los antecedentes de ulcus gastroduodenal, el consumo de alcohol o la toma de otras medicaciones como antiagregantes y anticoagulantes2.
Por otro lado, también se ha estudiado el efecto gastroerosivo de otros fármacos como los esteroides, aunque en este caso su riesgo resulta controvertido; según algunas publicaciones, los esteroides orales aumentarían al doble el riesgo de complicaciones gastrointestinales, efecto que, además, dependería de la dosis3. Dado que actualmente en la especialidad de reumatología el uso de esteroides y AINE es muy frecuente en el tratamiento de las enfermedades reumáticas, determinar los posibles efectos de su uso concomitante (especialmente en relación con la toxicidad gastrointestinal, aunque extensible a cualquier otro evento adverso) es de máximo interés en nuestro medio.
Por todo lo comentado, el objetivo de la presente revisión sistemática es buscar la evidencia publicada en torno a la seguridad del uso concomitante de AINE y esteroides, para así contribuir a un mejor manejo de nuestros pacientes.
Material y métodosSe realizó una revisión sistemática para analizar la seguridad del uso concomitante de AINE y esteroides. Los criterios de selección de estudios fueron: a) estudios en que los pacientes tuvieran diagnóstico de alguna enfermedad osteomuscular y estuvieran en tratamiento con esteroides, sin restricción en cuanto al tipo y la dosis del fármaco; b) estudios en que los pacientes, además del esteroide, tomaran concomitantemente algún AINE, sin restricción en cuanto al tipo y la dosis de éste, pero excluyendo los estudios en que los sujetos tomaban AINE a dosis antiagregante y no analgésica/antiinflamatoria o en tratamientos tópicos; c) para evaluar la seguridad del uso concomitante de los fármacos, se incluyeron estudios en que se analizara alguna de las siguientes variables: toxicidad gastrointestinal (como sangrado, perforación, obstrucción, etc.), renal y cardiovascular, entre otras, y d) ensayos clínicos (EC) y estudios de cohortes (prospectivas o retrospectivas) de buena calidad. Se excluyeron los estudios que sólo aportaban datos de farmacocinética y/o farmacodinámica, así como estudios en sujetos sanos voluntarios y estudios en animales. Finalmente se seleccionaron artículos en inglés y español.
Se buscó en las siguientes bases de datos electrónicas hasta diciembre de 2007: MEDLINE (desde 1960), EMBASE (desde 1980) y la Cochrane Library (Central). Se buscaron tanto términos MeSH como en formato de texto libre. No se puso límites a la fecha de publicación. La estrategia de búsqueda específica se detalla en las tablas 1 y 2. No se realizó búsqueda manual en lo publicado en congresos nacionales (SER) o internacionales (ACR, EULAR), dado el gran volumen de artículos rescatados en las bases de datos electrónicas.
Estrategia de búsqueda y artículos rescatados en MEDLINE
| # | Estrategia de búsqueda | Resultados |
| 1 | (Steroids OR steroid OR corticoids OR corticoid OR corticosteroids OR corticosteroid OR glucosteroids OR glucosteroid OR glucocorticoids OR glucocorticoid OR prednisone OR prednison OR prednisolone OR methylprednisolone OR cortisone OR cortisol OR triamcinolone OR dexamethasone OR betamethasone) | 738.575 |
| 2 | NSAID OR Nonsteroidal Anti-Inflammatory Agents OR Nonsteroidal Antiinflammatory Agents OR Analgesics, Anti Inflammatory OR Non-Steroidal Anti-Rheumatic Agents OR Non-Steroidal Antirheumatic Agents OR Aspirin-Like Agents OR Agents, Aspirin-Like OR naproxen* OR ibuprofen* OR dexibuprofen OR dexketoprofen OR flurbiprofen OR Ketoprofen OR Ketorola* Or aceclofenac Or diclofenac OR lornoxicam OR meloxicam OR piroxicam OR tenoxicam OR indometacin OR sulindac OR tolmetin OR fenilbutazon OR Phenylbutazone OR nabumeton OR celecoxib OR etoricoxib OR parecoxib OR rofecoxib OR valdecoxib OR lumiracoxib OR salicylic acid OR acetylsalicylic acid OR diflunisal OR Cyclooxygenase 2 Inhibitors OR COX-2 Inhibitors OR COX2 Inhibitors, OR Coxibs | 150.391 |
| 3 | Randomized [All Fields] OR random allocation"[TIAB] NOT Medline[SB]) OR "random allocation"[MeSH Terms] OR randomized[Text Word] OR controlled[All Fields] AND ("clinical trials as topic"[MeSH Terms] OR trial[Text Word]) OR placebo OR blinded | 819.404 |
| 4 | #1 AND #2 AND #3 | 2.430 |
| 5 | acute [All Fields] OR acute OR post-operative [All Fields] OR post-surgical[All Fields] OR postsurgical [All Fields] OR postoperative [All Fields] OR postoperative OR Postoperative Complications [Mesh] OR intraoperative [All fields] OR Intraoperative Complications [Mesh] dysmenorrhoea [All Fields] OR dysmenorrhea OR orthodontic [All fields] | 28.328 |
| 6 | #4 NOT #5 | 2.411 |
| 7 | #6 LimitsLimits: Humans, Clinical Trial, Meta-Analysis, Randomized Controlled Trial, Clinical Trial, Phase I, Clinical Trial, Phase II, Clinical Trial, Phase III, Clinical Trial, Phase IV, Comparative Study, Controlled Clinical Trial, English, Spanish | 1.243 |
Estrategia de búsqueda y artículos rescatados en EMBASE
| # | Estrategia de búsqueda | Resultados |
| 1 | steroids.mp. or exp Steroid / OR glucocorticoids.mp. or exp Glucocorticoid / | 568.743 |
| 2 | nsaid.mp. or Nonsteroid Antiinflammatory Agent/ or Nonsteroidal Anti-Inflammatory Agents.mp. or (coxib or Cyclooxygenase 2 Inhibitor).mp. or Acetylsalicylic Acid/ or Aspirin-Like Agents.mp. or naproxen.mp. or NAPROXEN/ or ibuprofen.mp. or IBUPROFEN/ or dexibuprofen$.mp. or DEXIBUPROFEN/ or dexketoprofen.mp. or DEXKETOPROFEN/ or flurbiprofen.mp. or FLURBIPROFEN/ or Ketoprofen.mp. or KETOPROFEN/ or KETOROLAC/ or Ketorolac.mp. or aceclofenac.mp. or ACECLOFENAC/ or diclofenac.mp. or DICLOFENAC/ or lornoxicam.mp. or LORNOXICAM/ or meloxicam.mp. or MELOXICAM/ or PIROXICAM/ or piroxicam.mp. or PIROXICAM/ or piroxicam.mp. or tenoxicam.mp. or TENOXICAM/ or INDOMETACIN/ or indometacin.mp. or sulindac.mp. or SULINDAC/ or tolmetin.mp. or TOLMETIN/ or Phenylbutazone.mp. or PHENYLBUTAZONE/ or nabumetone/ or nabumeton.mp. or celecoxib.mp. or CELECOXIB/ or etoricoxib.mp. or ETORICOXIB/ or parecoxib.mp. or PARECOXIB/ or rofecoxib.mp. or ROFECOXIB/ or salicylic acid.mp. or Salicylic Acid/ or acetylsalicylic acid.mp. or Acetylsalicylic Acid/ or diflunisal.mp. or DIFLUNISAL/ or valdecoxib.mp. or VALDECOXIB/ or lumiracoxib.mp. or LUMIRACOXIB/ | 207.945 |
| 3 | exp clinical trial/ or evidence based medicine/ or outcomes research/ or crossover procedure/ or double blind procedure/ or single blind procedure/ or prospective study/ or major clinical study/ or exp comparative study/ or placebo/ or "evaluation and follow up"/ or follow up/ or randomization/ | 1.964.112 |
| 4 | controlled study/ not case control study/ | 2.568.695 |
| 5 | 3 or 4 | 3.774.593 |
| 6 | ((clinic$ adj5 trial$) or ((singl$ or doubl$ or trebl$ or tripl$) adj (blind$ or mask$)) or random$ or placebo$).ti,ab. | 489.355 |
| 7 | 5 or 6 | 3.890.101 |
| 8 | 1 and 2 and 7 | 17.876 |
| 9 | perioperative period.mp. or PERIOPERATIVE PERIOD/ or perioperative care.mp. or SURGERY/ or surgery.mp. or SURGICAL TECHNIQUE/ or surgical procedures.mp. or PEROPERATIVE CARE/ or preoperative care.mp. or intraoperative care.mp. or PEROPERATIVE COMPLICATION/ or POSTOPERATIVE COMPLICATION/ or dysmenorrhoea.mp. or Dysmenorrhea/ or orthodontic.mp. or Orthodontics/ or exp malignant neoplastic disease/ or cancer/ or exp metastasis/ or exp mixed tumor/ or exp "neoplasms of uncertain behavior"/ or exp neoplasms subdivided by anatomical site/ or exp "oncogenesis and malignant transformation"/ or exp paraneoplastic syndrome/ or exp "precancer and cancer-in-situ"/ or adolescent.mp. or adolescent/ or hospitalized adolescent/ or juvenile.mp. or juvenile/ or child.mp. or child/ or boy.mp. or boy/ or gifted child/ or girl.mp. or girl/ or handicapped child/ or hospitalized child/ or preschool child/ or school child/ or infant.mp. or infant/ or baby.mp. or baby/ or high risk infant/ or hospitalized infant/ or newborn.mp. or newborn/ or suckling.mp. or suckling/ or pediatric.mp. or review/ or guideline.mp. | 3.370.213 |
| 10 | 8 not 9 | 666.390 |
| 11 | exp musculoskeletal disease/ or musculoskeletal disease.mp. or rheumatic polymyalgia.mp. or polymyalgia/ or lupus erythematosus systemic.mp. or systemic lupus erythematosus/ or vasculitis/ or vasculitis.mp. or polymyositis.mp. or polymyositis/ or dermatomyositis.mp. or dermatomyositis/ | |
| 12 | 10 and 11 | 3.391 |
| 13 | Limit 12 to humans, abstracts | 2.091 |
Un único revisor analizó los artículos resultantes de la estrategia de búsqueda, así como el análisis en detalle de los artículos incluidos. El resultado de la búsqueda primeramente se depuró por título y resumen, o por artículo entero en caso de que no existiera resumen, mediante sesiones de 20min de duración máxima. Tras este proceso, los artículos restantes se analizaron en detalle. Finalmente se realizó una búsqueda manual con las referencias de los artículos seleccionados para su análisis en detalle. Todas las referencias se recuperaron de internet y se introdujeron en el programa Procite 5.1 para facilitar su gestión.
Para evaluar la calidad metodológica de los estudios incluidos se utilizó, para los EC, la escala de Jadad4 (1 a 5, considerándose de buena calidad los estudios con Jadad de 3–5) y, para los estudios de cohortes, la escala de calidad de Oxford.
ResultadosLos resultados de la búsqueda se detallan en la figura 1. Finalmente se incluyeron 10 artículos. Un total de 6 fueron EC5–10 y 4, estudios de cohortes prospectivas11–14 que incluyeron a más de 20.000 pacientes.
Resumen de la evidenciaA continuación se describen los principales resultados de los estudios incluidos, que se pueden consultar en la tabla 3. El listado de artículos excluidos15–47 y la causa de exclusión de la revisión sistemática se detallan en la tabla 4.
Estudios incluidos, características y principales resultados
| Estudio | Participantes e intervención | Resultados |
| Benito-Garcia11;cohorte prospectiva; seguimiento, 3 años; calidad, 2a | n = 4.240 AR/OA (79% mujeres; media de edad, 61); COX2 + prednisona (n = 1.314) | RR (ajustada) no significativa para: malestar epigástrico (p = 0,8), acidez gástrica (p = 0,88), náuseas (0,066), ulcus gastroduodenal (p = 0,259) |
| Fries12; cohorte prospectiva; seguimiento, 4 años; calidad 2a | n = 2.224 AR; AINE: naproxeno, ácido acetilsalicílico, piroxicam, sulindac, ibuprofeno + prednisona (dosis media, 7mg/día) | Tasa de hospitalización por evento gastrointestinal: AINE frente a AINE + prednisona (0,86 frente a 1,59%; p > 0,050); naproxeno frente a naproxeno + prednisona (1,14 frente a 2,58%; p > 0,050); AAS frente a AAS + prednisona (1,26 frente a 2,22%; p > 0,050); piroxicam frente a piroxicam + prednisona (2,22 frente a 1,79%; p > 0,050); sulindac frente a sulindac + prednisona (2,1 frente a 0,75%; p > 0,050); ibuprofeno frente a ibuprofeno + prednisona (0,89 frente a 7,8%; p > 0,050) |
| Gabriel13; cohorte prospectiva; seguimiento, 21 años; calidad 2a | n = 232 PMR (70% mujeres; media de edad, 72 años). CE: AR, LES, PM, infecciones, mieloma. AINE + esteroides (n = 51); AINE solo (n = 57); esteroides solos (n = 124); duración media tratamiento esteroides, 2,5 años | a) Cualquier evento adverso: AINE solo (n = 38), AINE + esteroides (n = 41) (p = 0,120); b) hemorragia gastroduodenal: AINE solo (n = 5), AINE + esteroides (n = 2) (p > 0,050) |
| Goldstein5; EC doble ciego multicéntrico; seguimiento, 12 semanas; Jadad 3 | n = 536 AR/OA (67% mujeres; media de edad, 57 años); CE: otras enfermedades inflamatorias, enfermedad gastrointestinal activa, protectores gástricos, AINE; celecoxib 400mg/día 12 semanas (n = 185); celecoxib 400mg/día + esteroides 12 semanas (n = 26); naproxeno 1.000mg/día 12 semanas (n = 194); naproxeno 1.000mg/día + esteroides 12 semanas (n = 20) | Ulcus gastroduodenal (diagnóstico endoscópico); celecoxib (n = 16); celecoxib + esteroides (n = 2) (p = 0,969); naproxeno (n = 79); naproxeno + esteroides (n = 8) (p > 0,050) |
| Jick6; EC cruzado; seguimiento, 2 semanas; Jadad 3 | n = 26 pacientes con enfermedad reumática(75% mujeres; media de edad, 54 años): dexametasona 1,5mg/día 1 semanas (n = 26); dexametasona 0,75mg/día 1 semana + AAS 1.500mg/día 1 semana (n = 26) | a) Trastornos gastrointestinales (dolor, náuseas, diarrea); dexametasona (n = 3), dexametasona + AAS (n = 0) (p = 0,074); b) trastornos del SNC (cefalea, vértigo, tinnitus): dexametasona (n = 2), dexametasona + AAS (n = 5) (p = 0,222); c) dolor torácico: dexametasona (n = 0), dexametasona + AAS (n = 1) (p = 0,312) |
| Laine7; EC ciego multicéntrico; seguimiento, 13 meses; Jadad 3 | n = 8.076 AR (79,7% mujeres; media de edad, 58 años). Criterios de exclusión: protectores gástricos. Rofecoxib 50mg/día (n = 4.047); naproxeno 1.000mg/día (n = 4.029); todos toman esteroides | Incidencia (100 pacientes-año) de trastorno gastrointestinal serio (sangrado, perforación obstrucción, ulcus): rofecoxib solo, 2,1; rofecoxib + esteroides, 2,1 (p = 1); naproxeno solo, 4,5; naproxeno + esteroides, 5,67 (p = 0,274) |
| Laine8; EC ciegomulticéntrico; seguimiento, 13 meses; Jadad 3 | n = 8.076 AR (79,7% mujeres; media de edad, 58 años). CE: protectores gástricos. Rofecoxib 50mg/día + esteroides (n = 4.047); naproxeno 1.000mg/día + esteroides (n = 4.029) | Riesgo relativo de sangrado, perforación, obstrucción, ulceración, diverticulitis, en intestino grueso: rofecoxib, RR = 0,26; rofecoxib + esteroides, RR = 0,59 (p > 0,050); naproxeno, RR = 0,99; naproxeno + esteroides, RR = 0,76 (p > 0,050) |
| Littman9; EC doble ciego placebo control; seguimiento, 15 semanas; Jadad 3 | n = 32 PMR (63% mujeres; media de edad, 66). CE: otras enfermedades reumáticas. Tenidap 120mg/día + prednisona < 10mg/día 15 semanas (n = 16); placebo + esteroides < 10mg/día 15 semanas (n = 16) | a) Ulcus gastroduodenal: tenidap + esteroides (n = 1), esteroides (n = 0) (p = 0,242); b) aumento de transaminasas: tenidap + esteroides (n = 3), esteroides (n = 0) (p = 0,045) |
| Paulus10; EC; seguimiento, 3 años; Jadad 3 | n = 1.434 AR (71% mujeres; media de edad, 52 años). CE: otros AINE o FAME, prednisona > 5mg/día. AINE: etodolaco 300mg/día, etodolaco 1.000mg/día o ibuprofeno 2.400mg/día (n = 1.105); AINE (anteriores) + prednisona < 5mg/día (n = 328) | a) cualquier evento adverso: AINE (n = 118), AINE + prednisona (n = 34) (p = 0,439); b) alteraciones en análisis de laboratorio: AINE (n = 30), AINE + prednisona (n = 7) (p = 0,212) |
| Wolfe14; cohorteprospectiva; seguimiento, 13 años; calidad 2a | n = 8.605 AR/OA. AINE; AINE + prednisona | Incidencia de hospitalización en AR (100 pacientes/año) por sangrado gastrointestinal: prednisona, 0,97 (0,43-2,14); AINE, 0,19 (0,09-0,39); AINE + prednisona, 1,31 (0,82-2,08) |
AINE: antiinflamatorios no esteroideos; AR: artritis reumatoide; CE: criterios de exclusión; EC: ensayo clínico; FAME: fármacos modificadores de la enfermedad;
LES: lupus eritematoso sistémico; OA: osteoartrosis; PM: polimiositis; PMR: polimialgia reumática; RR: riesgo relativo.
Estudios excluidos (por autor y fecha del estudio) y motivos de exclusión
| Estudio | Motivo de exclusión |
| Abelson16 (1989) | Esteroides. No hay enfermedad reumática |
| Ambanelli17 (1991) | Esteroides. No hay datos específicos del uso concomitante de esteroides y AINE |
| Avidan18 (2001) | Esteroides. No hay datos específicos del uso concomitante de esteroides y AINE |
| Awni19 (1995) | Esteroides. Voluntarios sanos. No hay datos clínicos específicos del uso concomitante de esteroides y AINE |
| Badia20 (1975) | Esteroides. No hay datos específicos del uso concomitante de esteroides y AINE |
| Bowers21 (1975) | Esteroides. No hay datos específicos del uso concomitante de esteroides y AINE |
| Del Campo22 (1981) | Esteroides. No es posible valorar correctamente el uso concomitante de esteroides y AINE |
| Flores23 (1973) | Esteroides. No es posible valorar correctamente el uso concomitante de esteroides y AINE |
| Furtado24 (2005) | Esteroides. No hay datos específicos del uso concomitante de esteroides y AINE |
| Garcia25 (2006) | Esteroides. No relacionado con la pregunta de investigación |
| Garg26 (1992) | Esteroides. Voluntarios sanos. No hay datos clínicos específicos del uso concomitante de esteroides y AINE |
| Gergely27 (1989) | Esteroides. No hay datos específicos del uso concomitante de esteroides y AINE |
| Goycochea-Robles28 (2007) | Esteroides. No relacionado con la pregunta de investigación |
| Green29 (1998) | Esteroides. No hay rama que estudie el uso concomitante de esteroides y AINE |
| Harris30 (2006) | Esteroides. No relacionado con la pregunta de investigación |
| Helin-Salmivaara31 (2005) | Esteroides. No relacionado con la pregunta de investigación |
| Hochain32 (1995) | Esteroides. Estudio de mala calidad |
| Hernández-Díaz15 (2001) | Esteroides. Estudio en población general |
| Holvoet33 (1991) | Esteroides. No relacionado con la pregunta de investigación |
| Huerta34 (2005) | Esteroides. No hay datos específicos del uso concomitante de esteroides y AINE |
| Joshi35 (1977) | Esteroides. No hay datos específicos del uso concomitante de esteroides y AINE |
| Kolopp-Sarda36 (2001) | Esteroides. No relacionado con la pregunta de investigación |
| Komajda37 (2003) | Esteroides. No relacionado con la pregunta de investigación |
| Lanier38 (1987) | Esteroides. No hay datos específicos del uso concomitante de esteroides y AINE |
| Luftschein39 (1979) | Esteroides. No hay datos específicos del uso concomitante de esteroides y AINE |
| Martinez40 (1988) | Esteroides. No hay datos específicos del uso concomitante de esteroides y AINE |
| Martio41 (1980) | Esteroides. No hay datos específicos del uso concomitante de esteroides y AINE |
| McNeil42 (1993) | Esteroides. No hay datos específicos del uso concomitante de esteroides y AINE |
| Neustadt43 (1987) | Esteroides. No hay datos específicos del uso concomitante de esteroides y AINE |
| Paulus44 (2004) | Esteroides. No guarda relación con la pregunta de investigación |
| Rejholec45 (1979) | Esteroides. No hay datos específicos del uso concomitante de esteroides y AINE |
| Sheldon46 (2003) | Esteroides. No hay datos específicos del uso concomitante de esteroides y AINE |
| Tougas47 (1987) | Esteroides. Artículo de opinión |
AINE: antiinflamatorios no esteroideos.
Como ya se ha comentado, se incluyeron 10 artículos de buena calidad, 6 EC (Jadad 3) y 4 estudios de cohortes prospectivas (calidad 2a). Estos estudios analizaron a pacientes con afección osteomuscular, pero sobre todo incluyeron a pacientes con artritis reumatoide (AR) y/o artrosis (OA), la mayoría mujeres, de mediana edad. La duración del tratamiento varió de 1–15 semanas los EC a 3–21 años las cohortes, o no fue posible hallar este dato. Se utilizaron diferentes tipos de AINE y esteroides, así como dosis, aunque el esteroide más empleado fue la prednisona a dosis bajas, próximas a los 10mg/día. La mayoría de los estudios no permitían expresamente el uso de protectores gástricos o no registraron que los pacientes los tomaran.
En cuanto a los resultados de seguridad, no se ha encontrado evidencia suficiente que contraindique el uso concomitante de AINE y esteroides en pacientes con enfermedades reumáticas. Esto se basa en que no se ha visto una clara relación entre el uso combinado de estos fármacos y la aparición de eventos adversos gastrointestinales (leves o graves) u otro tipo de eventos, en comparación con el uso de AINE sin esteroides.
Resultados detallados del uso combinado de AINE y esteroidesEntre los resultados de seguridad del uso en combinación de AINE y esteroides, en los EC destacan:
- –
En el estudio de Goldstein et al5, se objetivó que el uso de celecoxib 400mg/día o naproxeno 1.000mg/día con esteroides durante 12 semanas no se asoció a ulcus gastroduodenal en comparación con estos AINE sin esteroides.
- –
Según Jick et al6, el uso de ácido acetilsalicílico 1.500mg/día con dexametasona 0,75mg/día durante 1 semana, en comparación con dexametasona sola, no se asoció a mayor número de trastornos gastrointestinales menores (no incluye ulcus ni hemorragias), trastornos en el SNC (cefalea, vértigo, tinnitus) o dolor torácico.
- –
En los artículos de Laine et al7,8, se observó que el uso de rofecoxib 50mg/día o naproxeno 1.000mg/día con esteroides, en comparación con el uso de los AINE solos, no se asoció a mayor riesgo de eventos adversos digestivos superiores e inferiores serios (ulcus, hemorragia, perforación, obstrucción o diverticulitis).
- –
En el artículo de Littman et al9, el uso de tenidap 120mg/día más prednisona (< 10mg/día) durante 15 semanas, en comparación con AINE en monoterapia, no se asoció a mayor riesgo de ulcus gastroduodenal, pero sí a mayor número de alteraciones analíticas.
- –
En el estudio de Paulus et al10, el uso de AINE (etodolaco 300mg/día, etodolaco 1.000mg/día o ibuprofeno 2.400mg/día) con prednisona (< 5mg/día), en comparación con los AINE solos, no se asoció con la aparición de mayor número de eventos adversos o alteraciones analíticas.
En cuanto a los estudios de cohortes prospectivas, se incluyeron 4: Benito-García et al11, Fries et al12, Gabriel et al13 y Wolfe et al14. En ellos se analizó a un total de 12.365 pacientes. En general, la incidencia de evento gastrointestinal serio fue baja y no se asoció al uso concomitante de AINE y esteroides. Destaca el estudio de Wolf et al14, en el que la combinación de AINE con esteroides no incrementó el riesgo de evento gastrointestinal importante en comparación con los AINE en monoterapia, mientras que fueron los esteroides en monoterapia los que aumentaron más el riesgo del evento.
DiscusiónEn la presente revisión sistemática se ha analizado la seguridad del uso concomitante de los AINE y los esteroides en pacientes con enfermedades reumáticas. Para ello, se realizó una extensa búsqueda en las principales bases de datos bibliográficas disponibles, tal y como se ha descrito. Sólo incluimos EC y estudios de cohortes de calidad, porque consideramos que era la mejor forma de contestar a esta pregunta de investigación.
Finalmente, se incluyeron 10 estudios (6 EC5–10, 4 estudios de cohortes11–14) de calidad aceptable: los EC fueron todos Jadad 3 y los de cohortes, calidad 2a. En cuanto a los pacientes estudiados, todos tenían algún tipo de afección osteomuscular, aunque es importante destacar que prácticamente todos eran pacientes con AR o artrosis. Los AINE y los esteroides estudiados fueron diversos, así como las dosis preescritas (en los estudios en este dato estaba disponible). En relación con los eventos estudiados, todos los artículos incluidos evaluaron eventos adversos gastrointestinales, y la mayoría de ellos también analizaron los eventos adversos clínicamente más relevantes y/o graves, como el ulcus gastroduodenal o las hemorragias digestivas. En general, estas medidas de resultado fueron definidas por criterios muy similares en todos los estudios.
En primer lugar, en la presente revisión sistemática se ha visto que la incidencia general de eventos adversos gastrointestinales serios (sangrado, perforación, obstrucción, etc.) que pudieran generar la hipótesis de contraindicar el uso combinado de ambos fármacos es baja. Además, los resultados de los EC indican que la combinación no incrementa el riesgo de eventos adversos gastrointestinales (tanto graves como otros como la dispepsia leve o las náuseas) u otros (trastornos del sistema nervioso central o dolor torácico) en comparación con el uso de los AINE sin esteroides. En cuanto a los estudios de cohortes prospectivas, tampoco se demostró que el uso combinado de AINE y esteroides incrementara el riesgo de evento adverso gastrointestinal en comparación con su uso en monoterapia. Entre ellos destacamos el estudio de Wolfe et al16, en el que la combinación de AINE y esteroides no incrementó el riesgo de evento gastrointestinal grave de los esteroides, que fueron los que mayor incidencia originaron. Por todo ello, se puede recomendar el uso de los AINE en combinación con esteroides (al menos a dosis bajas), en pacientes con enfermedades osteomusculares, con una evidencia 2a y una fuerza de la recomendación B/C.
No obstante, hay que interpretar todos estos datos con mucha cautela, ya que no están exentos de algunas limitaciones. En el caso de los EC, las limitaciones se derivan sobre todo por la representatividad de los pacientes incluidos en ellos, ya que probablemente no sean como muchos otros pacientes que habitualmente se siguen en las consultas de reumatología, es decir, pacientes con mayor número de factores independientes de riesgo de eventos adversos gastrointestinales, como por ejemplo los de edad más avanzada, con comorbilidades, etc.
Por otro lado, en los estudios de cohortes es muy difícil definir claramente las duraciones y las dosis de los fármacos estudiados para poder establecer relaciones causales más sólidas entre las combinaciones farmacológicas y sus posibles eventos adversos.
Pero, por otro lado, es importante comentar que estos datos contrastan con lo publicado en referencia a la población general y el uso de AINE con esteroides, para el que se ha descrito un riesgo incrementado de complicaciones gastrointestinales graves28. Esto podría deberse, al menos en parte, a que -como bien se ha descrito claramente en al menos dos de los EC y en uno de los estudios de cohortes y probablemente así sea en los demás– las dosis de esteroides utilizadas en los estudios incluidos en esta revisión sistemática fueron bajas, menores que las que habitualmente toman muchos pacientes con enfermedades reumáticas. En general, son dosis mucho más bajas que las dosis de esteroides utilizadas, por ejemplo, para el tratamiento de otras afecciones como las pulmonares y algunas neurológicas, que se incluirían en los estudios poblacionales, lo que probablemente incremente el riesgo de evento adverso del uso concomitante de AINE y esteroides.
Continuando con los eventos adversos en relación con estos fármacos, no cabe duda de que los gastrointestinales, por su frecuencia y su potencial gravedad, son de estudio y seguimiento obligatorios, pero destacamos la poca información disponible sobre otro tipo de eventos que pudieran ser de interés, como los renales o cardiovasculares.
Para terminar, en relación con el uso combinado de AINE y esteroides, en esta revisión sistemática se han incluido estudios con diferentes fármacos, tanto AINE como esteroides (aunque claramente el esteroide más empleado fue la prednisona), así como diferentes dosis y combinaciones de ambos, por lo que resulta extremadamente difícil establecer comparaciones entre combinaciones de ellos para definir cuál es la combinación de AINE y esteroide (y en qué dosis de cada uno) que presenta un mejor perfil de seguridad. Por ello, se deberá realizar en el futuro otros estudios especialmente diseñados para responder a esta cuestión.
En conclusión, el uso de AINE con esteroides a dosis bajas en pacientes con afecciones osteomusculares no parece incrementar el riesgo de eventos adversos gastrointestinales tanto leves como graves, por lo que se puede recomendar su uso en la práctica diaria.