Revisar la evidencia disponible sobre la repercusión de los tratamientos de la artritis reumatoide (AR) en la enfermedad pulmonar intersticial difusa (EPID) asociada.
MétodosRevisión sistemática de estudios que evalúan el impacto del tratamiento farmacológico en pacientes con AR y EPID. Se realizó una búsqueda bibliográfica en MEDLINE, EMBASE y Cochrane, selección de artículos y evaluación de la calidad metodológica (FLC 3.0 OSTEBA) y graduación del nivel de evidencia (SING).
ResultadosSe identificaron 1.720 referencias en búsqueda primaria y 7 en manual o indirecta. Se incluyeron 43 artículos: 7 revisiones sistemáticas, 2 ensayos clínicos aleatorizados, 5 estudios de cohortes, 8 estudios de casos-controles y 21 series de casos. Metotrexato (MTX) y leflunomida (LEF) no aumentan la incidencia, complicaciones ni mortalidad por EPID. Aunque los resultados no son uniformes, los anti-TNF han tenido con frecuencia peores resultados en incidencia, progresión y mortalidad por EPID que MTX, LEF, abatacept (ABA) y rituximab (RTX). La evidencia encontrada es escasa para los inhibidores de JAK quinasas y antifibróticos, y controvertida para los inhibidores de la IL-6.
ConclusionesNo existe evidencia de que MTX o LEF empeoren el pronóstico de los pacientes con AR-EPID. RTX y ABA parecen tener mejores resultados que otros biológicos, como anti-TNF, consiguiendo con frecuencia la estabilización y, en algunos casos, la mejoría de la EPID en pacientes con AR.
To review the available evidence on the impact of rheumatoid arthritis (RA) treatments in associated diffuse interstitial lung disease (ILD).
MethodsSystematic review of studies evaluating the impact of pharmacological treatment in patients with RA and ILD. A bibliographic search in MEDLINE, EMBASE and Cochrane, a selection of articles and the methodological quality assessment (FLC 3.0 OSTEBA) and grading of the level of evidence (SING) of the selected articles were performed.
Results1,720 references were identified in primary search and 7 in manual or indirect. Forty-three articles were included: 7 systematic reviews, 2 randomized clinical trials, 5 cohort studies, 8 case-control studies and 21 case series. Methotrexate (MTX) and leflunomide (LEF) do not increase incidence, complications or mortality due to ILD. Although the results are not uniform, anti-TNF have often had worse outcomes in incidence, progression and mortality due to ILD than MTX, LEF, abatacept (ABA) and rituximab (RTX). The evidence found is scarce for JAK kinase and antifibrotic inhibitors, and controversial for IL-6 inhibitors.
ConclusionsThere is no evidence that MTX or LEF worsens the prognosis of patients with AR-EPID. RTX and ABA seem to have better results than other biologicals, such as anti-TNF, often achieving stabilization and, in some cases, the improvement of ILD in patients with RA.
La artritis reumatoide (AR) es una enfermedad inflamatoria crónica inmunomediada de etiología desconocida. Afecta fundamentalmente a las articulaciones, pero las manifestaciones clínicas extraarticulares son comunes. El pulmón es uno de los órganos más frecuentemente afectados y causa una significativa morbimortalidad.
La enfermedad pulmonar intersticial difusa (EPID) es la manifestación pulmonar más frecuente en AR, con una incidencia estimada de 4 a 4,5 casos/1.000 pacientes-año1,2. Su prevalencia oscila entre 10 y 30% de los casos en AR precoz (< 2 años de evolución), y entre 3,6 y 42% en AR establecida2,3. Esta gran variación se debe a que los estudios son muy heterogéneos con diferentes métodos diagnósticos, poblaciones poco homogéneas y, además, con una falta de terminología y de criterios de clasificación validados.
La EPID de la AR se encuadra en la clasificación internacional de la neumonía intersticial idiopática de las Sociedades Americana y Europea de Neumología, que tiene en cuenta los hallazgos histopatológicos. Las formas más comunes son neumonía intersticial usual (NIU) y neumonía intersticial no específica (NINE) (44-46% y 33-44%, respectivamente), aunque se han comunicado casos con todas las formas anatomopatológicas descritas en el contexto de la enfermedad4.
La EPID en la AR se asocia a determinados factores de riesgo, como género masculino, edad avanzada, tabaquismo y positividad para FR y ACPA5. El curso clínico de la EPID varía desde formas asintomáticas hasta enfermedad rápidamente progresiva en una minoría de casos. Se ha estimado que los pacientes con AR y EPID tienen un riesgo de muerte hasta tres veces superior que aquellos sin EPID, constituyendo la segunda causa de mortalidad, tras las enfermedades cardiovasculares3,6. Esta alta mortalidad ha sido atribuida a la carga inflamatoria sistémica no controlada, infecciones y complicaciones de las terapias. El tratamiento de la AR ha mejorado de forma sustancial en los últimos años con la introducción de las terapias biológicas; sin embargo, el uso de estos agentes se ha restringido en pacientes con EPID por preocupaciones acerca de su seguridad.
A pesar de la frecuencia y potencial gravedad, no existe actualmente un consenso respecto al tratamiento más adecuado para los pacientes con AR y EPID. Realizamos una revisión sistemática (RS) de la literatura con el objetivo de responder con la mejor evidencia disponible a la pregunta de investigación: En pacientes con AR y EPID asociada ¿Qué influencia tienen los tratamientos empleados en la AR sobre la EPID, en términos de eficacia y seguridad?.
Material y métodosSe realizó una RS de estudios sobre tratamientos de pacientes con AR y EPID asociada.
Estrategia de Búsqueda. Se realizó una búsqueda sensible en MEDLINE (desde 1966), EMBASE (desde 1974) y COCHRANE (desde 1992) hasta 31 de septiembre de 2019, mediante términos MESH y texto libre. La estrategia incluyó sinónimos de “artritis reumatoide”, “enfermedad pulmonar intersticial difusa”, “fármacos antirreumáticos modificadores de la enfermedad (FAME)” y de los diferentes FAME e inmunosupresores (IS), y de los términos “respuesta” y “mortalidad”. La búsqueda se restringió a estudios en humanos publicados en inglés, francés o español. El proceso de selección de estudios para la revisión fue realizado de forma paralela e independiente por dos revisores (CCC y ECC) en dos pasos: 1) selección por título y resumen de los estudios localizados a través de la búsqueda bibliográfica y 2) selección por texto completo de los anteriormente seleccionados, eliminando los artículos que no cumplían con los criterios de inclusión. En caso de dudas o discrepancias, éstas fueron resueltas tras discusión y cuando no hubo consenso se consultó con un tercer revisor (PVC). Las discusiones y los acuerdos quedaron documentados. También se realizó una búsqueda manual secundaria en la bibliografía de los estudios incluidos. Se utilizó EndNote X8 para la gestión de las referencias bibliográficas.
Criterios de selección de estudios. Los criterios de selección de los estudios centrados en la población, intervención, comparación y desenlaces (outcomes) (PICO) relacionados con la pregunta de investigación, fueron definidos con anterioridad a la búsqueda. Se incluyeron los estudios realizados con pacientes adultos, diagnosticados de AR (criterios ACR 1987, ACR/EULAR 2010) y EPID asociada diagnosticada por tomografía axial computerizada de alta resolución (TACAR) de tórax (patrones radiológicos NIU o NINE) y/o pruebas funcionales respiratorias (CVF y/o DLCO) y tratados farmacológicamente (con FAME, glucocorticoides, IS o antifibróticos). La intervención de comparación fue placebo o cualquiera de los otros tratamientos. Los estudios debían incluir alguno de los siguientes desenlaces: eficacia (mejoría de EPID), toxicidad pulmonar (empeoramiento o aparición de EPID) y resultados, medidos mediante tasas de supervivencia o de mortalidad durante el tratamiento. Los cambios en la EPID fueron evaluados por TACAR, CVF y/o DLCO. En cuanto al diseño de estudios, se incluyeron metaanálisis, RS, ECA y en caso de insuficiente evidencia para contestar a la pregunta de investigación, estudios observacionales (cohortes, casos-controles y series de casos). Se excluyeron los casos clínicos aislados, así como la neumonitis aguda como desenlace y los tratamientos no farmacológicos.
Extracción de datos y evaluación de la calidad. La evaluación de la calidad de los estudios seleccionados se realizó utilizando las plantillas de fichas de lectura crítica de OSTEBA7 y la graduación del nivel de evidencia utilizando los niveles de evidencia del SIGN (Scottish Intercollegiate Guidelines Network)8.
Esta revisión no fue registrada prospectivamente en el Registro Prospectivo Internacional de Revisiones Sistemáticas PROSPERO.
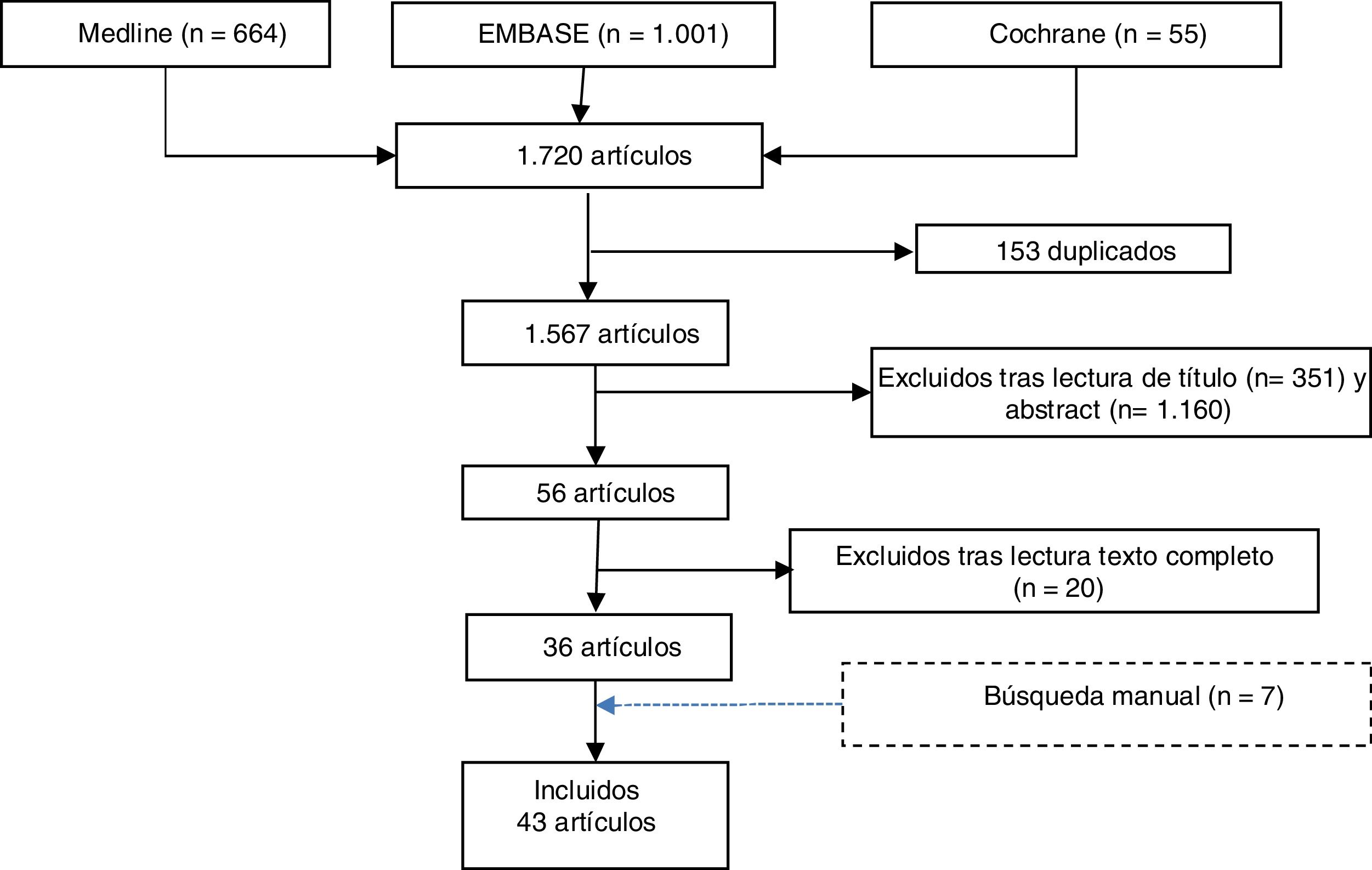
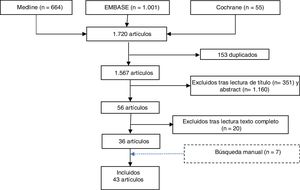
ResultadosLa búsqueda bibliográfica realizada identificó 1.720 referencias. Una vez eliminados los duplicados (153), se realizó el cribado por título y resumen de 1.511 referencias y se seleccionaron 56 artículos para su evaluación. Tras la lectura a texto completo se excluyeron 20 estudios, especificando el motivo de la exclusión (anexo 1). Adicionalmente, se seleccionaron otros 7 estudios obtenidos por búsqueda manual (fig. 1).
En total se incluyeron 43 estudios: 7 RS, 2 ECA (uno de RTX y otro de nintedanib), 5 estudios de cohortes, 8 de casos-controles y 21 series de casos (la mayoría de RTX). Los estudios se centran en EPID asociada a AR e intentan evaluar la eficacia y seguridad de los tratamientos habituales de la AR sobre la evolución de la EPID.
La calidad de los estudios incluidos en esta RS es en general media, aunque varía con las distintas terapias. En la tabla 1, se describen los datos más relevantes de las 7 RS incluidas. En la tabla 2, se resumen los únicos dos ECA seleccionados: uno abierto, que investiga el efecto de RTX en EPID asociada a AR9, y otro doble ciego, que evalúa nintedanib en pacientes con enfermedades fibrosantes10. En este último, hubo 89 pacientes con AR y EPID, pero sólo disponemos de resultados globales y no separados por patología.
Revisiones Sistemáticas y Metaanálisis
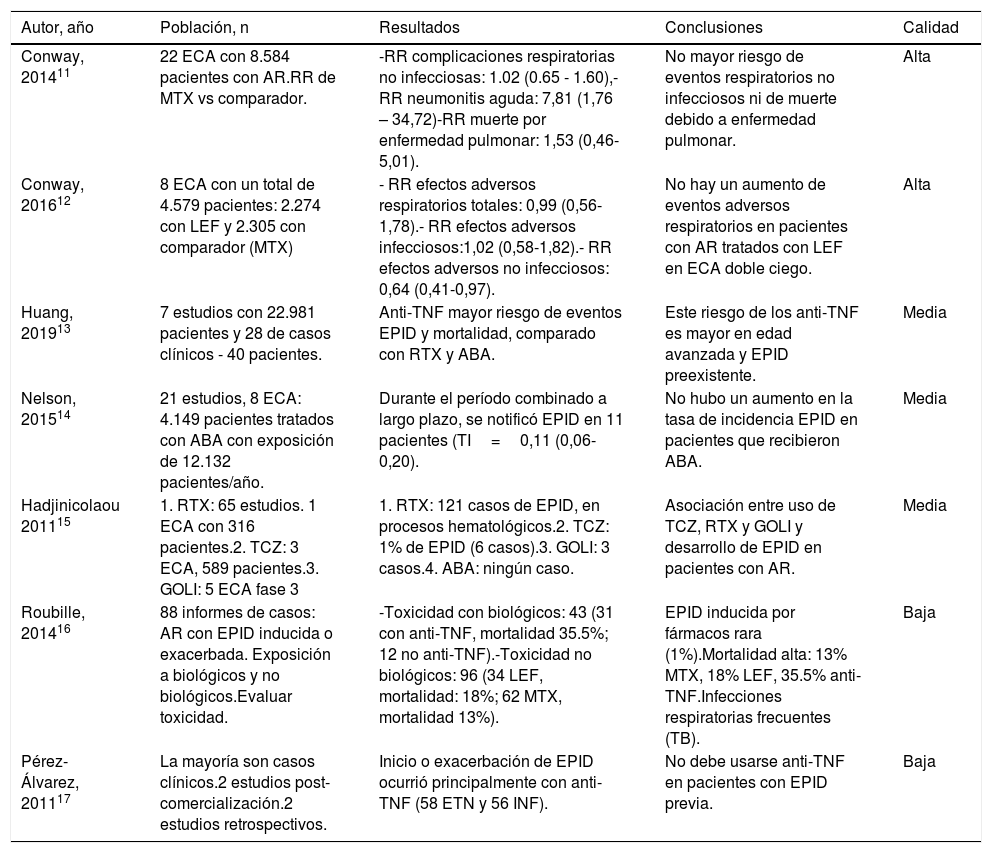
| Autor, año | Población, n | Resultados | Conclusiones | Calidad |
|---|---|---|---|---|
| Conway, 201411 | 22 ECA con 8.584 pacientes con AR.RR de MTX vs comparador. | -RR complicaciones respiratorias no infecciosas: 1.02 (0.65 - 1.60),-RR neumonitis aguda: 7,81 (1,76 – 34,72)-RR muerte por enfermedad pulmonar: 1,53 (0,46-5,01). | No mayor riesgo de eventos respiratorios no infecciosos ni de muerte debido a enfermedad pulmonar. | Alta |
| Conway, 201612 | 8 ECA con un total de 4.579 pacientes: 2.274 con LEF y 2.305 con comparador (MTX) | - RR efectos adversos respiratorios totales: 0,99 (0,56-1,78).- RR efectos adversos infecciosos:1,02 (0,58-1,82).- RR efectos adversos no infecciosos: 0,64 (0,41-0,97). | No hay un aumento de eventos adversos respiratorios en pacientes con AR tratados con LEF en ECA doble ciego. | Alta |
| Huang, 201913 | 7 estudios con 22.981 pacientes y 28 de casos clínicos - 40 pacientes. | Anti-TNF mayor riesgo de eventos EPID y mortalidad, comparado con RTX y ABA. | Este riesgo de los anti-TNF es mayor en edad avanzada y EPID preexistente. | Media |
| Nelson, 201514 | 21 estudios, 8 ECA: 4.149 pacientes tratados con ABA con exposición de 12.132 pacientes/año. | Durante el período combinado a largo plazo, se notificó EPID en 11 pacientes (TI=0,11 (0,06-0,20). | No hubo un aumento en la tasa de incidencia EPID en pacientes que recibieron ABA. | Media |
| Hadjinicolaou 201115 | 1. RTX: 65 estudios. 1 ECA con 316 pacientes.2. TCZ: 3 ECA, 589 pacientes.3. GOLI: 5 ECA fase 3 | 1. RTX: 121 casos de EPID, en procesos hematológicos.2. TCZ: 1% de EPID (6 casos).3. GOLI: 3 casos.4. ABA: ningún caso. | Asociación entre uso de TCZ, RTX y GOLI y desarrollo de EPID en pacientes con AR. | Media |
| Roubille, 201416 | 88 informes de casos: AR con EPID inducida o exacerbada. Exposición a biológicos y no biológicos.Evaluar toxicidad. | -Toxicidad con biológicos: 43 (31 con anti-TNF, mortalidad 35.5%; 12 no anti-TNF).-Toxicidad no biológicos: 96 (34 LEF, mortalidad: 18%; 62 MTX, mortalidad 13%). | EPID inducida por fármacos rara (1%).Mortalidad alta: 13% MTX, 18% LEF, 35.5% anti-TNF.Infecciones respiratorias frecuentes (TB). | Baja |
| Pérez-Álvarez, 201117 | La mayoría son casos clínicos.2 estudios post-comercialización.2 estudios retrospectivos. | Inicio o exacerbación de EPID ocurrió principalmente con anti-TNF (58 ETN y 56 INF). | No debe usarse anti-TNF en pacientes con EPID previa. | Baja |
Ensayos clínicos aleatorizados
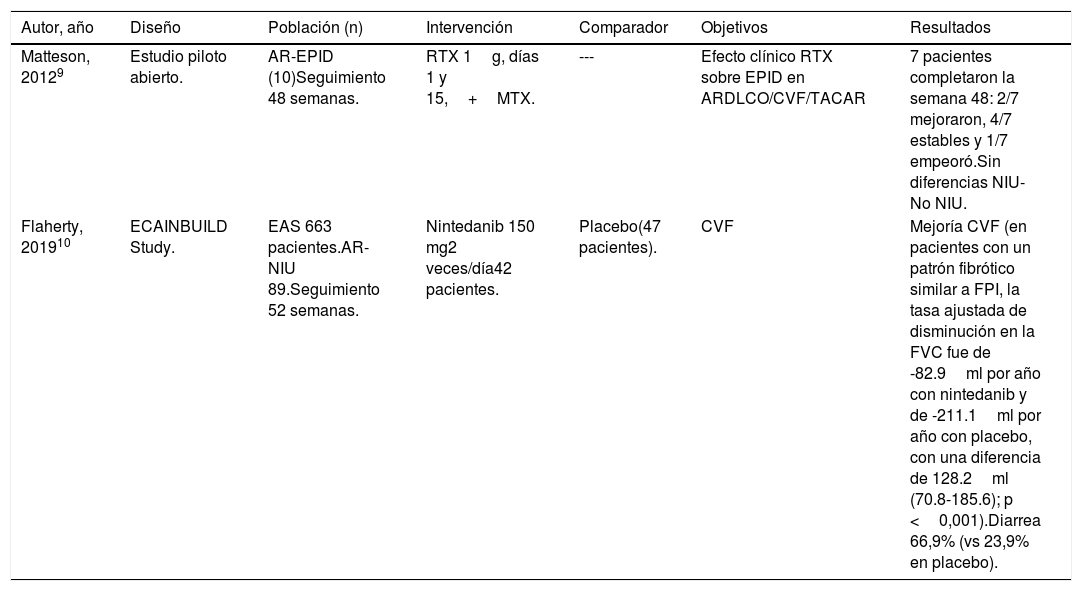
| Autor, año | Diseño | Población (n) | Intervención | Comparador | Objetivos | Resultados |
|---|---|---|---|---|---|---|
| Matteson, 20129 | Estudio piloto abierto. | AR-EPID (10)Seguimiento 48 semanas. | RTX 1g, días 1 y 15,+MTX. | --- | Efecto clínico RTX sobre EPID en ARDLCO/CVF/TACAR | 7 pacientes completaron la semana 48: 2/7 mejoraron, 4/7 estables y 1/7 empeoró.Sin diferencias NIU-No NIU. |
| Flaherty, 201910 | ECAINBUILD Study. | EAS 663 pacientes.AR-NIU 89.Seguimiento 52 semanas. | Nintedanib 150 mg2 veces/día42 pacientes. | Placebo(47 pacientes). | CVF | Mejoría CVF (en pacientes con un patrón fibrótico similar a FPI, la tasa ajustada de disminución en la FVC fue de -82.9ml por año con nintedanib y de -211.1ml por año con placebo, con una diferencia de 128.2ml (70.8-185.6); p <0,001).Diarrea 66,9% (vs 23,9% en placebo). |
En la actualidad, se están llevando a cabo otros dos ECA en pacientes con EPID asociada a AR: uno en fase II, con pirfenidona (NCT02808871) y otro en fase III con abatacept (NCT03084419), pero todavía no hay resultados disponibles en ninguno de ellos.
Las tablas 3 y 4 muestran la eficacia de los FAME sintéticos convencionales (FAMEsc), glucocorticoides (GC) e IS sobre la EPID en los pacientes con AR. En la tabla 5 se muestran los estudios cohortes y casos-controles de biológicos anti-TNF y no anti-TNF y en la tabla 6, resumen según niveles de evidencia.
Estudios que evalúan eficacia y supervivencia con FAMEsc
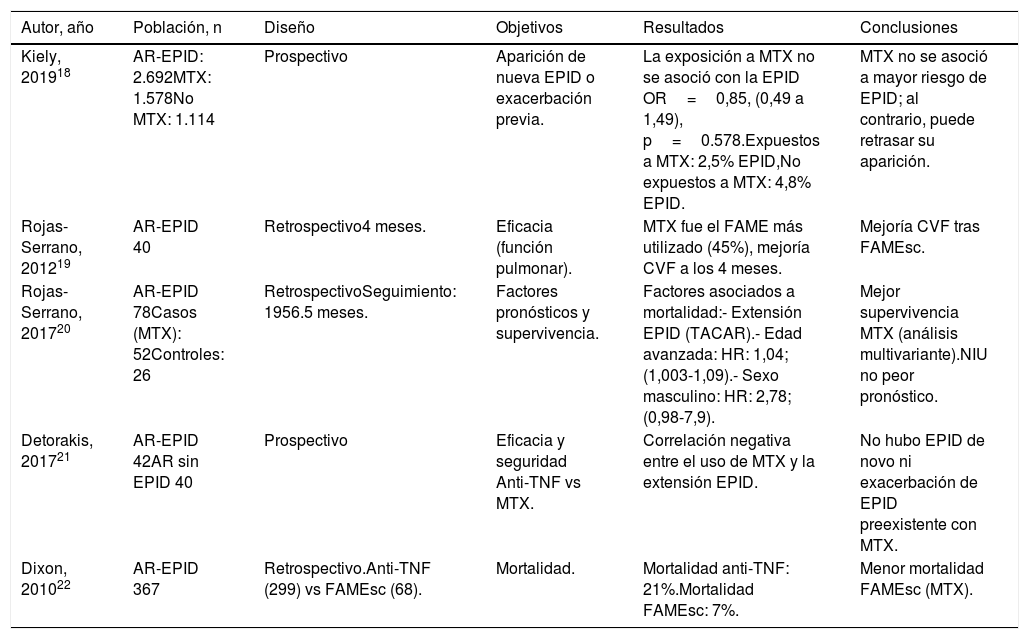
| Autor, año | Población, n | Diseño | Objetivos | Resultados | Conclusiones |
|---|---|---|---|---|---|
| Kiely, 201918 | AR-EPID: 2.692MTX: 1.578No MTX: 1.114 | Prospectivo | Aparición de nueva EPID o exacerbación previa. | La exposición a MTX no se asoció con la EPID OR=0,85, (0,49 a 1,49), p=0.578.Expuestos a MTX: 2,5% EPID,No expuestos a MTX: 4,8% EPID. | MTX no se asoció a mayor riesgo de EPID; al contrario, puede retrasar su aparición. |
| Rojas-Serrano, 201219 | AR-EPID 40 | Retrospectivo4 meses. | Eficacia (función pulmonar). | MTX fue el FAME más utilizado (45%), mejoría CVF a los 4 meses. | Mejoría CVF tras FAMEsc. |
| Rojas-Serrano, 201720 | AR-EPID 78Casos (MTX): 52Controles: 26 | RetrospectivoSeguimiento: 1956.5 meses. | Factores pronósticos y supervivencia. | Factores asociados a mortalidad:- Extensión EPID (TACAR).- Edad avanzada: HR: 1,04; (1,003-1,09).- Sexo masculino: HR: 2,78; (0,98-7,9). | Mejor supervivencia MTX (análisis multivariante).NIU no peor pronóstico. |
| Detorakis, 201721 | AR-EPID 42AR sin EPID 40 | Prospectivo | Eficacia y seguridad Anti-TNF vs MTX. | Correlación negativa entre el uso de MTX y la extensión EPID. | No hubo EPID de novo ni exacerbación de EPID preexistente con MTX. |
| Dixon, 201022 | AR-EPID 367 | Retrospectivo.Anti-TNF (299) vs FAMEsc (68). | Mortalidad. | Mortalidad anti-TNF: 21%.Mortalidad FAMEsc: 7%. | Menor mortalidad FAMEsc (MTX). |
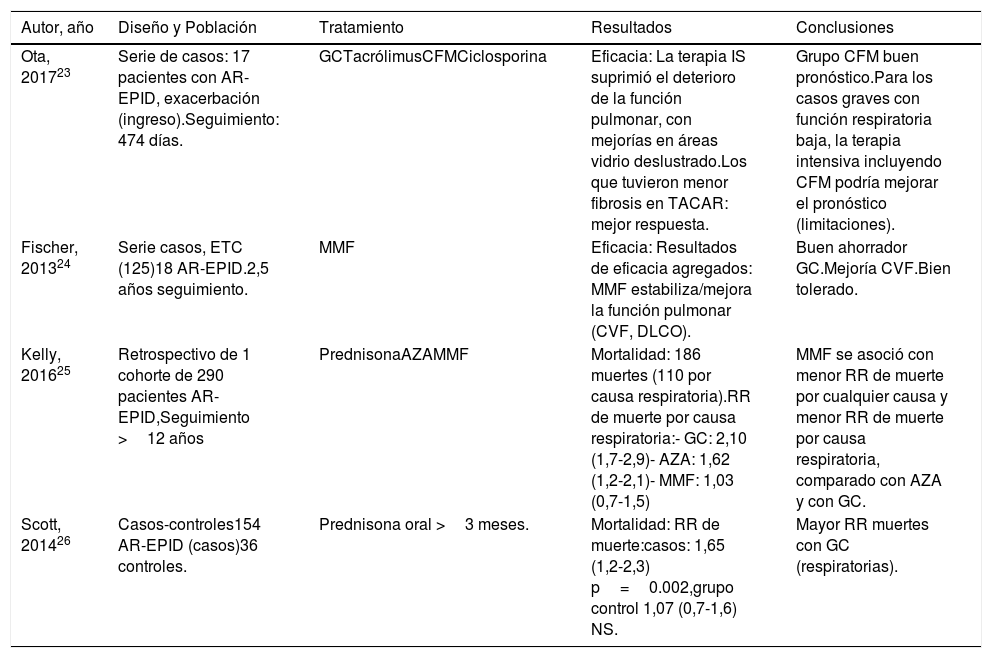
Estudios que evalúan eficacia y mortalidad por Glucocorticoides e Inmunosupresores
| Autor, año | Diseño y Población | Tratamiento | Resultados | Conclusiones |
|---|---|---|---|---|
| Ota, 201723 | Serie de casos: 17 pacientes con AR-EPID, exacerbación (ingreso).Seguimiento: 474 días. | GCTacrólimusCFMCiclosporina | Eficacia: La terapia IS suprimió el deterioro de la función pulmonar, con mejorías en áreas vidrio deslustrado.Los que tuvieron menor fibrosis en TACAR: mejor respuesta. | Grupo CFM buen pronóstico.Para los casos graves con función respiratoria baja, la terapia intensiva incluyendo CFM podría mejorar el pronóstico (limitaciones). |
| Fischer, 201324 | Serie casos, ETC (125)18 AR-EPID.2,5 años seguimiento. | MMF | Eficacia: Resultados de eficacia agregados: MMF estabiliza/mejora la función pulmonar (CVF, DLCO). | Buen ahorrador GC.Mejoría CVF.Bien tolerado. |
| Kelly, 201625 | Retrospectivo de 1 cohorte de 290 pacientes AR-EPID,Seguimiento >12 años | PrednisonaAZAMMF | Mortalidad: 186 muertes (110 por causa respiratoria).RR de muerte por causa respiratoria:- GC: 2,10 (1,7-2,9)- AZA: 1,62 (1,2-2,1)- MMF: 1,03 (0,7-1,5) | MMF se asoció con menor RR de muerte por cualquier causa y menor RR de muerte por causa respiratoria, comparado con AZA y con GC. |
| Scott, 201426 | Casos-controles154 AR-EPID (casos)36 controles. | Prednisona oral >3 meses. | Mortalidad: RR de muerte:casos: 1,65 (1,2-2,3) p=0.002,grupo control 1,07 (0,7-1,6) NS. | Mayor RR muertes con GC (respiratorias). |
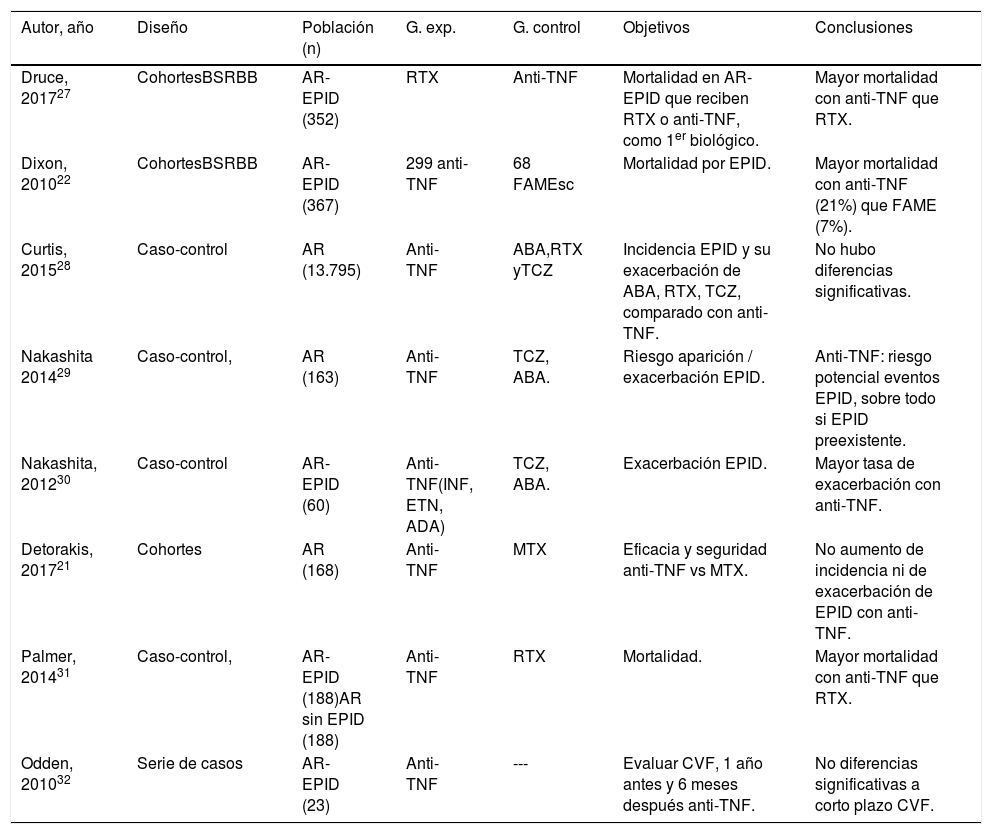
E. cohortes y casos-controles de biológicos anti-TNF y no anti-TNF
| Autor, año | Diseño | Población (n) | G. exp. | G. control | Objetivos | Conclusiones |
|---|---|---|---|---|---|---|
| Druce, 201727 | CohortesBSRBB | AR-EPID (352) | RTX | Anti-TNF | Mortalidad en AR-EPID que reciben RTX o anti-TNF, como 1er biológico. | Mayor mortalidad con anti-TNF que RTX. |
| Dixon, 201022 | CohortesBSRBB | AR-EPID (367) | 299 anti-TNF | 68 FAMEsc | Mortalidad por EPID. | Mayor mortalidad con anti-TNF (21%) que FAME (7%). |
| Curtis, 201528 | Caso-control | AR (13.795) | Anti-TNF | ABA,RTX yTCZ | Incidencia EPID y su exacerbación de ABA, RTX, TCZ, comparado con anti-TNF. | No hubo diferencias significativas. |
| Nakashita 201429 | Caso-control, | AR (163) | Anti-TNF | TCZ, ABA. | Riesgo aparición / exacerbación EPID. | Anti-TNF: riesgo potencial eventos EPID, sobre todo si EPID preexistente. |
| Nakashita, 201230 | Caso-control | AR-EPID (60) | Anti-TNF(INF, ETN, ADA) | TCZ, ABA. | Exacerbación EPID. | Mayor tasa de exacerbación con anti-TNF. |
| Detorakis, 201721 | Cohortes | AR (168) | Anti-TNF | MTX | Eficacia y seguridad anti-TNF vs MTX. | No aumento de incidencia ni de exacerbación de EPID con anti-TNF. |
| Palmer, 201431 | Caso-control, | AR-EPID (188)AR sin EPID (188) | Anti-TNF | RTX | Mortalidad. | Mayor mortalidad con anti-TNF que RTX. |
| Odden, 201032 | Serie de casos | AR-EPID (23) | Anti-TNF | --- | Evaluar CVF, 1 año antes y 6 meses después anti-TNF. | No diferencias significativas a corto plazo CVF. |
Tabla evaluación de la calidad de los resultados
| Resumen de la evidencia | NE |
|---|---|
| La EPID inducida por fármacos en pacientes con AR es infrecuente (1%) (Roubille 2014)16 | 1+ |
| Los pacientes con AR y EPID no tienen mayor riesgo de complicaciones respiratorias no infecciosas ni de mortalidad por causa respiratoria, cuando reciben MTX que cuando reciben otros FAMEsc o biológicos (Conway, 2014)11 | 1++ |
| El tratamiento con MTX de los pacientes con AR no presentan mayor incidencia de EPID e incluso puede retrasar su aparición (Kiely 2019)18 | 2+ |
| Los pacientes con EPID asociada a AR que reciben MTX tienen mejor supervivencia (Rojas-Serrano 201720 | 2+ |
| Los pacientes con AR tratados con LEF no tienen mayor riesgo de EPID ni de complicaciones pulmonares (Conway 2016)12 | 1++ |
| Los pacientes con EPID asociada a AR tratados con GC tienen mayor mortalidad por todas las causas y por causas respiratorias (Scott 2014)26 | 2++ |
| La terapia inmunosupresora puede ser efectiva para las exacerbaciones de EPID asociada a AR (Ota 2017)23 | 3 |
| La EPID asociada a AR tiene mayor mortalidad con anti-TNF que con FAMEsc (MTX o LEF) (Roubille 2014)16 | 1+ |
| Los anti-TNF podrían estar asociados con un mayor riesgo de complicaciones y de mortalidad relacionadas con EPID en los pacientes con AR, especialmente si tienen edad avanzada y EPID preexistente (Huang 2019, Koo, 2015)13,33 | 1+ |
| Los pacientes con AR que tienen EPID asociada tienen mayor mortalidad que los pacientes sin EPID (Palmer 2014)31 | 2+ |
| Los pacientes con AR que tienen EPID asociada tienen mayor tendencia a ser tratados con biológicos que los pacientes sin EPID (Palmer 2014)31 | 2+ |
| Los pacientes con EPID asociada a AR tienen mayor supervivencia cuando son tratados en primera línea con RTX que con anti-TNF (Druce, 2017)27 | 2+ |
| RTX consiguió estabilizar los parámetros funcionales y radiológicos de más de la mitad de los pacientes con AR que tenía EPID progresiva (Matteson, 2012)9 | 1+ |
| La mayoría de los pacientes con AR y EPID estable permanecieron estables con RTX (Kabia 2015)34 | 3 |
| Abatacept no aumenta la incidencia de EPID y estabiliza/mejora los parámetros de EPID pre-existente en los pacientes con AR (Nelson 2015)14 | 1+ |
| El riesgo de empeoramiento de EPID preexistente en pacientes con AR es menor con ABA que con anti-TNF (Nakashita 2016)35 | 3 |
La prevalencia de EPID en AR es variable. Un estudio prospectivo multicéntrico reciente18 encontró que el 3,7% de los pacientes con AR de inicio reciente tenía EPID, asociada a edad avanzada, tabaquismo, sexo masculino, actividad, seropositividad y retraso en la instauración de FAME. Con posterioridad a nuestra revisión, se ha publicado un estudio retrospectivo36 en el que encuentran que el desarrollo de EPID correlaciona con estos mismos factores, con una duración corta de la AR y con niveles aumentados de lactato deshidrogenasa (LDH), pero no con el uso de FAMEsc en AR. La EPID inducida por el tratamiento de la AR es más infrecuente (<1%)16. El desenlace de una EPID previa puede ser diferente según el fármaco utilizado.
FAME sintéticos convencionales e inmunosupresores.Los estudios en pacientes con AR y EPID tratados con FAMEsc son escasos y contradictorios, lo que ha llevado a una restricción de su uso en esta complicación.
Metotrexato (MTX). Considerado como prototipo de toxicidad pulmonar inducida por fármacos, MTX ha sido evitado hasta hace unos años en el tratamiento de los pacientes con AR que tenían EPID. En la actualidad, disponemos de la evidencia aportada por dos RS11,16 y dos estudios de cohortes18,20, que abordan la relación de MTX con la aparición, evolución y mortalidad por EPID. No se ha encontrado asociación entre la exposición a MTX y la aparición de EPID (OR: 0,85; (0,49-1,49); p=0,58) en un estudio prospectivo realizado por Kiely et al18 en 2.692 pacientes con AR de reciente comienzo (1.578 expuestos a MTX y 1.114 no expuestos). En los pacientes expuestos a MTX, el tiempo de aparición de EPID fue mayor que en los no expuestos (OR: 0,41; (0,23-0,75); p=0,004). Conway et al11 encontraron en un MA de 22 estudios con 8.584 pacientes con AR, que MTX produjo un pequeño aumento del riesgo de complicaciones respiratorias totales (RR: 1,10 (1,02-1,19), debido al aumento del riesgo de infecciones (RR: 1,11 (1,02-1,21). Sin embargo, no encontraron aumento del riesgo de complicaciones respiratorias no infecciosas (RR: 1,02 (0,6 –1,60), ni de muerte por enfermedad pulmonar (RR: 1,53 (0,46-5,01). MTX produjo un incremento del riesgo de neumonitis aguda (RR: 7.81 (1,76-34,72), pero no de neumopatía intersticial (NI) crónica.
El riesgo de ingreso hospitalario por EPID en pacientes con AR tratados con biológicos disminuyó con la exposición a MTX (HR: 0,06 (80,06-0,469); p<0,001), independientemente de la terapia biológica concomitante (anti-TNF vs no anti-TNF), en un estudio retrospectivo realizado a partir de los datos de mutuas de seguros médicos estadounidenses28. Tampoco se encontró asociación de MTX con la aparición ni el agravamiento de EPID en AR, en un estudio griego que comparaba el desenlace del tratamiento de AR durante 1 año, con anti-TNF y FAMEsc en pacientes con EPID (42 y 44) y sin EPID (40 y 44, respectivamente)21. Por el contrario, el análisis multivariante demostró una correlación negativa del uso de MTX con la extensión de EPID y el grado de atrapamiento aéreo.
La supervivencia de los pacientes con AR-EPID, ajustada por variables de confusión, fue mayor con MTX (mediana de 70 meses) que sin MTX (log Rank p<0,0005), en un estudio retrospectivo realizado por Rojas-Serrano et al20. Los 56 casos (25 con LEF asociada) y los 26 controles (4 AZA, 9 LEF, 4 SSZ y 9 sin FAME) habían recibido la misma pauta de GC.
En un MA, Roubille et al16 encontraron una mortalidad inferior de los pacientes con EPID en AR con MTX (13%) que con anti-TNF (35,5%).
Leflunomida (LEF). Después de su comercialización, comenzaron a publicarse casos de EPID en pacientes con AR tratados con LEF, especialmente en Japón. En 2016, Suissa et al37 publicaron un estudio extenso de casos y controles anidado a una cohorte de AR, en el que admiten que el incremento de 2 veces de EPID asociado a LEF puede revelar un sesgo de canalización de tratamientos de pacientes con EPID previa hacia LEF. Conway et al12 también publicaron una RS y MA de 8 ECA (sólo 1 en población asiática) de LEF en AR. Incluyeron 4.579 pacientes, de los que 2.274 recibieron LEF y 2.305 un comparador (por lo general, MTX) y encontraron 6 casos de neumonitis y 4 muertes por causa pulmonar, todas en el grupo comparador. LEF no se asoció a un aumento en el riesgo de efectos adversos respiratorios totales (RR: 0,99 (0,56-1,78), infecciosos (RR: 1,02 (0,58-1,82) o no infecciosos (RR: 0,64 (0,41-0,97), ni a un riesgo aumentado de muerte por enfermedad pulmonar (RR: 1,53 (0,46-5,01). La RS de casos de EPID asociada a AR16, mencionada antes, incluyó 12 estudios con 34 casos de EPID en AR tratados con LEF. En ella, Roubille et al. estimaron un desenlace fatal en el 18% de los pacientes con LEF, frente al 13% aquellos con MTX.
En el estudio de Rojas-Serrano et al20, que mostró mayor supervivencia en AR-EPID de los pacientes tratados con MTX, se observó que la asociación de LEF (25/58) no empeoró la supervivencia.
Glucocorticoides (GC) e Inmunosupresores (IS). Existe muy escasa evidencia del efecto de los IS sobre la EPID asociada a AR. En ocasiones, se utilizan en el tratamiento de las exacerbaciones de la EPID con buena respuesta según algunos trabajos23, cuyos autores concluyen que la terapia intensiva con GC y ciclofosfamida (CFM) puede mejorar el pronóstico en los casos graves, con una baja función respiratoria.
El efecto de los GC orales sobre la mortalidad en AR-EPID fue evaluado en un estudio de casos y controles26, que encontró que los pacientes que recibieron prednisona oral durante más de 3 meses tuvieron un mayor riesgo relativo de muerte que los que no la recibieron (RR: 2,06 (1,1-3,8); p=0.02), sobre todo por causas respiratorias (RR: 2,75 (1,6-4,7); p=0.0002). El predominio del patrón NIU en el grupo tratado con GC puede justificar parte del exceso de mortalidad.
Micofenolato de mofetilo (MMF) ha sustituido durante los últimos años a CFM y azatioprina (AZA) en el tratamiento de EPID asociada a enfermedades autoinmunes sistémicas (EAS). Fisher et al24 analizaron retrospectivamente los efectos de MMF sobre la evolución de EPID en 125 pacientes con EAS, de los que 18 tenían AR. En general, MMF fue bien tolerado y permitió disminuir la dosis de GC. En EPID asociada a AR, la tendencia previa al deterioro progresivo cambió a una mejoría de la CVF tras el inicio de MMF, aunque no alcanzó significación estadística. MMF también se asoció a un RR de muerte por cualquier causa, y también por causa respiratoria, menor que AZA y prednisona, en un estudio británico retrospectivo25 de 290 pacientes AR-EPID seguidos durante más de 12 años. Estos resultados coinciden con los resultados del estudio PANTHER38 en fibrosis pulmonar idiopática (FPI), donde se mostró un aumento de la mortalidad asociada al uso de prednisona y AZA, en comparación con placebo.
Respecto a Tacrólimus, sin indicación en nuestro medio para el tratamiento de los pacientes con AR, sólo hemos encontrado la descripción anecdótica de 10 casos de AR39 que desarrollaron lesiones pulmonares durante el tratamiento (con desenlace fatal en 2 de ellos), por lo que no podemos extraer conclusiones.
FAME biológico anti-TNFHemos encontrado 3 RS13,16,17 que se ocupan del efecto de los anti-TNF sobre los pacientes con EPID asociada a AR, pero la metodología empleada invita a ser muy cautos en la interpretación de los resultados.
La RS de Roubille et al16 se realizó a partir de casos clínicos publicados. Encontraron que los anti-TNF se asocian a una baja incidencia de EPID (1%), pero a una elevada mortalidad (35,5%).
En una RS más reciente de estudios de cohortes, caso-control y series de casos, Huang et al13 analizan la aparición o agravamiento de EPID (evento EPID) en pacientes con AR tratados con anti-TNF en comparación con biológicos no anti-TNF. Los anti-TNF estuvieron implicados en 85% de los eventos EPID detectados. Los eventos y la mortalidad se asociaron a mayor edad y al uso concomitante de AZA. Encontraron que los pacientes con EPID asociada a AR tratados con anti-TNF podrían tener más riesgo de eventos adversos y mortalidad por EPID que los tratados con ABA o RTX, especialmente a una edad avanzada y con EPID previa.
Una RS realizada en España sobre pacientes con EAS que desarrollaron EPID secundaria al uso de biológicos incluyó casos clínicos, estudios retrospectivos y post-comercialización17. Sólo 52 casos de EPID contaban con información suficiente, de los que 38 tenían AR. De estos, murieron 13 pacientes, que tenían una edad más elevada, EPID previa y tratamiento inmunosupresor con mayor frecuencia que los 25 supervivientes. Los autores concluyen que no debe utilizarse anti-TNF en pacientes con EPID previa.
Existen varios estudios de cohortes y casos-controles que implican a los anti-TNF comparándolos con FAMEsc21,22 o con FAMEb no anti-TNF27–31. A partir de los datos del registro británico de terapias biológicas, Dixon et al22 realizan un estudio observacional para evaluar la influencia de la terapia anti-TNF en la mortalidad global, y específicamente en la debida a EPID, en pacientes con AR y EPID previa. Se encontró una prevalencia de EPID del 2,6% de los pacientes con AR, siendo mayor en los tratados con anti-TNF (299/9.294) que con FAMEsc (68/2.454) (2,9% vs 1,8%; p=0,02). Esta prevalencia apoya la sospecha de que sólo se identifican en la clínica una parte de los pacientes con esta complicación. No se encontraron diferencias significativas entre ambos grupos para la tasa estandarizada de mortalidad ni para la mortalidad por EPID, aunque esta fue numéricamente superior con anti-TNF (15/70) que con FAMEsc (1/14) (21% vs 7%; NS). La EPID previa fue un fuerte predictor de mortalidad por todas las causas en ambas cohortes. Los autores concluyen que, a pesar de los resultados, no se debe asumir que cualquier paciente con EPID asociada a AR pueda ser tratado con anti-TNF. En otro estudio, realizado a partir del registro español de terapias biológicas (BIOBADASER)40, tampoco encontraron diferencias significativas en la incidencia de EPID ni la mortalidad por esta complicación en los pacientes tratados con anti-TNF en comparación con los tratados con FAMEsc en otra cohorte (EMECAR).
Un estudio de cohortes griego21 comparó la eficacia y seguridad de anti-TNF con la de FAMEsc (MTX) en 170 pacientes AR con y sin EPI. Los anti-TNF no se asociaron al desarrollo o la progresión de EPID, sino que por el contrario tuvieron un efecto beneficioso (engrosamiento de la pared y pruebas funcionales respiratorias) en los pacientes con EPID previa.
Dos estudios investigaron la mortalidad de los pacientes con EPID tratados con anti-TNF27,31. Un estudio multicéntrico31 encontró que la mortalidad por causa respiratoria fue superior en pacientes con EPID que sin EPID (10% vs 6%; NS) y mayor con anti-TNF que con RTX (15% vs 8%; NS). Aunque no se alcanzó significación estadística, los resultados del estudio sugieren una tendencia de los pacientes con EPID a tener mayor mortalidad y a recibir biológicos que los pacientes sin EPID, y a tener una supervivencia más prolongada si reciben RTX que anti-TNF.
Druce et al. compararon las tasas y causas de mortalidad a 5 años en pacientes con AR y EPID tratados en primera línea con RTX (43) o anti-TNF (309)27. La tasa de mortalidad para todas las causas fue 94,8 con anti-TNF y 53,0 con RTX por 1.000 pacientes/año. RTX comparado con anti-TNF tuvo un HR ajustado por variables de confusión a los 5 años de 0,49 (0,23-1,06). A pesar de no alcanzar significación estadística, este estudio también sugiere que los pacientes con EPID asociada a AR que recibieron RTX en primera línea tuvieron una mayor supervivencia que los que recibieron anti-TNF.
En otro estudio, realizado por Curtis et al28 a partir de los datos de mutuas de seguros médicos estadounidenses, se investigó la incidencia y exacerbación de EPID en una cohorte de pacientes con AR tratados en segunda o posterior línea con FAMEb no anti-TNF en comparación con anti-TNF. No se encontraron diferencias en el riesgo de desarrollar EPID ni de hospitalización por EPID previa entre las cohortes, pero los pacientes con EPID previa (419 pacientes con 499 episodios) tuvieron más probabilidad de recibir RTX (19,8% vs 8,5%) y menos de recibir anti-TNF (46,5% vs 59,8%) que los controles (10.800 pacientes sin EPID). El riesgo de hospitalización disminuyó con la exposición a MTX (HR: 0,06; 95% IC:0,06-0,46; p<0,001) y aumentó en el sexo masculino y hospitalizaciones previas por asma o EPID (p<0,05). Por lo tanto, parece que existen diferencias iniciales entre los pacientes que reciben anti-TNF o FAMEb con otro mecanismo de acción, pero no en la incidencia de EPID o la aparición de complicaciones.
Nakashita et al., realizaron dos estudios retrospectivos en pacientes con AR y EPID tratados con biológicos29,30. En ambos gradúan la extensión de la afectación pulmonar en 3 estadios mediante TACAR. En el primero30 participaron 58 pacientes, 46 casos (con anti-TNF) y 12 controles (9 TCZ y 3 ABA). Después de un año de seguimiento, la tasa de exacerbación de EPID previa fue elevada para anti-TNF (30,04%) y nula para FAMEb no anti-TNF (0%) (p=0,024).
Posteriormente, evaluaron el riesgo de aparición/exacerbación de EPID en 163 pacientes con AR que iniciaron un biológico (102 anti-TNF y 51 no anti-TNF), 58 con EPID previa (30 grado I, 22 grado II y 6 grado III) y 105 sin EPID29. Tras un año de seguimiento, se produjo evento EPID en 17 pacientes (10%), con mayor frecuencia en pacientes tratados con anti-TNF.
En un estudio retrospectivo de 23 pacientes con AR y EPID tratados con anti-TNF32 no se encontraron diferencias estadísticamente significativas en los datos de CVF a los 6 meses de tratamiento con respecto a los basales, lo que sugiere que los anti-TNF no empeoran a corto plazo la función pulmonar de los pacientes con EPID asociada a AR.
FAME biológicos no anti-TNF.Tocilizumab (TZC). TZC es un bloqueador de los receptores de la interleucina-6 (IL-6) útil en el tratamiento de los síntomas articulares y algunas manifestaciones sistémicas de la AR. Mientras que la producción excesiva de IL-6 se ha visto asociada con fibrosis en la EPID29, se han publicado diversos casos clínicos de aparición de novo o exacerbación de EPID tras inicio de tratamiento con TCZ.
Una RS realizada en 2010 para identificar complicaciones pulmonares no infecciosas con nuevos agentes biológicos utilizados en enfermedades reumatológicas incluyó 3 ECA de TCZ con 589 pacientes diagnosticados de AR15. Seis (1%) pacientes desarrollaron eventos adversos pulmonares no infecciosos, incluyendo 3 exacerbaciones de EPID previa (con un desenlace fatal), 1 EPID de inicio reciente y 1 fibrosis pulmonar idiopática.
Curtis et al28 no encontraron diferencias estadísticamente significativas en la incidencia de EPID ni en los ingresos hospitalarios de los pacientes con EPID previa de los 59 pacientes tratados con TCZ comparados con los 232 que recibieron anti-TNF, si bien el número de biológicos previos a TCZ fue mayor (2,1±1,1 vs 1,4 ±0,7; p<0,0001). Nakashita y colaboradores tampoco encontraron incremento del desarrollo o agravamiento de EPID en 36 pacientes tratados con TCZ29, pero sí con anti-TNF.
En un estudio de vigilancia post-marketing41 que analiza datos de seguridad acumulados de 7.901 pacientes japoneses tratados con TCZ, la incidencia de EPID en el grupo tratado fue de 10 casos/1.000 pacientes-año, siendo claramente superior a la estimada en la enfermedad (4 y 4.5/1.000 pacientes-año).
Recientemente, se publicó una serie de 12 pacientes con EPID (11 NIU) asociada a AR tratados con TCZ en un hospital japonés42, en la que observaron diferencias significativas en biomarcadores de actividad articular (MMP-3) pero no de actividad pulmonar (KL-6 y LDH) a los 6 meses de la administración de TCZ con respecto a los valores basales.
La evidencia es escasa y los resultados de los estudios no son uniformes, por lo que debemos ser cautelosos a la hora de extraer conclusiones. Se necesitan estudios controlados para evaluar la eficacia de TCZ en los pacientes con AR y EPID.
Rituximab (RTX). La observación de hiperplasia folicular de células B e infiltrados intersticiales de células plasmáticas en muestras de biopsia pulmonar de pacientes con AR y EPID ofrece una justificación histológica para la terapia anti-CD2043. Sin embargo, se precisa mayor evidencia de eficacia y seguridad en la práctica clínica, para recomendar el tratamiento con RTX en estos pacientes. La RS realizada por Hadjinicolaou et al15 incluyó un ECA de RTX en AR en el que desarrollo EPID 1 de los 136 pacientes del brazo activo (0,32%) y ninguno de los 149 controles.
Posteriormente, se realizó un estudio piloto prospectivo abierto con RTX9 en 10 pacientes con AR y EPID (CVF >50% y DLCO >30%) activa y progresiva, que no habían recibido FAMEb ni IS en las 8 semanas anteriores. Se administró 1g de RTX en las semanas 0, 2, 24 y 26. Hubo 3 pérdidas (1 reacción infusional y 2 muertes, por neumonía y fractura de cadera). De los 7 pacientes evaluables (CVF, DLCO o TACAR) en la semana 48, 5 permanecían estables, 1 había empeorado y 1 mejorado. Aunque no se observó una mejoría significativa, RTX consiguió la estabilización de EPID activa y progresiva en los pacientes tratados.
Como se ha comentado previamente, dos estudios sobre mortalidad23,27 encontraron mejores desenlaces con RTX que con anti-TNF, aunque no se alcanzó significación estadística. Uno encontró menor tasa de mortalidad en los 43 pacientes que recibieron RTX (HR 0,49; 95%IC: 0,23-1,06) que en los 309 que recibieron anti-TNF como primer biológico27. Previamente, en un estudio multicéntrico retrospectivo31 se había observado mayor mortalidad global y por causa respiratoria en los pacientes que tenían EPID (22% y 10%) que en los que no la tenían (14% y 6%); y entre los pacientes con EPID, en aquellos que recibieron anti-TNF (31% y 15%) que en los que recibieron RTX (8% y 4%).
Curtis et al28 no encontraron diferencias, en un estudio retrospectivo, en el riesgo de desarrollar EPID ni complicaciones de ésta durante el tratamiento con RTX, comparado con los anti-TNF. Pero los pacientes habían recibido RTX con mayor probabilidad si tenían EPID previa que si no la tenían (19,8% vs 8,5%; p<0,0001), al contrario de lo que ocurrió con los anti-TNF (46,5% vs 59,8%; p<0,0001).
Yusof et al. realizaron un estudio retrospectivo44 en una cohorte de 700 pacientes con AR tratados con RTX, 56 (8%) con EPID previa. En 10 años de seguimiento solo 1/700 pacientes desarrolló EPID (0,4%). De los que tenían EPID previa murieron 9 (16%) por progresión de ésta. En 44 de los pacientes se pudo evaluar la evolución de la función pulmonar (CVF y DLCO): 14 (31,8%) empeoraron, 23 (52%) permanecieron estables y 7 (16%) mejoraron con RTX. En otro estudio multicéntrico retrospectivo, Duarte y colaboradores45 evaluaron la efectividad y seguridad de RTX en pacientes con EAS (30 AR). Globalmente, encontraron una estabilización de la función pulmonar (CVF y DLCO) a los 12 meses del tratamiento en ambos patrones y del TACAR en los pacientes con NINE. Las infecciones fueron frecuentes y produjeron 4 suspensiones del tratamiento y 2 fallecimientos. De acuerdo con los autores de estos estudios, RTX parece una opción terapéutica aceptable, incluso en monoterapia, para los pacientes con AR y EPID. En un reciente estudio italiano46 encontraron una diferencia estadísticamente significativa en los valores de CVF y DLCO post-tratamiento entre casos (14 RTX) y controles (14 sin RTX), a pesar del pequeño tamaño muestral. Estos resultados coinciden con el estudio piloto, prospectivo, abierto realizado en 10 pacientes9, ya mencionado, y con numerosas series presentadas en congresos. En términos generales, el fármaco consigue la estabilización o mejoría de los parámetros de función respiratoria en un 70% de los casos, sin diferencias en la respuesta en función del patrón histopatológico, siendo un tratamiento relativamente seguro (aunque se suele asociar a un aumento de infecciones respiratorias o urinarias, en su mayoría no graves).
Abatacept (ABA). ABA, una proteína de fusión que inhibe la co-estimulación de los linfocitos T, ha sido posicionada favorablemente por la GUIPCAR2 en el tratamiento de los pacientes con AR que desarrollan EPID.
En dos RS14,16 se confirmó una baja incidencia de EPID inducida o exacerbada por biológicos en pacientes con AR. En la RS de casos clínicos de EPID por FAME de Roubille et al16 tan sólo encontraron un caso relacionado con ABA. En la extensa RS de Nelson et al14, por su parte, observaron una menor tasa de Incidencia (TI) en un MA de 8 ECA de ABA en AR (0,09 (0,01-0,31) a corto plazo y 0,11 (0,06-0,20) durante el periodo combinado de extensión) que en los estudios de seguros médicos (1,1 (0,1-4,1) en MarketScan y 4,0 (1,6-8,2) MediCare). Además, en esta RS, los estudios observacionales y los informes de casos mostraron que no hubo aumento de la incidencia de EPID y que los parámetros evaluados mejoraron en todos los casos, excepto uno, de EPID previa. Por lo tanto, a pesar de la limitación de los datos, parece que ABA no aumenta la incidencia de EPID y puede ser útil en el tratamiento de los pacientes con AR y EPID asociada.
Otros estudios, con menor nivel de evidencia, han encontrado resultados similares. Nakashita et al. comunicaron, a partir de un estudio caso-control con 25 controles de ABA29 y una serie de 16 casos de ABA35, que este fármaco tiene menos riesgo de producir nuevos casos de EPID o empeoramiento de EPID previa que los anti-TNF en pacientes japoneses con AR. Una extensa serie de casos de pacientes con AR y EPID recopilados en numerosos centros en España, ha dado lugar a diferentes comunicaciones. Al comparar retrospectivamente47 63 pacientes tratados con ABA, 30 con RTX y 25 con TCZ, encontraron mejoría a los 12 meses en el TACAR en 36,4% de pacientes con ABA, 28.6% con RTX y 8,3% con TCZ. En 2019 comunicaron los resultados de la serie más grande de AR y EPID tratada con ABA48. Analizaron la evolución clínica, funcional respiratoria (CVF y DLCO) y radiológica (TACAR) de 181 pacientes tratados con ABA (81 en monoterapia) durante una mediana de seguimiento de 12,1 (6,2 -24,1) meses y observaron una estabilización en la mayoría de los parámetros analizados en un porcentaje sustancial de pacientes. Kurata et al. encontraron en otra serie de 49 casos49 de AR tratados con diferentes fármacos, que el uso de ABA puede comportarse como un factor protector.
Por el contrario, un extenso estudio retrospectivo estadounidense (11.219 sujetos) para evaluar la incidencia de EPID y las complicaciones de EPID previa en pacientes con AR que recibían su segundo o posterior biológico28, en el que 109 de los 419 pacientes con EPID previa recibieron ABA, no encontraron diferencias en la incidencia de EPID ni en las complicaciones de EPID previa entre los diferentes biológicos.
FAME sintéticos dirigidos (FAMEsd).La seguridad de estos fármacos a nivel pulmonar no ha sido evaluada en ningún ECA y la información disponible es escasa. En un estudio de fármaco vigilancia post-comercialización50 realizado en 2.882 pacientes japoneses en tratamiento con tofacitinib se identificaron 14 casos de EPID (0.5%), de los que 3 fallecieron. En una descripción de 4 casos de AR con EPID tratados con tofacitinib51 los autores aseguran que los pacientes mejoraron y no tuvieron exacerbación pulmonar durante el seguimiento (8-12 meses), pero no aportan datos de evaluación pulmonar.
Antifibróticos.La información disponible sobre el efecto de los antifibróticos en pacientes con EPID asociada a AR es muy escasa. Recientemente se ha publicado el ECA INBULID10, donde se compara nintedanib frente a placebo en enfermedades del tejido conectivo (ETC) fibrosantes (663 pacientes, de los cuales 89 son AR-EPID). En pacientes con un patrón fibrótico similar al de la FPI, la tasa ajustada de disminución en la CVF fue de -82.9ml por año con nintedanib y de -211.1ml por año con placebo, con una diferencia de 128.2ml (IC 95%: 70.8 - 185.6; p <0,001). Existe un ensayo clínico fase II con pirfenidona en pacientes con AR y EPID (NCT02808871), del que todavía no disponemos de resultados, motivo por el que se ha excluido de la revisión. De acuerdo con las consideraciones de Fisher y Distler52, pirfenidona y nintedanib podrían frenar la progresión de la EPID en pacientes con AR, y con EAS, como ya han demostrado en los pacientes con FPI
Esta revisión tiene limitaciones, en este tipo de trabajo no se pueden descartar los sesgos por publicación e incluso, los derivados de una potencial confusión por indicación. Muchos de los estudios incluidos no tenían grupo comparador, lo que dificulta la asignación de una relación causal. Finalmente, muchos pacientes han recibido diferentes FAME, por lo que no se puede definir la aportación precisa de cada tratamiento a la evolución de la EPID. A pesar de estas limitaciones, nuestra revisión aporta evidencias de utilidad para la práctica clínica habitual de los reumatólogos. Por un lado, MTX no empeora la evolución de la EPID y no sería necesario retirarlo del tratamiento de estos pacientes. Por otro lado, RTX y ABA han mostrado resultados prometedores en EPID asociada a AR, por lo que deberían considerarse como una opción prioritaria frente a los anti-TNF cuando estos pacientes necesiten iniciar o cambiar un biológico por la actividad de la AR o la progresión de la EPID. Sin embargo, no hay suficiente evidencia para recomendar la suspensión de un anti-TNF si la AR está en remisión y la EPID no progresa.
ConclusionesLos pacientes con AR que desarrollan EPID presentan mayor mortalidad. Su manejo terapéutico supone un desafío para el clínico. En la actualidad no se utilizan IS para tratar la AR, pero han demostrado beneficio en las exacerbaciones de la EPID, especialmente CFM.
No parece necesario retirar MTX en pacientes con EPID-AR, ya que existe evidencia de que no aumenta la incidencia ni las exacerbaciones de EPID y mejora la supervivencia. Cuando estos pacientes necesitan una terapia biológica, es preferible utilizar ABA o RTX antes que anti-TNF (con más riesgo potencial) o FAMEsd (por falta de evidencia). Los antifibróticos pueden ser un tratamiento esperanzador para las formas más progresivas de EPID, aunque son necesarios más estudios controlados en AR. Las líneas futuras de investigación podrían centrarse en la combinación de terapias antifibróticas e inmunosupresoras en AR-EPID.
FinanciaciónNo hemos recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Responsabilidades éticasNone