El tratamiento de la artritis reumatoide ha cambiado drásticamente en los últimos años, sobre todo con el uso de los fármacos modificadores de la enfermedad (FAME). Los datos sobre el manejo de esta enfermedad en ensayo clínico son abundantes, pero no en la vida real. El objetivo de nuestro estudio es describir el manejo de una cohorte de artritis reumatoide de inicio en práctica clínica diaria, especialmente las suspensiones de los FAME y sus causas.
MétodosEstudio observacional retrospectivo de pacientes con artritis reumatoide diagnosticados entre 01/07 y 12/14 seguidos hasta 01/17, que usaron>1 FAME≥3 meses. Variables: sociodemográficas, clínicas, tratamiento, suspensión del FAME y causa. Análisis descriptivo de las características sociodemográficas, clínicas y de tratamiento. Incidencia de suspensión (IS) por técnicas de supervivencia, expresándose en 100 pacientes/año con intervalo de confianza del 95%.
ResultadosSe incluyen 814 pacientes con 2.388 cursos de tratamiento, el 77% mujeres, edad media 57,5 años. Primer curso: monoterapia (92,75%), especialmente metotrexate (56,06%). En posteriores cursos aumentan terapia combinada y uso de biológico (principalmente etanercept). Se registraron 1.094 suspensiones (29,5 [27,8-31,3]). La IS fue mayor para evento adverso (15,9 [14,7-17,3]), biológicos (49,6 [43,1-57,2]) y terapia combinada. El FAME con menor IS fue metotrexate (25,8 [23,8-28,1]).
ConclusiónEl metotrexate fue el fármaco más utilizado, el biológico aumentó a lo largo del seguimiento, siendo el más frecuente etanercept. La IS de los FAME fue 29/100 pacientes año, principalmente por evento adverso. Parece mayor en las terapias que incluyen biológicos y en las combinadas. El metotrexate es el fármaco con menor IS.
The treatment of rheumatoid arthritis has changed dramatically in recent years, especially with the use of disease modifying drugs (DMARDs). Data on the management of this disease in clinical trials are abundant, but not so in real life. The aim of our study is to describe the management of an early rheumatoid arthritis cohort in daily clinical practice, especially DMARD discontinuations and reasons.
MethodsA retrospective observational study of patients with rheumatoid arthritis diagnosed between 01/07 and 12/14 followed up to 01/17, using>1 DMARD≥3 months. Variables: sociodemographic, clinical, treatment, DMARD discontinuation and reason. Descriptive analysis of sociodemographic, clinical and treatment characteristics. Discontinuation incidence rate (DIR) due to survival techniques, expressed in 100 patients/year with 95% confidence interval.
Results814 patients were included with 2,388 courses of treatment, 77% women, mean age 57.5 years. First course: monotherapy (92.75%), especially methotrexate (56.06%). In later courses there was increased combined therapy and use of biologicals (mainly etanercept). There were 1,094 discontinuations (29.5 [27.8-31.3]). The DIR was higher for adverse events (15.9 [14.7-17.3]), biologicals (49.6 [43.1-57.2]) and combined therapy. The DMAR with the lowest DIR was methotrexate (25.8 [23.8-28.1]).
ConclusionMethotrexate was the most used drug, biologicals increased throughout the follow-up, the most frequent being Etanercept. The DMARD DIR was 29/100 patients per year, mainly due to adverse events. It seems to be higher in the therapies that include biologicals and combined therapies. Methotrexate is the drug with the lowest DIR.
La artritis reumatoide (AR) es una enfermedad autoinmune crónica que afecta, básicamente, a las articulaciones periféricas simétricamente, produciendo inflamación, destrucción progresiva y erosiones óseas1; además se asocia con complicaciones sistémicas2. También condiciona un deterioro de la capacidad funcional, discapacidad laboral, disminución de la calidad de vida y aumento de la mortalidad3. Su prevalencia oscila entre el 0,5-1% de la población3,4.
La aparición de daño articular es especialmente rápida al inicio de la enfermedad, surgiendo el concepto de «ventana de oportunidad», que hace referencia a los primeros meses desde su inicio, cuando se considera que el paciente es más susceptible de responder al tratamiento que en fases más avanzadas5,6. Por este motivo, es fundamental un diagnóstico y tratamiento precoces, aumentando así la probabilidad de controlar la inflamación y reducir el daño. Esto ha hecho que el manejo y el pronóstico de la AR hayan cambiado drásticamente en los últimos años, teniendo como objetivo principal conseguir una remisión completa, o al menos una baja actividad mantenida, mejorando el pronóstico funcional del paciente mediante la estrategia del «treat to target»7,8. Además, en el manejo no podemos olvidar el control del dolor, así como la disminución de la dosis de corticosteroides o, preferiblemente, su suspensión.
Las estrategias terapéuticas actuales incluyen tratamientos encaminados a controlar el dolor y la inflamación de forma rápida y fármacos modificadores de la enfermedad (FAME) que pueden ser sintéticos (FAMEs) y biológicos (FAMEb) (anti-TNF, otros biológicos y nuevas terapias dirigidas). Su uso debe hacerse cuanto antes en el curso de la enfermedad, a dosis plenas, solos o en combinación para incrementar la eficacia terapéutica según la estrategia del «treat to target»8,9.
No existiendo una manera estandarizada de emplear los distintos tratamientos, las combinaciones son diversas y dependen tanto del médico como de la accesibilidad a los fármacos y las características propias de cada paciente. El cambio en los objetivos terapéuticos y el aumento de las opciones de tratamiento han condicionado múltiples posibilidades de manejo del paciente en la práctica clínica diaria. Los datos en condiciones de ensayo clínico son abundantes en la literatura10,11 pero no así en la vida real. Por este motivo, nuestro objetivo es obtener información de práctica clínica acerca de la AR de inicio. Describiremos el manejo clínico y del tratamiento, persistencia del mismo, así como los motivos de suspensión en una cohorte de pacientes con AR de inicio en condiciones de la práctica clínica diaria seguidos en consultas externas de Reumatología de un hospital terciario.
Material y métodosDiseñoEstudio observacional longitudinal retrospectivo. Se incluyeron pacientes diagnosticados de AR entre 01/01/07 y 31/12/14. El seguimiento comprendió hasta la pérdida de seguimiento o el final de estudio (01/01/17).
Ámbito del estudioServicio de Reumatología del Hospital Clínico San Carlos que es un hospital público terciario con un área de captación de aproximadamente 600.000 personas.
SujetosSe incluyeron pacientes mayores de 16 años diagnosticados de AR (criterios ACR/EULAR 2010)12 menos de un año antes de la inclusión. Para entrar en el estudio era necesario que el paciente firmara el consentimiento informado, hubiese realizado al menos 2 visitas en el servicio de Reumatología y recibido al menos un FAMEs (cloroquina, hidroxicloroquina, metotrexate, leflunomida, sales de oro, sulfasalacina, ciclosporina, ciclofosfamida, azatioprina, micofenolato de mofetilo) o un FAMEb (infliximab, adalimumab, etanercept, golimumab, certolizumab pegol, rituximab, abatacept, tocilizumab) durante el período de inclusión.
Este estudio fue aprobado por el comité de ética y ensayos clínicos institucional del Hospital Clínico San Carlos. Además, según las indicaciones del mismo, se remitió a la Agencia Española del Medicamento, que lo clasificó como estudio observacional.
Fuentes de datosSe recogieron los datos de los pacientes a través de la historia clínica electrónica departamental del Servicio de Reumatología del Hospital Clínico San Carlos donde se registran en «tiempo real» las visitas rutinarias. Además, se revisaron en papel las historias clínicas para completar los datos que faltaban.
Variables1) Sociodemográficas: edad, sexo, estado civil, nivel educacional, categoría, situación laboral y de residencia (solo, familia/amigos, institucionalizado). 2) Clínicas: a) fecha de diagnóstico, b) fumador, c) calidad de vida basal medida por el índice de Rosser, d) analíticas: velocidad de sedimentación basal, factor reumatoide, anticuerpos antipéptido citrulinado, e) actividad basal de la enfermedad medida mediante HAQ y DAS 28. 3) Comorbilidad basal: hipertensión arterial, diabetes mellitus, hipercolesterolemia, cardiopatía isquémica, insuficiencia cardíaca congestiva, patología cerebrovascular, arteriopatía periférica, cáncer y tipo de cáncer, depresión, úlcera gastroduodenal, enfermedad pulmonar obstructiva crónica, hepatopatía, osteoporosis, fracturas, insuficiencia renal, deterioro cognitivo y alteraciones tiroideas. 4) FAMEs: tipo (cloroquina, hidroxicloroquina, metotrexate, leflunomida, sales de oro, sulfasalacina, ciclosporina, ciclofosfamida, azatioprina, micofenolato de mofetilo), fechas de inicio y fechas de fin. 5) FAMEb: tipo (infliximab, adalimumab, etanercept, golimumab, certolizumab pegol, rituximab, abatacept, tocilizumab), fechas de inicio y fechas de fin. 6) Tratamientos concomitantes (si se han empleado durante al menos 3 meses desde el inicio de cada curso de tratamiento con FAMEs): a) uso de analgésicos opioides y antiinflamatorios, b) dosis media de corticoides. 7) Motivos de suspensión de FAMEs: a) evento adverso (EA): se recogió el tipo, la gravedad y la relación con el fármaco, b) ineficacia, c) decisión del paciente, e) decisión del médico, f) remisión o mejoría definida por el criterio del reumatólogo responsable del paciente, g) otras (aquí se incluyen los deseos gestacionales o las suspensiones por cirugía programada superiores a 3 meses).
Análisis estadísticoSe realizó un análisis descriptivo de los sujetos con características sociodemográficas, clínicas y flujos de tratamientos con FAME (primera y segunda línea), monoterapia o combinados a lo largo del tiempo.
Se describieron los motivos de suspensión mediante distribución de frecuencias, media y desviación estándar, medianas o percentiles. La persistencia del tratamiento y la incidencia de suspensión se evaluó por técnicas de supervivencia, expresándose por 100 pacientes/año con su intervalo de confianza del 95%.
Todos los análisis se realizaron con el programa estadístico Stata v.13 Special Edition–Statistics/Data Analysis. Un valor de p de 2 colas por debajo de 0,05 se consideró significación estadística.
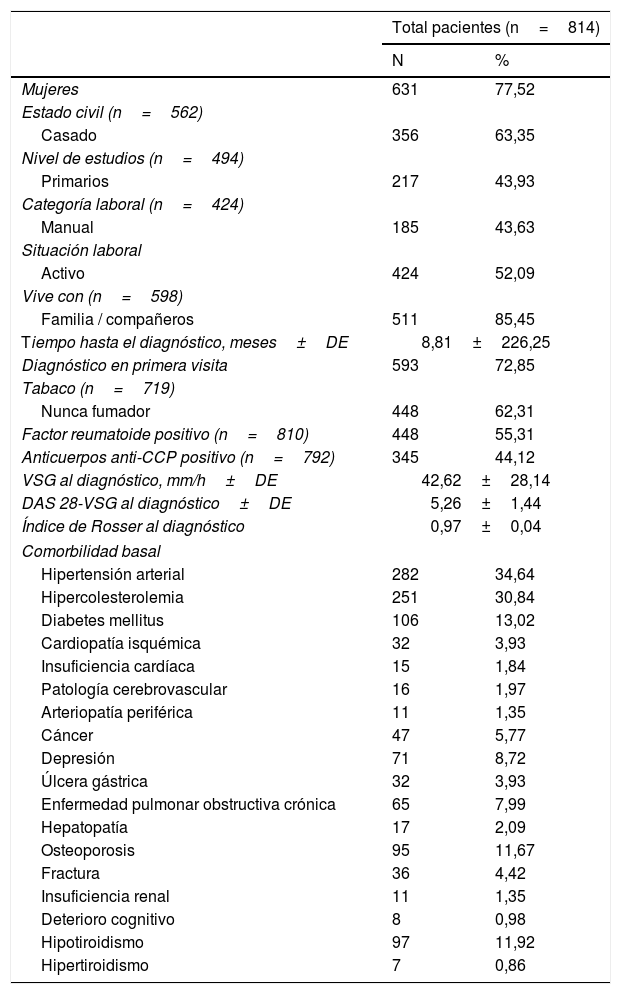
ResultadosSe incluyeron 814 pacientes, con un seguimiento medio de 5 años (mediana: 5,1 [p25-75: 2,97-7,12]). En la tabla 1 se recogen las características sociodemográficas y clínicas basales. Más de 3 cuartas partes de los pacientes fueron mujeres (77,52%) con una edad media al diagnóstico de 57,53 (±15,50 años).
Características sociodemográficas y clínicas basales
| Total pacientes (n=814) | ||
|---|---|---|
| N | % | |
| Mujeres | 631 | 77,52 |
| Estado civil (n=562) | ||
| Casado | 356 | 63,35 |
| Nivel de estudios (n=494) | ||
| Primarios | 217 | 43,93 |
| Categoría laboral (n=424) | ||
| Manual | 185 | 43,63 |
| Situación laboral | ||
| Activo | 424 | 52,09 |
| Vive con (n=598) | ||
| Familia / compañeros | 511 | 85,45 |
| Tiempo hasta el diagnóstico, meses±DE | 8,81±226,25 | |
| Diagnóstico en primera visita | 593 | 72,85 |
| Tabaco (n=719) | ||
| Nunca fumador | 448 | 62,31 |
| Factor reumatoide positivo (n=810) | 448 | 55,31 |
| Anticuerpos anti-CCP positivo (n=792) | 345 | 44,12 |
| VSG al diagnóstico, mm/h±DE | 42,62±28,14 | |
| DAS 28-VSG al diagnóstico±DE | 5,26±1,44 | |
| Índice de Rosser al diagnóstico | 0,97±0,04 | |
| Comorbilidad basal | ||
| Hipertensión arterial | 282 | 34,64 |
| Hipercolesterolemia | 251 | 30,84 |
| Diabetes mellitus | 106 | 13,02 |
| Cardiopatía isquémica | 32 | 3,93 |
| Insuficiencia cardíaca | 15 | 1,84 |
| Patología cerebrovascular | 16 | 1,97 |
| Arteriopatía periférica | 11 | 1,35 |
| Cáncer | 47 | 5,77 |
| Depresión | 71 | 8,72 |
| Úlcera gástrica | 32 | 3,93 |
| Enfermedad pulmonar obstructiva crónica | 65 | 7,99 |
| Hepatopatía | 17 | 2,09 |
| Osteoporosis | 95 | 11,67 |
| Fractura | 36 | 4,42 |
| Insuficiencia renal | 11 | 1,35 |
| Deterioro cognitivo | 8 | 0,98 |
| Hipotiroidismo | 97 | 11,92 |
| Hipertiroidismo | 7 | 0,86 |
Anti-CCP: antipéptido citrulinado; DAS: disease activity score; DE: desviación estándar; VSG: velocidad de sedimentación globular.
El tiempo medio hasta el diagnóstico fue de 8,81 meses (±226,25), consiguiendo un diagnóstico en primera visita en el 72,85% de los pacientes. Se registró un mayor porcentaje de pacientes que nunca había fumado respecto a fumadores activos o exfumadores. Aproximadamente la mitad de los pacientes presentaban una AR seropositiva. En cuanto a la actividad de la enfermedad al diagnóstico, la mediana de velocidad de sedimentación globular fue de 42,62 (±28,14) mm/h y el DAS 28 medio de 5,26±1,44. Respecto a la medición de la calidad de vida mediante el índice de Rosser al diagnóstico, se obtuvo una media de 0,97±0,04. Con respecto a la comorbilidad, tanto la hipertensión arterial como la hipercolesterolemia fueron las patologías más prevalentes al ser detectadas en más de un tercio de los pacientes al diagnóstico.
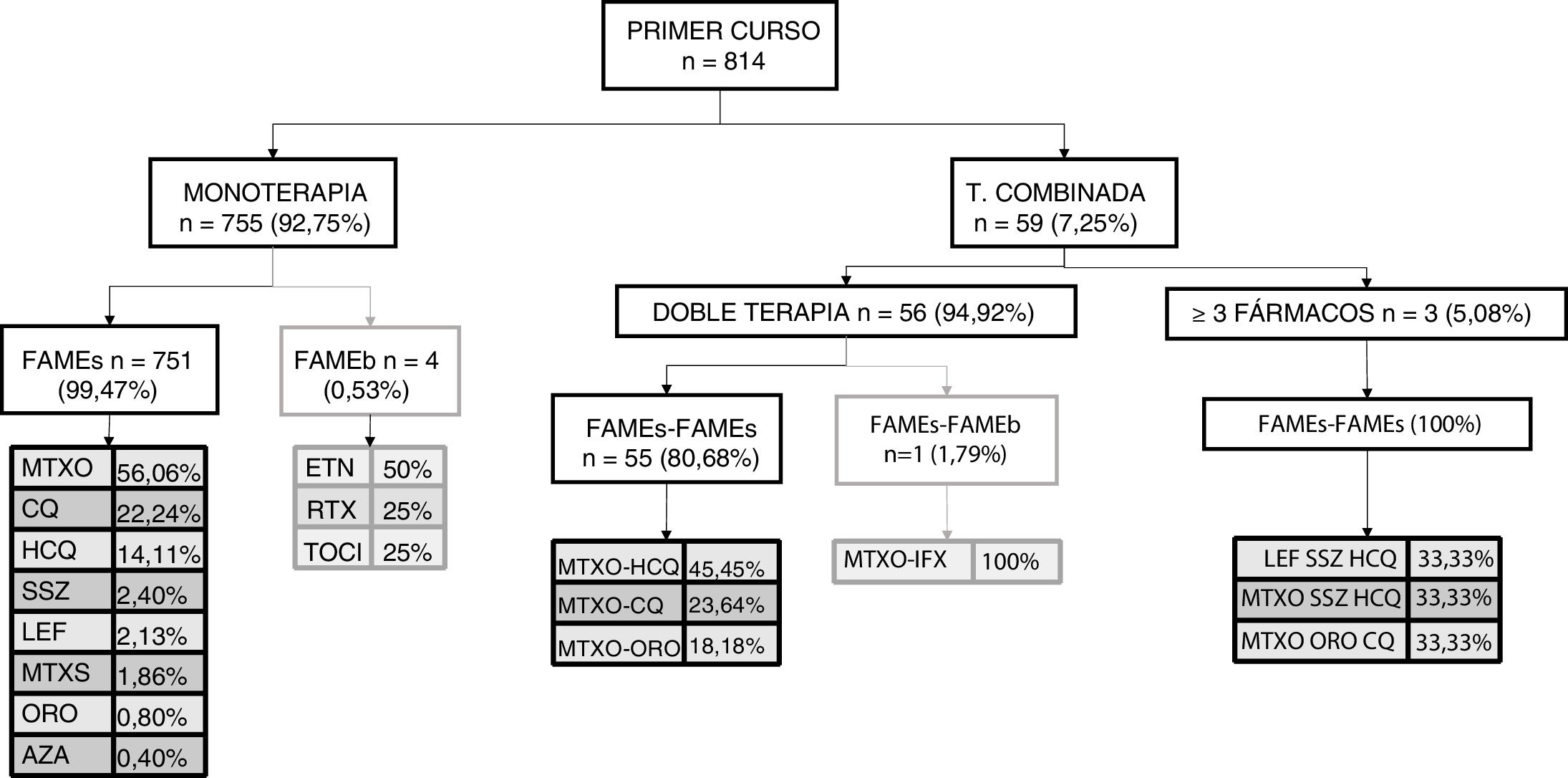
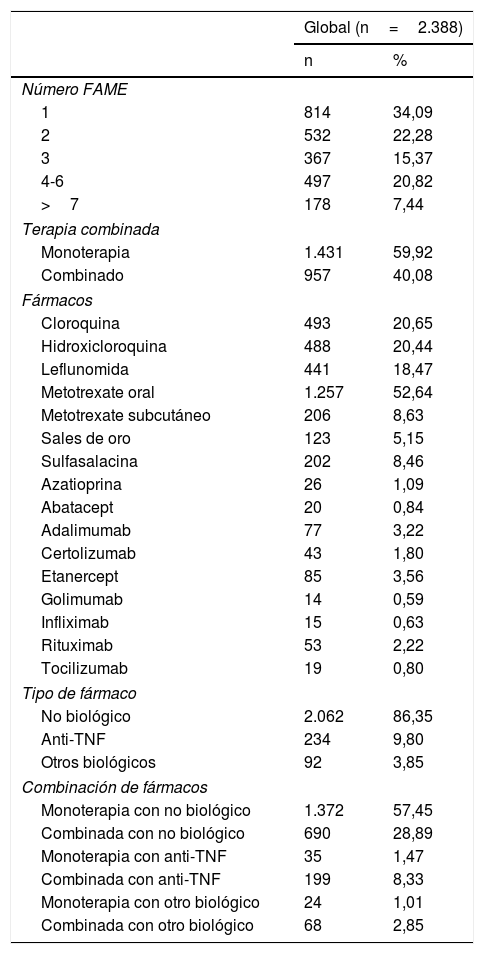
Se registraron 2.388 cursos de tratamiento con FAME en los 814 pacientes, la mediana de tiempo hasta el primer curso de tratamiento fue de 21 [0-43] días. El fármaco más empleado fue el metotrexate oral seguido de los antipalúdicos (ver tabla 2). La terapia combinada en nuestra cohorte se empleó en un 40,08% (doble terapia 31,87%; ≥3 fármacos 8,25%) y se emplearon fármacos biológicos en un 13,65% de los cursos de tratamiento tanto en monoterapia como en combinación. En cuanto a la manera de emplear los FAME, lo más frecuente fue la monoterapia de FAMEs (57,45%) seguido de la terapia combinada de FAMEs (28,89%).
Descripción de los cursos de tratamiento
| Global (n=2.388) | ||
|---|---|---|
| n | % | |
| Número FAME | ||
| 1 | 814 | 34,09 |
| 2 | 532 | 22,28 |
| 3 | 367 | 15,37 |
| 4-6 | 497 | 20,82 |
| >7 | 178 | 7,44 |
| Terapia combinada | ||
| Monoterapia | 1.431 | 59,92 |
| Combinado | 957 | 40,08 |
| Fármacos | ||
| Cloroquina | 493 | 20,65 |
| Hidroxicloroquina | 488 | 20,44 |
| Leflunomida | 441 | 18,47 |
| Metotrexate oral | 1.257 | 52,64 |
| Metotrexate subcutáneo | 206 | 8,63 |
| Sales de oro | 123 | 5,15 |
| Sulfasalacina | 202 | 8,46 |
| Azatioprina | 26 | 1,09 |
| Abatacept | 20 | 0,84 |
| Adalimumab | 77 | 3,22 |
| Certolizumab | 43 | 1,80 |
| Etanercept | 85 | 3,56 |
| Golimumab | 14 | 0,59 |
| Infliximab | 15 | 0,63 |
| Rituximab | 53 | 2,22 |
| Tocilizumab | 19 | 0,80 |
| Tipo de fármaco | ||
| No biológico | 2.062 | 86,35 |
| Anti-TNF | 234 | 9,80 |
| Otros biológicos | 92 | 3,85 |
| Combinación de fármacos | ||
| Monoterapia con no biológico | 1.372 | 57,45 |
| Combinada con no biológico | 690 | 28,89 |
| Monoterapia con anti-TNF | 35 | 1,47 |
| Combinada con anti-TNF | 199 | 8,33 |
| Monoterapia con otro biológico | 24 | 1,01 |
| Combinada con otro biológico | 68 | 2,85 |
FAME: fármaco modificador de la enfermedad; TNF: factor de necrosis tumoral.
Se recogieron también los tratamientos concomitantes empleados, en el 83,75% de los cursos de tratamiento se asociaron corticoides con una dosis media de 1,20 (±0,77)mg. En el 36,06% de los cursos de tratamiento se registró el uso concomitante de antiinflamatorios no esteroideos mientras que el de opioides fue muy inferior (opioides menores 6,74% de los cursos; opioides mayores 5,65% de los cursos).
Se llevó a cabo un análisis de las combinaciones de fármacos más frecuentemente empleadas y pudimos objetivar que el FAMEs más empleado en monoterapia fue el metotrexate y el FAMEb el etanercept; respecto a la terapia combinada, en doble terapia la combinación de FAMEs preferida fue metotrexate e hidroxicloroquina y la de FAMEs con FAMEb metotrexate y adalimumab. En cuanto a la triple terapia, en sintéticos lo preferido fue metotrexate con hidroxicloroquina y leflunomida y en FAMEs con FAMEb metotrexate con leflunomida y etanercept.
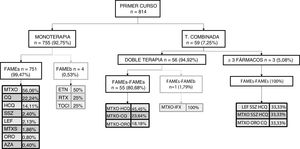
Este mismo análisis se repitió por curso de tratamiento. En la figura 1 podemos verlo para el primer curso de tratamiento. Durante el primer curso, lo más frecuentemente empleado fue la monoterapia y, dentro de esta, la monoterapia con FAMEs, especialmente el metotrexate; se registraron 4 casos de monoterapia con FAMEb. Respecto a la terapia combinada en el primer curso de tratamiento, su uso fue muy bajo y se hizo fundamentalmente a expensas de doble terapia, en algún caso triple terapia. Prácticamente siempre que se empleó fue con FAMEs; se registró un único caso de combinación FAMEs y FAMEb en el primer curso de tratamiento.
En posteriores cursos de tratamiento podemos apreciar varias diferencias. Respecto a la monoterapia, el FAMEs más empleado fue también el metotrexate (41,22%) pero hubo diferencias en el FAMEb puesto que se emplearon por igual etanercept y adalimumab (20% ambos). La terapia combinada se empleó con una mayor frecuencia (57,05%), y dentro de ella especialmente la doble terapia (78,51%). En doble terapia se combinaron fundamentalmente FAMEs con metotrexate-hidroxicloroquina siendo la combinación más empleada (22,18%) seguida de metotrexate-cloroquina (20,93%); dentro de la doble terapia con biológico se usó con mayor frecuencia metotrexate-adalimumab (13,70%) seguida por leflunomida-etanercept (9,59%). En cuanto a la triple terapia (21,49%) lo más frecuente fue una combinación con FAMEb (62,18%) siendo lo más usado metotrexate-leflunomida-etanercept (6,67%); cuando se optó por una triple terapia con FAMEs lo más empleado fue la combinación metotrexate-leflunomida-hidroxicloroquina (15,07%).
Se registraron 1.094 suspensiones de los 2.388 cursos de tratamiento en 533 pacientes. Hubo 584 suspensiones por EA en 361 pacientes, 150 por ineficacia en 110 pacientes, 124 por decisión del médico en 102 pacientes, 66 por mejoría en 61 pacientes, 116 por decisión del paciente en 103 pacientes y 54 por otras causas en 51 pacientes.
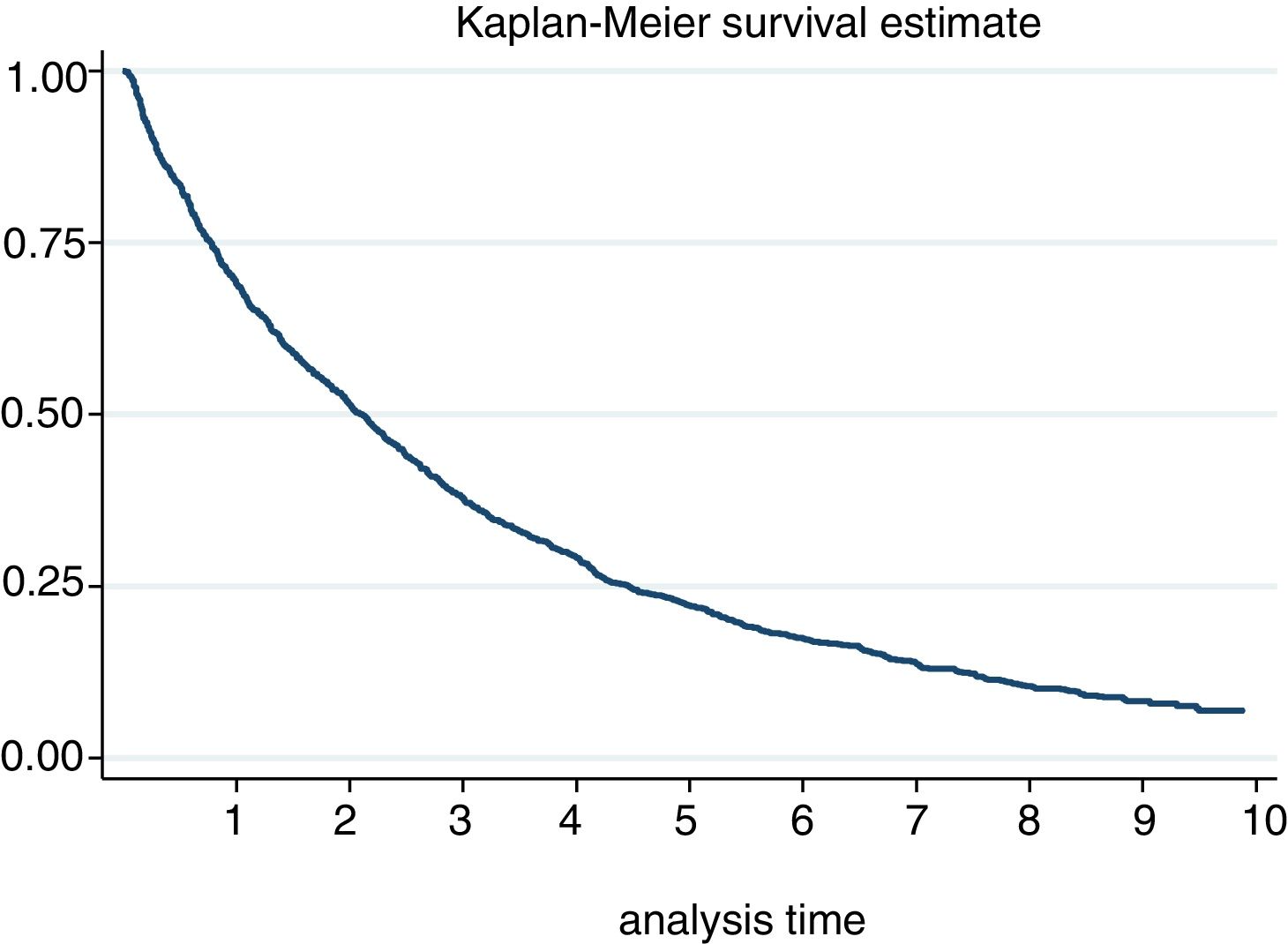
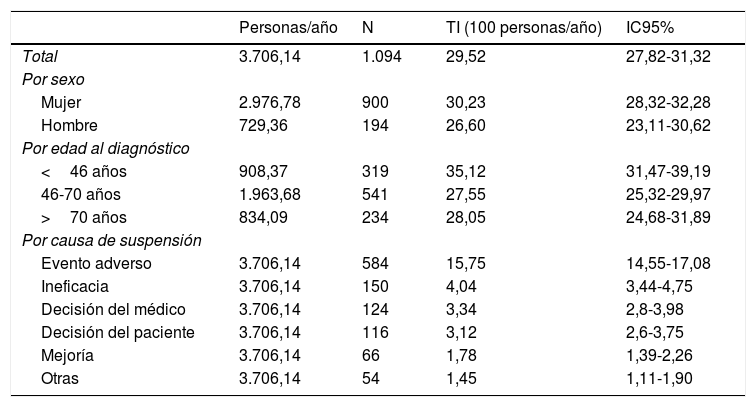
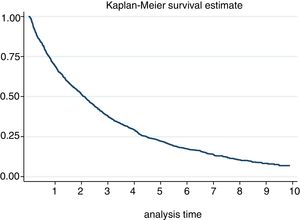
La incidencia de suspensión en nuestra cohorte se estimó en 29,52 [27,82-31,32]. Al año y a los 5 años, el 30% y el 78% respectivamente discontinuaron el tratamiento (fig. 2). De hecho, el 50% de los pacientes discontinuaron el tratamiento a los 2,1 [1,9-2,3] años de inicio del mismo. Según las causas de suspensión, la mayor incidencia fue por EA, seguido de ineficacia, decisión del paciente y decisión del médico. Con relación a las características sociodemográficas, la incidencia fue superior en mujeres y en pacientes menores de 46 años (tabla 3). Se registró una pérdida de seguimiento de un 20%.
Incidencias de suspensiones global, por edad y sexo, por causa de suspensión
| Personas/año | N | TI (100 personas/año) | IC95% | |
|---|---|---|---|---|
| Total | 3.706,14 | 1.094 | 29,52 | 27,82-31,32 |
| Por sexo | ||||
| Mujer | 2.976,78 | 900 | 30,23 | 28,32-32,28 |
| Hombre | 729,36 | 194 | 26,60 | 23,11-30,62 |
| Por edad al diagnóstico | ||||
| <46 años | 908,37 | 319 | 35,12 | 31,47-39,19 |
| 46-70 años | 1.963,68 | 541 | 27,55 | 25,32-29,97 |
| >70 años | 834,09 | 234 | 28,05 | 24,68-31,89 |
| Por causa de suspensión | ||||
| Evento adverso | 3.706,14 | 584 | 15,75 | 14,55-17,08 |
| Ineficacia | 3.706,14 | 150 | 4,04 | 3,44-4,75 |
| Decisión del médico | 3.706,14 | 124 | 3,34 | 2,8-3,98 |
| Decisión del paciente | 3.706,14 | 116 | 3,12 | 2,6-3,75 |
| Mejoría | 3.706,14 | 66 | 1,78 | 1,39-2,26 |
| Otras | 3.706,14 | 54 | 1,45 | 1,11-1,90 |
IC: intervalo de confianza; TI: tasa de incidencia.
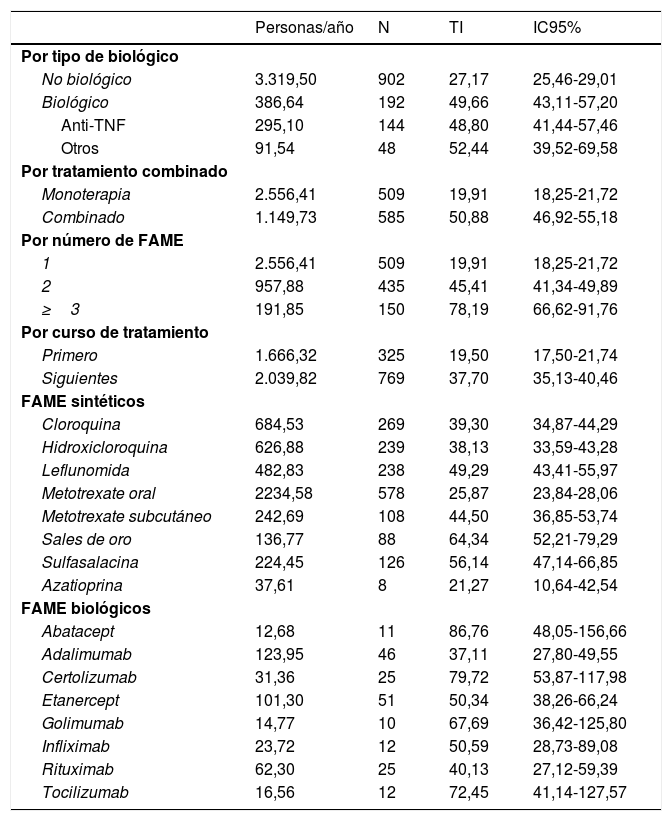
En la tabla 4 se presentan las tasas crudas de suspensión analizadas en función del tratamiento, y podemos ver que la tasa de suspensión de FAMEb es casi el doble que la de FAMEs, sin grandes diferencias entre los grandes grupos de agentes biológicos (anti-TNF u otros biológicos). Respecto a las combinaciones de fármacos, la incidencia de suspensión es más del doble en la terapia combinada en comparación con la monoterapia, sobre todo cuando la combinación es de 3 o más fármacos. Se analizaron las suspensiones en función del curso de tratamiento, siendo más altas en cursos posteriores en comparación con el primero.
Incidencias de suspensión en función del tratamiento
| Personas/año | N | TI | IC95% | |
|---|---|---|---|---|
| Por tipo de biológico | ||||
| No biológico | 3.319,50 | 902 | 27,17 | 25,46-29,01 |
| Biológico | 386,64 | 192 | 49,66 | 43,11-57,20 |
| Anti-TNF | 295,10 | 144 | 48,80 | 41,44-57,46 |
| Otros | 91,54 | 48 | 52,44 | 39,52-69,58 |
| Por tratamiento combinado | ||||
| Monoterapia | 2.556,41 | 509 | 19,91 | 18,25-21,72 |
| Combinado | 1.149,73 | 585 | 50,88 | 46,92-55,18 |
| Por número de FAME | ||||
| 1 | 2.556,41 | 509 | 19,91 | 18,25-21,72 |
| 2 | 957,88 | 435 | 45,41 | 41,34-49,89 |
| ≥3 | 191,85 | 150 | 78,19 | 66,62-91,76 |
| Por curso de tratamiento | ||||
| Primero | 1.666,32 | 325 | 19,50 | 17,50-21,74 |
| Siguientes | 2.039,82 | 769 | 37,70 | 35,13-40,46 |
| FAME sintéticos | ||||
| Cloroquina | 684,53 | 269 | 39,30 | 34,87-44,29 |
| Hidroxicloroquina | 626,88 | 239 | 38,13 | 33,59-43,28 |
| Leflunomida | 482,83 | 238 | 49,29 | 43,41-55,97 |
| Metotrexate oral | 2234,58 | 578 | 25,87 | 23,84-28,06 |
| Metotrexate subcutáneo | 242,69 | 108 | 44,50 | 36,85-53,74 |
| Sales de oro | 136,77 | 88 | 64,34 | 52,21-79,29 |
| Sulfasalacina | 224,45 | 126 | 56,14 | 47,14-66,85 |
| Azatioprina | 37,61 | 8 | 21,27 | 10,64-42,54 |
| FAME biológicos | ||||
| Abatacept | 12,68 | 11 | 86,76 | 48,05-156,66 |
| Adalimumab | 123,95 | 46 | 37,11 | 27,80-49,55 |
| Certolizumab | 31,36 | 25 | 79,72 | 53,87-117,98 |
| Etanercept | 101,30 | 51 | 50,34 | 38,26-66,24 |
| Golimumab | 14,77 | 10 | 67,69 | 36,42-125,80 |
| Infliximab | 23,72 | 12 | 50,59 | 28,73-89,08 |
| Rituximab | 62,30 | 25 | 40,13 | 27,12-59,39 |
| Tocilizumab | 16,56 | 12 | 72,45 | 41,14-127,57 |
FAME: fármaco modificador de la enfermedad; IC: intervalo de confianza; TI: tasa de incidencia; TNF: factor de necrosis tumoral.
Por último, se presentan las tasas de suspensión por cada fármaco individualmente. Dentro de los FAMEs destacan las sales de oro, la sulfasalacina y la leflunomida como aquellos que muestran una tasa cruda de mayor incidencia de suspensión; entre los FAMEb el adalimumab seguido de certolizumab fueron los que presentaban una tasa de discontinuación más elevada.
DiscusiónEste estudio contribuye a incrementar nuestro conocimiento sobre el manejo en condiciones de la vida diaria de pacientes con AR de inicio, describiendo las causas de suspensión de los distintos FAME utilizados.
Nuestra cohorte incluye a 814 pacientes con AR de inicio y un seguimiento máximo de 10 años. La mayoría de los pacientes fueron mujeres con una edad media al inicio de la enfermedad de 57 años y más de la mitad se encontraba en situación laboral activa. El diagnóstico se estableció en casi 3 cuartas partes de los pacientes en primera visita y más de la mitad presentaron una AR seropositiva con elevada actividad de la enfermedad. Las comorbilidades más prevalentes fueron la hipertensión arterial y la hipercolesterolemia. Nuestra cohorte puede considerarse representativa de una población de AR de inicio, siendo comparable a otras publicadas en cuanto a características sociodemográficas y clínicas. La escocesa SERA13 es análoga, aunque sus pacientes tienen mayor frecuencia de seropositividad y menor actividad de la enfermedad a la entrada; la inglesa NORFLOK14,15, muy semejante a la nuestra pero con menor frecuencia de seropositividad así como menor actividad de la enfermedad y mayor tiempo hasta el inicio del primer FAME; o la multicéntrica canadiense CATCH16 y la francesa ESPOIR17,18, muy similares a la nuestra salvo porque sus pacientes son ligeramente más jóvenes.
Respecto al manejo de nuestros pacientes, el tratamiento con FAME se inició precozmente, menos de un mes después de establecido el diagnóstico de AR. El inicio del tratamiento se realizó preferiblemente en monoterapia con FAMEs siendo el fármaco más empleado de forma global el metotrexate oral tanto en monoterapia como en terapia combinada, de los FAMEb globalmente el más empleado fue el etanercept seguido del adalimumab. La terapia combinada se utilizó en un 40% de los cursos de tratamiento, especialmente la doble, y se empleó FAMEb en un 13% de los mismos. Respecto a las combinaciones de fármacos más frecuentemente empleadas globalmente, la de FAMEs más empleada fue metotrexate-hidroxicloroquina y la de FAMEs con FAMEb metotrexate-adalimumab, en cuanto a la triple terapia, en sintéticos lo preferido fue metotrexate-hidroxicloroquina-leflunomida y en FAMEs con FAMEb metotrexate-leflunomida-etanercept.
En el primer curso de tratamiento la mayoría de los pacientes recibieron monoterapia con FAMEs, de ellos el más utilizado fue el metotrexate. La terapia combinada se empleó en menos del 10% de los pacientes y cuando se hizo fue fundamentalmente doble terapia con FAMEs, sobre todo metotrexate-antipalúdico. En muy pocos casos se empleó la terapia con FAMEb en primer curso, y cuando se hizo el fármaco preferido fue el etanercept. En los cursos posteriores el fármaco más empleado en monoterapia siguió siendo el metotrexate, pero el uso de terapia combinada se incrementó considerablemente llegando a usarse en más de la mitad de los pacientes, especialmente la doble terapia. En terapia combinada de nuevo metotrexate-antipalúdico sigue siendo lo más frecuente; en cuanto a FAMEb la combinación más frecuente es metotrexate-adalimumab.
En todas las cohortes previamente publicadas, el FAME más empleado es el metotrexate, igual que en nuestra cohorte con un uso de FAMEb muy semejante al nuestro13–18 quizá un poco superior en la francesa17,18. En cuanto a la terapia combinada, cabe destacar la cohorte francesa17,18 donde se empleó con mucha mayor frecuencia. Dentro de los biológicos, los más usados fueron también adalimumab y etanercept16–18.
Se registraron 1.094 suspensiones en 2.388 cursos de tratamiento, siendo la principal causa de suspensión el desarrollo de un EA seguida de la ineficacia. Estos resultados concuerdan de forma global con los datos previamente publicados. Cabe destacar los registros de FAMEb LORHEN19 y SCQM-RA20 así como los estudios monocéntricos de cohortes, Flendrie et al.21 y León et al.22, puesto que en ellos más de la mitad de las suspensiones fueron también por EA con la ineficacia en segundo lugar. En los registros DANBIO y DREAM23,24 la principal causa de suspensión es la ineficacia seguida del EA; hay que tener en cuenta que son registros nacionales de pacientes con AR establecida que reciben anti-TNF con resultados publicados precozmente (6 primeros meses de tratamiento en DANBIO23 y primer año en DREAM24). Por último, se revisaron los datos publicados por los registros nacionales de FAMEb en enfermedades reumáticas de Portugal25, España26 e Italia27. Analizando los datos referentes a AR, la principal causa de discontinuación fue la ineficacia seguida de los EA. En cuanto a los FAMEb no anti-TNF, los datos disponibles de estos fármacos son menores puesto que su comercialización fue posterior a los anti-TNF.
La principal limitación de este estudio es el diseño retrospectivo, lo que conlleva la existencia de datos perdidos. Por otra parte, cabe destacar que el número de pacientes que recibieron los FAMEb más nuevos (tocilizumab o abatacept) es más bajo que el de los que recibieron el resto de fármacos debido a esa comercialización tardía. Sin embargo, este estudio presenta la gran fortaleza de incluir un amplio número de pacientes con AR de inicio y seguirlos a largo plazo, lo que aporta rotundidad a los resultados. Además, se trata de un estudio realizado en condiciones de la vida real con pacientes no seleccionados en un único centro.
En conclusión, describimos una cohorte representativa de AR de inicio, seguida 10 años, en la que se ha realizado un manejo de la enfermedad de acuerdo a los estándares, consiguiendo un diagnóstico rápido e instaurando un tratamiento precoz y agresivo con FAME. En cuanto a la persistencia de los FAMEs, mostramos que casi un 30/100 pacientes al año discontinúa alguno de estos fármacos, siendo la supervivencia media de 2 años, corroborando que lo más habitual es la suspensión por EA.
Estos estudios longitudinales, a largo plazo y en la vida real aportan información muy útil para ayudar al médico en su práctica diaria. Sería muy interesante completar estas cohortes, dentro de unos años, con más datos de los nuevos biológicos (rituximab, abatacept y tocilizumab) como de los fármacos inhibidores de las JAK-cinasas.
FinanciaciónEste trabajo se realizó con el apoyo del Instituto de Salud Carlos III, Ministerio de Sanidad [contrato de investigación Miguel Servet: CP11/00189 de Lydia Abásolo; Fondo de Investigaciones Sanitarias: PI18/01188; Red de Investigación en Inflamación y Enfermedades Reumáticas: RD16/0012/0014] y Sanofi-Aventis, S.A.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.