El objetivo de este estudio ha sido comparar la eficiencia de utilizar el metotrexato subcutáneo (Metoject®) con respecto al metotrexato oral en el manejo de pacientes con AR en España.
MétodosSe ha realizado un análisis coste-efectividad/utilidad del tratamiento de la AR temprana utilizando un modelo de Markov. El modelo ha permitido estimar la efectividad a largo plazo del tratamiento de la AR en función de los datos de la literatura y de la opinión de expertos y combinarlo con información de los costes en España. El análisis se ha realizado desde la perspectiva del Sistema Nacional de Salud, utilizando un horizonte temporal de 5 años y de toda la vida del paciente. Todos los costes se expresaron en euros del año 2009 y se ha utilizado una tasa de descuento del 3%.
ResultadosLa razón de coste (solo costes farmacológicos) por año de vida ajustado por calidad (AVAC) ganado con Metoject® fue de 25.173–35.807€ a los 5 años y de 19.056–25.351€ para toda la vida. Al tener en cuenta los costes directos de la AR se observó que el coste-efectividad a los 5 años fue de 29.682–42.175€/AVAC ganado y para toda la vida fue de 22.514–29.848€/AVAC ganado.
ConclusionesLos costes adicionales de Metoject® respecto a metotrexato oral se verían compensados por su mejora en efectividad, expresada en términos de AVAC, revelando que Metoject® podría ser un tratamiento costeefectivo para la AR en el Sistema Nacional de Salud según el umbral asumido en España.
The aim of this study was to compare the clinical and economic consequences of using subcutaneous methotrexate (Metoject®) with respect to oral methotrexate in the management of rheumatoid arthritis (RA) in Spain.
MethodsA cost-effectiveness analysis was performed to compare early treatment of RA using a Markov model. The model allowed us to estimate long term efficacy of RA treatment based on data from the literature and expert opinion, and to combine this data with costs of managing RA in Spain. The perspective of the study was from the National Health System point of view, using a time horizon of 5 years and patient lifetime. All costs were expressed in 2009 euros and a 3% discount rate was applied.
ResultsThe cost (only pharmacologic costs) per quality-adjusted life year (QALY) gained with Metoject® went from 25,173 to 35,807€ at 5 years and from 19,056 to 25,351€ for patient lifetime. When direct costs in RA treatment were considered, it was observed that cost-effectiveness at 5 years went from 29,682 to 42,175€/QALY gained, and for patient lifetime from 22,514 to 29,848€/ QALY gained.
ConclusionsAdditional costs of Metoject® with respect to oral methotrexate would be offset by their improved effectiveness, expressed in QALY, showing that Metoject® could be a cost-effective treatment option for RA in the Spanish Health System assuming a spanish threshold.
La artritis reumatoide (AR) es una enfermedad agresiva que conduce a la destrucción articular y al deterioro funcional irreversible en un elevado porcentaje de pacientes. Es por ello que un diagnóstico precoz y la instauración rápida del tratamiento son de la máxima relevancia para inducir la remisión durante los primeros meses de evolución de la AR1. Aunque el deterioro radiológico y funcional progresa durante todo el curso de la enfermedad, la máxima velocidad de desarrollo de las lesiones radiológicas y del compromiso funcional ocurre durante los 2 primeros años de evolución de la AR2. El curso clínico de la AR es progresivo y conduce a una disminución de la calidad de vida, así como a un aumento de la morbilidad y mortalidad3.
El programa de control de la carga mundial de la enfermedad de la OMS ha identificado a la AR como una de las 10 principales causas de discapacidad en la UE4. En España, la AR afecta al 0,5% de la población adulta (aproximadamente 162.250 personas)5. Las estimaciones relativas a la incidencia de la AR van desde 4,13 por 100.000 hombres adultos a 13–16 por 100.000 mujeres adultas.
El tratamiento de la AR debe dirigirse a disminuir la actividad inflamatoria y evitar la progresión de la lesión articular6. La primera línea terapéutica suelen ser los AINE y los glucocorticoides7. Estos fármacos actúan rápidamente mejorando el dolor y la tumefacción causada por la AR. Los fármacos antirreumáticos modificadores de la enfermedad (FAME) son compuestos que actúan de forma más lenta mejorando no solo los síntomas sino también la progresión clínica y radiográfica. Debido a que su efecto puede tardar en observarse varias semanas o meses, los FAME suelen prescribirse inicialmente junto con agentes que actúan de forma más rápida, como los AINE y los glucocorticoides7. Los FAME han demostrado capacidad para enlentecer o detener la progresión de la AR y entre ellos hay que destacar por su eficacia y rapidez de acción al metotrexato que se puede administrar por vía oral o parenteral8. Por otro lado, los fármacos modificadores de la respuesta biológica (agentes biológicos) actúan contrarrestando el efecto de los mediadores inflamatorios en el tejido dañado por la AR. El tratamiento inicial con anti-TNF más metotrexato podría estar justificado en pacientes con inicio reciente en los que se sospeche una evolución especialmente agresiva9.
El objetivo del presente estudio ha sido comparar la eficiencia de metotrexato subcutáneo (Metoject®) respecto a metotrexato oral en el manejo de los pacientes con AR en España.
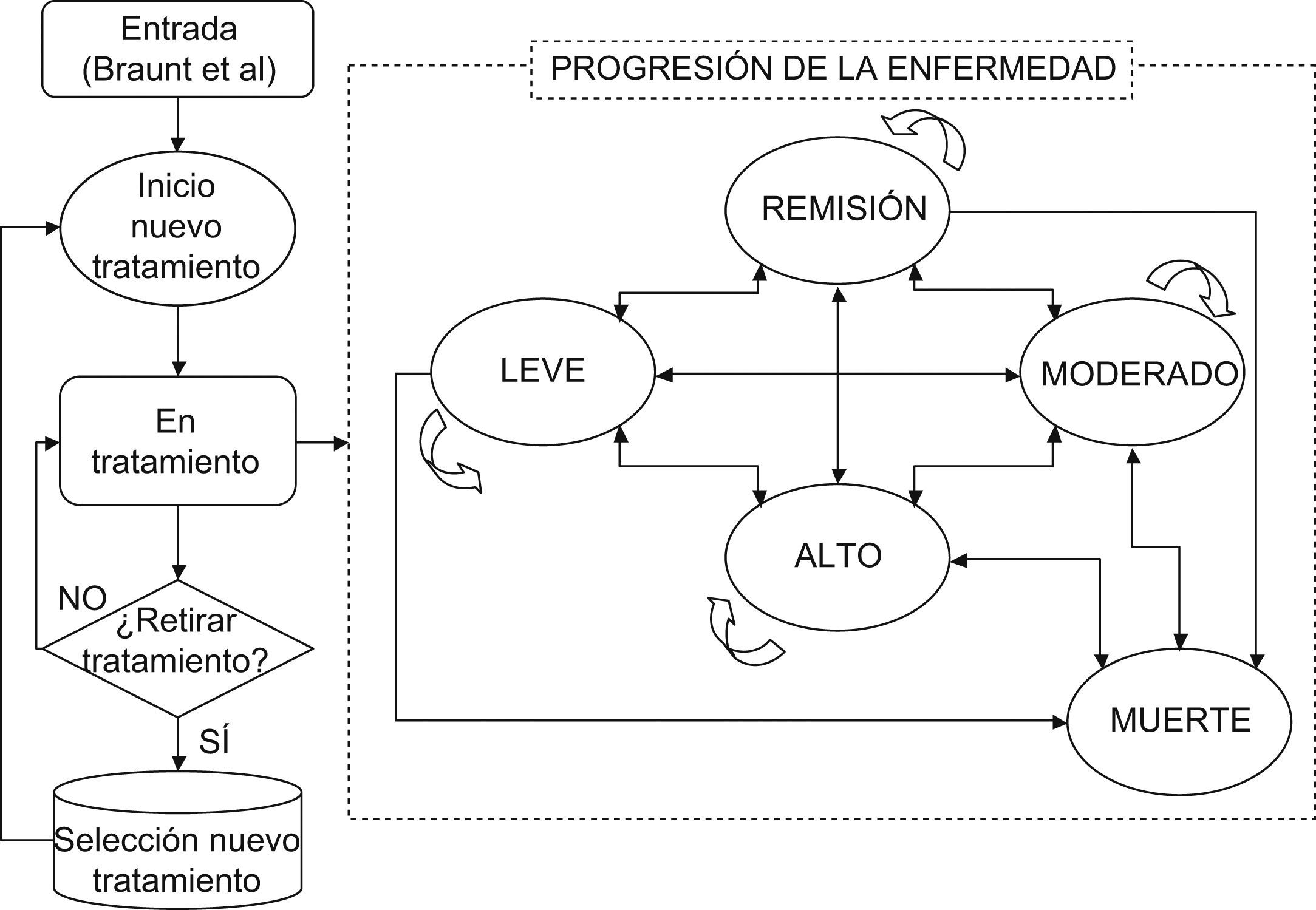
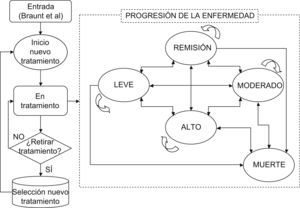
MétodosModelizaciónSe ha realizado un análisis coste-efectividad del tratamiento con Metoject® frente a metotrexato oral utilizando un modelo de simulación basado en datos de la literatura y la opinión de un panel de expertos especialistas en reumatología para la asignación de consecuencias económicas a cada opción de comparación a 5 años y durante toda la vida del paciente. Para ello se ha adaptado al entorno español un árbol de decisión para las primeras 24 semanas y un modelo de Markov que simula la historia natural de la AR temprana (fig. 1) y la práctica clínica habitual en el manejo de los pacientes que la sufren en España.
El modelo ha permitido estimar la efectividad a largo plazo del tratamiento de la AR, combinando información sobre los costes a corto y largo plazo del manejo de pacientes que sufren AR en España con el pronóstico. Para ello, se ha tomado como punto de partida el estudio de 24 semanas de Braun et al10 y se ha evaluado el cambio verosímil de tratamiento cada 6 meses dependiendo del fármaco, del estado inicial de la enfermedad y si el paciente mejora, empeora o se mantiene en el mismo estado de salud. Además según la recomendación de los expertos se ha pautado la secuencia de tratamiento tras el fallo de los mismos según la práctica clínica española, siendo aumentar dosis de metotrexato, cambio de vía de administración, sustituir/añadir otro FAME (leflunomida, hidroxicloroquina, sulfasalazina y sales de oro) o incluso añadir un tratamiento biológico. De tal forma, que la cohorte hipotética tiene las características y la tasa de progresión de la enfermedad para metotrexato en primera línea de tratamiento equivalente a la del ensayo clínico multicéntrico donde se comparaba metotrexato oral frente a subcutáneo10. A partir de las 24 semanas del estudio Braun et al10, la efectividad incluida en el modelo es la misma para los comparadores (metotrexatos) y para los tratamientos administrados tras fallo (otros FAME, metotrexato+biológicos) provenientes de los resultados a medio plazo (12 meses) del ensayo clínico controlado ATTRACT de 54 semanas en pacientes con AR11, del análisis coste-efectividad del estudio ATTRACT de Wong et al12 y de la revisión Cochrane con infliximab13 y adalimumab14. Para los resultados a largo plazo (segundo año–resto de la vida) se realizó un pronóstico a largo plazo de los pacientes tomado del modelo farmacoeconómico del estudio de Wong et al12, de Brennan et al15,16 y de un estudio observacional holandés17.
Sujetos del estudioEl análisis se ha desarrollado a partir de una cohorte hipotética de pacientes con AR (edad media 56 años; el 78,9% mujeres) naïve a metotrexato, a semejanza de los participantes del estudio de Braun et al10.
ParámetrosLa eficacia diferencial de las presentaciones de metotrexato existentes en España, según su vía de administración, proviene del estudio de Braun et al10. En los ensayos clínicos la medida de eficacia principal es la respuesta al índice ACR aunque también se mide como criterio de respuesta el índice Disease Activity Store (DAS28). Los criterios de mejoría del ACR18, valoran la respuesta terapéutica, pero no miden valores absolutos de actividad, sino sus cambios porcentuales. Debido a la naturaleza del estudio y teniendo en cuenta que no siempre la eficacia se mide con DAS28, se han presentado los análisis en base al éxito terapéutico con ACR20, ACR50 y ACR70. En los casos en que la respuesta solo aparece con DAS28 se ha previsto que la respuesta ACR20 corresponde al DAS28 moderado, la respuesta ACR50 al DAS28 leve y la respuesta ACR70 al DAS28 remisión.
Por lo que respecta a las actitudes terapéuticas en caso de progresión de la enfermedad, la distribución de cambios terapéuticos en función del tratamiento inicial fueron tomados de Wong et al12 y validados y completados por la opinión del panel de expertos españoles especialistas en reumatología. De tal forma, que cuando en un paciente la enfermedad progresa se evalúa cuantos de ellos continúan el tratamiento y cuantos de ellos cambian a los tratamientos derivados de la práctica clínica española. La validación y obtención de datos españoles específicos fue obtenida del panel de expertos españoles mediante un cuestionario creado adhoc. El cuestionario para la obtención y validación de los datos fue elaborado previamente con el investigador principal antes de su envío al resto de los investigadores los cuales son coautores de este manuscrito. En aquellos casos que se detectaron discrepancias en las respuestas se llevó a cabo entrevistas en profundidad para detectar si eran pertinentes las modificaciones en un sentido u otro.
Con respecto a la calidad de vida, se han utilizado datos de diferentes procedencias ya que no existen datos españoles que pudiesen reflejar los valores para todos los estados de salud necesarios12,17.
Se han considerado 3 grandes tipos de costes sanitarios: el coste del tratamiento analizado, el coste inicial del manejo de los distintos eventos (ACR20, ACR50, ACR70, muerte) y el coste de seguimiento de los pacientes supervivientes a los distintos eventos.
El uso de recursos fue obtenido a partir de la opinión de expertos y los costes unitarios españoles provienen de la base de datos del medicamento del consejo general de colegios oficiales de farmacéuticos19 para los fármacos y de la base de datos de costes sanitarios eSalud para el resto20. La estimación de los costes de las segundas líneas (otros FAME, anti-TNF) y de la medicación concomitante proviene de estudios específicos españoles21,22.
Perspectiva, horizonte temporal y descuentoEl análisis está realizado desde la perspectiva del Sistema Nacional de Salud, utilizando el horizonte temporal de 5 años y de toda la vida. Todos los costes se expresan en euros del año 2009 y se ha utilizado una tasa de descuento del 3% tanto para los costes como para los efectos.
Análisis coste-efectividadLos resultados del modelo se expresan mediante la curva de aceptabilidad a pagar, donde se muestra con qué probabilidad se debe escoger Metoject® en detrimento de metotrexato oral según diferentes disponibilidades a pagar teóricas asumibles por un decisor23. De tal forma que cuando se supera el umbral de equiprobabilidad (50%) nos muestra que la alternativa estudiada es más eficiente que la alternativa comparada.
Los datos de mortalidad y de utilidad introducidos en el modelo de Markov se estimaron a partir de estudios internacionales. Debido a la incertidumbre de estos datos, se realizaron varios escenarios que combinaban diferentes utilidades y datos de mortalidad por estado de salud. El escenario base se refiere a valores según el estudio de Welsing et al17 para utilidad y valores del estudio de Kobelt et al24 para mortalidad. La estimación de la calidad de vida para este caso base varía en función de la evolución de la enfermedad utilizando los valores 0,75; 0,71; 0,64 y 0,56 para estados de remisión, leve, moderado y alto respectivamente. Asimismo, los datos de mortalidad también son diferentes en función de estos estados y se considera que el riesgo relativo de 1,00 equivale a la remisión, 1,30 al estado leve, 1,65 al moderado y 2,00 al estado alto24. Las utilidades y la mortalidad empleadas en el caso base corresponden al escenario más conservador para Metoject® al estimarse la calidad de vida para diferentes estados de salud como la mayor observada de los estudios y con la menor mortalidad posible. Por otro lado se construyó el escenario más favorable para Metoject® (aunque el más desfavorable para los pacientes) con los pacientes que progresan en su gravedad y tienen la peor calidad de vida (remisión 0,77; leve 0,68; moderado 0,62 y grave 0,52) posible además de una menor esperanza de vida (riesgo relativo de 1,00 para remisión, 1,46 para leve, 1,92 para moderado y 2,39 para grave)16,24.
Análisis del impacto presupuestarioSe ha desarrollado un análisis del impacto presupuestario potencial de extender el uso de Metoject® sustituyendo en distintas proporciones al tratamiento farmacológico por v.o. Estudiamos un escenario con el uso actual de Metoject® y el coste potencial de su mayor introducción en esta población, utilizando el coste por paciente para cada opción, durante los próximos 5 años. Para proyectar los pacientes susceptibles de ser tratados con metotrexato se ha llevado a cabo una regresión lineal ajustando según los datos históricos25.
Análisis de sensibilidadPara valorar la influencia de la incertidumbre de los parámetros (eficacia, tasa de abandono, costes, etc.) en los resultados del estudio y validar la solidez de los resultados obtenidos, se realizó un análisis de sensibilidad probabilístico mediante una simulación de Monte Carlo de segundo orden, de tal forma que se simuló 1.000 veces el coste-efectividad de cada comparación.
Para llevar a cabo el análisis de sensibilidad se han seleccionado unas distribuciones fijas y se han estimado los parámetros de cada distribución en función de los datos primarios recopilados26.
ResultadosEfectos sobre la salud y los costesEn base a los resultados del estudio de Braun et al10 de 24 semanas de duración se ha concluido que Metoject® controla mejor el progreso de la enfermedad ya que el 41% de los pacientes consiguen alcanzar la remisión (metotrexato oral 33%), el 21% finalizan con un DAS28 leve (metotrexato oral 26%), el 16% con un DAS28 moderado (metotrexato oral 11%) y solo el 22% con un DAS28 alto (metotrexato oral 30%). Se observa que el porcentaje de pacientes en remisión es un 8% mayor en el grupo Metoject® respecto a metotrexato oral y que el porcentaje de pacientes con DAS28 alto es inferior en el grupo Metoject®, lo cual indica una mejora global del estado de salud de los pacientes.
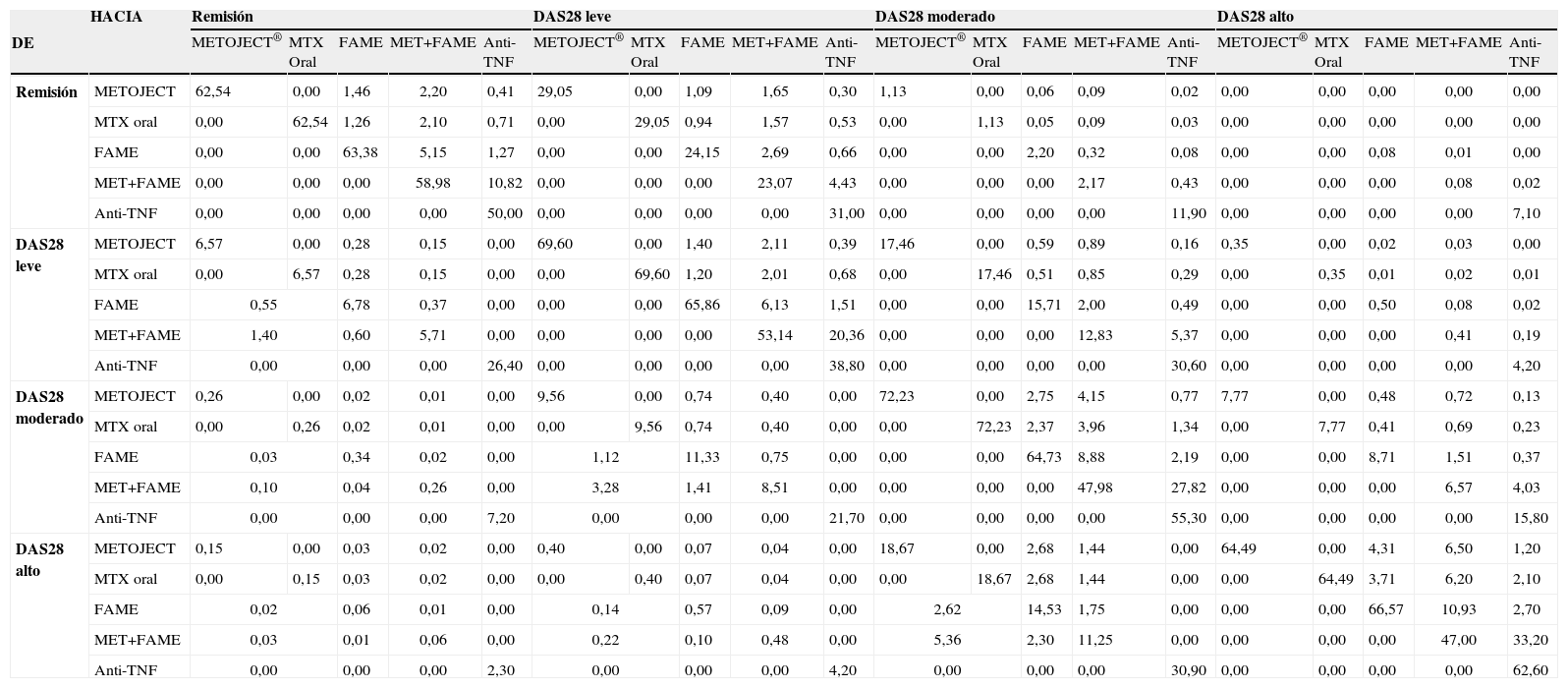
Los datos del pronóstico de los pacientes a largo plazo en cada opción terapéutica se han tomado de análisis de coste-efectividad previos12,17 y denotan que la mayoría de los pacientes se mantienen en su estado de salud (tabla 1). Asimismo, por lo que respecta a las actitudes terapéuticas en caso de progreso de la enfermedad se observa que entre el 84–95% de los pacientes mantienen el tratamiento. Así la mayoría de veces que se opta por el cambio de tratamiento se añade otro FAME y en pocos casos (entre el 10–20%) se elige añadir un anti-TNF. Por otro lado, en el caso de mejorar la progresión de la enfermedad se observa que tanto en la práctica clínica como en los estudios internacionales, se realizan cambios de tratamiento aunque en baja frecuencia (entre el 5–23% para metotrexato, entre el 9–35% para FAME y entre el 16–41% en la combinación de metotrexato más FAME). Cuando se lleva a cabo este cambio se puede observar que normalmente se basa en la sustitución por metotrexato u otro FAME.
Probabilidades de transición del modelo de Markov
| HACIA | Remisión | DAS28 leve | DAS28 moderado | DAS28 alto | |||||||||||||||||
| DE | METOJECT® | MTX Oral | FAME | MET+FAME | Anti-TNF | METOJECT® | MTX Oral | FAME | MET+FAME | Anti-TNF | METOJECT® | MTX Oral | FAME | MET+FAME | Anti-TNF | METOJECT® | MTX Oral | FAME | MET+FAME | Anti-TNF | |
| Remisión | METOJECT | 62,54 | 0,00 | 1,46 | 2,20 | 0,41 | 29,05 | 0,00 | 1,09 | 1,65 | 0,30 | 1,13 | 0,00 | 0,06 | 0,09 | 0,02 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 |
| MTX oral | 0,00 | 62,54 | 1,26 | 2,10 | 0,71 | 0,00 | 29,05 | 0,94 | 1,57 | 0,53 | 0,00 | 1,13 | 0,05 | 0,09 | 0,03 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | |
| FAME | 0,00 | 0,00 | 63,38 | 5,15 | 1,27 | 0,00 | 0,00 | 24,15 | 2,69 | 0,66 | 0,00 | 0,00 | 2,20 | 0,32 | 0,08 | 0,00 | 0,00 | 0,08 | 0,01 | 0,00 | |
| MET+FAME | 0,00 | 0,00 | 0,00 | 58,98 | 10,82 | 0,00 | 0,00 | 0,00 | 23,07 | 4,43 | 0,00 | 0,00 | 0,00 | 2,17 | 0,43 | 0,00 | 0,00 | 0,00 | 0,08 | 0,02 | |
| Anti-TNF | 0,00 | 0,00 | 0,00 | 0,00 | 50,00 | 0,00 | 0,00 | 0,00 | 0,00 | 31,00 | 0,00 | 0,00 | 0,00 | 0,00 | 11,90 | 0,00 | 0,00 | 0,00 | 0,00 | 7,10 | |
| DAS28 leve | METOJECT | 6,57 | 0,00 | 0,28 | 0,15 | 0,00 | 69,60 | 0,00 | 1,40 | 2,11 | 0,39 | 17,46 | 0,00 | 0,59 | 0,89 | 0,16 | 0,35 | 0,00 | 0,02 | 0,03 | 0,00 |
| MTX oral | 0,00 | 6,57 | 0,28 | 0,15 | 0,00 | 0,00 | 69,60 | 1,20 | 2,01 | 0,68 | 0,00 | 17,46 | 0,51 | 0,85 | 0,29 | 0,00 | 0,35 | 0,01 | 0,02 | 0,01 | |
| FAME | 0,55 | 6,78 | 0,37 | 0,00 | 0,00 | 0,00 | 65,86 | 6,13 | 1,51 | 0,00 | 0,00 | 15,71 | 2,00 | 0,49 | 0,00 | 0,00 | 0,50 | 0,08 | 0,02 | ||
| MET+FAME | 1,40 | 0,60 | 5,71 | 0,00 | 0,00 | 0,00 | 0,00 | 53,14 | 20,36 | 0,00 | 0,00 | 0,00 | 12,83 | 5,37 | 0,00 | 0,00 | 0,00 | 0,41 | 0,19 | ||
| Anti-TNF | 0,00 | 0,00 | 0,00 | 26,40 | 0,00 | 0,00 | 0,00 | 0,00 | 38,80 | 0,00 | 0,00 | 0,00 | 0,00 | 30,60 | 0,00 | 0,00 | 0,00 | 0,00 | 4,20 | ||
| DAS28 moderado | METOJECT | 0,26 | 0,00 | 0,02 | 0,01 | 0,00 | 9,56 | 0,00 | 0,74 | 0,40 | 0,00 | 72,23 | 0,00 | 2,75 | 4,15 | 0,77 | 7,77 | 0,00 | 0,48 | 0,72 | 0,13 |
| MTX oral | 0,00 | 0,26 | 0,02 | 0,01 | 0,00 | 0,00 | 9,56 | 0,74 | 0,40 | 0,00 | 0,00 | 72,23 | 2,37 | 3,96 | 1,34 | 0,00 | 7,77 | 0,41 | 0,69 | 0,23 | |
| FAME | 0,03 | 0,34 | 0,02 | 0,00 | 1,12 | 11,33 | 0,75 | 0,00 | 0,00 | 0,00 | 64,73 | 8,88 | 2,19 | 0,00 | 0,00 | 8,71 | 1,51 | 0,37 | |||
| MET+FAME | 0,10 | 0,04 | 0,26 | 0,00 | 3,28 | 1,41 | 8,51 | 0,00 | 0,00 | 0,00 | 0,00 | 47,98 | 27,82 | 0,00 | 0,00 | 0,00 | 6,57 | 4,03 | |||
| Anti-TNF | 0,00 | 0,00 | 0,00 | 7,20 | 0,00 | 0,00 | 0,00 | 21,70 | 0,00 | 0,00 | 0,00 | 0,00 | 55,30 | 0,00 | 0,00 | 0,00 | 0,00 | 15,80 | |||
| DAS28 alto | METOJECT | 0,15 | 0,00 | 0,03 | 0,02 | 0,00 | 0,40 | 0,00 | 0,07 | 0,04 | 0,00 | 18,67 | 0,00 | 2,68 | 1,44 | 0,00 | 64,49 | 0,00 | 4,31 | 6,50 | 1,20 |
| MTX oral | 0,00 | 0,15 | 0,03 | 0,02 | 0,00 | 0,00 | 0,40 | 0,07 | 0,04 | 0,00 | 0,00 | 18,67 | 2,68 | 1,44 | 0,00 | 0,00 | 64,49 | 3,71 | 6,20 | 2,10 | |
| FAME | 0,02 | 0,06 | 0,01 | 0,00 | 0,14 | 0,57 | 0,09 | 0,00 | 2,62 | 14,53 | 1,75 | 0,00 | 0,00 | 0,00 | 66,57 | 10,93 | 2,70 | ||||
| MET+FAME | 0,03 | 0,01 | 0,06 | 0,00 | 0,22 | 0,10 | 0,48 | 0,00 | 5,36 | 2,30 | 11,25 | 0,00 | 0,00 | 0,00 | 0,00 | 47,00 | 33,20 | ||||
| Anti-TNF | 0,00 | 0,00 | 0,00 | 2,30 | 0,00 | 0,00 | 0,00 | 4,20 | 0,00 | 0,00 | 0,00 | 30,90 | 0,00 | 0,00 | 0,00 | 0,00 | 62,60 | ||||
DAS 28: disease Activity Score; FAME: fármacos antirreumáticos modificadores de la enfermedad; MTX: metotrexato.
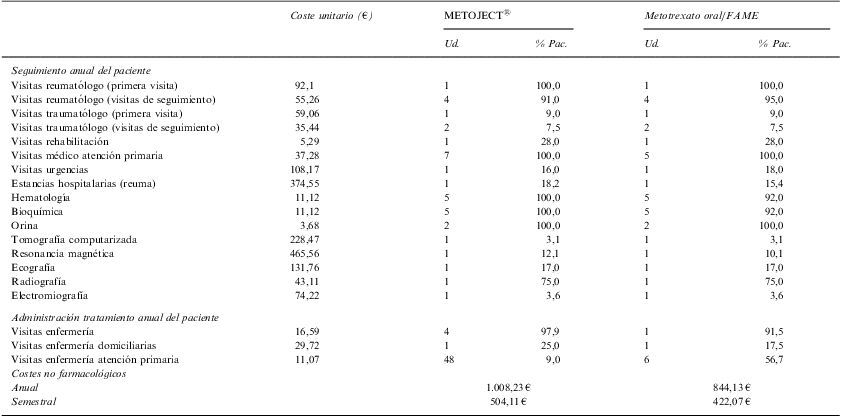
Con respecto a los costes principales, se observó que el uso de recursos de Metoject® es similar al de metotrexato oral y, por tanto, los costes directos semestrales no farmacológicos solo se incrementaban en 82€ para el grupo de Metoject® (tablas 2 y 3).
Uso de recursos y coste en el manejo de los pacientes con AR
| Coste unitario (€) | METOJECT® | Metotrexato oral/FAME | |||
| Ud. | % Pac. | Ud. | % Pac. | ||
| Seguimiento anual del paciente | |||||
| Visitas reumatólogo (primera visita) | 92,1 | 1 | 100,0 | 1 | 100,0 |
| Visitas reumatólogo (visitas de seguimiento) | 55,26 | 4 | 91,0 | 4 | 95,0 |
| Visitas traumatólogo (primera visita) | 59,06 | 1 | 9,0 | 1 | 9,0 |
| Visitas traumatólogo (visitas de seguimiento) | 35,44 | 2 | 7,5 | 2 | 7,5 |
| Visitas rehabilitación | 5,29 | 1 | 28,0 | 1 | 28,0 |
| Visitas médico atención primaria | 37,28 | 7 | 100,0 | 5 | 100,0 |
| Visitas urgencias | 108,17 | 1 | 16,0 | 1 | 18,0 |
| Estancias hospitalarias (reuma) | 374,55 | 1 | 18,2 | 1 | 15,4 |
| Hematología | 11,12 | 5 | 100,0 | 5 | 92,0 |
| Bioquímica | 11,12 | 5 | 100,0 | 5 | 92,0 |
| Orina | 3,68 | 2 | 100,0 | 2 | 100,0 |
| Tomografía computarizada | 228,47 | 1 | 3,1 | 1 | 3,1 |
| Resonancia magnética | 465,56 | 1 | 12,1 | 1 | 10,1 |
| Ecografía | 131,76 | 1 | 17,0 | 1 | 17,0 |
| Radiografía | 43,11 | 1 | 75,0 | 1 | 75,0 |
| Electromiografía | 74,22 | 1 | 3,6 | 1 | 3,6 |
| Administración tratamiento anual del paciente | |||||
| Visitas enfermería | 16,59 | 4 | 97,9 | 1 | 91,5 |
| Visitas enfermería domiciliarias | 29,72 | 1 | 25,0 | 1 | 17,5 |
| Visitas enfermería atención primaria | 11,07 | 48 | 9,0 | 6 | 56,7 |
| Costes no farmacológicos | |||||
| Anual | 1.008,23€ | 844,13€ | |||
| Semestral | 504,11€ | 422,07€ | |||
FAME: fármaco modificador de enfermedad; Ud: unidades; % Pac: porcentaje de pacientes.
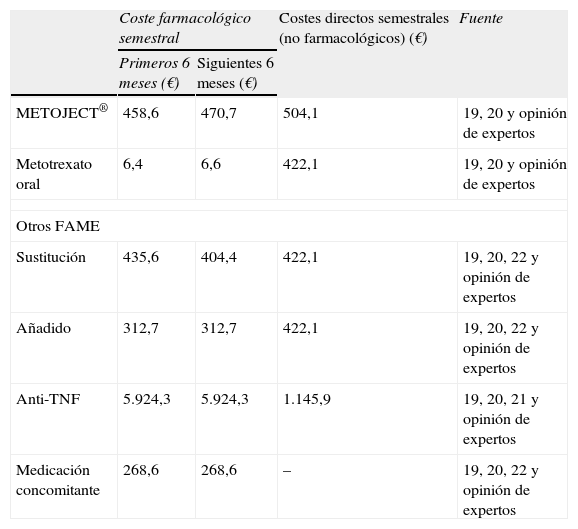
Costes sanitarios directos
| Coste farmacológico semestral | Costes directos semestrales (no farmacológicos) (€) | Fuente | ||
| Primeros 6 meses (€) | Siguientes 6 meses (€) | |||
| METOJECT® | 458,6 | 470,7 | 504,1 | 19, 20 y opinión de expertos |
| Metotrexato oral | 6,4 | 6,6 | 422,1 | 19, 20 y opinión de expertos |
| Otros FAME | ||||
| Sustitución | 435,6 | 404,4 | 422,1 | 19, 20, 22 y opinión de expertos |
| Añadido | 312,7 | 312,7 | 422,1 | 19, 20, 22 y opinión de expertos |
| Anti-TNF | 5.924,3 | 5.924,3 | 1.145,9 | 19, 20, 21 y opinión de expertos |
| Medicación concomitante | 268,6 | 268,6 | – | 19, 20, 22 y opinión de expertos |
FAME: fármaco modificador de enfermedad.
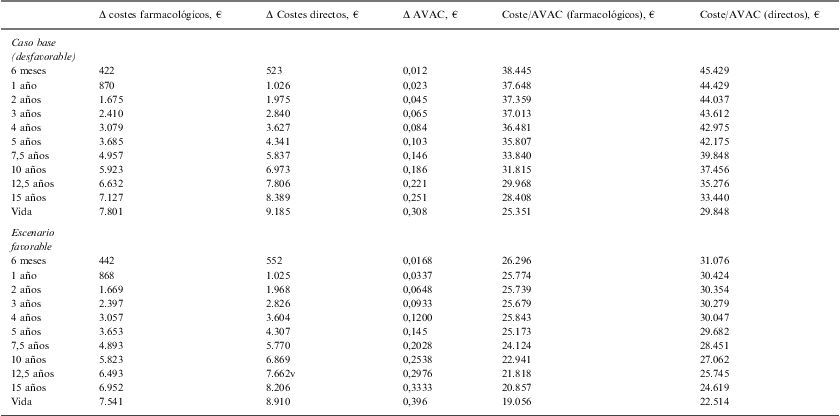
Metoject® aporta al paciente una ganancia de alrededor de 0,103–0,145 AVAC a los 5 años, llegando a suponer en toda la vida aproximadamente entre 0,308–0,396 AVAC.
La razón de coste (solo costes farmacológicos) por años de vida ajustados por calidad (AVAC) ganado con Metoject® frente a metotrexato oral fue de entre 25.173–35.807€ a los 5 años y de 19.056–25.351€ para el horizonte temporal de toda la vida, valor por debajo del umbral asumido en España (tabla 4)23. Al tener en cuenta todos los costes directos que intervienen en el tratamiento de la AR, se observó que el coste-efectividad de Metoject® frente a metotrexato oral a los 5 años fue de 29.682–42.175€/AVAC ganado y para toda la vida fue de 22.514–29.848€/AVAC ganado (tabla 4).
Coste adicional de METOJECT® por AVAC ganado en los diferentes escenarios en su comparación con metotrexato oral
| Δ costes farmacológicos, € | Δ Costes directos, € | Δ AVAC, € | Coste/AVAC (farmacológicos), € | Coste/AVAC (directos), € | |
| Caso base (desfavorable) | |||||
| 6 meses | 422 | 523 | 0,012 | 38.445 | 45.429 |
| 1 año | 870 | 1.026 | 0,023 | 37.648 | 44.429 |
| 2 años | 1.675 | 1.975 | 0,045 | 37.359 | 44.037 |
| 3 años | 2.410 | 2.840 | 0,065 | 37.013 | 43.612 |
| 4 años | 3.079 | 3.627 | 0,084 | 36.481 | 42.975 |
| 5 años | 3.685 | 4.341 | 0,103 | 35.807 | 42.175 |
| 7,5 años | 4.957 | 5.837 | 0,146 | 33.840 | 39.848 |
| 10 años | 5.923 | 6.973 | 0,186 | 31.815 | 37.456 |
| 12,5 años | 6.632 | 7.806 | 0,221 | 29.968 | 35.276 |
| 15 años | 7.127 | 8.389 | 0,251 | 28.408 | 33.440 |
| Vida | 7.801 | 9.185 | 0,308 | 25.351 | 29.848 |
| Escenario favorable | |||||
| 6 meses | 442 | 552 | 0,0168 | 26.296 | 31.076 |
| 1 año | 868 | 1.025 | 0,0337 | 25.774 | 30.424 |
| 2 años | 1.669 | 1.968 | 0,0648 | 25.739 | 30.354 |
| 3 años | 2.397 | 2.826 | 0,0933 | 25.679 | 30.279 |
| 4 años | 3.057 | 3.604 | 0,1200 | 25.843 | 30.047 |
| 5 años | 3.653 | 4.307 | 0,145 | 25.173 | 29.682 |
| 7,5 años | 4.893 | 5.770 | 0,2028 | 24.124 | 28.451 |
| 10 años | 5.823 | 6.869 | 0,2538 | 22.941 | 27.062 |
| 12,5 años | 6.493 | 7.662 | 0,2976 | 21.818 | 25.745 |
| 15 años | 6.952 | 8.206 | 0,3333 | 20.857 | 24.619 |
| Vida | 7.541 | 8.910 | 0,396 | 19.056 | 22.514 |
AVAC: años de vida ajustados por calidad; Δ: incremento.
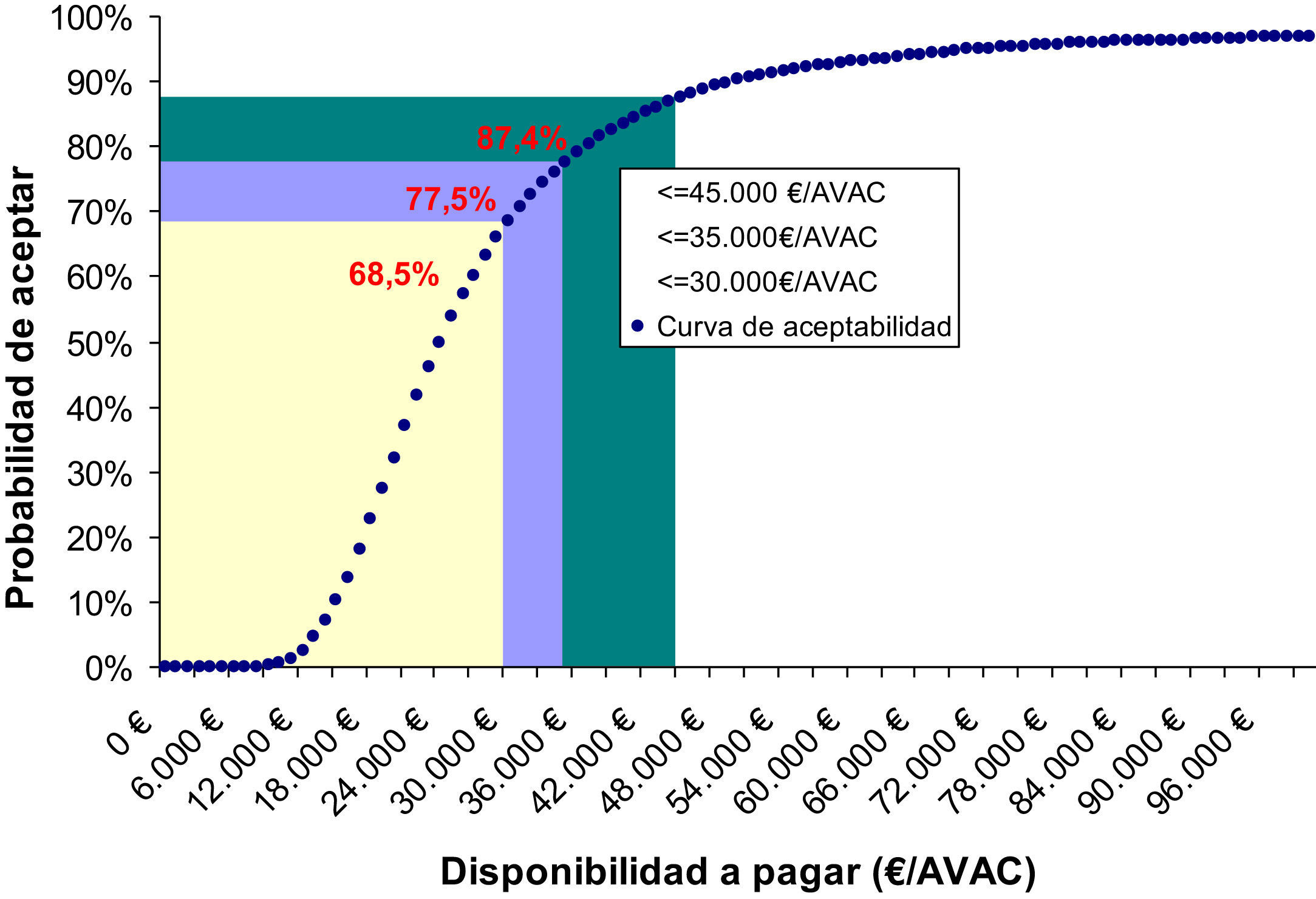
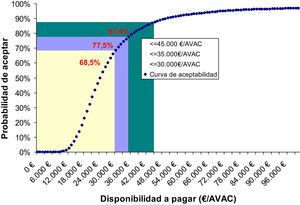
El análisis de sensibilidad mostró que el 68, 77 y 87% de los casos tratados con Metoject® están por debajo de los umbrales de coste-efectividad de 30.000, 35.000 y 45.000€/AVAC ganado, respectivamente. Así, la figura 2 demuestra que Metoject® es un medicamento eficiente cuando se supera el umbral de equiprobabilidad de 24.000€ por AVAC ganado.
Asimismo, la simulación mostró que el coste por AVAC mediano ronda los 23.836€/AVAC, con un rango intercuartílico de 14.627€/AVAC, valores que incluye tanto el escenario más desfavorable (caso base) y favorable (tabla 4 y fig. 2).
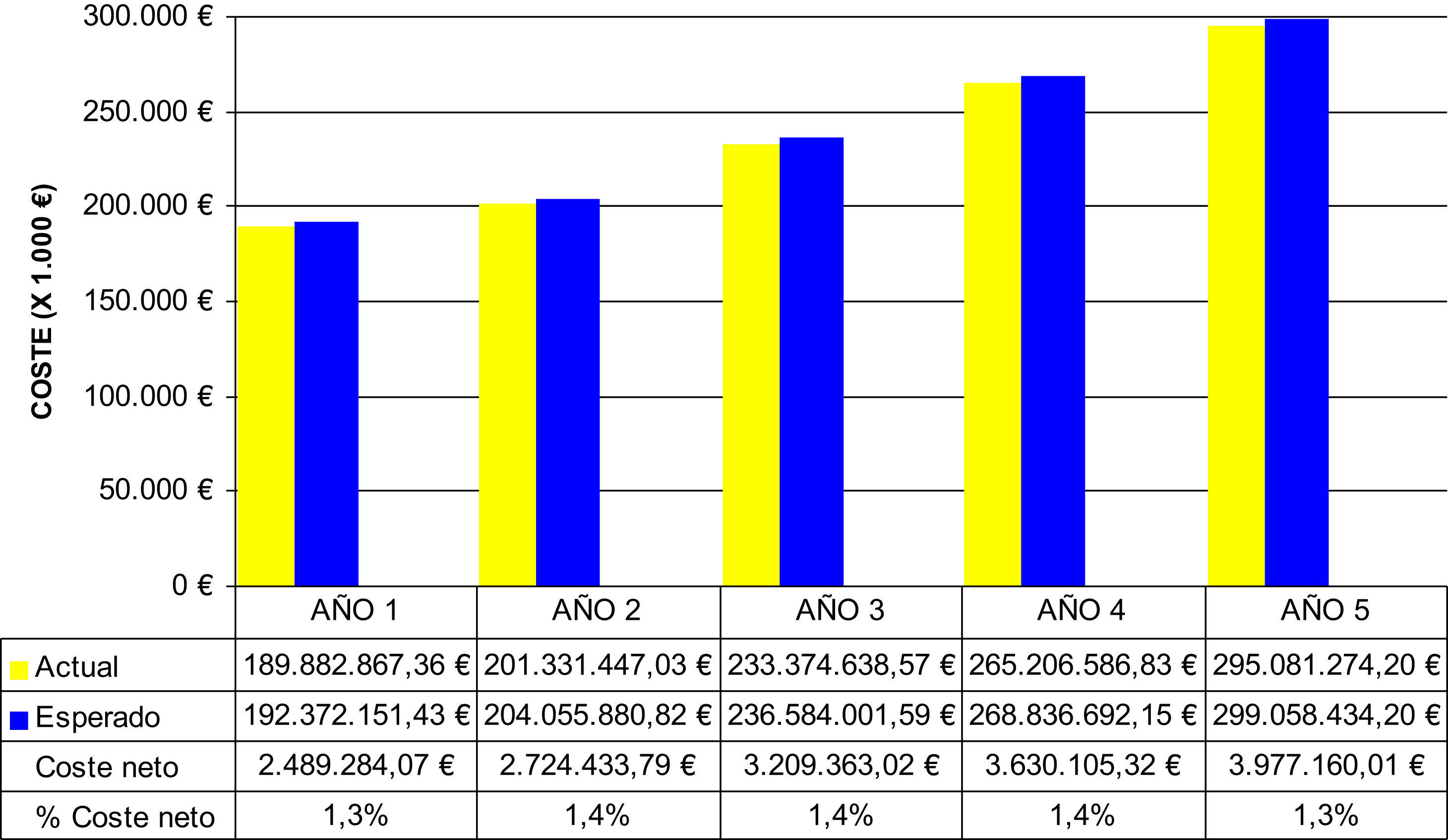
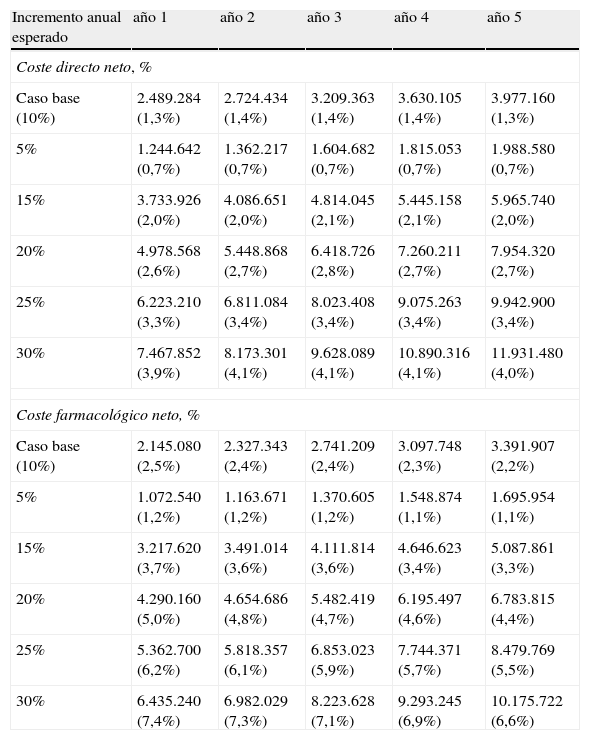
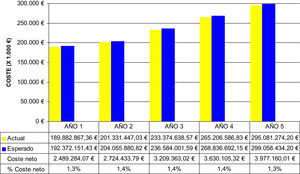
Análisis del impacto presupuestarioEn términos de impacto presupuestario la población tributaria de metotrexato es de entre 120.000–160.000 pacientes el primer y quinto año, respectivamente, con un 20–24% de pacientes en tratamiento con Metoject® (tabla 5). De tal forma que si se asume un incremento del uso de Metoject® del 10% anual respecto al escenario actual entonces los costes directos asociados a la intervención ascienden a 2,5–4 millones€. Como puede apreciarse en la figura 3, la repercusión presupuestaria de incrementar la introducción de Metoject® sobre el gasto sanitario de la población diana estimada supone un incremento del 1,4% del coste de la patología.
Análisis de sensibilidad del impacto presupuestario neto variando el número de paciente esperados con METOJECT®
| Incremento anual esperado | año 1 | año 2 | año 3 | año 4 | año 5 |
| Coste directo neto, % | |||||
| Caso base (10%) | 2.489.284 (1,3%) | 2.724.434 (1,4%) | 3.209.363 (1,4%) | 3.630.105 (1,4%) | 3.977.160 (1,3%) |
| 5% | 1.244.642 (0,7%) | 1.362.217 (0,7%) | 1.604.682 (0,7%) | 1.815.053 (0,7%) | 1.988.580 (0,7%) |
| 15% | 3.733.926 (2,0%) | 4.086.651 (2,0%) | 4.814.045 (2,1%) | 5.445.158 (2,1%) | 5.965.740 (2,0%) |
| 20% | 4.978.568 (2,6%) | 5.448.868 (2,7%) | 6.418.726 (2,8%) | 7.260.211 (2,7%) | 7.954.320 (2,7%) |
| 25% | 6.223.210 (3,3%) | 6.811.084 (3,4%) | 8.023.408 (3,4%) | 9.075.263 (3,4%) | 9.942.900 (3,4%) |
| 30% | 7.467.852 (3,9%) | 8.173.301 (4,1%) | 9.628.089 (4,1%) | 10.890.316 (4,1%) | 11.931.480 (4,0%) |
| Coste farmacológico neto, % | |||||
| Caso base (10%) | 2.145.080 (2,5%) | 2.327.343 (2,4%) | 2.741.209 (2,4%) | 3.097.748 (2,3%) | 3.391.907 (2,2%) |
| 5% | 1.072.540 (1,2%) | 1.163.671 (1,2%) | 1.370.605 (1,2%) | 1.548.874 (1,1%) | 1.695.954 (1,1%) |
| 15% | 3.217.620 (3,7%) | 3.491.014 (3,6%) | 4.111.814 (3,6%) | 4.646.623 (3,4%) | 5.087.861 (3,3%) |
| 20% | 4.290.160 (5,0%) | 4.654.686 (4,8%) | 5.482.419 (4,7%) | 6.195.497 (4,6%) | 6.783.815 (4,4%) |
| 25% | 5.362.700 (6,2%) | 5.818.357 (6,1%) | 6.853.023 (5,9%) | 7.744.371 (5,7%) | 8.479.769 (5,5%) |
| 30% | 6.435.240 (7,4%) | 6.982.029 (7,3%) | 8.223.628 (7,1%) | 9.293.245 (6,9%) | 10.175.722 (6,6%) |
El análisis de sensibilidad del impacto presupuestario nos muestra que el incremento anual del uso de Metoject entre un 10–30% provocaría como máximo un coste directo neto del 4,1% del presupuesto (tabla 5). Asimismo, cuando se estudia solo el impacto farmacológico de la mayor introducción de Metoject® se observa que el coste asciende al 2,2–2,5% en el caso base y alcanza el 6,6–7,4% al asumir un incremento del 30% (tabla 5).
DiscusiónHasta la actualidad los datos existentes de eficacia comparativa no permitían concluir que el metotrexato por vía parenteral fuese mayor que el metotrexato por v.o., si bien la eficacia del fármaco está más que probada y es respaldada por las sociedades médicas internacionales, entre ellas la Sociedad Española de Reumatología27. Con la aparición del estudio de Braun et al10, se constata con un mayor grado de evidencia que la eficacia del metotrexato administrado por vía subcutánea, como Metoject®, es mayor que la eficacia del mismo fármaco administrado por v.o. debido a la superior biodisponibilidad en la administración parenteral. Esta mejora de la biodisponibilidad junto a la ya demostrada necesidad del tratamiento precoz de la AR con FAME28,29 ofrece, tal como se muestra en nuestro estudio, mayores posibilidades de modificar el curso de la enfermedad. Asimismo, se observa que el uso precoz de Metoject® aporta al paciente una ganancia de alrededor de 0,103–0,145 AVAC a los 5 años, llegando a suponer en toda la vida aproximadamente entre 0,308–0,396 AVAC.
Aparte de valorar en la práctica clínica española los efectos de la mayor eficacia de Metoject® a lo largo de la vida del paciente, nuestro estudio sugiere que los costes adicionales de Metoject® respecto a metotrexato oral se ven compensados por su mejor efectividad, expresada en términos de AVAC. Hasta el momento, la información sobre el coste-efectividad del metotrexato en el tratamiento de la AR atendiendo a su vía de administración no había sido estudiada en profundidad debido a la carencia de ensayos clínicos que comparasen la eficacia del fármaco según su administración subcutánea u oral, aunque hubiese sido posible llevar a cabo estudios de minimización de costes. Nuestra investigación es, en definitiva, un nuevo punto de partida para posibles estudios de evaluación económica que pueden permitir validar externamente que el uso de Metoject® en pacientes con AR es una terapia eficiente y por tanto, de elección ante la disyuntiva de qué vía de administración utilizar.
El análisis del impacto presupuestario es una técnica utilizada para estimar cuantitativamente la alteración prevista en el gasto sanitario para la atención de una patología con la mayor introducción de una nueva intervención sanitaria para su tratamiento30. En el caso de la mayor introducción de Metoject® en el Sistema Nacional de Salud, el impacto se deberá esencialmente a la disminución del gasto por la progresión de la enfermedad evitada y el coste diferencial del nuevo tratamiento.
Cabe destacar que la perspectiva adoptada en el estudio es la del Sistema Nacional de Salud y por tanto, hemos excluido otros costes que serían considerados importantes desde un punto vista social, por ejemplo, los costes asociados a la pérdida de horas laborales o el coste de la ayuda de los familiares. Es conocido que la mayoría de los costes de la AR son indirectos, ya que aproximadamente duplican a los costes directos31 y que el tratamiento eficaz de una persona a la que se le ha diagnosticado una AR también puede reducir la carga que soporta la persona y la sociedad.
Una de las principales limitaciones del estudio deriva de la utilización de datos de diferentes procedencias respecto a costes a corto y largo plazo, pronóstico a largo plazo, parámetros de eficacia, calidad de vida, mortalidad y utilidades ya que no existen datos españoles que pudiesen reflejar los valores para todos los estados de salud necesarios. Esta disparidad de estudios usados para establecer el modelo, al no disponer de datos comparativos a medio/largo plazo pueden estar influenciando los resultados debido a que la práctica clínica de nuestro ámbito puede no ser la misma práctica clínica derivada de los estudios de los cuales hemos asumido los valores, aunque en todo momento fue validada por el panel de expertos. Asimismo, cabe mencionar que la opción de inicio de tratamiento con metrotexato oral en nuestro modelo puede no corresponderse con la práctica clínica habitual, en la que pacientes en que este tratamiento no es eficaz son cambiados a la forma SC. Sin embargo, dado que no existen evidencias de una mayor eficacia del tratamiento SC más allá del periodo inicial que se observó en el estudio de Braun, la consideración de este cambio de oral a SC no se ha podido incluir en el modelo.
Además, se tiene que tener en cuenta en la valoración de estos resultados la limitación por tratarse de un modelo teórico basado en resultados de ensayos clínicos, sobre todo del estudio de Braun et al10 que podría estar sobreestimando los beneficios del metotrexato inyectable comparado con estudios de un solo brazo. Hay que tener en cuenta que Braun et al10 demuestran que metotrexato subcutáneo es posiblemente más eficaz que metotrexato oral a dosis de 15mg semanales. Ello puede observarse en ACR20 y 70 pero no en ACR50. Por lo tanto, nuestro estudio teórico se basa en datos comparativos solo a corto plazo (6 meses) y límite de dosis razonable ,sin embargo, de 15mg semanales. Por otro lado, en la misma línea que el estudio de Braun, 2 estudios recientes observacionales prospectivos llevados a cabo en Reino Unido han demostrado de nuevo que metotrexato subcutáneo es más eficaz que metotrexato oral y que se tolera bien en los pacientes con AR, incluso en los casos en los que la enfermedad es más crónica32,33.
Por último, aunque el coste por AVAC ganado del estudio cae dentro del límite arbitrariamente aceptado en países occidentales, está bastante próximo al margen superior aceptado para el mismo. Sería pues deseable disponer de nuevos estudios comparativos directos en la práctica clínica que permitiesen un mejor ajuste de las valoraciones tanto de la efectividad como de los costes.
De nuestra investigación se desprende que el estudio de la AR debe continuar intentando abordar aspectos no contemplados, como el cumplimiento terapéutico o la satisfacción de los pacientes, o sobre cómo reducir la incertidumbre respecto a la efectividad a largo plazo y a los costes (directos/indirectos) asociados a la AR a nivel nacional. Por otro lado, aunque existen algunos estudios donde se ha evaluado la calidad de vida de los pacientes con AR en España34 aún son necesarios estudios de calidad de vida con mayor número de pacientes que estudien en profundidad los estados de salud y con medidas equivalentes a las preferencias de los mismos como es el caso del EuroQol-5D.
En conclusión, aunque se precisan más datos a medio largo plazo para confirmar nuestros resultados, nuestro estudio sugiere que los costes adicionales de Metoject® respecto a metotrexato oral se verían compensados por su mejora en efectividad, revelando que Metoject® podría ser un tratamiento costeefectivo para el sistema sanitario español según el umbral asumido, con un impacto relativo al gasto generado actualmente por estos pacientes muy limitado.
FinanciaciónEl estudio fue financiado por Gebro Pharma, pero la empresa no participó en la recogida de datos, en la interpretación de ellos ni en la decisión de publicar.
Conflicto de interesesJordi Galván trabaja en Gebro Pharma que es la empresa promotora del estudio. Max Brosa y Carlos Crespo trabajan para la consultora Oblikue Consulting que recibió honorarios de la empresa promotora del estudio en concepto de ayuda a la investigación.