Analizar la eficacia, adherencia, satisfacción del paciente, seguridad, farmacodinámica y costo-efectividad del metotrexato (MTX) parenteral en pacientes con enfermedades reumáticas.
MétodosSe llevó a cabo una revisión sistemática basada en una estrategia de búsqueda en Medline, Embase y Cochrane Library (inicio-06/2019). Se identificaron estudios que incluyeran pacientes adultos con enfermedades reumáticas en tratamiento con MTX parenteral y que analizaran datos de eficacia, adherencia, satisfacción, seguridad, farmacocinética o costo-efectividad. En cuanto a los diseños se permitieron revisiones sistemáticas, ensayos clínicos o estudios observacionales, incluyendo transversales y estudios con muestras pequeñas si eran estudios de farmacocinética.
ResultadosDe 4.160 artículos identificados, se incluyeron finalmente 80. El MTX parenteral parece útil de manera general y en especial en aquellos pacientes con respuesta insuficiente a MTX oral. La vía parenteral no parece aumentar la tasa ni la gravedad de los eventos adversos con respecto a la oral y podría reducir costes en aquellos pacientes con respuesta inadecuada a MTX oral. La adherencia y satisfacción se ven favorecidas por programas de entrenamiento en la vía parenteral. Los resultados en enfermedades reumáticas distintas a la artritis reumatoide (AR) son muy escasos y no permiten obtener datos concluyentes.
ConclusionesEl MTX por vía parenteral podría ser una alternativa al uso de MTX oral, por su perfil de eficacia, seguridad, adherencia, satisfacción y resultados fármaco-económicos, especialmente en pacientes con AR.
To analyse the efficacy, adherence, patient satisfaction, safety, pharmacodynamics and cost-effectiveness of parenteral methotrexate (MTX) in patients with rheumatic diseases.
MethodsA systematic review of literature was carried out in Medline, Embase and Cochrane Central from the beginning until June 2019. Studies including adult patients with rheumatic diseases being treated with parenteral MTX were identified and data on efficacy, adherence, satisfaction, safety, pharmacokinetics, and cost-effectiveness analysed. As for the designs, systematic reviews, clinical trials, or observational studies were permitted, including cross-sectional and small-sample studies if they were pharmacokinetic studies.
ResultsOut of 4160 identified articles, 80 articles were finally included. The efficacy profile of parenteral MTX seems useful in general and in those patients with insufficient response to oral MTX. The parenteral route does not seem to increase the rate or severity of adverse events due to the use of MTX. The use of parenteral MTX is an appropriate way to reduce costs in patients with inadequate response to oral MTX. Adherence and satisfaction are favoured by training programmes in the use of the parenteral route. The results in rheumatic diseases other than rheumatoid arthritis (RA) are very scarce and do not enable obtaining conclusive data.
ConclusionsParenteral MTX can be an alternative to the use of oral MTX, due to its profile of efficacy, safety, adherence and pharmacoeconomic results, especially in those patients with RA.
En la actualidad, el metotrexato (MTX) es el fármaco antirreumático modificador de la enfermedad (FAME) más utilizado en reumatología por su efectividad para el control sintomático, el retraso en el daño articular, su bajo coste y su buen perfil de seguridad.
El MTX es un análogo estructural del ácido fólico que actúa inhibiendo competitivamente la enzima dihidrofolato reductasa (DHFR), la cual participa en la formación del ácido folínico, que es necesario para la formación del nucleósido timidina, requerido para la síntesis de ADN, ARN, timidilatos y proteínas1. Teniendo en cuenta esto, cabe esperar que se distribuya fundamentalmente en órganos con altos niveles de DHFR (pulmón, hígado, riñón y tubo digestivo) y con alto recambio celular (piel, células germinales y tumorales), de lo que derivan sus indicaciones y sus principales efectos secundarios. El MTX actúa inhibiendo parcialmente el sistema inmunitario y reduciendo la inflamación articular autoinmunitaria a largo plazo2.
A pesar de que su perfil de seguridad está bien establecido y es favorable, un número elevado de pacientes pueden presentar intolerancia gastrointestinal, especialmente al aumentar su dosis, lo que puede limitar la eficacia e incluso su uso3. Existe, además, una falta de adherencia variable a MTX, probablemente multifactorial (acontecimientos adversos, falta de adherencia a medicaciones crónicas, etc.) que en algunos estudios puede llegar hasta el 30-40% de los pacientes4,5.
La administración parenteral de MTX puede ser una alternativa útil en muchos de estos pacientes. El objetivo de esta revisión sistemática es establecer, en base a la mejor evidencia disponible, el perfil de uso, adherencia, seguridad, satisfacción, farmacocinética y análisis fármaco-económico del MTX parenteral en pacientes con enfermedades reumáticas.
Material y métodosSe llevó a cabo una revisión sistemática. Para ello se seleccionaron estudios que incluyesen 1) pacientes adultos con enfermedades reumáticas, 2) en tratamiento con MTX parenteral, independientemente de la vía de administración, y que 3) analizaran datos de eficacia, seguridad, adherencia, satisfacción, farmacocinética o costo-efectividad. En cuanto a los diseños, se aceptaron estudios con los siguientes diseños: revisiones sistemáticas, ensayos clínicos o estudios observacionales con muestras pequeñas siempre que fuesen de farmacocinética. Se excluyeron estudios en animales y de ciencia básica.
Estrategia de búsquedaLas estrategias de búsqueda fueron generadas por una experta documentalista (MPR) con términos MeSH y texto libre en las siguientes bases de datos bibliográficas: Medline (vía OVID), Embase y Cochrane Library, todas ellas desde su inicio hasta junio de 2019. Como límites se utilizaron artículos en humanos y en inglés o español. Posteriormente, se realizó una búsqueda manual secundaria de la bibliografía de los artículos finalmente incluidos.
El anexo 1 muestra la estrategia de búsqueda en Medline. Sobre esta, se generaron las de Embase y Cochrane. Todas las citas resultantes de las búsquedas se introdujeron en bibliotecas de EndNote® para facilitar su gestión.
Selección de artículos, recogida de datos y evaluación de sesgosDos revisoras, reumatólogas y con amplia experiencia en revisiones sistemáticas (TO, EL), cribaron de forma independiente los artículos resultantes de la estrategia de búsqueda en las diferentes bases de datos bibliográficas. En caso de discrepancia, se recurrió a una tercera investigadora (LC). El resultado de la búsqueda primeramente se depuró por título y abstract o por artículo completo en caso de que no tuviera resumen, mediante sesiones de 60min de duración máxima. Tras este proceso, se recuperó el texto completo de los artículos seleccionados y se analizaron en detalle. Los artículos recuperados se clasificaron en función de los temas de interés que cubrían (eficacia, seguridad, adherencia, satisfacción, etc.) y se recogió la información directamente en tablas preparadas al efecto. Para realizar de manera homogénea una evaluación de los estudios se utilizaron las guías del centro Oxford para Medicina Basada en la Evidencia, asignándose un nivel de evidencia a cada estudio en función de la pregunta que contestaba6.
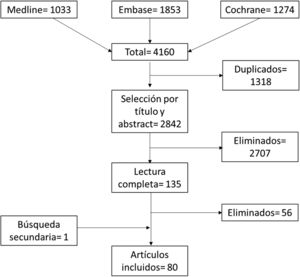
ResultadosLa figura 1 muestra el diagrama de flujo del proceso de selección de los artículos. De los 4.160 inicialmente capturados por las búsquedas, y tras eliminación de duplicados y selección por título y abstract y lectura completa, se incluyeron 80 artículos (los artículos con lectura completa y excluidos se pueden consultar en el anexo 1). De estos artículos, 72 incluían pacientes con artritis reumatoide (AR), 6 con espondiloartritis (EspA), 3 con enfermedades autoinmunes sistémicas y uno de enfermedad por depósito de pirofosfato.
En la tabla 1 se presentan los datos descriptivos de los artículos incluidos y en la tabla 2 se detallan sus resultados, en función de los temas de interés. A continuación, se presenta la síntesis por preguntas y enfermedades reumáticas.
Tabla de evidencia
| # | Estudio | Duración | Población | Vía | Comparación(Antes --> después) | Dosis media (mg/s) | Ác. fólico | Otros tto | Variables respuesta | Calidad |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Ahmed 20107EC | 24s | -AR | sc | sc vs. oral | 2mg/s con dosis ascend | - | - | -Eficacia | 3b |
| 2 | Arthur 19998O, R | - | -n:AR=33; APs=4-68% ♀-edad 49-durac enf 5 | im | vo--> im | 20mg/sa | - | -Adherec-Satisfc-Seg | 2c | |
| 3 | Bakker 20109ECA | 3m | -n: AR=151-77%♀-edad 54 | sc | vo--> sc-->+ciclos | Máx 30mg/s | 0,5mg/d | -AINE | -Eficacia | 2b |
| 4 | Branco 201610O, R | 7a | -n: AR=50-87% ♀-edad 55-durac enf 11a | sc | vo--> sc | 18,3mg/sb | - | -FAME-Biolog | -Eficacia-Seg | 3b |
| 5 | Bharadwaj200711O, R | 12m | -n: AR=32-edad 61-durac enf 4a | sc | vo--> sc | 7,5-25mg/s | 15mg/s | -Eficacia-Seg | 3b-4 | |
| 6 | Bianchi 201812EC abierto | 12s | -n: AR=10-70% ♀-edad 58 | sc | 50mg/s (durante 4s, seguido de 25mg /4s; y 15mg /4s) | 12mg/s | -Eficacia-Seg | 3a | ||
| 7 | Bingham200313O, P | 24s | -n: AR=33-edad 51 | im | vo--> im | Máx 25mg/s | 5mg/d × 6d/s | -FAME-Cortic | -Eficacia-Seg | 3b-4 |
| 8 | Borman201414O, R | 3m | -n: AR=80-edad 54-durac enf 122m | sc | vo--> sc | 16,5mg/s | - | -Cortic-AINE | -Eficacia-Seg | 3a |
| 9 | Braun200815ECA | 6m | -n: AR=384-79% ♀-edad 58-durac enf 2,5m | sc | -vo--> sc-sc--> vo | 15-20mg/sb | 5mg/d | -Cortic-AINE | -Eficacia-Seg | 1b |
| 10 | Brooks199016O, P | 1s | -n: AR=5-60% ♀-edad 45-75 | im/sc | vo-->im-->sc | 24,5mg/s | -FarmacoK | 4 | ||
| 11 | Burbage200117O, R | 9m | -n: AR=24; SpA=4; LES=2 | im | vo--> im | 10-15mg/s | - | -Eficacia-Satisfc-Seg | 3b-4 | |
| 12 | Calasan 201318T | - | -n: AR=249; APs=42-62,2%-edad 59,4 | sc | vo vs. sc | 20,0mg/s | -AINE-IBP-Cortis-FAME | -Seg | 2b | |
| 13 | Capone 200019O, P | 8s | -n: AR=29-72,4%♀ | im | - | 7,5mg | - | -Corti-Paracetamol | -FarmcoK | 3b |
| 14 | Carpentier_199820EC, cruzado | 6m | -n: AR=23-69,5% ♀-edad 61 | im | vo (antes de iniciar el estudio) | 10,7mg | 6d/sem | -Corti-AINE | -FarmacoK | 2b |
| 15 | Chichasova 201821O, P | 36m | -n: AR=74-edad 45,2-durac enf 5,2m | sc | 15mg/s | 5-10mg/s | -AINE | -Eficacia-Seg | 2b | |
| 16 | Crespo201422F-E | 5a | Cohorte imaginaria-78,9% ♀-edad 56 | sc | sc vs. vo | -Econ | 2a | |||
| 17 | Curtis201623O, P | 12m | -n: AR=979-91% ♀-edad 48 | sc | MTX sc vs. MTX vo vs. biolg | -Seg | 3b | |||
| 18 | De Groot 199724O, P | - | -n:GW=17-47% ♀-edad 46 | iv | - | 1,7-7,5mg/día | -Cortic | -Eficacia | 3b-4 | |
| 19 | Demary252014ECA | 6m | -n: AR=111-73% ♀-edad 54-durac enf 3 | sc | sc--> sccsc--> scEduc al pac | 15-20mg/s | -1/s | -FAME-AINE | -Satisfc-Seg | 2a |
| 20 | Dhaon 201326EC | 24s | -n: AR=66 | sc | 1) 7,5mg/ 2 o 3 veces en s2) 15-22,5mg/oral3) 15-22,5mg/parenteral | 15-22,5 | - | - | -Eficacia-Seg | 2b |
| 21 | Dhaon201727O, P | 24s | -n: AR=135-80% ♀-edad 40-durac enf 67m | im | vo/2 o 3 veces /svo/dosis únicaim | 15-20mg/s | -HCQ | -Eficacia-Seg | 2a | |
| 22 | Finckh 201428ECA, cruzado | 3m | -n: CPPD=26-56% ♀-edad 62 | sc | scPBO | 15mg/s | 5-10mg/s | -Analg | -Eficacia-Seg | 3a |
| 23 | Fitzpatrick 201129F-E | - | -NICE | sc | -Econ | 3a | ||||
| 24 | Fitzpatrick 201130F-E | - | Costes en Gran Bretaña | sc | -Econ | 3a | ||||
| 25 | Flipo 201831O, P | 6m | -n: AR=466-edad 59-durac enf: 6,5a | sc | sc (con uso previo de vo)sc | 15,1mg | -Adherec | 3a | ||
| 26 | Freundlich201432O, P | 8s | -n: AR=101-79,2% ♀-edad 60-durac enf 13a | sc | vo--> sc | 1/25mg/s | - | -Satisfc-Seg | 2a-b | |
| 27 | Godfrey 199833O, P | 36m | n:AR=62-66% ♀-edad 58-durac enf 153s | im | 10,4mg | - | -AINE | FarmacoK | 2b | |
| 28 | Gottheil201634 | 3a | -n: AR=1.214-71,3% ♀-edad 54-durac enf 5,5m | sc | MTX vo vs. MTX sc vs. terapia combinada | -Eficacia | 4 | |||
| 29 | Gridneva 201535O, P | -n: AR=237 | sc | 10 --> 20-30mg/s | - | - | -Seg-Satisfc | 3b | ||
| 30 | Gridneva201636ECA | 12m | -n: AR=47-38% ♀-edad 51-durac enf 4,2m | sc | sc | Máx 30mg/s | -Eficacia | 1b | ||
| 31 | Gridneva 201837O, P | 1a | -n: AR=106 | sc | 10-15mg/s (max 30mg) | Seg | 3b | |||
| 32 | Griffin200438O, R | 6m | -n: AR=22 | sc/im | vo--> sc/im | 17,5mg/s | -Eficacia | 4 | ||
| 33 | Haibel 200739EC, abierto | 16s | -n: EA=20-20% ♀-edad 40-durac enf 14a | sc | 15mg/s (4s)--> 20mg/s (12s) | -Cortic-AINE-FAME | -Eficacia-Seg | 2b | ||
| 34 | Hameed201040O, R | 3m | -n: AR=103-71% ♀-edad 55 | sc | vo --> sc | 15mg/s | - | -Eficacia | 4 | |
| 35 | Hamilton199741O, P | 18m | -n: AR=21-67% ♀-edad 54 | im | vo--> sc; MTX vo vs. MTX im | -Cortic-AINE | -FarmacoK | 3b | ||
| 36 | Hammond201542O, R | 8a | -n: AR=49-edad media 61 | sc/vo | MTX vo vs. MTX sc | 5-15mg/s | -Eficacia | 4 | ||
| 37 | Harris 201843O, R | - | -n: AR=7.017-9,3% ♀-edad 54-durac enf 5,2m | -Eficacia-Seg | 3a | |||||
| 38 | Hattesohl 201844O, R | 12s | -n: 478 (AR=39,3%; APs=23,4%; Ps=23,4)-57,1% ♀ | sc | sc vs. autoinyector | Satisfc | 3b | |||
| 39 | Hazlewood201645O, P | 12m | -n: AR=714-75,1% ♀-edad media 54-durac enf 5,2m | sc | MTX vo vs. MTX sc | 22,3mg/s | - | -Cortic-FAME | -Eficacia-Seg | 2a |
| 40 | Hoekstra200446O, P | 2s | -n: AR=15-73% ♀-durac enf 7a | sc | vo --> sc | -FAME-Cortic | -FarmacoK | 3b | ||
| 41 | Huber_200647O, R | 11m | -n: LE cutáneo=15 | sc | (previamente MTX iv) | 7,5-20mg/s | 5mg 2d/s | -HCQ-Cortis | -Eficacia | 3b-4 |
| 42 | Islam201348ECA | 6m | -n: AR=92-74% ♀-edad 44-durac enf 4a | sc | vo (escalando dosis)--> sc | - | -Analg-IBP | -Eficacia-Seg | 2c | |
| 43 | Jundt199349O, P | 4s | -n: AR=12-58% ♀-edad 58 | sc/im | vovo--> imvo--> sc | - | -FarmacoK | 3b-4 | ||
| 44 | Katz 201550ECA | 6m | -n: AR=29-62%♀-edad 49 | sc | -Educación estándar-Video | - | - | - | -Satisfac | 3a |
| 45 | Lafforgue199551O, P | 6m | -n: AR=46-63% ♀-edad 50-durac enf 6a | im | im | 11mg/sem | -FAME-Analg-AINE | -Eficacia-FarmacoK-Seg | 3a | |
| 46 | Lambert200452ECA | 22s | -n: AR=64-81% ♀-durac enf 9a | im | vo--> im | 5mg/s | -Eficacia-Seg | 1b | ||
| 47 | Lee 201653O, P | 1a | -n: AR=35.640 | sc | vovo--> biologvo--> scvo--> sc-->Biolog | - | - | - | -Econ | 3b |
| 48 | Linde200654O, R | >2a | -n: AR=212-71% ♀-edad 51-durac enf 8a | im | vo--> im | 20mg/s | -Adherec-Eficacia | 3a | ||
| 49 | Luchikhina201655O, P | 24m | -n: AR=191-82% ♀ | sc | sc (2 veloc escalada) | -Eficacia | 3b | |||
| 50 | Mainman201056C-C | 6m | -n: AR=156-75% ♀-edad 54 | sc | MTX sc vs. MTX vo | 5-30mg/s | -AINE-Cortic | -Eficacia-Econ | 3a | |
| 51 | Michaels198257O, P | <2m | -n: AR=14 | iv | iv | -AINE-Cortic | -Eficacia-Seg | 4 | ||
| 52 | Michaud201658O, R | 17a | -n: AR=22.621-79% ♀-edad 59-durac enf 14a | sc | MTX sc vs. MTX vo | -FAME | -Eficacia | 3 | ||
| 53 | Moitra200559O, R | - | -n=AR=102 | sc | vo --> sc | -Satisfc | 3b-4 | |||
| 54 | Monjanel-Mouterde 199860T | - | -n: AR=34-67% ♀-edad 49 | im | 10,5mg/s | -FarmacoK | 2c | |||
| 55 | Müller201561O, R | 2a | -n: AR=70-57% ♀-edad 58-durac enf 1,6a | sc | scsc --> sc+biolog | 20mg/s | -Eficacia-Seg | 2c | ||
| 56 | Müller-Ladner 201062O, P | 6m | -n: AR=128-73% ♀-edad 56-durac enf 3a | sc | scb --> sca | -AINE-Cortic | -Satisfc-Eficacia-Seg | 2b | ||
| 57 | Myasoutova201663ECA | 6m | -n: AR=43-84% ♀ | sc | MTX sc vs. MTX vo | 11,6mg/s | -FAME | -Eficacia-Seg | 3 | |
| 58 | Ng200464O, R | >5a | -n: AR=7.017 | sc | MTX scb vs. MTX vo | -Eficacia | 2a | |||
| 59 | O’Connor201665O, R | 12m | -n: AR=103-61,4% ♀-edad 56-durac enf 160d | sc | sc | -Eficacia-Seg | 3 | |||
| 60 | Oguey199266O, P | 3s | -n: AR=10-50% ♀-edad 58 | iv | iv--> vo cena --> vo desayuno | -AINE-Cortic | -FarmacoK | 3a | ||
| 61 | Osman200167T | - | -n: AR=22; PM=1; AIJ=1 | im | vo --> im | 17,5mg/s | - | -Eficacia | 4 | |
| 62 | Pachon 201368 | 2s | -n: AR=104 | sc | - | - | - | -Satisf | 3b-4 | |
| 63 | Przygodzka 201769O, L | 3m | -n: AR=194 | sc | vosc | - | - | - | -Eficacia-Seg | 3b |
| 64 | Rau199770 | 12m | -n: AR=174-60% ♀-edad 54-durac enf 11a | im | im 7,5mg/s --> im 15mg/sSAu 25mg/s m --> SAu 50mg/s | No permitido | -AINE-Cortic | -Eficacia-Seg | 2b | |
| 65 | Rau200271ECA | 12m+2a | -n: AR=174-60% ♀-edad 54-durac enf 11a | im | im 7,5mg/s --> im 15mg/sSAu 25mg/s m --> SAu 50mg/s | No permitido el 1.er a | -AINE-Cortic | -Eficacia | 2b | |
| 66 | Rawat201672O, R | - | -n: AR=100 | sc | sc | - | - | - | Satisfc | 4 |
| 67 | Rutkowska-Sak200973 | - | -n: AR=70-91% ♀-edad 55-durac enf 11a | sc | vo--> sc | 15mg/s | - | - | -Seg | 4 |
| 68 | Sames 201474 | - | -n: AR=29-durac enf 15,3 | sc | - | -- | - | - | Seg | 4 |
| 69 | Sampaio-Barros 200075 | 1a | -n: EA=34 | im | 12,5mg/s | - | -AINE | -Eficacia-Seg | 3a | |
| 70 | Saraux 201976 | 6m | -n: AR=271-75% ♀-edad: 59,2-durac enf: 5,3 | sc | MTXa vs. autoinyector | 15,4mg/s | -Eficacia-Adher-Satisf-Seg | 2b | ||
| 71 | Schiff2014_277ECA | 8s | -n: AR=49-63,3% ♀-edad 61-durac enf 13a | sc | MTX vo vs. MTX sc (abd) vs. MTX sc (muslo) | - | -FarmacoK-Seg | 2a | ||
| 72 | Schiff201778 | 8s | -n: AR=49-63,3% ♀-edad 61-durac enf 13a | sc | vo--> sc | -FarmacoK-Seg | 2b | |||
| 73 | Scott 201479 | 5a | -n: AR=196-75,5% ♀-edad 47 | sc | vo--> sc | 17,7mg/s | - | -FAME | -Eficacia-Seg | 2c |
| 74 | Stamp201180O, P | 6m | -n: AR=30-76,6% ♀-edad 51-durac enf 7a | sc | vo--> sc | 20mg/s | 5mg/s | -FAME-AINE-Cortic | -Eficacia-Seg-Adher-FarmacoK | 3a |
| 75 | Striesow201281O, P | 5s | -n: AR=310; APs=59-68,2% ♀ | sc | sca | - | -Satisfc-Seg | 2b | ||
| 76 | Thompson198482 | 12s | -n: AR=48-75% ♀-edad 54-durac enf 13a | im | PBO vs. MTX im | 15-25mg/s | - | -Eficacia-Seg | 1b | |
| 77 | Thornton200883 | 6m | -n: AR=30-87% ♀-durac enf 15a | sc | vo-->sc | 19,9mg/s | - | - | -Eficacia-Seg | 2c |
| 78 | Todoerti201684 | 9a | -n: AR=5.337-68% ♀-edad 63 | sc | sc | -Seg | 3a | |||
| 79 | Wan 201785 | -n: AR=7.968 | sc | vo (--> aumento dosis)vo--> sc | -Eficacia | 2c | ||||
| 80 | Wegrzyn200486 | 6m | -n: AR=143-90% ♀-edad 65 | im | im --> vo--> im | Sí | -Eficacia-Seg | 2c |
a: años; abd: abdomen; Ác: ácido; Adherec: adherencia; AINE: antiinflamatorios no esteroideos; analg: analgésicos; APs: artritis psoriásica; AR: artritis reumatoide; ascend: ascendente; biolog: fármacos biológicos; C-C: casos y contropm; CPPD: artritis por pirofosfato cálcico; ciclos: ciclosporina; cortic: corticoides; d/s: días en semana; durac enf: duración enfermedad; EC: ensayo clínico; ECA: ensayo clínico aleatorizado; Econ: económico; educ al pac: educación al paciente; F-E: fármaco-económico; FAME: fármacos modificadores de la enfermedad; farmacoK: farmacocinética; GW: Granulomatosis de Wegener; HCQ: hidroxicloroquina; IBP: inhibidor de la bomba de protones; im: intramuscular; LES: lupus eritematoso sistémico; m: meses; máx: máximo; mg/d: milígramo/día; mg/s: milígramos/ semana; MTX: metotrexato; NICE: National Institute for Health and Care Excellence; O: observacional; P: prospectivo; PBO: placebo; PM: polimiositis; Ps: psoriasis; R: retrospectivo s: semana; satisfc: satisfacción; SAu: sales de oro; sc: subcutáneo; seg: seguridad; SpA: Espondiloartritis; T: transversal; tto: tratamiento; veloc: velocidad; vo: vía oral.
Eficacia
| Estudio / Enf | Índices de actividad | RFA | EVA/recuentos articulares/HAQ | Supervivencia | Otras |
|---|---|---|---|---|---|
| Ahmed 20107 / AR | % ACR 20 (sc vs. oral): 57,5 vs. 9,1% ACR 50 (sc vs. oral): 12,5 vs. 0 | ||||
| Bakker 20109 / AR | Respuesta a cambio de tto (IC 95%)-MTX sc=63 (50-70)-Ciclos=48 (32-64) | ||||
| Branco 201610 / AR | Posibilidad discontinuación MTX sc (IC 95%)-1 a=6,1% (0-9,5)-2 a=8,5% (0,1-16,1)-3 a=23,2% (5,3-37,7) | ||||
| Bharadwaj 200711 / AR | -DAS28 final<5,1=87,5%-DAS28 final<3,2=37,5%-Δ DAS 28>1,2=71,8% | ||||
| Bianchi 201812 / AR | -DAS28-VSG remisión=44,4%-ΔDAS28> 1,2=88,8% | ||||
| Bingham 200313/ AR | -Δ DAS28 s12=5,8 (p=0,015)-Δ DAS28 s24=5,7 (p=0,014) | -↓PCR s12 (NS)-↓PCR s24 (p=0,022) | -s12=88%-s24=58% | Dosis corticoides-s12: Sin cambios-s24: ↓prednisona (NS) | |
| Borman 201414 / AR | 1m-DAS 28=3,6 (p<0,010)3m-DAS 28=3,4 (p<0,010) | 1m-VSG:33,8 (p<0,050)-PCR:1,4 (p<0,050)3m-VSG:29,7 (p<0,050)-PCR:0,8 (p<0,050) | 1m- EVA dolor: 53,9 (p<0,050)3m- EVA dolor: 51,6 (p<0,050) | ||
| Braun 200815 | 6m (sc vs. oral)-ACR20: 78 vs. 70 (p<0,050)-ACR 50: 62 vs. 59 (NS)-ACR 70: 41 vs. 33 (p<0,050)-DAS28: 3,3 vs. 3,7 (p no mostrada) | MTX sc vs. MTX vo-NAT: 2 vs. 3 (p=0,040)-NAD: 3,5 vs. 6 (NS)-HAQ: 0,4 vs. 0,5 (NS) | s16n=52 (14%) no respondedores-Cambio MTX vo --> MTX sc (n=30, 30% ACR20 6 m)-Cambio MTX sc 15mg --> 20mg (n=22, 23% ACR20 6 m) | ||
| Burbage 200117 / AR, SpA, LES | Mejoría VSG y PCR a 3 y 9 m (p<0,01 ambos) | ||||
| Chichasova 201821 / AR | LDA--3m=18 pac--6m=51%--12m=81%--36m=64%Remisión--12m=19%--36m=36% | -Progresión radiográfica mínima: 24% | |||
| De Groot_1997 24/ GW | -7 pac con respuesta--6 remisión completa--4 remisión parcial-Dosis mediana de prednisona=1,75mg/d--7 pac con retirada completa de pred | ||||
| Dhaon 201326 / AR | -SDAI--Dosis fraccionada vs. parenteral (p=0,005) | ||||
| Dhaon201727 / AR | MTX vs/2s vs. MTX vo vs. MTX im-LDA (%)=49 vs. 35,5 vs. 47ΔSDAI=-8 (±4,5) vs. -0,1 (±7,6) vs. -6 (±7,2) | ||||
| Finckh 201428 / CPPD | MTX vs. PBODAS44=-0,08 vs. -0,13 | MTX vs. PBOPCR=0,2 vs. 0,3 | MTX vs. PBONAD=0 vs. -1NAT=-1 vs. 0EVA dolor=-1 vs. 0 | MTX vs. PBORetiradas 5vs. 0 | MTX vs. PBON.° analgésicos=0 vs. 0N.° brotes /3m=0 vs. 0 |
| Gottheil201634 / AR | MTX sc vs. MTX oral en la necesidad de biológicos--> HR=0,47; p=0,015 | ||||
| Gridneva 201636 / AR | Según IMC ≤25 vs. 25-30 vs. ≥303m-Remisión ACR/EULAR 2011=20 vs. 6 vs. 06m-DAS 28=2,1 vs. 2,6 vs. 30=3-SDAI=4,3 vs. 5,5 vs. 10,0-Remisión ACR/EULAR 201=30 vs. 24 vs. 1012m-DAS 28-VSG=2,0 vs. 2,9 vs. 2,4-DAS 28-PCR=1,7 vs. 2,4 vs. 2.3-SDAI=1,2 vs. 3,3 vs. 4,3-Remisión ACR/EULAR 2011=60 vs. 30 vs. 30 | Según IMC ≤25 vs. 25-30 vs. ≥30Dosis media de MTX sc (mg/s)=--3 m=12,7 vs. 11,3 vs. 10,3--6 m=13,3 vs. 11,5 vs. 9,4--12 m=13,1 vs. 11,5 vs. 10,2Necesidad en el uso de FAME (%)=23 vs. 60 vs. 60 | |||
| Griffin 200438 / AR | -↓ NAT (p<0,05)-↓ NAD (p<0,01)-↓ dolor (p<0,01)-↓ VGP (p<0,02)-↓ VGM (p<0,02)-↓ HAQ (NS) | -A los 6 m-↓ uso corticoides (p<0,03)-↑ hemoglobina (p<0,05) | |||
| Haibel 200739 / EA | -ASAS20=25%-ASAS40=10%-ASAS70=0-ASAS remisión parcial=0-BASDAI20=30%-BASDAI50%=10%-BASDAI70=5%-ΔBASDAI=0 | -PCR=1mg/dl --> 0,8mg/dl | -Dolor espinal médico=sin mejoría-NAT=4,7 --> 1,2-N° entesis=2,2 --> 1,9 | -4 retiradas ineficacia (2 en s4 y 2 en s12) | |
| Hameed 201040 / AR | -Δ DAS28 grupo inef 3 mes 4,2 (p=0,006)-Remisión grupo inef n=4 (10%)-Δ DAS28 grupo AE 3 mes 43 (p<0,001)-Remisión grupo AE n=21 (33%), 6 ya estaban en remisión al inicio | ||||
| Hammond 201542/ AR | -Respuesta inadecuada a MTX vo (tolerabilidad) (n=20)-DAS 28 pre cambios vs. post-cambio: 4,46 vs, 3,65-DAS28 ≤3,2=40%-DAS28 ≤2,6=30%-Respuesta inadecuada a MTX vo (eficacia) (n=29)-DAS28 pre-cambios vs. post-cambio: 5,34 vs. 4,08-DAS28 ≤3,2=24%-DAS28 ≤2,6=7% | -Duración media del MTX sc en monoterapia-Respuesta inadecuada a MTX vo (tolerabilidad)=28,6m-Respuesta inadecuada a MTX vol (eficacia)=7m | |||
| Harris 201843 / AR | HR (probabilidad de cambio terapéutico): 0,64 (IC 95% 0,52-0,78) | ||||
| Hazlewood 2016 45 / AR | (Datos estimados para MTX sc)-Diferencia DAS 28 entre grupos de tto: HR=-0,38 (-0,64, -0,10); p=0,04-Remisión DAS 28: OR=1,02 (0,96, 1,06); p=0,002-Remisión sostenida DAS 28: OR=1,02 (0,96, 1,06); p=0,43 | -HAQ: HR=-0,02 (-0,13, 0,10); p=0,75 | |||
| Huber 200647 / LE cutáneo | -Mejoría de las lesiones | ||||
| Islam 201348/ AR | -MTX sc vs. MTX vo-ACR20 (%)=93 vs. 80 (p=0,020)-ACR50 (%)=89 vs. 72 (p=0,030)-ACR70 (%)=11 vs. 9 (NS) | -MTX sc vs. MTX vo-VSG=43 vs. 50 (p=0,03) | -MTX sc vs. MTX vo-NAD=21 vs. 31 (p=0,020)-NAT=4 vs. 8 (p=0,030)-Dolor=2 vs. 3 (NS)-VGP=2 vs. 3 (NS)-VGM=2 vs. 3 (p=0,020)-HAQ=7 vs. 9 (p=0,04)-RM (min)=25 vs. 38 (NS) | ||
| Lafforgue 199551/ AR | Respondedores (n=32, 70%) vs. no respondedores (n=14, 30%) | ||||
| Lambert 200452 / AR | -MTX im en escalada vs. MTX im control-DAS28<3,2=3,7 vs. 3,7 (NS)-Δ DAS28>1,2=18,5 vs. 18,5 (NS)-ACR20=3,7 vs. 3,7 (NS)-Respuesta EULAR buena=0 vs. 0 (NS)-Respuesta EULAR moderada=30 vs. 36 (NS)-Sin respuesta EULAR=70 vs. 74 (NS)-SF-12: NS (datos no mostrados)-Δ DAS28: -0,5 vs. -0,7 (NS) | -Δ VSG: 2, vs. -5,4 (NS) | -Δ NAT: -1 vs. -2 (NS)-Δ NAT: -4 vs. -3 (NS)-Δ EVA VGP: -12 vs. -10 (NS)-Δ EVA VGM: -3,5 vs. -3,6-Δ EVA dolor: 9 vs. -18- Δ HAQ: 0,05 vs. 0,14 (NS) | -Pac con infiltraciones con corticoides 59% vs. 37%-N.° infiltraciones con corticoides 20 vs. 12 | |
| Linde 200654 / AR | -Δ PCR 6m: 20 a 12 (p>0,001) | -Uso corticoides 6 m: 66% a 46% (p>0,001) | |||
| Luchikhina 201655 / AR | 12m-% SDAI baja actividad=38,2-% SDAI remisión=34 | % pac con cambio a biológico=63,9A los 12m (Escalada rápida vs. escalada lenta)-% en monoterapia: 49,4 vs. 25-% cambio a biológico: 50,6 vs. 75A los 24 m (Escalada rápida vs. escalada lenta)-% en monoterapia: 46,3 vs. 19,7-% cambio a biológico: 53,7 vs. 80,3 | |||
| Mainman 201056/ AR | MTX sc vs. MTX vo-% DAS28>1,2=74 vs. 48 (p=0,035)-% DAS28>3,2=92 vs. 16 (p=0,002)- %Respuesta EULAR ≥buena (MTX sc): 58 | -Δ VSG=N) | -Δ Dolor=NS | ||
| Michaels 198257/ AR | -Δ VSG: 63 a 38 | -Δ RM: 6 a 2,5-Δ recuento articular: 57 a 33 | |||
| Michaud 201658/ AR | Mediana supervivencia: MTX sc ms MTX vo=1,5 (0,5-3,5) vs. 2 (1-5,5)-% cambio entre las dos admon=16,2 | ||||
| Müller 201561 / AR | 6m/12m/18m/24m-Todos los pac-DAS28: 2,70/ 2,45/ 2,50/ 2,51-% DAS28<3,2: 80-%DAS28<2,): 72,9-MTX sc monoterapia-DAS28: 2,11/ 1,92/ 1,93/ 1,84-%DAS28<3,2: 81,1-%DAS28<2,6: 75,7-MTX sc+biológico-DAS28: 3,18/ 2,81/ 2,81/ 2,89-%DAS28<3,2: 78,8-%DAS28<2,6: 69,7 | 6m/12m/18m/24m-Todos los pacientes-VSG:9/ 9/ 8/ 8-PCR:3,23/ 3,20/ 3,78/ 3,85-MTX sc monoterapia- VSG: 7/ 7/ 7/ 7-PCR: 2,66/ 2,53/ 3,22/ 3,12-MTX sc+biológico-VSG: 10/ 8/ 9/ 9-PCR: 3,61/ 3,52/ 4,07/ 4,2 | -Tasa discontinuación 45,7% (MTX sc vs. MTX sc+biológico 46% vs. 45% (NS) | -Dosis medias MTX sc vs. MTX sc+biológico 17,4 vs. 19,1 (NS) | |
| Müller-Ladner 201062/ AR | 20ml vs. 50 ml-EVA-VGP=63,5 vs. 95 (p<0,001)-EVA VGM=82 vs. 96 (p<0,001) | ||||
| Myasoutova 201663 / AR | MTX sc vs. MTX vo- ACR 20 (pac)=23 vs. 14- DAS 28 a los 6m=2,3 vs. 1,3 (p<0,05) | ||||
| Ng 200464 / AR | -Probabilidad de cambio con MTX sc HR=0,64 (IC 95% 0,52–0,78) | ||||
| O’Connor 2016 65/ AR | Basal/ 6s/12sCDAI- ≤2,8=0/ 16,7/19,1-2,9-10,0=8,8/ 26,0/ 53,9-10,1- 22,0l=25,5/ 38,5/ 23,6->22=65,7/ 18,8/ 3,4SDAI- ≤3,3=0/ 6,9/ 8,1-3,4-11,0=3,1/ 22,4/ 43,2-10,1- 22,0=15,5/ 32,8/ 35,1->26=81,4/ 37,9/ 13,5DAS 28- ≤2,4=2,1/ 25,9/ 30,3-2,5-3,6=9,6/ 32,9/ 43,4-3,7- 5,5=42,6/ 34,1/ 25,0->5,5=45,7/ 7,1/ 1,3 | ||||
| Osman 200167 / AR | PCR=53 --> 34mg/l | -20 pac mejoraron-3 empeoraron-1 sin cambios | |||
| Przygodzka 201769 / AR | 3mvo--> sc=26%sc--> vo=4%Cortis=12% del grupo vo | ||||
| Rau 199770 / AR | -MTX im Δ medidos 0m/6m/12m-Lansbury index: 64,6/31,3/29 (p<0,05)-Remisión clínica MTX vs. SAu 11,5% vs. 24,1% p<0,050 | -MTX im Δ medidos 0m/6m/12m-VSG: 41,5/22,8/21,1 (p<0,05)-PCR: 4,1/2,2/2,5 (p<0,05) | -MTX im Δ medidos 0 m/6 m/12 m-NAD: 18,4/11,9/11,4 (p<0,05)-NAT: 14,9/8/7,6 (p<0,05)-RM: 3,4/2,2/2,1 (p<0,05)-Dolor articular: 3,6/2,7/2,8 (p<0,05)-Fza mano derecha: 0,3/0,5/0,5 (p<0,05)-AVD: 69,1/81,1/78,4 (p<0,05) | -Mejoría marcada 68% vs. 76% (NS)-Fallo tratamiento 14% vs. 19% (NS) | |
| Rau 200271 / AR | MTX im-->12m/24 m/36m-Ratingen score=11,9/14/17,6, p<0,05 vs. basal, NS vs. sSAu (en cualquier tempo)-Articulaciones con erosiones=8,7/ 10,2/ 11,1 p<0,05 vs. basal, NS vs. SAu (en cualquier tempo)-Ratingen score ≤5%=60/ 54,1/ 50 NS vs. SAu (en cualquier tempo)-Ratingen score 6-10%=22,7/ 25,7/ 22,9 NS vs. SAu (en cualquier tempo)-Ratingen score 11-20%=13,3/ 13,5/ 15,7 NS vs. SAu (en cualquier tempo)-Ratingen score>20%=4/ 6,8/ 11,4 NS vs. SAu (en cualquier tempo)-Progresión <2° que 1.er año (Retinger score y erosiones) p<0,050 | ||||
| Sampaio-Barros 200075 / EA | -↓ VSG (p<0,001) | -31 pacientes finalizaron tto | -53% se consideraron respondedores | ||
| Saraux 201976 / AR | % cambio HAQ(Autoinyector vs. jeringa precargada)=20,4 vs. 20,3 | ||||
| Scott 201479 / AR | -% Supervivencia de MTX sc-1 a=83-2 a=75,2-5 a=47 | ||||
| Stamp 201180 / AR | -Δ DAS28 (mediana) 0-6m- 3,27 vs. 2,56 (NS) | -Δ mediano 0-6m-VSG: NS-PCR: NS | -Mediana de cambio-NAT: 2 vs. 0 (p=0,001)-NAD: NS-HAQ modificado: 0,5 vs. 0,125 (p=0,030)-Dolor: 24,5 vs. 17 (p=0,014)-VGP: 29,5 vs. 16 (p=0,004)-Fatiga: NS | ||
| Thompson 198482/ AR | -Δ VSG (6 s) MTX im vs. PBO=29 vs. 43 (p<0,001)Pac con mejoría clínica importante--MTX im 10 mg/s vs. PBO=6 vs. 0 (p<0,010)--MTX im 25 mg/s vs. PBO=6 vs. 0 (p<0,005) | -Δ medio (6 s) MTX im (10 y 25mg/sem) vs. PBO-NAT: 18 vs. 35 (p<0,001)-NAD: 25 vs. 55 (p<0,002)-VGM: 69 vs. 38 (p<0,001)-Dolor: 33 vs. 65 (p<0,001)-RM: 0,9 vs. 3,8 (p<0,005)-Fza mano=126 vs. 97 (p<0,005)-Tpo para caminar 50 pasos=12,6 vs. 14,2 (NS)- Pac con mejoría clínica importanteMTX im 10mg/s vs. PBONAT: 5 vs. 0 (p<0,050)-NAD: 6 vs. 2 (NS)--VGM: 10 vs. 2 (p<0,01)-Dolor: 8 vs.1 (p>0,010)-RM: 10 vs. 2 (p<0,01)-Fatiga: 4 vs. 3 (NS)-Fza mano 1 vs. 0 (NS)-Tpo para caminar 50 pasos: 0 vs. 0 (NS)MTX im 25mg/s vs. PBO-NAT: 1 vs. 0 (NS)-NAD: 6 vs. 2 (p<0,050)-VGM:6 vs. 2 (p<0,010)-Dolor: 5 vs. 1 (p<0,050)-RM: 7 vs. 2 (p<0,010)-Fatiga: 6 vs. 3 (NS)-Fza mano: 2 vs. 0 (NS)-Tpo para caminar:0 vs. 0 (NS) | |||
| Thornton 200883/ AR | A los 3/6m-↓media DAS28: 2,34 (p<0,001)/ 2,09 (p<0,001)-Buena respuesta EULAR: 74% / 52% | A los 3/6 m-Uso anti-TNFα: 0 / n=3 pacientes | |||
| Wan 201785 / AR | Razón de probabilidad de iniciar tto biológico (categoría de referencia aumento de dosis vo): 1,06 (IC 95% 0,82-1,38; p=0,635) | ||||
| Wegrzyn 200486/ AR | (↑/↓/ sin cambio)3 m-MTX im -->vo-Dolor matutino 49/ 0/ 41 (p<0,001)-RM: 64/ 0/ 34 (p<0,001)-Tpo rigidez art: 63/ 0/ 34 (p<0,001)-Dolor art: 71/ 0/ 29 (p<0,001)-Inflamación art: 59/ 0/ 34 (p<0,001)-MTX vo --> im ↑ con vo seguido de ↓ tras im-Dolor matutino=42% (p<0,001)-RM: 49% (p<0,001)-Tpo rigidez art: 60% (p<0,001)-Dolor art: 70% (p<0,001)-Inflamación art: 40% (p<0,001) | -MTX im --> vo 3 mConsumo analgésicos 66% / 0% / 31% (p<0,001)-Duración consumo analgésicos 66% / 0% / 31% (p<0,001)-Sequedad ocular 14% / 0% / 57% (NS)-Sequedad de boca 19% / 0% / 50% (NS)-MTX vo --> im ↑ con vo seguido de ↓ tras im-Consumo analgésicos 63% (p<0,001)-Duración consumo analgésicos 65% (p<0,001)-Sequedad ocular sin cambios 47%-Sequedad de boca sin cambios 40% |
a: años; ACR: American College of Rheumatology; admon: administración; AE: acontecimientos adversos; AR: artritis reumatoide; art: articular; ASAS: Assessment of SpondyloArthritis International Society; AVD: actividades de la vida diaria; BASDAI: Bath Ankylosing Spondylitis Disease Activity Index; CDAI: Clinical Disease Activity Index; ciclos: ciclosporina; cortis: corticoides; DAS: Disease Activity Score; EA: espondilitis Anquilosante; Enf: enfermedad; EVA: escala visual analógica; FAME: fármaco modificador de la enfermedad; fza: fuerza; HAQ: Health Assessment Questionnaire; IC: intervalo de confianza; im: intramuscular; IMC: índice de masa corporal; inef: ineficacia; LDA: low disease activity; LES: lupus eritematoso sistémico; m: meses; MTX: metotrexato; NAD: número de articulaciones dolorosas; NAT: número de articulaciones tumefactas; NS: no significativo; pac: paciente; PBO: placebo; PCR: proteína C reactiva; RFA: reactantes de fase aguda; RM: rigidez matutina; s: semanas; SAu: sales de oro; sc: subcutáneo; SDAI: Simplified Disease Activity Index); SpA: Espondiloartritis;TNF: factor de necrosis tumoral; tpo: tiempo; tto: tratamiento; VGM: valoración global del médico; VGP: valoración global del paciente; vo: vía oral; VSG: velocidad de sedimentación glomerular.
Aunque la mayoría de los estudios incluidos evalúan la eficacia de MTX parenteral, la mayor parte de los mismos no tiene un grupo comparador. Además, al incluirse estudios antiguos, las variables de eficacia que se utilizan actualmente, como la remisión o la respuesta EULAR, solo pudieron encontrarse en los estudios más recientes. Los dominios evaluados incluyen datos sobre actividad (incluyendo la remisión), daño estructural, dolor, rigidez, función, fatiga, fuerza en las manos, valoraciones globales de médico y paciente, calidad de vida, reactantes de fase aguda, consumo de corticoides y, como posible variable de eficacia, el ahorro /retraso en la prescripción de terapias biológicas, la supervivencia del MTX y los cambios terapéuticos.
Artritis reumatoideLa evidencia más robusta vendría de ensayos clínicos aleatorizados (ECA) con grupo comparador paralelo. En el ECA de Braun et al.15, al comparar la eficacia de MTX vo con el MTX sc a las mismas dosis durante un período de 6 meses en AR naïve a MTX, en su mayoría de inicio, encontraron superioridad estadísticamente significativa de la formulación sc en los índices de respuesta compuestos ACR20 y 70, sin diferencias en el ACR50, aunque el porcentaje fue mayor con la formulación subcutánea, y en la reducción del número de articulaciones tumefactas, pero no en la de articulaciones dolorosas. No se alcanzaron tampoco diferencias en el HAQ, y en cuanto al índice de actividad DAS28, a los 6 meses en el grupo de MTX sc fue de 3,3 vs. 3,7 en el MTX vo (valor p no mostrado). Por otro lado, en el subgrupo de pacientes que fracasaron con la formulación oral y cambiaron a sc a la semana 16, el 30% alcanzó el ACR20 a los 6 meses.
Siguiendo con los ECA, en el estudio de Islam et al.48 de 6 meses de duración, se aleatorizaron pacientes refractarios a MTX vo a aumentar la dosis oral o a MTX sc. Al comparar ambas formulaciones, de nuevo para muchas de las variables, la formulación sc fue significativamente superior a la vo, en concreto para el ACR20 y 50 pero no el 70, aunque el porcentaje fue mayor con el sc (11% vs. 9%), número de articulaciones dolorosas (NAD), valoración global del médico (VGM), HAQ, y velocidad de sedimentación globular (VSG), pero no hubo diferencias en el dolor, la valoración global del paciente (VGP) y la rigidez matutina.
En otros ECA y en los estudios observacionales incluidos, la comparación entre formulaciones del MTX es secuencial y no en grupos paralelos. Aquí se encuentra que, tanto en pacientes que cambian el MTX vo por ineficacia como por toxicidad, se puede conseguir respuesta terapéutica, con distintas magnitudes del efecto. La mayoría de los seguimientos no son demasiado prolongados (varios meses; puntualmente hay datos de hasta 3 años), aunque se empiezan a comunicar datos que indican que la eficacia del fármaco se puede mantener más a largo plazo42.
Cabe destacar un análisis de subgrupos en el estudio de Gridneva y Muraviev en 201636, que comparó el efecto del MTX por vía sc en función del índice de masa corporal (≤25kg/m2 frente a mayor), observando un mayor porcentaje de mejoría en los pacientes con menor índice de masa corporal.
Espondiloartritis (EspA)Solo uno de los trabajos realizados en EspA estudió, y de manera indirecta, la eficacia del MTX sc. El estudio de Burbage et al., de 200117, incluía datos de varias enfermedades reumáticas, entre ellas, 4 pacientes con EspA. Se evaluó la eficacia mediante los reactantes de fase aguda. De este modo se observó que, en los pacientes con mala tolerancia a la vo, el cambio a la vía parenteral se asociaba a mejoría en estos parámetros.
Otras enfermedadesDe manera casi anecdótica se encontraron en estudios que incluían otras enfermedades. En un estudio en lupus eritematoso sistémico con 2 pacientes (LES)17 y otro en polimiositis con un solo paciente67, la efectividad se evaluó analizando la disminución del valor de PCR, dato que fue conseguido en ambas patologías. Ambos trabajos son, además, de baja calidad. También se encontró un estudio donde se analizaba la eficacia del MTX sc en el tratamiento de la enfermedad por depósito de pirofosfato cálcico (n=26)28, sin obtenerse una claro resultado a favor del grupo de tratamiento frente a placebo.
SeguridadCasi dos tercios de los estudios incluidos en esta revisión evalúan la seguridad y tolerabilidad del MTX parenteral, algunos comparándolo con MTX vo, y otros con diferentes dosis de MTX parenteral, pero la mayoría no tiene un grupo comparador (anexo 2). Al igual que ocurre con la eficacia, la comparación entre la formulación oral y la parenteral habitualmente no se efectúa en diseños paralelos, sino secuencial. Independiente de la farmacocinética del MTX, este hecho no puede evitar al 100% la existencia de efectos residuales que sesguen los resultados obtenidos con la vía parenteral. Es de reseñar que no siempre queda bien definido el tipo de evento adverso (EA) ni las distintas formas de graduar la gravedad de los mismos, existiendo una gran variabilidad en la forma de definirlos y registrarlos.
En general, tanto en los ECA15,48 como en los estudios observacionales (independientemente de cómo se comparan los tratamientos), el MTX parenteral no incrementa la tasa, tipo ni gravedad de EA descritos para el MTX vo. Tampoco se han observado cambios con diferentes dosis de MTX parenteral o al comparar distintas concentraciones en la formulación sc.
Se ha sugerido que la administración parenteral de MTX posiblemente afectaría favorablemente la tasa de EA gastrointestinales en relación con la formulación oral. Uno de los ECA incluidos así lo observa48, pero no el ECA de Braun et al.15. De hecho, los autores comentan en la discusión este hallazgo como inesperado. Hay un estudio observacional (de baja calidad) que específicamente compara la intensidad de EA gastrointestinales entre dosis de 7,5 y 15mg/semana en las dos formulaciones. En general (aunque depende del tipo de EA), la intensidad es mayor con la formulación oral.
De igual manera, se ha sugerido que la vía parenteral podría mejorar los hallazgos sobre los niveles de transaminasas descritos con la vía oral. El ECA de Braun et al.15 encuentra elevación de transaminasas en un 4,3% de los pacientes con MTX vo y en el 1,6% en la formulación parenteral. Faltan estudios comparativos para confirmar definitivamente este punto.
AdherenciaDestacan 4 estudios observacionales de calidad moderada-buena y un EC de bajo nivel de evidencia, en los que directamente (aunque siguiendo definiciones diferentes) se evalúa la adherencia al tratamiento parenteral. Sin embargo, carecen de grupo comparador, y en el primero que se describe era criterio de inclusión que el paciente fuese un «potencial cumplidor» (anexo 3). Cabe destacar que son todos ellos estudios con pocos pacientes, con lo que la validez de los resultados se ve muy limitada.
En el primero de estos estudios (de duración poco clara, parece que a corto plazo) se evalúa la adherencia autorreferida a fármacos parenterales8. Se incluyeron 40 pacientes con AR y artritis psoriásica (APs), de los que 20 inician MTX im. A dichos pacientes se les proporcionó educación y entrenamiento para la autoinyección, refiriendo un 92,5% de adherencia, entendida como un ≥80% de seguimiento del esquema de prescripción.
Otro estudio54 observó que en 12 pacientes con enfermedad reumática que cambiaron el MTX vo por la vía im, a los 6 meses, no hubo diferencias en la adherencia del MTX im por el hecho de haber discontinuado el MTX vo por ineficacia o por EA. Stamp et al.80, tras analizar 30 pacientes con AR que cambiaron MTX vo a MTX sc, solo encontraron un paciente no-adherente a los 6 meses.
El estudio de Flipo et al.31 (baja calidad), en el que se medía la adherencia mediante el índice de Morisky, los resultados muestran una adherencia moderada. En este trabajo, los médicos consideraron que la adherencia que tenían sus pacientes era mayor de la que estos declaraban.
Algunos estudios evaluaron la persistencia del MTX parenteral10,54, uno de los cuales solo se encontró en forma de abstract a congreso42. Se observa que la persistencia del fármaco disminuye con el tiempo y que la del MTX parenteral es superior a la del MTX vo.
Es importante tener en cuenta el papel favorecedor que puedan tener la educación y el entrenamiento para la administración parenteral, el usar jeringas precargadas y el menor volumen de las mismas8,62,81 sobre la adherencia.
SatisfacciónLos estudios que evalúan la satisfacción son muy heterogéneos en forma y contenido y de calidad media-baja (anexo 4). En general, todos los trabajos recogen una satisfacción buena o muy buena, por encima del 70%, aunque en cada uno de ellos el análisis de satisfacción está planteado desde un abordaje distinto, por ejemplo, satisfacción con el cambio de vía de tratamiento59, el tipo de dispositivo utilizado para la administración parenteral25,81 o incluso el dolor en la zona de la inyección32, entre otros. Por las características del diseño y su calidad, es difícil obtener conclusiones definitivas en esta categoría.
Estudios de farmacocinéticaLos resultados encontrados sobre farmacocinética se muestran en el anexo 5. La evidencia sobre las diferencias en la biodisponibilidad entre la formulación oral y la parenteral se basa en un ECA cruzado, de calidad buena y 8 semanas de duración, así como en múltiples estudios observacionales de calidad moderada, de corta duración y con muestras pequeñas41,46,49,51,66. Se ha evaluado la farmacocinética, tanto del MTX sc, im, como iv y a distintas dosis.
Con el MTX vo se ha observado que al aumentar la dosis disminuye su biodisponibilidad, alcanzando un plateau a partir de los 15mg/semana, fenómeno que no se observa con el MTX parenteral. Es decir, a partir de 15mg/semana, la biodisponibilidad del MTX parenteral sería superior a la de la vía oral, siendo similares a dosis menores. En base también a estos hallazgos, uno de los estudios46 sugiere que para conseguir incrementos de eficacia en pacientes con MTX 25mg/semana, se debería pasar a vía parenteral.
Schiff y Sadowski78 sugieren una fórmula basada en la farmacocinética para el paso de dosis de oral a parenteral (y=0.6101x+2.9274), que podría tener aplicabilidad clínica.
Análisis fármaco-económicoLa revisión sistemática incluyó un estudio de calidad sobre la costo-efectividad del MTX parenteral en AR näive a MTX ajustado a las peculiaridades (incluyendo los costes) de nuestro sistema nacional de salud22.
Otros estudios han realizado otros análisis fármaco-económicos, en concreto de minimización de costes29,30. Utilizando costes del Reino Unido, el uso de MTX sc en pacientes refractarios a MTX vo puede ahorrar 7.197 libras por paciente el primer año, y 9,3 millones de libras por año en pacientes nuevos. Otros estudios56 han estimado que, de cada 1.000 pacientes con AR, 40 están siendo tratados con MTX sc, y, teniendo en cuenta que en 36 de estos pacientes se obtiene una respuesta equivalente a la de un anti-TNFα, el ahorro (por utilizar el MTX sc en vez de la terapia biológica) se calcula en 306.000 libras esterlinas, o lo que es lo mismo, 300 libras esterlinas por paciente-año. Todos los estudios encontrados sobre farmacocinética se pueden consultar en el anexo 6. La diferencia entre los distintos sistemas de salud y la diferencia entre las variables utilizadas en cada trabajo, así como su calidad, dificultan la extracción de unos resultados adecuados.
DiscusiónAunque el MTX es en la actualidad la piedra angular del tratamiento de inicio en la AR, muchas veces no es suficientemente bien tolerado por los pacientes y siempre se plantea la posibilidad de un cambio en la vía de administración para conseguir una mejor adherencia, así como una disminución en los EA. Con esta revisión, se ha pretendido estudiar el fenómeno desde la perspectiva clínica de eficacia, adherencia y seguridad, como también desde aspectos económicos o de satisfacción de los pacientes, aspectos estos, que no deben ser minusvalorados en la práctica clínica.
En cuanto a la eficacia, parece interesante explorar el paso de la vo a la vía sc en aquellos pacientes que puedan no estar consiguiendo unos resultados óptimos en el control de la enfermedad en la AR, y hacerlo sin aumentar los EA. De este modo, parece que la eficacia en AR —no se puede concluir en EspA, ni en otras enfermedades autoinmunes sistémicas, debido a los escasos datos encontrados—, se relaciona más con la dosis que con la vía de administración, aunque un cambio a la vía parenteral puede incrementar la eficacia en algunos pacientes, por lo que sería interesante realizar estudios en perfiles concretos. En general, con MTX, cuando una respuesta clínica es insuficiente, se puede valorar el aumento de dosis, debido a la relación casi lineal entre la dosis y el efecto observado87,88.
A pesar de la baja calidad de los estudios para valorar la seguridad del MTX parenteral —en muchos de ellos no existe grupo comparador o la comparación con el MTX vo no se realiza en paralelo, por lo que se puede estar observando un efecto residual de este—, se observa cierta tendencia a que los efectos secundarios son de mayor intensidad con el MTX oral, incluyendo también una mayor elevación de transaminasas15,66.
En cuanto a la evaluación de la adherencia, existe también el problema de la calidad de los estudios, y los diferentes parámetros empleados para su valoración. En general, la adherencia es buena en la vía parenteral, hecho que puede estar muy influido por la necesidad de educación en los dispositivos para su administración. En este sentido, las enfermeras juegan un papel fundamental a la hora de la detección precoz de efectos secundarios, comorbilidades y en la educación sobre temas relacionados con su enfermedad, incluida la necesidad de adherencia89.
En general, también se puede afirmar que los pacientes están satisfechos con el uso parenteral, aunque la mayoría de los trabajos en este sentido evalúan distintas presentaciones farmacológicas25,32,81, lo que hace difícil evaluar la satisfacción respecto a la vía per se. De manera indirecta, se puede entender que la buena adherencia y persistencia del fármaco puede deberse a la satisfacción de los pacientes con su uso. Conviene tener en cuenta que al utilizarse el MTX parenteral para dosis en general más altas (en pacientes, por tanto, con una enfermedad más grave), puede existir mayor conciencia de necesidad, un aspecto crítico para la adherencia4.
La mayoría de los estudios que investigan una segunda línea en AR se decantan por los agentes biológicos y el MTX sc no está incluido en los escenarios. Sin embargo, el cambio de la administración oral a la parenteral en pacientes con una respuesta inadecuada también es ventajoso por razones de eficacia, ya que puede evitar el cambio a tratamiento biológico27,15,90. El análisis fármaco-económico del MTX parenteral muestra ahorro al conseguir una optimización adecuada del tratamiento y evita en la medida de lo posible el uso de fármacos biológicos, con su consecuente carga económica para el sistema y carga de efectos secundarios, particularmente infecciones.
A pesar de intentar abarcar el máximo número de aspectos de interés en torno al MTX, es difícil extraer unas conclusiones precisas. Esto puede deberse a que el nivel de evidencia de los trabajos encontrados es medio-bajo y, en muchos casos, el número de pacientes incluidos también limita la extrapolación de las conclusiones. De igual modo, la falta de una variable de resultado común en los distintos ámbitos analizados representa también otra limitación. Teniendo en cuenta los resultados de esta revisión, son necesarios más estudios del uso de MTX parenteral en otras enfermedades autoinmunes sistémicas, ya que los resultados obtenidos no permiten extraer conclusiones válidas.
Con las limitaciones inherentes dada la evidencia disponible, el MTX por vía parenteral podría ser una alternativa al uso de MTX oral si existe necesidad de aumento de dosis y hay problemas de tipo gastrointestinal, por su perfil de eficacia, seguridad, adherencia y resultados fármaco-económicos, especialmente en pacientes con AR.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.