El acoplamiento ventriculoarterial derecho (AVAD) puede alterarse precozmente antes de presentar disfunción del ventrículo derecho (VD) e hipertensión pulmonar; su medición en pacientes con artritis reumatoide (AR) ha sido poco estudiada.
ObjetivosDeterminar si existe diferencia en el AVAD en pacientes con AR. Investigar si existe la asociación en pacientes con AR para presentar acoplamiento ventriculoarterial anormal.
MétodosSe realizó un estudio unicéntrico, analítico, transversal, observacional. Se incluyeron los pacientes con diagnóstico de AR según los criterios de clasificación de la ACR/EULAR 2010, sin ninguna otra comorbilidad, a los que se les realizó un ecocardiograma en el Hospital Civil de Guadalajara Fray Antonio Alcalde. Se compararon los pacientes con controles sanos pareados por edad y género. Se contrastaron las variables clínicas, de laboratorio y ecocardiográficas. El AVAD se determinó con la relación strain longitudinal de la pared libre del VD/presión sistólica de la arteria pulmonar.
ResultadosSe incluyeron 51 pacientes en cada grupo. Dentro de las variables ecocardiográficas, se encontró que los pacientes con AR tenían mayor área telediastólica del VD y presión sistólica de la arteria pulmonar, mientras que fue menor la fracción de acortamiento del VD, el strain longitudinal de la pared libre del VD y el AVAD. Se asoció que el padecer AR era un factor asociado de manera independiente a la disminución del AVAD.
ConclusiónEl daño miocárdico subclínico del VD, determinado por el acoplamiento ventriculoarterial, está presente en los pacientes con AR. El padecer AR se asoció a presentar un acoplamiento ventriculoarterial anormal.
Right ventriculoarterial coupling (RVAC) is altered early before presenting right ventricular (RV) dysfunction and pulmonary hypertension; its measurement in patients with rheumatoid arthritis (RA) has been barely studied.
ObjectivesTo determine if there is a difference in RVAC in patients with RA. To investigate if there is an association in patients with RA to present abnormal RVAC.
MethodsA single-center, analytical, cross-sectional, observational study was performed. Patients with a diagnosis of RA were included according to the ACR/EULAR 2010 classification criteria, without any other comorbidity, and the echocardiograms were made at the Hospital Civil de Guadalajara Fray Antonio Alcalde. Patients were compared with healthy controls matched by age and gender. The clinical, laboratory and echocardiographic variables were contrasted. The RVAC was determined with the RV free wall longitudinal strain/pulmonary artery systolic pressure ratio.
ResultsFifty one patients were included in each group. Among the echocardiographic variables, it was found that patients with RA had a greater RV diastolic area and the pulmonary artery systolic pressure; while the RV fractional shortening, the RV free wall longitudinal strain and the RVAC were lower. RA was independently associated to an abnormal RVAC.
ConclusionThe RV subclinical myocardial damage, determined by the RVAC, is present in patients with RA, and it was associated with an abnormal ventriculoarterial coupling.
La artritis reumatoide (AR) es una enfermedad inflamatoria multisistémica que se manifiesta principalmente como una poliartritis periférica simétrica, sin embargo, la afección extraarticular ha sido ampliamente descrita. Específicamente las manifestaciones cardiovasculares que se han reportado son la cardiopatía isquémica, alteraciones pericárdicas, valvulopatías e hipertensión pulmonar1. La fisiopatología de la afección cardiovascular se puede explicar por anormalidades inmunológicas, inflamación sistémica, enfermedad de pequeños vasos, aterosclerosis acelerada y un estado procoagulante2,3.
Previamente se han descrito las múltiples alteraciones que puede provocar la AR en el corazón, siendo de las más descritas la cardiopatía isquémica, la insuficiencia cardiaca, las valvulopatías, la disfunción diastólica, las alteraciones del pericardio y la hipertensión pulmonar4. Recientemente ha habido múltiples estudios en los cuales se ha descrito que los pacientes con AR tienen un strain miocárdico reducido en comparación con controles sanos, demostrando un daño miocárdico subclínico mucho antes de que se pueda presentar alguna complicación como insuficiencia cardiaca, cardiopatía isquémica o hipertensión pulmonar5–11.
El acoplamiento ventriculoarterial derecho (AVAD) es la relación que guarda el ventrículo derecho para mantener una adecuada función del ventrículo con la poscarga generada por la presión pulmonar. Es un marcador de daño subclínico, además de ser predictor de mortalidad en pacientes con hipertensión pulmonar e insuficiencia cardiaca12.
El objetivo del estudio es determinar si los pacientes con AR presentan un mayor daño miocárdico subclínico determinado por un AVAD disminuido en comparación con controles sanos, además de determinar si existe asociación del padecer AR con la disminución del AVAD.
MétodosSe realizó un estudio unicéntrico, analítico, transversal, observacional. Se incluyeron los pacientes con diagnóstico de AR según los criterios de clasificación de la ACR/EULAR 2010, sin ninguna otra comorbilidad, a los que se les realizó un ecocardiograma en el Hospital Civil de Guadalajara Fray Antonio Alcalde. Se excluyeron los pacientes con alguna enfermedad concomitante conocida o que tuvieran el diagnóstico de alguna cardiopatía estructural, cardiopatía isquémica, enfermedad pulmonar intersticial o EPOC. Se compararon los pacientes con controles sanos pareados por edad y género. Se contrastaron las variables clínicas, de laboratorio y ecocardiográficas. Los ecocardiogramas fueron analizados por 2 cardiólogos con alta especialidad en ecocardiografía, para los cuales estuvieron cegados los datos clínicos de los pacientes. El ecocardiograma utilizado fue un ACUSON SC2000™ de Siemens; el strain miocárdico se realizó con la técnica VVI.
Las variables clínicas fueron: género, edad, índice de masa corporal, tiempo de evolución de la AR, escala visual análoga del médico y el paciente, índice clínico de actividad de la enfermedad –CDAI–, índice simplificado de actividad de la enfermedad –SDAI–, índice de actividad de la enfermedad –DAS28–, cuestionario de discapacidad de la enfermedad –HAQ-DI–, abordaje global del médico –PhsGA– y abordaje global del paciente –PxGA–.
Las variables de laboratorio fueron: hemoglobina (g/dL), leucocitos (109/L), creatinina (mg/dL), colesterol total (mg/dL), c-HDL (mg/dL), c-LDL (mg/dL), proteína C reactiva (PCR) (mg/L), factor reumatoide (U/mL) y anticuerpos anti-CCP. Se calculó el riesgo cardiovascular de todos los pacientes por medio de las escalas de la American Heart Association/American College of Cardiology (AHA/ACC) y el Cardiovascular Risk Score (QRISK).
Las variables ecocardiográficas que se determinaron fueron: la fracción de expulsión del ventrículo izquierdo, el volumen indexado del ventrículo izquierdo, el volumen indexado de la aurícula izquierda, el área diastólica del ventrículo derecho, la fracción de acortamiento del ventrículo derecho, el volumen de la aurícula derecha, la presión sistólica de la arteria pulmonar (PSAP), el strain longitudinal de la pared libre del ventrículo derecho (SLPLVD), el strain longitudinal global (SLG) de la aurícula derecha; el AVAD se determinó con la relación SLPLVD/PSAP.
El strain miocárdico se refiere a qué porcentaje se acorta o se alarga durante el ciclo cardiaco cada fibra miocárdica; específicamente, el SLPLVD se refiere a qué tanto se acortan las fibras miocárdicas de la pared libre en sentido longitudinal, es decir, el movimiento de la base hacia la punta del ventrículo derecho.
Se contrastaron las variables cuantitativas con la t de Student o la U de Mann-Whitney, según la normalidad de las variables; las variables cualitativas se compararon con χ2. Se determinó la asociación con AVAD anormal con análisis mediante regresión múltiple; las variables con p<0,1 pasaron al siguiente modelo.
Se realizó el análisis estadístico mediante el software MedCalc versión 15.0. Se determinó significación estadística con una p<0,05.
Se siguieron las reglas del Comité de Ética del Hospital Civil de Guadalajara Fray Antonio Alcalde, siendo aprobado con el folio CEI 272/23, que se basa en la declaración de Helsinki.
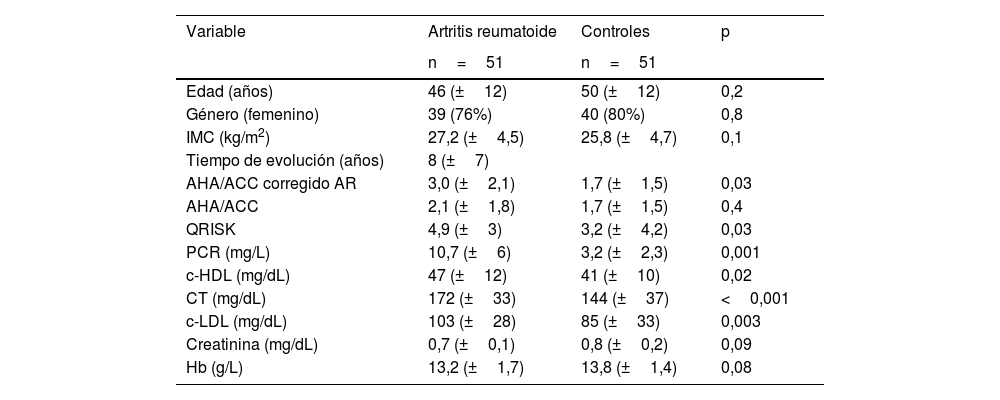
ResultadosSe recabaron en total 51 pacientes con diagnóstico de AR, pareados por edad y género con controles sanos (tabla 1). La media de edad fue de 46 años, hubo una proporción mayor de género femenino, siendo 4 de cada 5 pacientes mujeres. Los pacientes con AR tenían mayor grado de riesgo cardiovascular según las escalas de AHA/ACC y QRISK.
Comparación de las características clínicas y de laboratorio de los pacientes
| Variable | Artritis reumatoide | Controles | p |
|---|---|---|---|
| n=51 | n=51 | ||
| Edad (años) | 46 (±12) | 50 (±12) | 0,2 |
| Género (femenino) | 39 (76%) | 40 (80%) | 0,8 |
| IMC (kg/m2) | 27,2 (±4,5) | 25,8 (±4,7) | 0,1 |
| Tiempo de evolución (años) | 8 (±7) | ||
| AHA/ACC corregido AR | 3,0 (±2,1) | 1,7 (±1,5) | 0,03 |
| AHA/ACC | 2,1 (±1,8) | 1,7 (±1,5) | 0,4 |
| QRISK | 4,9 (±3) | 3,2 (±4,2) | 0,03 |
| PCR (mg/L) | 10,7 (±6) | 3,2 (±2,3) | 0,001 |
| c-HDL (mg/dL) | 47 (±12) | 41 (±10) | 0,02 |
| CT (mg/dL) | 172 (±33) | 144 (±37) | <0,001 |
| c-LDL (mg/dL) | 103 (±28) | 85 (±33) | 0,003 |
| Creatinina (mg/dL) | 0,7 (±0,1) | 0,8 (±0,2) | 0,09 |
| Hb (g/L) | 13,2 (±1,7) | 13,8 (±1,4) | 0,08 |
AHA/ACC: American Heart Association/American College of Cardiology; AR: artritis reumatoide; c-HDL: colesterol unido a lipoproteínas de alta densidad; c-LDL: colesterol unido a lipoproteínas de baja densidad; CT: colesterol total; Hb: hemoglobina; IMC: índice de masa corporal; PCR: proteína C reactiva; QRISK: Cardiovascular Risk Score.
Dentro de los parámetros bioquímicos, se encontró diferencia significativa en los valores de hemoglobina, siendo menor en los pacientes con AR, los valores de colesterol total fueron mayores en pacientes con AR, además de tener mayor riesgo aterogénico por presentar niveles más elevados de c-LDL.
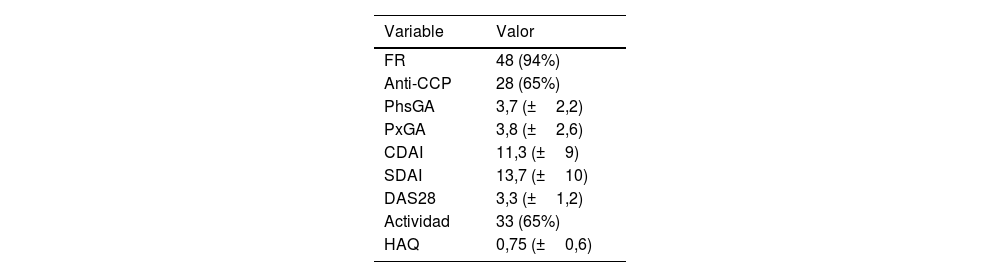
La mediana de tiempo de evolución con AR fue de 8 años, con una media de DAS28, PCR de 3,3 puntos, y el 65% presentaban criterios de actividad de la enfermedad (tabla 2).
Parámetros de los pacientes con artritis reumatoide
| Variable | Valor |
|---|---|
| FR | 48 (94%) |
| Anti-CCP | 28 (65%) |
| PhsGA | 3,7 (±2,2) |
| PxGA | 3,8 (±2,6) |
| CDAI | 11,3 (±9) |
| SDAI | 13,7 (±10) |
| DAS28 | 3,3 (±1,2) |
| Actividad | 33 (65%) |
| HAQ | 0,75 (±0,6) |
Anti-CCP: anticuerpos antipéptidos cíclicos citrulinados; CDAI: índice clínico de actividad de la enfermedad; DAS28: índice de actividad de la enfermedad; FR: factor reumatoide; HAQ: cuestionario de discapacidad de la enfermedad; PhsGA: abordaje global del médico; PxGA: abordaje global del paciente; SDAI: índice simplificado de actividad de la enfermedad.
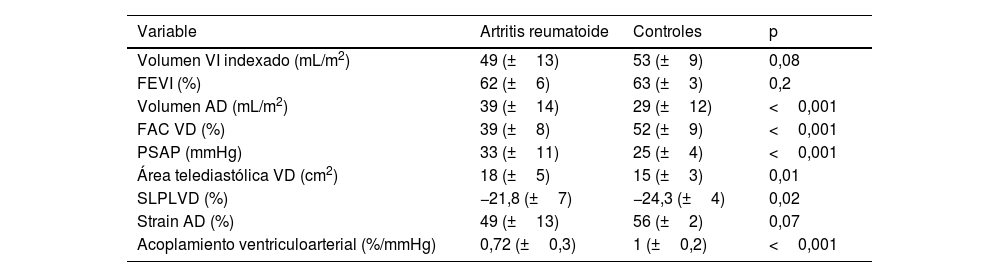
En cuanto a las variables ecocardiográficas (tabla 3), no se encontró diferencia en la fracción de expulsión del ventrículo izquierdo, el volumen indexado del ventrículo izquierdo, el volumen de la aurícula derecha ni el SLG de la aurícula derecha; en cambio, existió diferencia en el área telediastólica y la PSAP, siendo mayores en pacientes con AR, mientras que la fracción de acortamiento del ventrículo derecho, el SLPLVD y el AVAD fueron menores en AR.
Comparación de las variables ecocardiográficas
| Variable | Artritis reumatoide | Controles | p |
|---|---|---|---|
| Volumen VI indexado (mL/m2) | 49 (±13) | 53 (±9) | 0,08 |
| FEVI (%) | 62 (±6) | 63 (±3) | 0,2 |
| Volumen AD (mL/m2) | 39 (±14) | 29 (±12) | <0,001 |
| FAC VD (%) | 39 (±8) | 52 (±9) | <0,001 |
| PSAP (mmHg) | 33 (±11) | 25 (±4) | <0,001 |
| Área telediastólica VD (cm2) | 18 (±5) | 15 (±3) | 0,01 |
| SLPLVD (%) | −21,8 (±7) | −24,3 (±4) | 0,02 |
| Strain AD (%) | 49 (±13) | 56 (±2) | 0,07 |
| Acoplamiento ventriculoarterial (%/mmHg) | 0,72 (±0,3) | 1 (±0,2) | <0,001 |
AD: aurícula derecha; FAC: fracción de acortamiento; FEVI: fracción de expulsión del ventrículo izquierdo; PSAP: presión sistólica de la arteria pulmonar; SLPLVD: strain longitudinal de la pared libre del ventrículo derecho; VD: ventrículo derecho; VI: ventrículo izquierdo.
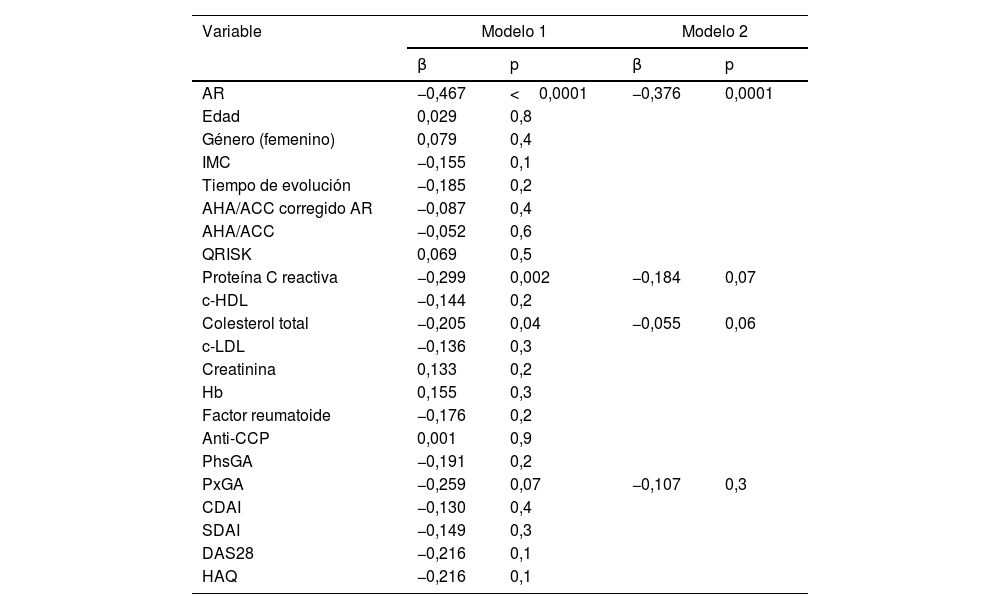
Al realizar la regresión múltiple (tabla 4) en búsqueda de una asociación con un AVAD disminuido, pudimos encontrar que el presentar AR era un factor asociado, así como también los niveles de PCR y colesterol total; en el modelo 2, sólo el padecer AR fue un factor independientemente asociado a un AVAD disminuido.
Asociación de variables clínicas con un acoplamiento ventriculoarterial derecho anormal
| Variable | Modelo 1 | Modelo 2 | ||
|---|---|---|---|---|
| β | p | β | p | |
| AR | −0,467 | <0,0001 | −0,376 | 0,0001 |
| Edad | 0,029 | 0,8 | ||
| Género (femenino) | 0,079 | 0,4 | ||
| IMC | −0,155 | 0,1 | ||
| Tiempo de evolución | −0,185 | 0,2 | ||
| AHA/ACC corregido AR | −0,087 | 0,4 | ||
| AHA/ACC | −0,052 | 0,6 | ||
| QRISK | 0,069 | 0,5 | ||
| Proteína C reactiva | −0,299 | 0,002 | −0,184 | 0,07 |
| c-HDL | −0,144 | 0,2 | ||
| Colesterol total | −0,205 | 0,04 | −0,055 | 0,06 |
| c-LDL | −0,136 | 0,3 | ||
| Creatinina | 0,133 | 0,2 | ||
| Hb | 0,155 | 0,3 | ||
| Factor reumatoide | −0,176 | 0,2 | ||
| Anti-CCP | 0,001 | 0,9 | ||
| PhsGA | −0,191 | 0,2 | ||
| PxGA | −0,259 | 0,07 | −0,107 | 0,3 |
| CDAI | −0,130 | 0,4 | ||
| SDAI | −0,149 | 0,3 | ||
| DAS28 | −0,216 | 0,1 | ||
| HAQ | −0,216 | 0,1 | ||
AHA/ACC: American Heart Association/American College of Cardiology; Anti-CCP: anticuerpos antipéptidos cíclicos citrulinados; AR: artritis reumatoide; CDAI: índice clínico de severidad de la enfermedad; c-HDL: colesterol unido a lipoproteínas de alta densidad; c-LDL: colesterol unido a lipoproteínas de baja densidad; DAS28: índice de actividad de la enfermedad; HAQ: cuestionario de discapacidad de la enfermedad; Hb: hemoglobina; IMC: índice de masa corporal; PhsGA: abordaje global del médico; PxGA: abordaje global del paciente; QRISK: Cardiovascular Risk Score; SDAI: índice simplificado de actividad de la enfermedad.
El principal hallazgo en este estudio fue la presencia de un AVAD anormal, caracterizado por la disminución en la relación SLPLVD PSAP en pacientes con AR activa sin antecedente de enfermedades cardiovasculares, en comparación con un grupo control normal. Además, se encontró la presencia de alteraciones en las dimensiones de las cavidades derechas (ventrículo/aurícula), caracterizadas por un incremento del volumen telediastólico y una menor función sistólica, determinada por la fracción de acortamiento y el strain longitudinal.
Aunque hasta hace algunos años se consideraba al ventrículo derecho como el «ventrículo olvidado», la tendencia sobre su estudio ha ido en incremento por la implicación clínica que conlleva. Lo anterior, es el motivo por el cual se eligió esta cavidad como objetivo del estudio, a través del cociente SLPLVD/PSAP como método para determinar daño miocárdico subclínico. Fine et al. encontraron un SLG biventricular deteriorado en 59 pacientes con AR que compararon con sujetos normales13.
Además, otro estudio realizado con población mexicana con AR realizado por Azpiri-Lopez et al.14 demostró que la función sistólica determinada por la excursión sistólica del anillo tricuspídeo estaba disminuida en pacientes con AR, y también se investigó el AVAD, mediante la relación excursión sistólica del anillo tricuspídeo/PSAP, siendo esta también menor en esta población de pacientes.
La función sistólica del ventrículo izquierdo, determinada por la fracción de expulsión, fue normal en ambos grupos, lo que confirma la utilidad de la metodología de strain para detectar el daño miocárdico de manera temprana. Este hallazgo fue respaldado por Naseem et al.15, quienes estudiaron a 120 pacientes con AR activa y evaluaron la relación del grado de actividad de la enfermedad con la función ventricular izquierda y derecha mediante ecocardiograma con método de strain, y reportaron una asociación estadísticamente significativa entre la puntuación de la enfermedad y la predicción de disfunción ventricular derecha subclínica (r=−0,682, p≤0,001 y r=−0,731, valor de p≤0,001) para las puntuaciones SDAI y DAS28, respectivamente.
En estudios previos, se ha asociado el estado inflamatorio sistémico crónico inherente a la AR como un mecanismo de disfunción miocárdica subclínica debido al proceso fibrótico celular y microvascular. En nuestro estudio, la elevación de los marcadores inflamatorios estudiados (PCR) mantuvo una franca significación estadística con los hallazgos ecocardiográficos previamente mencionados. Lo anterior, fue respaldado por Løgstrup et al.16, quienes evaluaron la función ventricular izquierda en relación con los niveles séricos de anti-CCP, encontrando una correlación significativa entre el deterioro del SLG y los títulos de anti-CCP durante el seguimiento a 2 años. Esto es contrario a los datos reportados por Magda et al.17, quienes no encontraron relación significativa en los marcadores biológicos de inflamación y fibrosis miocárdica (PCR, interleucinas 6 y 10, selectina P) debido al aparente adecuado control terapéutico de su grupo de estudio.
Un aspecto importante a mencionar, debido a las implicaciones clínicas que conlleva en fases tardías de la enfermedad, es la PSAP. Si bien en ambos grupos de nuestro estudio se mantuvo dentro de rangos normales, se observa significación estadística para el incremento encontrado en pacientes con AR, lo que demuestra la utilidad del ecocardiograma como herramienta diagnóstica en fases tempranas de hipertensión pulmonar. Ünlü et al.18, a través del análisis retrospectivo de ecocardiogramas en pacientes con hipertensión arterial pulmonar precapilar, demostraron que la relación SLPLVD/PSAP mostró una adecuada predicción con una sensibilidad del 92% y una especificidad del 82,5%. Aunque no existe una validación de este método en el contexto de la AR, permite realizar una mayor investigación en torno a encontrar herramientas no invasivas.
Tal como se mostró en nuestros resultados, las escalas de riesgo (AHA/ACC adaptado para AR y QRISK) demostraron de manera estadísticamente significativa un mayor riesgo cardiovascular, confirmando que la AR es considerada un factor de riesgo cardiovascular en las personas que la padecen. En su estudio, Magda et al.17 encontraron la misma asociación, representada por la presencia de disfunción subclínica del ventrículo derecho en pacientes con ausencia de enfermedad cardiovascular o pulmonar conocida. Múltiples estudios2,8,19–24 han demostrado que los pacientes con AR tienen mayor riesgo de aterosclerosis, así como tener niveles más altos de colesterol total y c-LDL en comparación con controles sanos, por lo que no es de extrañar que en nuestra cohorte de pacientes se haya visto esta relación.
De acuerdo con el análisis estadístico realizado, se observó una asociación estadísticamente significativa para presentar un AVAD anormal en pacientes con la enfermedad activa de AR, evaluados mediante la evaluación global de la enfermedad por el médico y con niveles positivos de PCR y colesterol total. Lo anterior coincide con lo observado por Midtbø et al.25 al estudiar a 78 pacientes y advertir un mayor acortamiento del SLG en pacientes con la enfermedad activa, comparados con pacientes con AR en remisión (49). Los niveles de colesterol total fueron otro marcador que presentó asociación significativa (β=−0,205, p≤0,04), dato a considerar ya que en el estudio realizado por Naseem et al.15 no encontraron mayor asociación.
Entre las limitaciones del trabajo se encuentra que es un estudio unicéntrico y con una muestra relativamente pequeña de pacientes. Otro punto para tomar en cuenta es que la mayoría de los pacientes se encontraban con actividad de la enfermedad.
Según nuestro conocimiento este es el primer estudio donde se documenta la asociación franca de la AR con la disminución del AVAD, siendo un hecho relevante porque nos habla del daño miocárdico subclínico de esta población de pacientes, pudiendo ser un marcador precoz de aumento de presiones pulmonares. El presente trabajo y sus resultados pueden servir de antecedente para futuros estudios multicéntricos y con un mayor número de pacientes y variables de acuerdo con los diferentes contextos demográficos que se observan en la evolución de la enfermedad, antes de determinar el uso clínico de rutina de este método ecocardiográfico.
Un punto importante para considerar en estudios prospectivos y que en el presente no se tomó en cuenta es la asociación e influencia de la terapia para la enfermedad con los resultados obtenidos para determinar una posible contención de daño miocárdico o el uso definitivo de terapia cardiovascular. Nos lleva a la pregunta de si dando un tratamiento más intensivo de manera temprana en los pacientes con AR pueda cambiar el curso del daño miocárdico. Este estudio abre las puertas a aclarar estas interrogantes en futuras líneas de investigación, para disminuir la morbimortalidad cardiovascular de los pacientes con AR.
ConclusionesLos pacientes con AR presentan un AVAD anormal, determinado por una relación SLPLVD/PSAP disminuida, además de presentar asociación de la AR con los valores anormales de AVAD. Este valor nos indica el daño miocárdico subclínico que se encuentra presente en los pacientes con AR, siendo un marcador precoz de disfunción del ventrículo derecho al aumento de las presiones pulmonares.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.