Las pruebas de laboratorio en las miopatías inflamatorias idiopáticas (MII) son útiles en el diagnóstico de estas enfermedades. Actualmente hay dos grupos de pruebas: uno que cuantifica las enzimas que se elevan por la inflamación muscular y otro que detecta la presencia de autoanticuerpos que ocurren por el proceso autoinmune de la enfermedad. La más importante de las enzimas en el diagnóstico y manejo de las MII es la creatina cinasa. Otras enzimas importantes son la aspartato aminotransferasa, la alanina aminotransferasa, la aldolasa y la deshidrogenasa láctica.
De los autoanticuerpos, los anticuerpos antinucleares son los más importantes. Ocurren entre el 50–80% de los pacientes con MII y ayudan a definir subgrupos clínicos. Se dividen en dos grupos: los autoanticuerpos específicos de miositis (MSA) y los autoanticuerpos asociados a miositis. De los MSA, los más útiles son el anti-Jo-1 y el anti-Mi-2.
Laboratory tests in inflammatory myopathies (IIM) are of great help in the diagnosis of these diseases. Two main groups can be defined, one of them quantifies the muscle enzymes that reflect muscle inflammation and the other one detects the presence of autoantibodies which reflect the autoimmune process in these diseases. The most important muscle enzyme is creatine kinase and other enzymes to take into consideration are aspartate and alanine aminotransferase, aldolase and lactic dehydrogenase.
In the autoantibodies group, antinuclear antibodies are the most important, since they occur in approximately 50–80% of patients with IIM and help define the distinct disease sub-groups. They are divided into myositis specific antibodies (MSA) and myositis associated antibodies (MAA). The most important MSA are anti-Jo-1 antibody which occur in patients with Polymyositis and anti-Mi-2 antibody that occur in patients with Dermatomyositis.
Las pruebas de laboratorio que se utilizan para evaluar a los pacientes con sospecha de miopatías inflamatorias idiopáticas se dividen en 2 categorías principales: 1) la cuantificación de enzimas y otras moléculas que detectan el proceso inflamatorio y el daño muscular per se, y 2) las pruebas que detectan el proceso autoinmune de la enfermedad, en las que se incluyen los distintos autoanticuerpos asociados a las miopatías inflamatorias. El poder conjuntar estos dos tipos de pruebas de laboratorio resulta de gran importancia para el diagnóstico y manejo de este grupo de miopatías.
Enzimas muscularesLa medición de la actividad enzimática liberada por el músculo inflamado ha sido utilizada por muchos años y continúa siendo un elemento diagnóstico importante para el manejo de estas miopatías. La mioglobina es un elemento detectable en el suero de casi todos los pacientes con miopatías inflamatorias activas y podría ser un elemento de mayor sensibilidad para definir miositis activa, pero por su poca disponibilidad es evaluada con menor frecuencia que las enzimas tradicionales. Asimismo, la medición de las troponinas ha ido en aumento en los últimos años, aunque sabemos que su utilidad es mayormente dirigida hacia el daño del músculo cardíaco, lo que rara vez se observa en las miopatías inflamatorias1.
La elevación de enzimas musculares observadas en pacientes con miositis refleja la presencia de daño muscular y ayuda a diferenciar estas miopatías con otras enfermedades musculares, como las atrofias o las miopatías secundarias al uso de esteroides2.
Creatina cinasaEsta enzima desempeña una función muy importante en el transporte energético del músculo, ya que transfiere un fosfato altamente energético de ATP a creatina para formar creatina fosfato y adenosín bifosfato (ADP) y viceversa. La molécula creatina fosfato tiene la función de almacenar energía para la regeneración de ATP durante una alta demanda energética y, asimismo, sirve como un transportador para movilizar energía de la mitocondria al sarcoplasma3.
Tradicionalmente, esta enzima ha sido considerada la prueba de laboratorio más importante para el diagnóstico y manejo de los pacientes adultos con miositis, ya que la creatina cinasa (CK) es la más sensible para medir daño muscular. El aumento de esta enzima en miositis usualmente se eleva 10 veces por arriba de su límite superior normal, pero puede llegar hasta 100 veces más de su valor normal.
La mayoría de los pacientes con miositis activa (80–90%) muestran elevación de la CK en su primera evaluación médica, y alrededor del 95% de todos los pacientes con miositis presentará elevación enzimática durante algún punto del curso de la enfermedad. Sin embargo, en un número pequeño de pacientes se ha observado que no presentan elevación de esta enzima y esto puede ocurrir en etapas tardías de la enfermedad, quizá debido a un curso prolongado de inflamación muscular y, por ende, una reducida masa muscular presente en el paciente4. Los niveles de CK usualmente son un buen parámetro para correlacionar el grado de actividad en las miopatías inflamatorias, sin embargo, un par de estudios trataron de correlacionar la actividad de la enfermedad con medidas funcionales y de fuerza y no lograron encontrar resultados significativos5,6.
Otras enzimas muscularesOtras enzimas útiles para medir la actividad de la enfermedad y especialmente en casos donde los niveles de CK son normales son la deshidrogenasa láctica (DHL), la aspartato aminotransferasa (antes conocida como transaminasa glutámico-oxalacética), la alanina aminotransferasa (antes conocida como transaminasa glutámico-pirúvica) y la aldolasa. La mayoría de los pacientes van a presentar elevación de al menos una de estas enzimas durante algún momento de su enfermedad7.
La aldolasa es una enzima que usualmente está presente en muchos tejidos, por lo que podemos observar elevación de esta enzima en muchas otras condiciones, como daño hepático, lo cual podría causar confusión sobre la actividad de la miositis8. La DHL que está presente en el tejido muscular es su isoenzima 5, y ha mostrado buena correlación con la actividad de la dermatomiositis (DM) juvenil y ha superado a las otras enzimas en este contexto9. Es importante notar que la elevación de la DHL sin otras enzimas involucradas nos obliga a considerar la posibilidad de hemólisis o algún trastorno linfoproliferativo, que deben investigarse.
Las transaminasas se pueden elevar cuando hay daño al tejido muscular, con mayor presencia de la aspartato aminotransferasa sobre la alanina aminotransferasa, y también es de gran utilidad en el monitoreo de actividad de la enfermedad en pacientes con DM juvenil. Sin embargo, su elevación puede confundirse con un diagnóstico erróneo de enfermedad hepática si no se reconoce la miopatía, especialmente en los casos en los que se monitorea el tratamiento con metotrexato10,11.
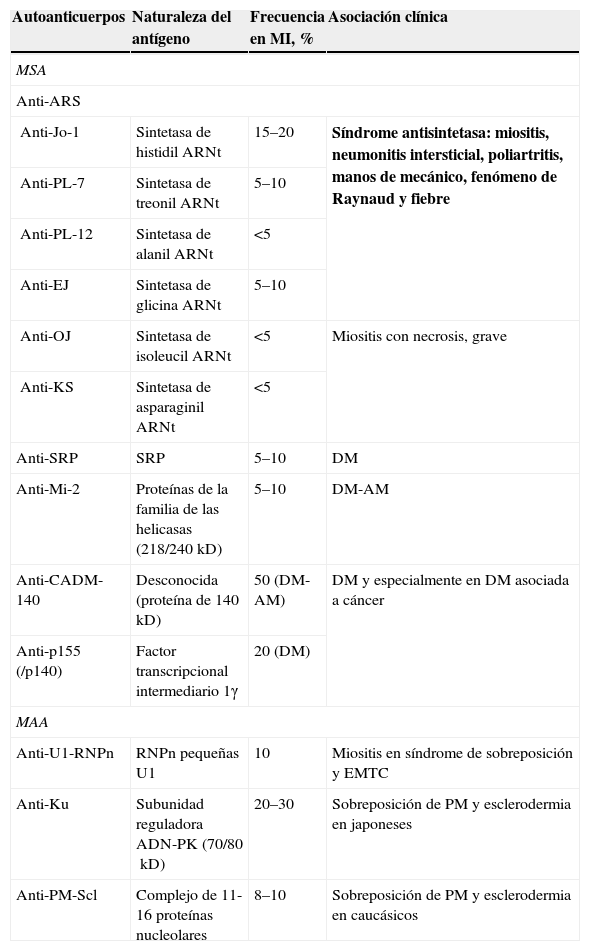
AutoanticuerposLa investigación de autoanticuerpos en el suero de pacientes con enfermedades reumáticas ha sido muy importante en los últimos 20 años y, aunque su valor diagnóstico es limitado, su principal utilidad ha sido como marcadores para el diagnóstico, y en algunos casos ayudan, además, a identificar subgrupos clínicos de ciertas enfermedades. En las miopatías inflamatorias los autoanticuerpos que se han encontrado se dividen en dos grandes grupos: 1) autoanticuerpos específicos de miositis (MSA) y 2) autoanticuerpos asociados a miositis (MAA) (tabla 1).
Autoanticuerpos en miositis, naturaleza del antígeno y su asociación clínica
| Autoanticuerpos | Naturaleza del antígeno | Frecuencia en MI, % | Asociación clínica |
| MSA | |||
| Anti-ARS | |||
| Anti-Jo-1 | Sintetasa de histidil ARNt | 15–20 | Síndrome antisintetasa: miositis, neumonitis intersticial, poliartritis, manos de mecánico, fenómeno de Raynaud y fiebre |
| Anti-PL-7 | Sintetasa de treonil ARNt | 5–10 | |
| Anti-PL-12 | Sintetasa de alanil ARNt | <5 | |
| Anti-EJ | Sintetasa de glicina ARNt | 5–10 | |
| Anti-OJ | Sintetasa de isoleucil ARNt | <5 | Miositis con necrosis, grave |
| Anti-KS | Sintetasa de asparaginil ARNt | <5 | |
| Anti-SRP | SRP | 5–10 | DM |
| Anti-Mi-2 | Proteínas de la familia de las helicasas (218/240kD) | 5–10 | DM-AM |
| Anti-CADM-140 | Desconocida (proteína de 140kD) | 50 (DM-AM) | DM y especialmente en DM asociada a cáncer |
| Anti-p155 (/p140) | Factor transcripcional intermediario 1γ | 20 (DM) | |
| MAA | |||
| Anti-U1-RNPn | RNPn pequeñas U1 | 10 | Miositis en síndrome de sobreposición y EMTC |
| Anti-Ku | Subunidad reguladora ADN-PK (70/80kD) | 20–30 | Sobreposición de PM y esclerodermia en japoneses |
| Anti-PM-Scl | Complejo de 11-16 proteínas nucleolares | 8–10 | Sobreposición de PM y esclerodermia en caucásicos |
ADN: ácido desoxirribonucleico; ADN-PK: proteína cinasa dependiente de ADN; AM: amiopática; Anti-ARS: anticuerpos antisintetasa del aminoacil del ARN de transferencia; ARNt: ácido ribonucleico de transferencia; DM: dermatomiositis; EMTC: enfermedad mixta del tejido conjuntivo; MAA: autoanticuerpos asociados a miositis; MI: miopatía inflamatoria; MSA: autoanticuerpos específicos de miositis; PM: polimiositis; RNPn: ribonucleoproteínas nucleares; SRP: partículas de reconocimiento de señales.
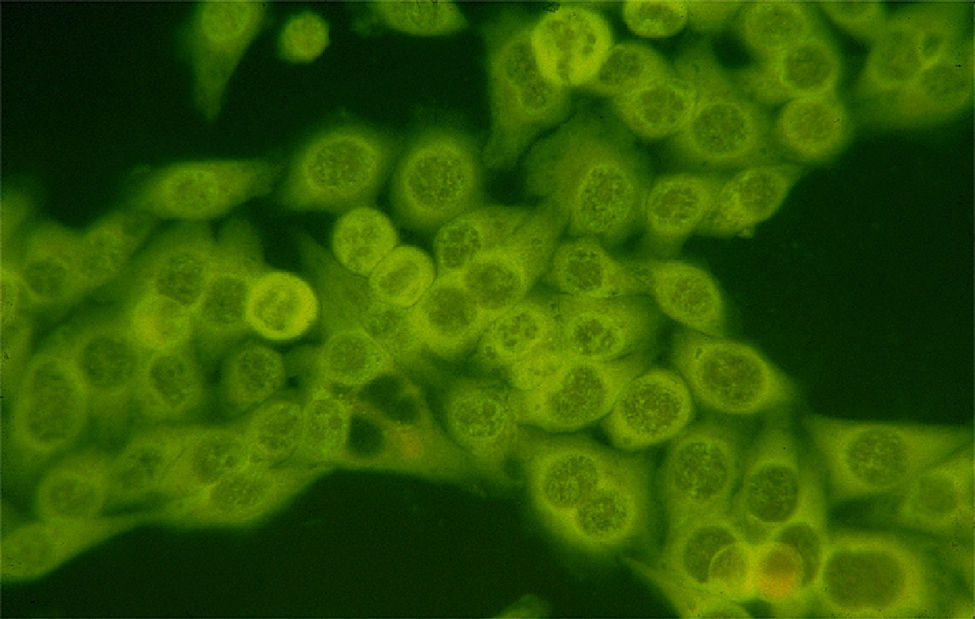
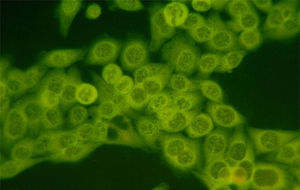
La búsqueda de estos autoanticuerpos se lleva a cabo con el método de inmunofluorescencia indirecta en células HEp-2, que se considera todavía como el estándar de oro. Con este método, los anticuerpos son positivos en un 50–80% de los pacientes con miopatías inflamatorias y son más frecuentes en pacientes con DM y polimiositis (PM) que en los pacientes con miositis por cuerpos de inclusión. Otro dato importante que hay que enfatizar es que los títulos elevados de estos anticuerpos en pacientes con miopatías se observan con mayor frecuencia en pacientes que tienen un síndrome de sobreposición con otras enfermedades autoinmunes y los títulos bajos generalmente se presentan en pacientes con miopatías asociadas a neoplasias. Por otra parte, en los pacientes con distrofias y con otras miopatías no autoinmunes los anticuerpos son negativos12,13.
El patrón más frecuente de anticuerpos antinucleares que se observa en estos pacientes es el moteado fino/grueso; sin embargo, entre el 10–15% de los pacientes presenta un patrón citoplásmico puro (fig. 1). Aproximadamente la mitad de los pacientes con miositis tienen autoanticuerpos específicos, cada anticuerpo de este grupo (MSA) se asocia a alguna característica clínica, muchas de las cuales son manifestaciones extramusculares, como el eritema en la DM y la enfermedad pulmonar intersticial en PM12,14.
Autoanticuerpos específicos de miositisDentro de este grupo de autoanticuerpos, los más importantes son los que están dirigidos contra unas enzimas del citoplasma de las células llamadas sintetasas. La función de estas enzimas es catalizar la unión de los aminoácidos a su correspondiente ARN de transferencia de una manera dependiente de energía. A la fecha se han identificado 6 diferentes autoanticuerpos: anti-Jo-1 (histidil), anti-PL-7 (treonil), anti-PL-12 (alanil), anti-EJ (glicil), anti-OJ (isoleucil) y anti-KS (asparaginil)15.
Con algunas excepciones, estos pacientes sólo presentarán uno de estos anticuerpos, sin embargo, las asociaciones clínicas en pacientes con anticuerpos anti-Jo-1 han sido extensamente estudiadas y se ha logrado identificar diferencias significativas en los pacientes con miopatías inflamatorias sin anticuerpos antisintetasas. La presencia de estos anticuerpos en estos pacientes se asocia en la mayoría de los casos al llamado síndrome antisintetasa, que está caracterizado por miositis, poliartritis, fiebre, fenómeno de Raynaud, manos de mecánico y enfermedad pulmonar intersticial, que puede llegar a ser incapacitante y a empeorar el pronóstico14.
Dentro de este grupo de autoanticuerpos se encuentran también los anticuerpos contra partículas de reconocimiento de señales, los cuales reconocen a una ribonucleoproteína compuesta de 6 proteínas unidas al ácido ribonucleico 7SL (7SL ARN), cuya función es asistir en la traslocación de algunos polipéptidos del citoplasma al retículo endoplásmico. Tiene un peso molecular de 54 kD y se une a la porción cercana al ribosoma; sin embargo, la utilidad clínica de estos anticuerpos no ha sido bien definida16. En un estudio se encontró a 6 pacientes con este anticuerpo, y una de las características principales es que tenían una presentación aguda más agresiva que el resto de los pacientes, la biopsia mostraba más necrosis que inflamación y tuvieron una pobre respuesta al tratamiento y un mal pronóstico, con una tasa de sobrevida a 5 años del 25%12.
El anticuerpo anti-Mi-2 es otro anticuerpo específico de miositis, el cual fue uno de los primeros en asociarse a miopatías inflamatorias y su caracterización completa ocurrió a finales del año 2000. La molécula reconocida por este anticuerpo consiste en un complejo de 8 proteínas, siendo la más grande el antígeno que se reconoce con mayor frecuencia, que tiene un peso molecular de 240kD17. Los estudios iniciales en los que se utilizó inmunodifusión y posteriormente inmunoprecipitación encontraron una gran asociación de este anticuerpo en los pacientes con DM. Su frecuencia ha sido similar en adultos y niños con manifestaciones clínicas clásicas de eritema en heliotropo, pápulas de Gottron, signo de la V en el cuello y el signo del chal. Al igual que algunos anticuerpos antisintetasas, estudios inmunogenéticos han logrado identificar una asociación entre este anticuerpo dirigido contra una enzima helicasa del núcleo celular (anti-Mi-2) al haplotipo HLA-DR718. Algunos pacientes con anti-Mi-2 tienen enfermedad severa o recurrente, pero como grupo tienen poca frecuencia de enfermedad pulmonar intersticial y, por ende, el pronóstico suele ser mejor que en los pacientes con antisintetasas.
Recientemente, se han identificado nuevos anticuerpos dentro de este grupo de anticuerpos específicos de miositis, especialmente en pacientes con DM amiopática y en miositis asociada a neoplasias. Uno de ellos es el anti-C-ADM que fue identificado por Sato et al, quienes encontraron que está dirigido contra una proteína de 140kD y se ha encontrado en pacientes con los hallazgos típicos de DM, como eritema en heliotropo y signo de Gottron, pero sin debilidad muscular o mialgias, y con niveles normales de enzimas musculares19.
El otro anticuerpo identificado es el anti-p155, reconocido por Targoff et al, el cual está dirigido contra una proteína de 155kD. Se ha encontrado en pacientes con datos típicos de DM así como en pacientes con DM asociada a cáncer20.
Autoanticuerpos asociados a miositisDentro de este grupo de autoanticuerpos, los más importantes que se han descrito son los anticuerpos anti-U1-RNPn, los cuales están dirigidos contra ribonucleoproteínas nucleares pequeñas unidas al U1 ARN. Estos anticuerpos se encuentran en un 10% de pacientes con miositis asociada a síndromes de sobreposición y en pacientes con enfermedad mixta del tejido conjuntivo21.
Otro anticuerpo perteneciente a este grupo es el anticuerpo anti-Ku, el cual está dirigido contra la subunidad reguladora ácido desoxirribonucleico (ADN)-PK, una proteína cinasa dependiente de ADN y con peso molecular de 70–80kD. Estos anticuerpos se han encontrado en un 20–30% de los pacientes japoneses que tienen un síndrome de sobreposición de PM y esclerodermia22.
Finalmente, el anticuerpo anti-PM-Scl, el cual reconoce como antígeno a un complejo de 11–16 proteínas nucleolares y se ha detectado en aproximadamente el 10% de los pacientes caucásicos que tienen un síndrome de sobreposición de PM y esclerodermia23.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónParte de este trabajo se realizó gracias al apoyo del Programa Nacional de Posgrado de Calidad (PNPC) del Consejo Nacional de Ciencia y Tecnología (CONACYT) al Departamento de Inmunología y Reumatología del Hospital General de Occidente.