En su mayoría, las infecciones por estreptococos del grupo B de la clasificación de Lancefield (Streptococcus agalactiae) afectan a mujeres gestantes o durante el puerperio, así como a neonatos. Durante las tres últimas décadas, se han comunicado cada vez más infecciones invasivas en adultos sin relación con la gestación, aunque las artritis y osteomielitis siguen siendo muy poco frecuentes. En este artículo, describimos 4 nuevos pacientes adultos con artritis séptica por S. agalactiae (2 mujeres posmenopáusicas y 2 varones), dos de ellos con afectación esternoclavicular, y realizamos una revisión de la literatura.
Most infections by group B streptococcus of the Lancefield classification (Streptococcus agalactiae), were reported in pregnant women or during the puerperal period, as well as in neonates. During the past three decades there have been reports of increasingly invasive infections in adults unrelated to pregnancy, although arthritis and osteomyelitis are still very rare. In this article, we describe four new adult patients with arthritis by S. agalactiae (two postmenopausal women and two men), two of them with affection of the sternoclavicular joint. We also review the medical literature.
El Streptococcus agalactiae es un coco grampositivo perteneciente al grupo B de la clasificación de Lancefield que puede disponerse en cadenas y en parejas (diplococos). Constituye una de las bacterias de la flora vaginal de mujeres gestantes, de la uretra de ambos sexos, del recto y de la faringe. Ha sido causa tradicional de graves enfermedades en mujeres grávidas, durante el periodo puerperal, y en los recién nacidos1,2. En adultos, la primera artritis séptica por S. agalactiae fue descrita en 1940 por Ranz3, pero esta complicación se consideró excepcional hasta la década de los 80, momento en que el número de comunicaciones en adultos comenzó a incrementarse de forma gradual. La revisión de la literatura hasta diciembre de 2008 mediante Medline, Embase y Ovid nos ha permitido localizar únicamente 147 casos4–20. Por este motivo, hemos considerado de interés aportar 4 nuevos casos de artritis séptica por este microorganismo, 3 sobre articulaciones nativas, 2 de ellas de localización esternoclavicular, y otra sobre una prótesis de rodilla.
Casos clínicosCaso 1Varón de 58 años con antecedentes de EPOC y diverticulosis del colon, que había abandonado el hábito tabáquico 10 años antes, tras haber sido diagnósticado de un carcinoma epidermoide de lengua en estadio (pT1, N0, M0) para el que, aparte de su exéresis quirúrgica, recibió radioterapia. Se presentó en el Servicio de Urgencias de nuestro hospital por dolor e impotencia funcional en el hombro derecho. Los síntomas se habían iniciado 6 días antes, tras haber realizado varios empastes dentarios.
En la exploración destacaba una temperatura axilar de 37,5°C, presión arterial de 160/80mmHg, tumefacción dolorosa de la articulación esternoclavicular derecha asociada a limitación de los movimientos activos del hombro derecho, roncus y sibilancias teleinspiratorias en ambas bases pulmonares, así como hepatomegalia blanda de 2cm y aumento difuso del tamaño de la próstata.
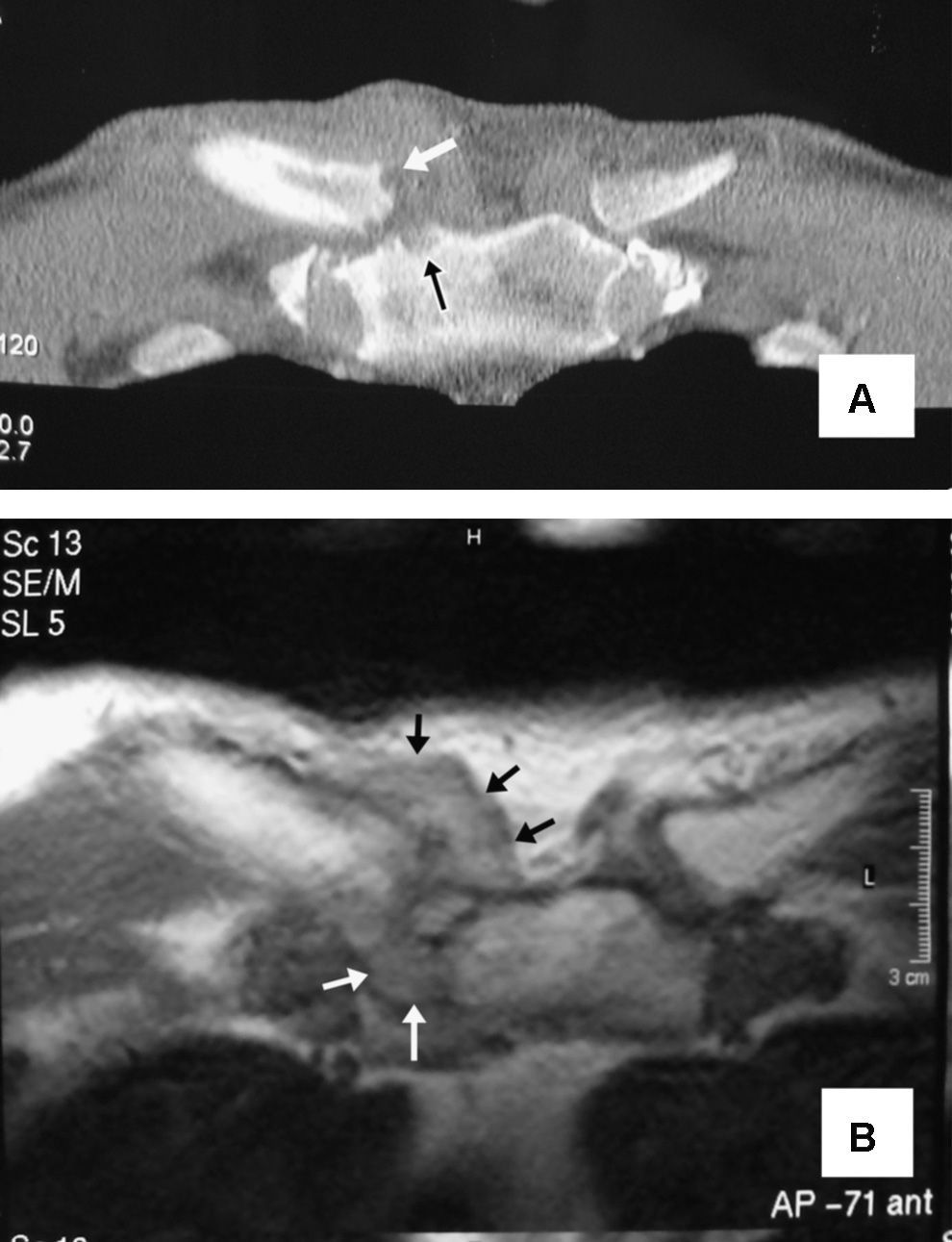
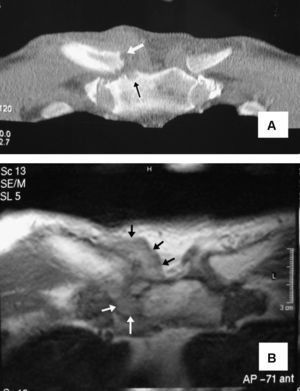
En las determinaciones de laboratorio destacaban una VSG de 66mm/1.ah, 19,4×109leucocitos/l (89% polimorfonucleares neutrófilos), glucosa: 303mg/dl (VN: 70–110mg/dl), urea: 58mg/dl (VN: 10–50), GOT-ASAT (61U/l; VN: 9–37), GPT-ALAT (95U/l; VN:10–65), fibrinógeno (455mg/dl; VN: 200–400). Los siguientes parámetros fueron normales o negativos: creatinina, colesterol total, triglicéridos, ácido úrico, GGT, FA, Bi, CPK, Ca, P, FR (látex) y ANA. Tres hemocultivos fueron negativos. En la gasometría arterial se objetivó pH (7,41), pCO2 (35mmHg), pO2 (76,4mmHg), saturación de O2 (94,3%), HCO3 (22,6mEq/l). La radiografía de tórax mostró signos compatibles con EPOC. En el estudio ecográfico abdominopélvico se observó un incremento de la ecogenicidad y volumen del hígado compatible con esteatosis, así como un aumento difuso del tamaño prostático, sin imágenes nodulares. Se realizó una resonancia del hombro derecho y articulaciones esternoclaviculares que objetivó hiperseñal en las secuencias ponderadas en T2 e hiposeñal en las ponderadas en T1, involucrando los extremos óseos de la esternoclavicular derecha junto a erosiones e imagen compatible con absceso (fig. 1).
A) Corte coronal de tomografía computarizada de las articulaciones esternoclaviculares del caso 1. En la derecha se observa un aumento del volumen y densidad de las partes blandas, además de erosiones en las superficies óseas articulares (flechas). B) Imagen axial de resonancia magnética ponderada en T2, correspondiente al mismo paciente. Se objetiva destrucción de las superficies articulares y un marcado aumento de partes blandas (flechas) que, posteriormente, dieron paso a un absceso retroesternal que requirió drenaje quirúrgico.
Mediante punción aspirativa de la articulación esternoclavicular derecha, se obtuvieron 2ml de pus en el que la tinción de Gram mostró cocos Gram positivos, siendo recuperados posteriormente en el cultivo y tipificados como S. agalactiae (grupo B). El paciente fue tratado con desbridamiento quirúrgico y perfusión intravenosa de la asociación de clavulánico (200mg) y amoxicilina (1.000mg) cada 6h durante tres semanas, continuando posteriormente por vía oral con 875mg de amoxicilina asociadas a 125mg de clavulánico cada 8h. El tratamiento se interrumpió a la sexta semana con buenos resultados clínicos y funcionales.
Caso 2Mujer de 80 años con antecedentes de psoriasis, HTA e insuficiencia renal crónica, internada en una residencia de ancianos desde hacía 5 años, que acudió al Servicio de Urgencias de nuestro hospital por dolor e impotencia funcional en el hombro izquierdo, síntomas que se habían instaurado de forma aguda 3 semanas antes y no habían respondido a diclofenaco (100mg/día).
En la exploración destacaba una temperatura axilar de 37,6°C, presión arterial de 140/70mmHg, palidez cutaneomucosa, soplo sistólico eyectivo más audible en el foco aórtico, así como dolor a la palpación y tumefacción de la articulación esternoclavicular izquierda. La abducción del hombro ipsilateral exacerbaba el dolor y, por ello, mantenía una actitud antiálgica con el brazo en rotación interna y aducción.
En las determinaciones de laboratorio destacaban anemia normocrómica normocítica (Hb: 73g/l); 8,7×109leucocitos/l; plaquetas: 303×109/l; VSG: 140mm/1.ah; PCR: 127mg/l; creatinina: 1,9mg/dl, urea: 83mg/dl, ácido úrico: 6,9mg/dl, sideremia: 24μg/ml (VN: 35–150μg/ml); TSH: 6,8mUI/ml (VN: 0,5–4,5). El sedimento urinario contenía 45–55 leucocitos y 12–15 hematíes por campo. Los siguientes parámetros fueron normales o negativos: glucosa, urea, creatinina, ácido úrico, GOT-ASAT, GPT-ALAT, GGT, FA, Bi, colesterol total, triglicéridos, CPK, Ca, P, proteínograma, dosificación de inmunoglobulinas (IgM, IgG, IgA) y de complemento (C3, C4), FR (látex), ANA y ANCA. En el urocultivo se aislaron más de 105 unidades formadoras de colonias de bacilos que fueron identificados como Escherichia coli, sensible a amoxicilina. No se obtuvo crecimiento bacteriano en tres hemocultivos seriados.
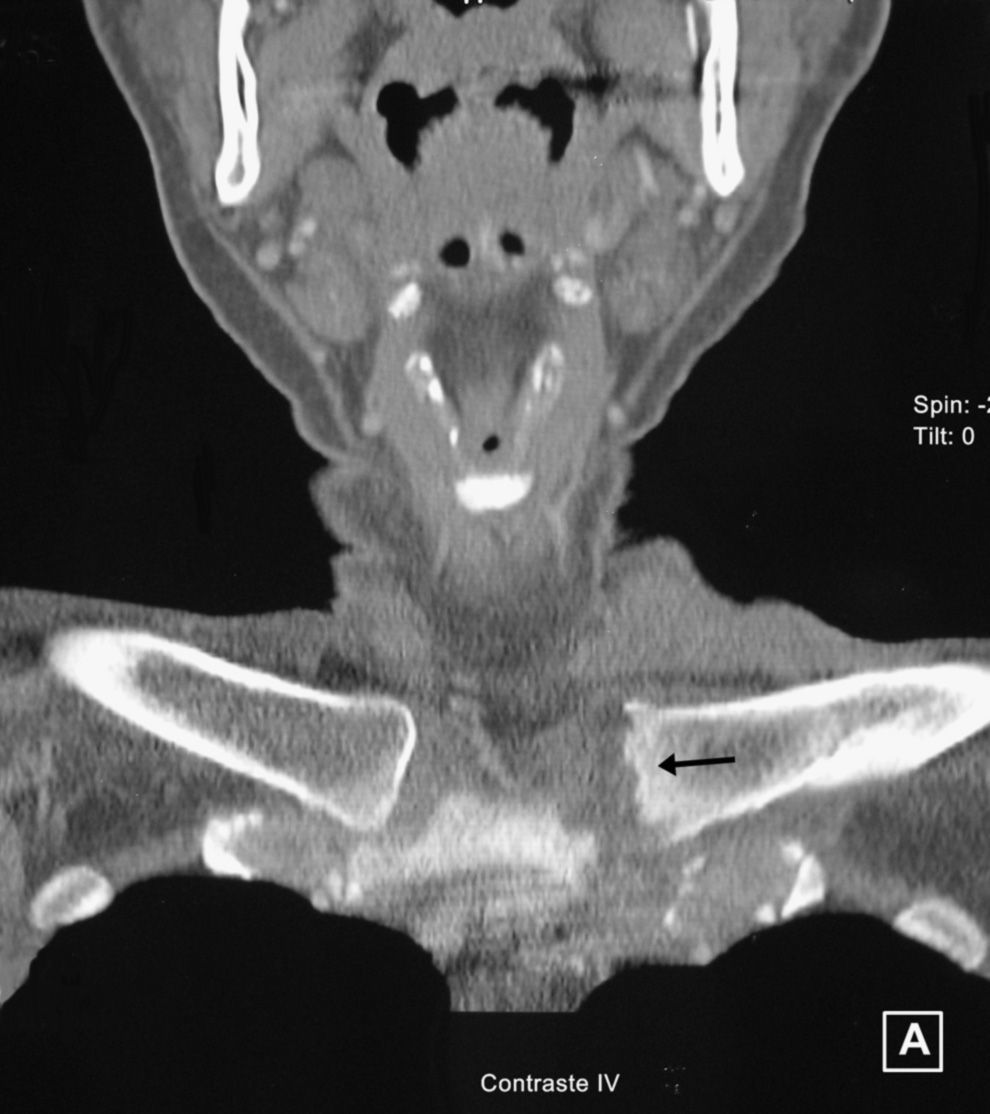
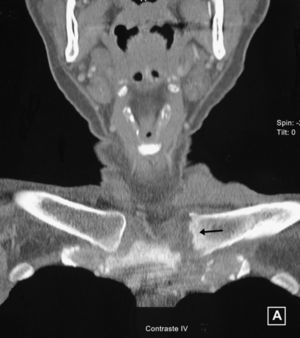
Se realizó una TAC de las esternoclaviculares en la que se observaron erosiones y aumento del volumen y densidad de partes blandas (fig. 2). La punción aspirativa obtuvo 1,5cc de exudado de aspecto purulento en cuyo cultivo se obtuvo crecimiento de abundantes colonias de S. agalactiae (estreptococos del grupo B). La paciente fue tratada durante 4 semanas por vía intravenosa con la asociación de amoxicilina y clavulánico (1.000mg/200mg) cada 6h, continuando posteriormente por vía oral (875mg/125mg) cada 8h hasta completar 6 semanas. La evolución fue favorable, aunque quedó deformidad y un leve dolor mecánico en la esternoclavicular izquierda con algunos movimientos.
Caso 3Varón de 34 años que fue ingresado desde el Servicio de Urgencias a causa de una artritis aguda febril de la rodilla derecha iniciada 10 días antes. Entre sus antecedentes destacaba un accidente de tráfico en el que sufrió una fractura de la diáfisis femoral derecha y rotura esplénica, motivo por el que había sido esplenectomizado.
En la exploración destacaba una temperatura axilar de 38,4°C y derrame a tensión de la rodilla derecha cuya flexión activa no alcanza los 25°. No se observaron efracciones cutáneas en la vecindad. Excepto la cicatriz de laparotomía y piorrea, no se identificaron otras anomalías.
El hemograma demostró leucocitosis (15,8×109/l; 87% neutrófilos), y trombocitosis (479×109/l). Había una marcada elevación de la VSG (79mm/1.ah) y de la PCR (84,7mg/l). Los siguientes parámetros bioquímicos fueron normales o negativos: glucosa, urea, creatinina, ácido úrico, GOT-ASAT, GPT-ALAT, GGT, FA, Bi, colesterol total, triglicéridos, CPK, Ca, P, proteínograma, dosificación de inmunoglobulinas (IgM, IgG, IgA) y de complemento (C3, C4). Las radiografías simples de las rodillas solo mostraban un aumento del volumen y densidad de partes blandas en la derecha, de la que, mediante artrocentesis se obtuvieron 158cc de aspecto purulento. No se visualizaron microorganismos mediante las tinciones de Gram, Zielhl-Neelsen y auramina-rodamina, pero en el cultivo se recuperaron abundantes colonias de cocos Gram positivos que, posteriormente, fueron identificados como S. agalactiae. Esta bacteria también se recuperó en dos de los 3 hemocultivos tomados al ingreso. El paciente fue tratado por vía intravenosa mediante axetil-cefuroxima (2 semanas) y posteriormente por vía oral (4 semanas). Dejó de observarse crecimiento bacteriano en las muestras de artrocentesis (punción aspirativa diaria) a partir del cuarto día.
La evolución fue favorable, aunque como secuela quedó un déficit de flexión en la rodilla derecha de unos 20°.
Caso 4Mujer de 72 años que consultó por dolor, tanto en reposo como en movimiento, en la rodilla derecha, donde 7 años antes se le había realizado una artroplastia total por gonartrosis masiva. Tres meses antes de la consulta, después de una limpieza dentaria, comenzó con dolor e impotencia funcional en dicha articulación, síntomas que empeoraron gradualmente hasta llegar a impedirle la deambulación y se acompañaron de anorexia y pérdida ponderal de 5kg.
En la exploración se objetivaba una temperatura axilar de 37,8°C, derrame y eritema en la rodilla derecha, con restricción dolorosa de la flexión (75°) y de la extensión (−5°). En la rodilla izquierda se apreciaba crepitación subrotuliana, deformidad en varo y limitación de la flexión (97°). En las manos se apreciaban nódulos de Heberden y de Bouchard, así como signos de artrosis trapeciometacarpiana bilateral.
Los análisis mostraron elevación de la proteína C reactiva (95mg/l) y de la VSG (43mm/1.ah), anemia (Hb: 95g/L) microcítica e hipocrómica e hipercolesterolemia (292mg/dl; colesterol-LDL de 198mg/dl). En las radiografías se visualizaban signos de aflojamiento con osteopenia en la interfase prótesis-hueso, así como aumento de volumen y densidad de partes blandas. Mediante artrocentesis se obtuvieron 25cc de líquido articular de aspecto purulento con una glucosa de 31mg/dl (glucemia: 117mg/dl) y cuya celularidad fue de 62.700/mm3 (95% polimorfonucleares neutrófilos). Con la tinción de Gram se visualizaron diplococos Gram positivos que se recuperaron en el cultivo y se tipificaron como S. agalactiae, microorganismo que también se aisló en uno de los 3 hemocultivos tomados al ingreso.
El tratamiento antibiótico se realizó con axetil-cefuroxima (1g/i.v./8h) durante 8 semanas y se realizó un recambio protésico en 2 tiempos con buen resultado funcional. Transcurridos 24 meses de la implantación de la segunda prótesis, no se han identificado síntomas ni signos sugestivos de recidiva.
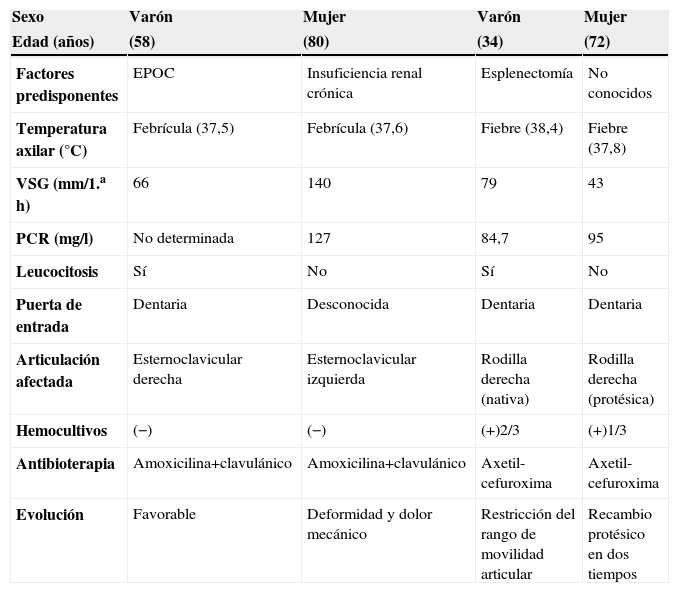
La tabla 1 resume los principales datos clínicos de los 4 pacientes presentados.
Resumen de los datos clínicos de los cuatro pacientes con artritis piógena por Streptococcus agalactiae
| Sexo | Varón | Mujer | Varón | Mujer |
| Edad (años) | (58) | (80) | (34) | (72) |
| Factores predisponentes | EPOC | Insuficiencia renal crónica | Esplenectomía | No conocidos |
| Temperatura axilar (°C) | Febrícula (37,5) | Febrícula (37,6) | Fiebre (38,4) | Fiebre (37,8) |
| VSG (mm/1.ah) | 66 | 140 | 79 | 43 |
| PCR (mg/l) | No determinada | 127 | 84,7 | 95 |
| Leucocitosis | Sí | No | Sí | No |
| Puerta de entrada | Dentaria | Desconocida | Dentaria | Dentaria |
| Articulación afectada | Esternoclavicular derecha | Esternoclavicular izquierda | Rodilla derecha (nativa) | Rodilla derecha (protésica) |
| Hemocultivos | (−) | (−) | (+)2/3 | (+)1/3 |
| Antibioterapia | Amoxicilina+clavulánico | Amoxicilina+clavulánico | Axetil-cefuroxima | Axetil-cefuroxima |
| Evolución | Favorable | Deformidad y dolor mecánico | Restricción del rango de movilidad articular | Recambio protésico en dos tiempos |
EPOC: enfermedad pulmonar obstructiva crónica; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular.
En 1938, Fry21 realizó la primera comunicación sobre la patogenicidad humana de los estreptococos del grupo B y, 2 años después, Ranz3 describió la primera infección articular en un diabético de edad avanzada. No obstante, hasta la década de los 80 la mayoría de las infecciones se comunicaron en neonatos y en mujeres gestantes, siendo muy raras en otros grupos de pacientes adultos1,22. A lo largo de los últimos 25 años, se ha producido un notable aumento de las infecciones invasivas por S. agalactiae en adultos22, entre las que se incluyen neumonías, empiema pleural, celulitis, endocarditis, meningitis, endoftalmitis, fascitis necrotizantes, bursitis23, osteomielitis24 y artritis sépticas3–19.
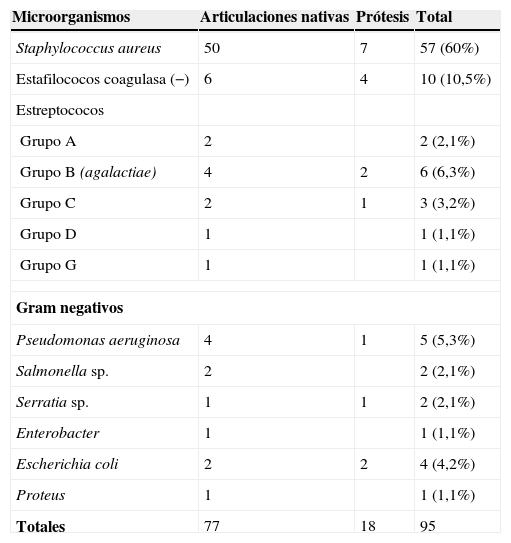
S. agalactiae causa entre 4% y el 10,5% de las artritis sépticas4,5,7. Su frecuencia se incrementa paralelamente a la edad de los pacientes, lo que queda reflejado en la amplia serie de Gavet et al12, donde S. agalactiae fue responsable del 13% de los casos en menores de 60 años, del 31% en pacientes de 60 a 80 años y del 41% en los mayores de 80 años. En nuestro hospital y durante el periodo 1995–2008, se recogieron 95 casos de artritis piógenas en adultos, 6 de ellos (6,3%) causados por S. agalactiae (tabla 2), 2 de los cuales fueron sobre prótesis articulares. Junto con la edad avanzada4,7,22, otros factores que predisponen a las artritis sépticas por S. agalactiae son: diabetes mellitus, neoplasias malignas, quimioterapia, alcoholismo, vejiga neurógena, úlceras de decúbito, artritis reumatoide y cirrosis hepática4,18,22, aunque no siempre se han identificado factores de riesgo4,19. Si bien en el conjunto de las artritis piógenas suelen predominar los varones, la relación tiende a invertirse en las producidas por S. agalactiae4,7 (1:1,1), hecho explicable por el gradual incremento del porcentaje de mujeres con artritis sépticas a partir de los 60 años12 y por la mayor prevalencia femenina de las artritis estreptocócicas7.
Etiología de las artritis piógenas en el hospital POVISA en el periodo 1995–2008
| Microorganismos | Articulaciones nativas | Prótesis | Total |
| Staphylococcus aureus | 50 | 7 | 57 (60%) |
| Estafilococos coagulasa (−) | 6 | 4 | 10 (10,5%) |
| Estreptococos | |||
| Grupo A | 2 | 2 (2,1%) | |
| Grupo B (agalactiae) | 4 | 2 | 6 (6,3%) |
| Grupo C | 2 | 1 | 3 (3,2%) |
| Grupo D | 1 | 1 (1,1%) | |
| Grupo G | 1 | 1 (1,1%) | |
| Gram negativos | |||
| Pseudomonas aeruginosa | 4 | 1 | 5 (5,3%) |
| Salmonella sp. | 2 | 2 (2,1%) | |
| Serratia sp. | 1 | 1 | 2 (2,1%) |
| Enterobacter | 1 | 1 (1,1%) | |
| Escherichia coli | 2 | 2 | 4 (4,2%) |
| Proteus | 1 | 1 (1,1%) | |
| Totales | 77 | 18 | 95 |
Como para el resto de las artritis sépticas, la principal localización es la rodilla4, mientras que las pequeñas articulaciones de manos y pies junto con las articulaciones interapofisarias de la columna vertebral son las menos afectadas10. No obstante, S. agalactiae muestra un notable tropismo por las articulaciones axiales y, frente al 2% de afectación esternoclavicular o sacroilíaca en las series generales de artritis piógena en adultos, S. agalactiae alcanza el 16% y 12%, respectivamente4. Aún así, solo el 3% de las artritis esternoclaviculares13 y el 12–14% de las sacroiliitis piógenas en adultos25,26 son producidas por estreptococos del grupo B, estas últimas con marcado predominio femenino. Dos de nuestros pacientes presentaban artritis esternoclavicular, donde el dolor referido al hombro puede ser la primera manifestación clínica (25%) y el curso evolutivo puede complicarse con osteomielitis de clavícula o esternón (56%), o con abscesos de la pared torácica (25%) y, más raramente, con una mediastinitis o un derrame pleural13. Se han comunicado artritis esternoclaviculares por S. agalactiae algunos días tras el parto y también se ha señalado mayor susceptibilidad para el desarrollo de complicaciones infecciosas en esta articulación en mujeres sometidas a radioterapia por cáncer de mama27. Más del 80% de los casos de artritis piógena son monoarticulares, pero S. agalactiae provoca oligo o poliartritis en un tercio de los enfermos4,5, lo que está en relación con la elevada frecuencia de bacteriemia y alta rentabilidad de los hemocultivos con positividades de hasta el 66% en la serie de Nolla et al4. Las infecciones oligo o poliarticulares, sobre todo en pacientes de edad avanzada, donde es habitual la comorbilidad, plantean un diagnóstico diferencial con otras artropatías inflamatorias y contribuyen a retrasar el diagnóstico4,5. También es frecuente la coexistencia de otros focos infecciosos (30%)4,17,19,23,28 con especial relevancia de la osteomielitis vertebral y las infecciones del tracto urinario.
La puerta de entrada puede identificarse en casi la mitad de los casos. Dos de nuestros enfermos tenían antecedentes de manipulación dentaria en los días previos al inicio de los síntomas (casos 1 y 4) mientras que en otro se objetivó piorrea (caso 3). En el segundo paciente descrito, las lesiones cutáneas de psoriasis podrían haber sido la puerta de entrada. De hecho, la colonización cutánea y oral por S. agalactiae aumenta con la edad, es particularmente elevada en ancianos internados en residencias22 y se consideran las principales puertas de entrada para este microorganismo7.
Las infecciones tardías de prótesis articulares son, en su mayor parte, consecuencia de bacteriemias y, respecto a las infecciones precoces, cursan con menos síntomas sistémicos8. Se han comunicado menos de 16 casos producidos por S. agalactiae y con demora promedio para el diagnóstico superior a los 4 meses8,22. En el cuarto de los pacientes descritos, la artritis sobre la prótesis de rodilla derecha cursó de forma subaguda y se precedió de una limpieza dentaria, que pudo constituir la puerta de entrada del microorganismo. En este sentido, la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica recomienda adoptar medidas de profilaxis antibiótica en portadores de prótesis cuando se sometan a procedimientos que impliquen alto riesgo de bacteriemia29, lo que incluye algunos tipos de limpieza dentaria.
El diagnóstico se realiza con la recuperación de S. agalactiae en el cultivo de líquido articular, muestras de la membrana sinovial de las articulaciones afectadas o en 2 o más hemocultivos, cuando el contexto clínico es compatible, además, la rentabilidad de los hemocultivos es elevada4. Otros hallazgos frecuentes pero inespecíficos son la leucocitosis (50–60%), el incremento de la velocidad de sedimentación globular (95%) y de la proteína C reactiva4,5,7,8. El diagnóstico diferencial plantea dificultades en los casos con escasa expresividad clínica, localizaciones infrecuentes16, afectación poliarticular4,5 o comorbilidad articular previa15,30, lo que es habitual entre los enfermos de edad avanzada.
Como en toda artritis séptica, el tratamiento no debe demorarse. Se inicia de forma empírica una vez obtenidas las muestras de líquido sinovial y los hemocultivos seriados. S. agalactiae sigue siendo muy susceptible a la penicilina G, ampicilina y cefalosporinas, pero se observa un gradual incremento de las resistencias a macrólidos, clindamicina y tetraciclinas, lo que dificulta el tratamiento de pacientes alérgicos a los betalactámicos31. Además, recientemente se ha comunicado la aparición de cepas cada vez menos susceptibles a la penicilina32 y se han descrito algunas resistencias a fluoroquinolonas33. La duración de la antibioterapia no se ha consensuado, pero no debe ser inferior a 4 semanas y, por lo general, se recomiendan 6 semanas cuando están afectadas articulaciones axiales4. La coexistencia de una endocarditis infecciosa, una osteomielitis vertebral o la afectación de una articulación protésica obligan a prolongar el tratamiento.
Como para otras artritis piógenas, el pronóstico depende de factores del huésped y del retraso en el inicio del tratamiento. La tendencia a afectar a personas de edad avanzada con pluripatología favorece un diagnóstico tardío y ensombrece el pronóstico4,5. La morbimortalidad aumenta de manera proporcional a la edad de los pacientes, al grado de compromiso inmune, a la demora en el inicio del tratamiento y con la afectación oligo o poliarticular. Aunque en la serie de artritis piógenas de Dubost et al7, la mortalidad fue menor entre las de etiología estreptocócica que entre las causadas por estafilococos (3,6% versus 7,8%), las infecciones articulares por S. agalactiae tienen globalmente una mortalidad entorno al 9%4. Las recidivas o recurrencias son muy raras.
La virulencia de S. agalactiae depende de las moléculas de la superficie capsular, como el ácido siálico o los polisacáridos. Además, la expresión de una potente citotoxina, la betahemolisina, también le confiere mayor capacidad artritógena34. La vacunación de pacientes con factores de riesgo mediante antígenos de los polisacáridos capsulares estreptocócicos podría reducir la incidencia de infecciones invasivas por S. agalactiae, incluidas las articulares22.