La búsqueda de biomarcadores en la artritis reumatoide (AR) ha sido objeto de interesantes investigaciones en los últimos años, aunque no siempre los resultados han sido relevantes. Se han estudiado múltiples biomarcadores en distintas localizaciones: marcadores solubles en sangre, orina y líquido sinovial o en el propio tejido sinovial, de distinta naturaleza: autoanticuerpos, marcadores genéticos, del «remodelado articular» y de diferentes medidas de desenlace: marcadores de diagnóstico y de pronóstico (destrucción articular, discapacidad, ausencia de remisión, mortalidad, respuesta al tratamiento antirreumático, etc.). En el presente artículo sólo se van a revisar las investigaciones sobre biomarcadores solubles, fundamentalmente en suero, relacionados con el diagnóstico y la destrucción articular en la AR.
The search for biomarkers in rheumatoid arthritis (RA) has been the object of interesting research in the past few years, although results have not always been relevant. Several biomarkers, from several different locations (blood, urine, synovial fluid, synovial tissue) and of different nature (autoantibodies, genetic markers, joint remodeling markers), and related to different outcomes, diagnostic and prognostic markers (joint destruction, disability, lack of remission, mortality, response to anti-rheumatic treatment, etc.) have been studied. The present article reviews research only on soluble biomarkers, mainly those in serum, related to the diagnosis and joint destruction in RA.
En los criterios diagnósticos o de clasificación de la AR que se han venido utilizando hasta la actualidad (criterios ACR 1987) sólo se incluye un biomarcador que es el factor reumatoide (FR). Este anticuerpo dirigido contra la fracción constante de la inmunoglobulina G se descubrió hace ya más de 50 años y ha constituido un elemento importante para el clínico como ayuda diagnóstica y marcador pronóstico en la AR. No obstante, su relativa falta de especificidad ha condicionado su uso e interpretación en la práctica clínica. Sin duda, el principal y más importante avance en el descubrimiento de nuevos biomarcadores en la AR han sido los denominados anticuerpos frente a péptidos/proteínas citrulinados (ACPA), que para algunos autores serian los verdaderos «factores reumatoides»1, por su gran especificidad, mucho más elevada que la del FR, aunque no sean patognomónicos de la enfermedad. Los ACPA presentan se presentan hoy en día como los autoanticuerpos con un mejor balance sensibilidad/especificidad para el diagnóstico de la AR2.
La importancia de los ACPA como marcadores diagnósticos queda bien reflejada en los recientemente consensuados nuevos criterios de clasificación ACR/EULAR de la AR3, que no vamos a detallar pues son objeto de revisión en otro capítulo de la presente monografía. En estos nuevos criterios aparecen, en comparación con los de la ACR de 1987, además de los reactantes de fase aguda (PCR y VSG), los ACPA, situándose a un nivel equiparable al del FR. Diferentes estudios han demostrado la gran utilidad de los ACPA como marcadores predictivos de evolución o diagnóstico de AR en aquellos pacientes que se presentan en las consultas o clínicas de artritis de inicio como artritis indiferenciadas o inclasificables. El mejor ejemplo viene representado por un estudio holandés donde de 318 pacientes con artritis indiferenciadas (de una muestra total de 936 artritis de inicio) el 93% de los que tenían ACPA positivos fueron finalmente diagnosticados de AR por sólo el 25% de los que fueron ACPA negativos en un seguimiento de 3 años. La razón de probabilidad para el diagnóstico de AR en los ACPA positivos frente a los negativos fue de 16,74.
En cuanto al papel diagnóstico de los ACPA en la AR, revisaremos tres aspectos que pueden tener interés para la práctica clínica.
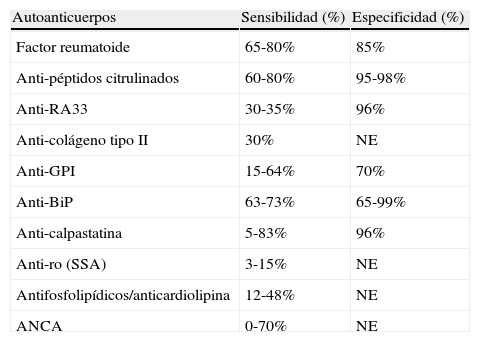
Sensibilidad y especificidad de los anticuerpos frente a péptidos/proteínas citrulinadosLa sensibilidad de los ACPA en los diferentes estudios suele ser similar al FR (tabla 1), identificando aproximadamente a unas dos terceras partes de los pacientes con AR. No obstante, existen ciertas discrepancias entre los diferentes estudios que, en muchas ocasiones, se relacionan con el tipo de población estudiada. Así, en los pacientes con AR evolucionada, la sensibilidad suele ser mayor (más del 65%), mientras que en las series de AR de inicio suele ser inferior, del orden del 50-60%5. Posiblemente esta circunstancia refleja que en las AR evolucionadas el diagnóstico de AR es más consistente y que se trata posiblemente de los casos más graves, ya los ACPA identifican esta población con mayor destrucción articular. Existe una notable asociación entre los ACPA y el FR, ya que la frecuencia de ACPA es mayor en la AR FR+ que la que tiene el FR–. En un estudio realizado por nuestro grupo, la frecuencia de ACPA (medidos a través de dos técnicas distintas) en las AR FR+ fue del 83-88%, mientras que en las AR FR– fue del 40-54%. Esta última cifra indica que el porcentaje actual de verdaderos seronegativos (FR y ACPA negativos) se reduce considerablemente y se situaría alrededor del 10-15% de nuestros pacientes con AR6.
Sensibilidad y especificidad de autoanticuerpos en el suero de pacientes con artritis reumatoide según diferentes estudiosa
| Autoanticuerpos | Sensibilidad (%) | Especificidad (%) |
| Factor reumatoide | 65-80% | 85% |
| Anti-péptidos citrulinados | 60-80% | 95-98% |
| Anti-RA33 | 30-35% | 96% |
| Anti-colágeno tipo II | 30% | NE |
| Anti-GPI | 15-64% | 70% |
| Anti-BiP | 63-73% | 65-99% |
| Anti-calpastatina | 5-83% | 96% |
| Anti-ro (SSA) | 3-15% | NE |
| Antifosfolipídicos/anticardiolipina | 12-48% | NE |
| ANCA | 0-70% | NE |
ANCA: anticuerpos frente a citoplasma de neutrófilos; BiP: endoplasmic reticulum chaperone binding proteína; GPI: glucosa-6-fosfato isomerasa; NE: no evaluado.
Los ACPA son, sin duda, los marcadores serológicos más específicos de la AR, con una especificidad del 98-99% en algunos estudios. Cabe resaltar no obstante que estas especificidades tan altas se obtienen cuando la población con AR se compara con población sana; es decir sólo el 1-2% de los individuos sanos tienen ACPA. No obstante, la especificidad, aun siendo muy alta, es algo inferior cuando se compara con pacientes con otras enfermedades reumáticas que pueden considerarse en el diagnóstico diferencial de la AR, como es el caso de la artritis psoriásica, el lupus eritematoso sistémico (LES), el síndrome de Sjögren y otras enfermedades sistémicas. Así, por ejemplo, el 7,6% de pacientes con LES tiene ACPA positivos en un estudio de nuestro grupo7 y otros estudios encuentran un porcentaje similar, no superior al 10%, en la población con artritis psoriásica8 o síndrome de Sjögren9. Llama la atención que en estos pacientes la frecuencia de poliartritis suele ser superior que en los que no presentan ACPA9, y queda la duda en algunos casos de si se trata de la coexistencia de dos enfermedades o que los ACPA serían marcadores de artritis en estas poblaciones. Los ACPA, en cambio, son casi siempre negativos en pacientes con infección crónica por el virus de la hepatitis C, una de las entidades que más frecuentemente ocasiona un «falso FR» positivo7.
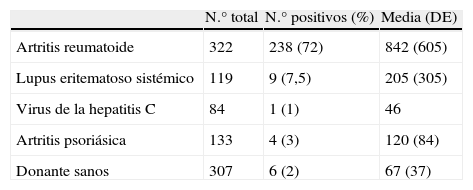
Importancia de los niveles (concentraciones) de anticuerpos frente a péptidos/proteínas citrulinadosNo sólo la presencia o ausencia de ACPA puede tener un interés diagnóstico en la AR, sino que los niveles pueden ser también importantes. Esta circunstancia quedaría reflejada claramente en los nuevos criterios de la AR (ACR/EULAR 2010), donde se considera que los niveles altos de FR y ACPA ponderan más (3 puntos) que los niveles bajos (2 puntos)3. El punto de corte que separa niveles positivos bajos de positivos altos se ha establecido, creemos que de manera bastante empírica, en el triple del punto de corte que separa los valores positivos de los negativos3. Cuando analizamos en nuestra población7, las concentraciones de ACPA en los pacientes ACPA positivos de pacientes sin AR pudimos comprobar cómo en estas poblaciones (individuos sanos, LES, artritis psoriásica y hepatitis C) no sólo la frecuencia de ACPA era muy inferior a la AR, sino que las concentraciones de ACPA eran también claramente inferiores a las de los pacientes con AR (tabla 2).
Prevalencia y media de los niveles de ACPA (anti-CCP2) en pacientes con AR y en 4 poblaciones control.
| N.° total | N.° positivos (%) | Media (DE) | |
| Artritis reumatoide | 322 | 238 (72) | 842 (605) |
| Lupus eritematoso sistémico | 119 | 9 (7,5) | 205 (305) |
| Virus de la hepatitis C | 84 | 1 (1) | 46 |
| Artritis psoriásica | 133 | 4 (3) | 120 (84) |
| Donante sanos | 307 | 6 (2) | 67 (37) |
Tomado de Sanmartí et al7.
Sólo existe una entidad donde la frecuencia y las concentraciones de ACPA son similares a los de la AR, que es el reumatismo palindrómico (RP)10. Es bien conocido que el RP puede ser una forma de presentación de la AR, ya que muchos pacientes acaban desarrollando esta enfermedad durante el seguimiento11; en este sentido, los pacientes ACPA tendrían una mayor predisposición a esta evolución. No obstante, no es menos cierto que muchos de los pacientes con RP y niveles altos de ACPA son seguidos en nuestra consulta sin haber desarrollado una artritis persistente después de varios años de seguimiento. Es por este motivo que se podría considerar esta entidad como una forma frustrada de AR en muchos casos10. A nivel práctico, consideramos que en los pacientes con clínica compatible con RP pero que no presentan ACPA debe aumentarse la sospecha de otras formas de artritis intermitente de presentación clínica similar, como una enfermedad de Whipple u otras enteropatías inflamatorias11. En este sentido, es interesante la reciente observación de una mayor frecuencia de mutaciones en el gen de la fiebre mediterránea familiar en nuestros pacientes con RP y ACPA negativos12.
Métodos de determinación de los anticuerpos frente a péptidos/proteínas citrulinadosExisten diferentes métodos de determinación de ACPA, la mayoría utilizan una prueba de enzimoinmunoensayo sobre un sustrato antigénico de péptidos cíclicos citrulinados de segunda generación: los denominados CCP213. Estos péptidos citrulinados se obtienen de manera sintética y no tienen homología conocida con ninguna proteína humana. Son los más utilizados en la práctica clínica, con un nivel de sensibilidad superior a la obtenida con los CCP1, donde la secuencia peptídica corresponde a la filagrina humana. Existen diferentes casas comerciales que utilizan la prueba de ELISA para CCP2, con una muy buena correlación entre ellos, sin que existan discrepancias notables14. Con el objeto de incrementar la sensibilidad de estas pruebas y explicar mejor el papel patogenético de los ACPA, se ha estudiado la presencia de anticuerpos frente a péptidos citrulinados, naturales o sintéticos, de proteínas humanas que están presentes en la sinovial reumatoide, como la fibrina7 o la vimentina15 o formar parte de proteínas bacterianas como la enolasa16. El estudio con estos sustratos antigénicos es muy relevante desde el punto de vista de investigación, con el objeto de conocer mejor el péptido o péptidos causantes de esta inmunogenicidad tan característica de la AR, pero aportan relativas pocas ventajas sustanciales a la prueba del CCP2 en la práctica clínica. Así, parece que los anticuerpos anti-vimentina citrulinada se correlacionan en parte con la actividad inflamatoria15, los anticuerpos antienolasa, aunque poco sensibles, son los que más se asociarían a los alelos HLA que conforman el epítopo reumatoide16, y los anticuerpos antifibrina humana podrían aumentar el valor pronóstico en cuanto a progresión radiológica de la enfermedad7.
En conclusión, los ACPA representan el principal avance en el terreno de los biomarcadores en la AR, ya no sólo considerando su interés diagnóstico, sino también su interés en la clasificación de dos grupos de pacientes con poliartritis que, aunque los llamemos AR por su forma de presentación clínica inicial similar, en realidad las formas ACPA positivas se comportan de manera totalmente distinta de las ACPA negativas, tanto desde el punto de vista genético (asociación con HLA-DR, PTPN22), epidemiológico (asociación con tabaquismo), de evolución clínica (mayor progresión de daño estructural) o de comorbilidades (mayor número de complicaciones cardiovasculares y mortalidad). Es por ello que algunos autores sugieren que en realidad se trata de dos entidades distintas17.
Biomarcadores pronósticos de destrucción articular en la artritis reumatoideEl estudio de biomarcadores pronósticos de progresión de la enfermedad, centrados básicamente en el daño estructural/destrucción articular de la enfermedad, ha sido fruto de múltiples investigaciones que, en general, han dado resultados bastantes homogéneos. La mayoría de los estudios identifican claramente algunos factores que presentes al inicio de la enfermedad determinan una peor evolución radiológica (más daño estructural) durante el seguimiento, con independencia del tratamiento efectuado. Dentro de estos factores se incluiría el género (mujeres), una mayor actividad inflamatoria inicial (medida por índices clínicos o reactantes de fase aguda), la presencia de daño radiológico previo y la presencia de autoanticuerpos (FR y ACPA). De hecho, éstos son los factores de mal pronóstico que se incluyen en las recientes recomendaciones EULAR para determinar el uso de una terapia más intensiva, incluida el uso de biológicos en los pacientes con AR18. Cabe recordar, no obstante, que estos factores y otros que aparecen en otros estudios (genotipo HLA, nivel educativo, etc.) operan básicamente en series de pacientes con AR tratadas con fármacos antirreumáticos modificadores de enfermedad de naturaleza química (metotrexato, salazopirina, leflunomida, etc.) pero no tanto en pacientes que reciben terapia biológica anti-factor de necrosis tumoral, donde la relevancia de estos factores se vería disminuida por el notable efecto de estos fármacos sobre la destrucción articular19.
No es objeto de este capítulo tratar de la relevancia de los autoanticuerpos (FR y ACPA) sobre la progresión radiológica en la AR, ya que es un hecho bien conocido y existen interesantes estudios sobre el particular que confirman su interés pronóstico. En algunos de ellos se observa que el papel pronóstico de los ACPA es superior al del FR20 y que no sólo su presencia, sino también los niveles, tienen implicaciones pronósticas21. Así pues, nos centraremos de forma exclusiva en los biomarcadores solubles, que se pueden determinar en sangre y/o orina, de moléculas presentes en la articulación reumatoide y que estarían implicadas en el metabolismo y el proceso de degradación del cartílago y hueso subcondral, lo que denominaríamos biomarcadores del «remodelado» articular.
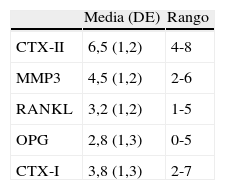
El grupo OMERACT ha intentado desarrollar unos criterios de validación de distintos biomarcadores solubles que puedan ser útiles para pronosticar el daño articular en la AR y la espondiloartritis22. Dichos criterios deberían cumplir los requisitos clave de validez, discriminación y viabilidad. Un grupo de expertos utilizando la metodología Delphi propuso unos criterios provisionales para estos biomarcadores y posteriormente, en un análisis pormenorizado de la bibliografía médica, que incluía un total de 111 artículos, identificó un total de cinco posibles biomarcadores de destrucción articular en la AR, a los que, sobre la base de la evidencia científica, les dio un «ranking» de mayor a menor relevancia (tabla 3). Estos biomarcadores son: telopéptido carboxiterminal del colágeno tipo II (CTX-II) como marcador de degradación del cartílago hialino; metaloproteinasa III (MMP3) como enzima expresada en el cartílago y sinovial con importantes efectos en la degradación de la matriz extracelular del cartílago; RANKL, ligando del receptor activador del factor nuclear kappa B, como marcador de actividad osteoclástica; osteoprotegerina, inhibidor natural del RANKL, y el telopéptido carboxiterminal del colágeno tipo I (CTX-I), como marcador de destrucción o remodelado óseo. Los autores, si bien destacan que algunos estudios muestran que su determinación en suero y/o orina pueden proporcionar información sobre la destrucción articular en la AR, no aportarían ventajas sustanciales y definitivas para que se puedan aplicar en la práctica diaria y mucho menos sustituir al estudio radiológico23. Un claro ejemplo de la discordancia entre diferentes estudios son los resultados dispares que se observan en dos estudios prospectivos y metodológicamente correctos en los que se analizan distintos biomarcadores solubles del remodelado articular en la AR. En uno de ellos se concluye que algunos de los marcadores bioquímicos, como el MMP3, CTX-II, los niveles de piridolina o de COMP (proteína oligomérica de la matriz), tanto a nivel basal o como valores integrados en el tiempo, son marcadores fiables de destrucción articular en la AR después de 2 años de seguimiento; su significación pronóstica sería, además, claramente superior a la observada con marcadores clásicos, como la PCR o el FR24. De forma totalmente contraria, Syversen et al25 no encuentran ningún biomarcador soluble que sea predictor de destrucción articular a los 5 y 10 años de seguimiento, mientras que sí lo serían los reactantes de fase aguda, como la PCR o la VSG. Únicamente encuentran una asociación débil con los niveles séricos de CTX-I. Dicha asociación con CTX-I y también con CTX-II se observa también en otro estudio de este mismo grupo26, aunque los autores concluyen nuevamente que estas determinaciones serían poco útiles a nivel individual, ya que la considerable superposición de valores entre los pacientes que progresan y no progresan limitaría su uso en la práctica clínica. Por otra parte, en este mismo estudio se comprueba que algunos de estos biomarcadores, como es el caso de la MMP3, serían marcadores de inflamación sinovial más que de destrucción articular, al observarse su estrecha correlación con el edema óseo y la sinovitis valorada por resonancia magnética26.
Estratificación (escala numérica de 0-10) según el poder de evidencia en la revisión sistemática de la literatura de acuerdo con el daño estructural que refleja cada biomarcador según OMERACTa
| Media (DE) | Rango | |
| CTX-II | 6,5 (1,2) | 4-8 |
| MMP3 | 4,5 (1,2) | 2-6 |
| RANKL | 3,2 (1,2) | 1-5 |
| OPG | 2,8 (1,3) | 0-5 |
| CTX-I | 3,8 (1,3) | 2-7 |
Además de los cinco biomarcadores solubles propuestos por el grupo OMERACT, existen estudios con otras moléculas, dos de la cuales merecerían una especial consideración, como la ya mencionada COMP y la calprotectina.
La COMP es una glucoproteína pentamérica de la matriz extracelular del cartílago, que se considera un marcador especifico del turnover del cartílago articular: posteriormente, se ha visto que no sólo se expresa en cartílago hialino, sino también a nivel de membrana sinovial, hueso y tendones27. Se ha estudiado específicamente en la artrosis y está considerado como un biomarcador de mayor destrucción articular y mayor progresión de la artrosis de grandes articulaciones28. En la AR se ha visto que carece de valor diagnóstico y que no se correlaciona con los parámetros inflamatorios; también se ha asociado a mayor progresión de la artritis de grandes articulaciones29, aunque podríamos concluir que los resultados son discordantes entre los distintos estudios y que, en todo caso, la magnitud del efecto sería muy moderada.
La calprotectina es una proteína presente en grandes cantidades en el citosol de neutrófilos/monocitos y que se expresa en la sinovial a nivel de la unión cartílago/pannus, localización donde se inicia el proceso erosivo en la AR30. Los niveles de calprotectina se correlacionan con parámetros inflamatorios y se encuentra en altas concentraciones en el líquido sinovial de pacientes con AR en comparación con la artrosis. Las concentraciones son más levadas en pacientes con AR y autoanticuerpos (FR/ACPA) positivos. A pesar de esta asociación con marcadores clásicos de mayor destrucción articular (actividad inflamatoria, autoanticuerpos), un estudio longitudinal reciente encuentra que es un biomarcador independiente de progresión radiológica en AR después de 10 años de seguimiento31. No obstante, faltan más estudios para conocer si podría ser de utilidad en la práctica clínica en un futuro próximo.
En conclusión, del estudio de los biomarcadores de destrucción articular en la AR pone de manifiesto que estamos todavía lejos de descubrir el o los biomarcadores ideales que puedan utilizarse en nuestra práctica clínica. Aparte de los marcadores clásicos, como los reactantes de fase aguda o los autoanticuerpos (FR y especialmente ACPA), los marcadores del remodelado articular, aunque objeto de múltiples estudios que sin duda continuarán en el futuro, han aportado hasta ahora una información insuficiente o poco relevante.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.