Las infecciones virales crónicas en un paciente reumático constituyen un reto diagnóstico y terapéutico. Algunos de los fármacos antirreumáticos modificadores de la enfermedad (FAME) más utilizados en la artritis reumatoide, como el metotrexato y la leflunomida, presentan riesgo de hepatotoxicidad. Con la terapia biológica, que es hoy en día ampliamente utilizada en pacientes refractarios a estos y otros FAME, se han descrito casos de reactivación de hepatitis B, incluso fulminante, especialmente con los antagonistas del TNF y rituximab, por lo que su utilización ha de ser cuidadosamente valorada y, generalmente, administrada junto con tratamiento antiviral. Sin embargo, no se han descrito casos de reactivación de hepatitis C tras terapia inmunosupresora. En los pacientes con serología VIH la administración de tratamiento inmunosupresor conlleva un elevado riesgo de infecciones oportunistas, aunque la nueva terapia antiviral altamente activa permite utilizar algunos fármacos en casos seleccionados.
Chronic viral infections in rheumatic patients are a diagnostic and therapeutic challenge. Some of the disease-modifying antirheumatic drugs (DMARD) commonly used in rheumatoid arthritis, such as methotrexate and leflunomide, are hepatotoxic. With biological therapy, which is now widely used in patients refractory to these and other DMARD, some cases of reactivation of hepatitis B, even fulminant cases, have been reported, especially when employing TNF antagonists and rituximab, so their use must be carefully assessed and usually accompanied by antiviral therapy. However, there have not been reports of reactivation of hepatitis C after immunosuppressive therapy. In patients with HIV infection, administration of immunosuppressive therapy carries a high risk of opportunistic infections, although the new highly active antiviral therapy allows the use of some drugs in selected cases.
La artritis reumatoide (AR) es una enfermedad autoinmune, crónica, de curso progresivo, caracterizada por la inflamación crónica de las articulaciones, que afecta al 0,5-1% de la población adulta española. La coexistencia de una infección vírica en el entorno de un paciente reumático plantea, en ocasiones, un dilema diagnóstico, al poder presentar la infección vírica manifestaciones reumatológicas, y un reto terapéutico por el riesgo de hepatotoxicidad de los fármacos utilizados en el tratamiento de la AR y, sobre todo, por la probabilidad de reactivación de la infección viral subyacente. Debido a este posible riesgo, con frecuencia, en la práctica clínica, estos pacientes pueden estar infratratados, con el riesgo de progresión de su enfermedad articular.
Actualmente no existen guías en Reumatología sobre cómo tratar a estos pacientes, sólo estrategias de prevención basadas, la mayoría de ellas, en los datos observados de pacientes.
Artritis reumatoide y serología virus de hepatitis BDesde el punto de vista epidemiológico, España se ha clasificado entre los países de endemia media baja de infección por virus de hepatitis B (VHB), con una prevalencia aproximada del 2%, aunque su incidencia ha disminuido notablemente desde la introducción de la vacunación obligatoria contra el VHB. Aunque en áreas endémicas la principal vía de transmisión es vertical, en España se observa mayor transmisión por vía sexual y parenteral, de forma que su infección se observa con frecuencia en ciertos grupos de riesgo, entre los que se incluyen: pacientes procedentes de áreas endémicas, con conducta de riesgo sexual (antecedentes de varias parejas sexuales, de enfermedad de transmisión sexual o de relación homosexual), contacto familiar o sexual con persona infectada por VHB, coinfección por virus de hepatitis C (VHC) o virus de la inmunodeficiencia humana (VIH), los pacientes adictos a drogas por vía parenteral y los que están en hemodiálisis o reciben tratamiento inmunosupresor1.
Historia natural de la infección crónica por virus de hepatitis BExisten aproximadamente 2.000 millones de personas infectadas en todo el mundo por VHB, con una prevalencia mundial del 5%. La infección crónica por el VHB es la primera causa de cirrosis hepática (CH) y de carcinoma hepatocelular (CHC) y, aproximadamente 500.000 personas mueren cada año por complicaciones de la infección por VHB.
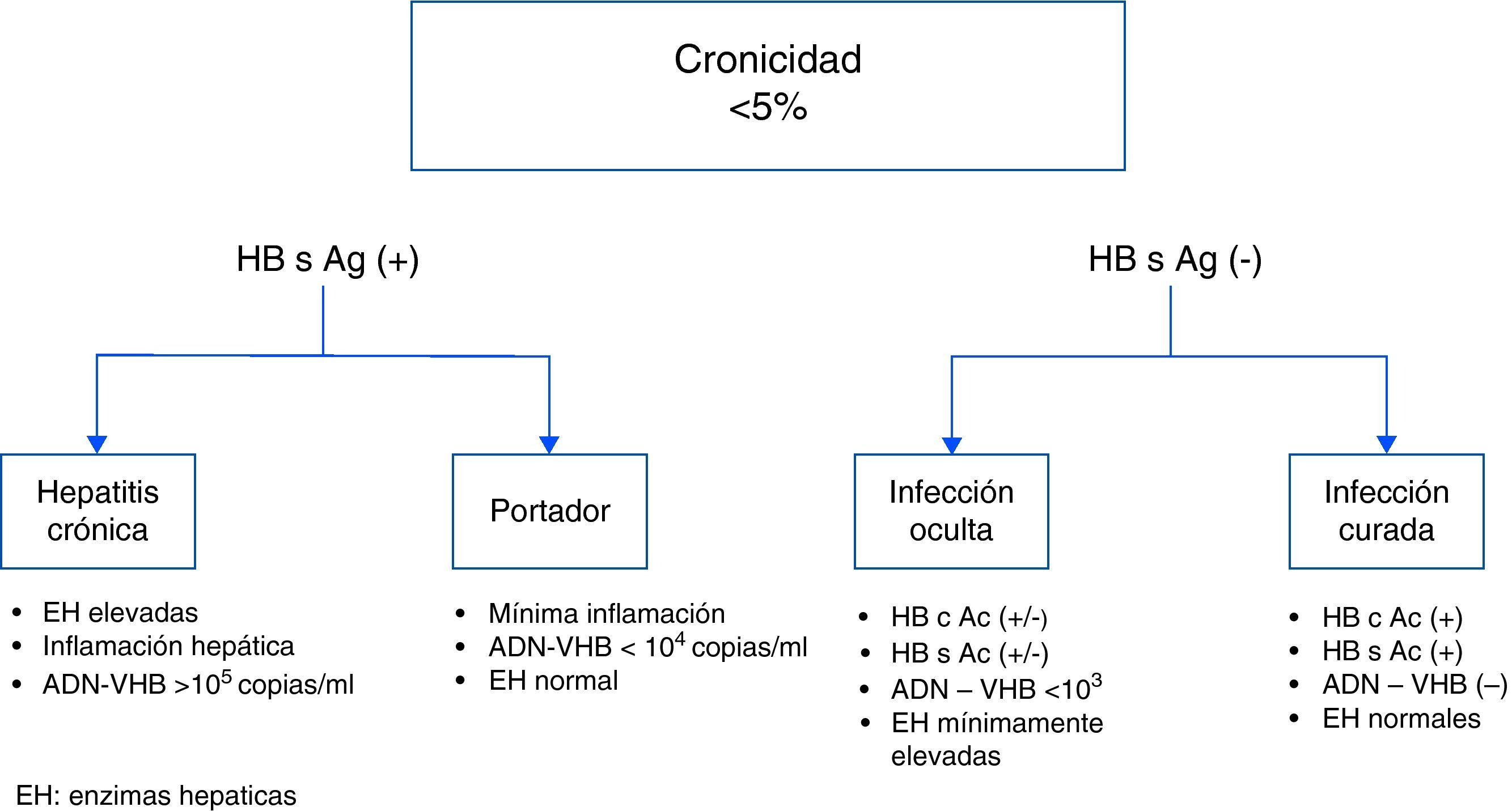
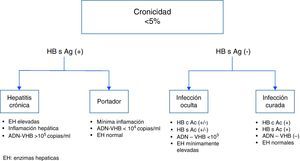
Aunque cerca del 95% de las infecciones se resuelven en la etapa aguda, un 5% se cronifican2. La cronicidad se define por la persistencia de la positividad del HB s Ag en suero durante más de 6 meses. Los pacientes que presentan persistencia de HB s Ag (+) se pueden, a su vez, subdividir en dos: aquéllos con hepatitis crónica por VHB y los que presentan un estado de portador asintomático de VHB. En los pacientes con hepatitis crónica por VHB las enzimas hepáticas están elevadas, se observa inflamación en la histología hepática, el ADN de VHB es > 105 copias/l y existe mayor riesgo de progresión a CH y CHC, así como mayor riesgo de transmisión de VHB. Por el contrario, los portadores asintomáticos no presentan elevación de enzimas hepáticas, tienen una mínima inflamación hepática y el ADN viral es < 104 copias/l2.
Aunque tradicionalmente se consideraba que aquellos pacientes con antecedentes de hepatitis B con serología negativa HB s Ag (–) tenían una infección curada, recientemente se han descrito casos en pacientes con estas características que pueden tener una infección oculta por VHB. En ambos casos el HB s Ag es negativo, pero en la infección curada las enzimas hepáticas son normales, el ADN VHB es negativo y son positivos los anticuerpos HB s Ac y HB c Ac. En los casos de infección oculta las enzimas hepáticas pueden estar levemente alteradas, el ADN viral es positivo, aunque a títulos bajos (muchas veces inferior a la técnica utilizada, por lo que la identificación depende de la sensibilidad y especificidad de los ensayos utilizados) y los anticuerpos HB c Ac y HB s Ac pueden o no ser positivos2,3 (fig. 1). La infección oculta por VHB se ha documentado principalmente en aquellos pacientes que presentan coinfección por VHC o VIH, CHC y fibrosis hepática criptogenética. Estos pacientes se superponen con los que previamente eran considerados curados y son pacientes que deben estar estrechamente vigilados por el riesgo de reactivación viral cuando se inicia una terapia inmunosupresora. De hecho, se han descrito casos de reactivación de infección oculta por agentes biológicos, incluyendo el rituximab3.
Reactivación del VHBEl VHB es un virus hepatotropo, no citotropo, que infecta a los hepatocitos, siendo la hepatitis B una enfermedad inmunomediada, de forma que la respuesta del huésped depende sobre todo del estado de inmunosupresión. Así, en un paciente inmunocompetente existe una respuesta citotóxica y humoral frente a los hepatocitos infectados, produciéndose su citólisis y dando lugar a la hepatitis. En cambio, en un paciente inmunocomprometido (por ejemplo, en tratamiento inmunosupresor) no tiene lugar la citólisis, por lo que se produce un aumento de la replicación viral y de la viremia. Cuando el sistema inmune se restituye (por ejemplo, al suprimir el tratamiento inmunosupresor) tiene lugar una hiperrespuesta inmune contra los hepatocitos infectados, produciéndose la hepatitis que, en muchas ocasiones, puede ser fulminante.
El factor de necrosis tumoral (TNF) es la principal citocina implicada en la infección por VHB. Inhibe la replicación viral y estimula la respuesta inmune, produciendo citólisis e induciendo la apoptosis del hepatocito infectado. Los fármacos biológicos, al inhibir el TNF, producen una inhibición del sistema inmune, creando un ambiente favorable para la replicación viral4.
Reactivación de infección por virus de hepatitis B y fármacos antirreumáticos modificadores de la enfermedadLa reactivación de la infección por VHB es la reaparición de la inflamación y necrosis hepática en personas que eran conocidas portadores sanos o que presentaban una infección aparentemente resuelta y se caracteriza por niveles elevados de enzimas hepáticas, fluctuaciones de los niveles del ADN viral y positividad del HB s Ag1.
Se han observado casos de reactivación de VHB en pacientes con AR en relación con la administración de FAME, principalmente metotrexato (MTX), siendo el primero descrito por Flowers et al en 19905. Esta reactivación se ha observado en pacientes con AR con HB s Ag (+) que recibían MTX, generalmente a dosis bajas (≤ 10 mg/semana) y, habitualmente, a los 15-60 días de la disminución de dosis de MTX o de su retirada6. Su evolución puede ser grave, habiéndose publicado casos de insuficiencia hepática e incluso exitus6.
Reactivación de infección por VHB y anti-TNFSe han descrito casos de reactivación de VHB con los 3 agentes anti-TNF, la mayoría de los casos en relación con infliximab, tras la 3.a o 4.a infusión. Sin embargo, el hecho de que el infliximab fuera el primer biológico aprobado para el tratamiento de la AR podría dar la falsa impresión de ser el principal responsable de la reactivación en la mayoría de los casos. Además, debido a su esquema de tratamiento (entre la 3.a y 4.a infusión pasan aproximadamente 8 semanas) se produce un tiempo suficiente para restablecer el sistema inmune y producir la reactivación de VHB, mientras que con los otros biológicos hay un menor intervalo entre dosis4.
Reactivación de virus de hepatitis B y rituximabSe han publicado casos de reactivación de VHB, incluso hepatitis fulminante, tras tratamiento con rituximab (RTX) tanto en pacientes con HB s Ag (+) como en pacientes con infección oculta por VHB (HB s Ag [–]), principalmente en el campo onco-hematólógico7. Debido a este elevado riesgo no se recomienda tratar con RTX a pacientes con HB s Ag (+). En los pacientes con HB s Ag (–), sería casi obligatorio descartar una infección oculta por VHB antes de iniciar RTX. Se debería determinar el ADN VHB basal y, posteriormente, cada 1-3 meses, así como realizar un control estricto de las enzimas hepáticas de forma mensual7.
HepatotoxicidadLos FAME utilizados más frecuentemente en la AR en la actualidad, el MTX y la leflunomida (LFN), son hepatotóxicos y se han descrito casos de elevación de enzimas hepáticas, sobre todo en los 6 primeros meses, aunque la insuficiencia hepática es excepcional. A pesar de que en muchos de estos casos existían otros fármacos posiblemente hepatotóxicos utilizados concomitantemente (AINE) y muchos pacientes tenían otros factores de riesgo (consumo excesivo de alcohol), no se recomendaría la utilización de MTX y LFN en pacientes con VHB. En estos casos, el efecto tóxico del tratamiento se añadiría al efecto vírico sobre el tejido hepático produciendo un efecto sinérgico y aumentando el riesgo de daño hepático8.
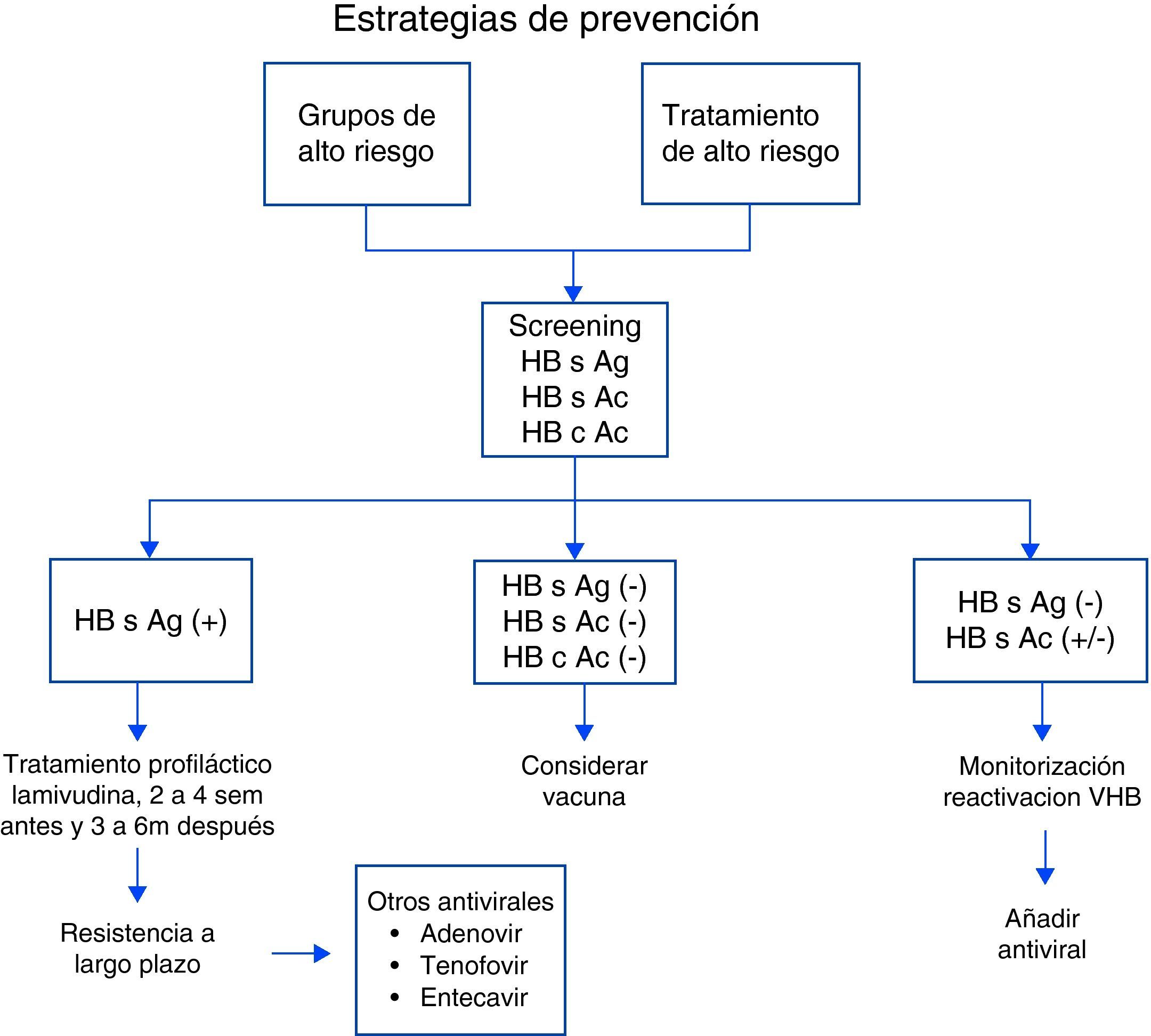
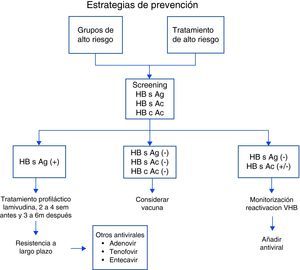
Estrategia de actuación ante un paciente con artritis reumatoide con serología virus de hepatitis BAunque actualmente en el campo de la Reumatología no existen consensos ni guías de manejo de pacientes con AR y serología de VHB, existen ciertas estrategias de prevención, siendo la más citada en la literatura la de Calabrese et al2, que divide los pacientes en grupos de alto riesgo de VHB, comentados previamente, y los que recibirán tratamiento de alto riesgo (corticoides a altas dosis, tratamiento inmunosupresor, biológico).
En primer lugar, aconsejan la realización de serología de VHB incluyendo HB s Ag, HB c Ac y HB s Ac. Si el HB s Ag es positivo se debería realizar tratamiento profiláctico con antivirales (lamivudina), iniciarlo 2-4 semanas antes de comenzar el tratamiento inmunosupresor y mantenerlo hasta 6 meses después de discontinuar el tratamiento. Cuando el tratamiento inmunosupresor se mantiene a largo plazo se han descrito casos de resistencia a lamivudina, por lo que debemos tener en cuenta otros antivíricos (adenovir, tenofovir, entecavir). Si toda la serología de VHB es negativa se debe considerar la vacunación del paciente. En un paciente con HB s Ag (–), HB c Ac (+) y HB s Ac (+/–) se debería realizar una monitorización estrecha y en caso de reactivación, añadir tratamiento antiviral2 y evaluación por el hepatólogo (fig. 2).
Artritis reumatoide y serología virus de hepatitis CLa infección por el VHC es también un problema mundial con una prevalencia global del 2,2%, siendo en España la prevalencia aproximadamente del 1,2-1,9%. A diferencia del VHB, del 70 al 80% de la infección VHC se cronifica7.
El VHC es hepatotropo y linfotropo. Existe un posible enlace patogénico, mediado por complejos inmunes, entre la infección crónica de VHC y cuadros de poliartralgias/poliartritis que, en ocasiones, pueden simular una AR, por lo que debe realizarse el diagnóstico diferencial. Los pacientes con VHC pueden presentar también mialgias, vasculitis, crioglobulinemia y, muy frecuentemente, positividad de factor reumatoide y anticuerpos antinucleares9.
Fisiopatología de infección por virus de hepatitis CA diferencia del VHB, la principal citocina implicada en el aclaramiento viral en el VHC es el interferón gamma (INF-γ). Aunque el TNF no tiene un efecto directo en la patogénesis de la infección por VHC, produce una inhibición del INF-γ y disminuye, de forma indirecta, el aclaramiento viral. Además, la persistencia de niveles elevados de TNF se ha asociado con recaídas de VHC, por lo que podría estar implicado en la refractariedad al tratamiento con INF-γ 10. En este sentido, los antagonistas del TNF al bloquear la inhibición producida por el TNF, podrían producir una mejoría de la infección por VHC.
Virus de hepatitis C y fármacos antirreumáticos modificadores de la enfermedadEn relación con los FAME, el MTX y la LFN podrían agravar el daño hepático debido a su potencial hepatotoxicidad, al igual que en la VHB. En los pacientes con VHC se podrían también utilizar otros FAME como las sales de oro, salazopirina o antimaláricos, aunque no siempre consiguen el control de la enfermedad. La ciclosporina A posee, además, un efecto inhibitorio de la replicación viral, mediada por la inhibición de la ciclofilina B.
Virus de hepatitis C y terapia biológicaLos antagonistas del TNF no son hepatotóxicos y, como hemos visto previamente, producen una disminución de la carga viral, por lo que, a diferencia de VHB, no existiría riesgo de reactivación de la infección vírica. En estos casos, no sería necesaria la profilaxis antiviral. Además, estudios en pacientes con VHC con tratamiento antiviral (ribavirina, interferón) demostraron que la adición de tratamiento con antagonistas del TNF obtenía mejor resultado en cuanto a mejoría de la infección viral10. A pesar de estos buenos resultados y de no existir contraindicación, se aconseja realizar la monitorización de enzimas hepáticas de forma mensual y, si éstas aumentan, determinar el ARN viral10. Existen pocos casos con abatacept, aunque no se ha descrito reactivación de VHC11.
Artritis reumatoide y serología virus de la inmunodeficiencia humanaLa infección por VIH afecta a cerca de 40 millones de personas en todo el mundo. Desde el punto de vista reumatológico, la infección por VIH puede asociarse a diversas enfermedades reumáticas como el síndrome de Reiter, artritis psoriásica, miositis inflamatoria, síndrome de Sjögren, vasculitis necrotizante, artropatías monoarticulares, poliarticulares u oligoarticulares y fibromialgia. En estos pacientes se había descrito una menor incidencia de AR debido a la mayor inmunosupresión por la infección VIH. Con la introducción de la terapia antirretroviral altamente activa (TARGA) se han producido cambios drásticos en la historia natural del VIH, consiguiéndose un menor nivel de inmunosupresión en estos pacientes y una mayor supervivencia y observándose, además, un aumento de la incidencia de enfermedades reumáticas.
En estos pacientes está permitido el tratamiento con ciertos FAME como las sales de oro, antimaláricos o salazopirina.
Respecto a la terapia biológica, se sabe que el TNF tiene un papel en la patogénesis de la infección por VIH, ya que favorece su propagación, la depleción linfocitaria y el aumento de la apoptosis, y contribuye así a la progresión de la inmunodeficiencia10. En este sentido, la terapia anti-TNF podría ser beneficiosa, aunque se ha descrito un aumento del riesgo de infecciones oportunistas12. Sin embargo, en determinados casos, sobre todo en aquellos pacientes menos inmunodeprimidos, se podría plantear terapia biológica si no se consigue el control de la AR con FAME. Se ha propuesto que estos pacientes deberían presentar: unas cifras de CD4 > 200/mm3, una carga viral < 60.000 copias/mm3 y no presentar infección concomitante antes de iniciar la terapia biológica10.
Actualización del Consenso de la Sociedad Española de ReumatologíaEn la última actualización de la Sociedad Española de Reumatología sobre terapia en AR se señala el riesgo de hepatotoxicidad de la LFN y el MTX. En relación con los agentes biológicos se sugiere determinar serologías VHB y VHC antes del inicio de tratamiento y realizar un control estricto de la función hepática, así como valorar la vacunación de VHB en pacientes sin infección13.
Recomendaciones del American College of RheumatologyLas últimas recomendaciones del American College of Rheumatology contraindican el tratamiento con MTX y LFN en todos los pacientes con VHB y/o VHC. En relación con la terapia biológica su contraindicación depende del estado funcional de la hepatopatía. Así, los anti-TNF, el RTX y el abatacept están contraindicados en pacientes con VHB y/o VHC que presentan un Child-Pugh clase B o C (independientemente del tratamiento antiviral profiláctico), estando permitidos en aquéllos con Child-Pugh A14.
Recomendaciones de la European League Against RheumatismLas últimas recomendaciones de European League Against Rheumatism sobre el tratamiento de AR aconsejan realizar serología VHB y VHC antes de iniciar la terapia biológica en todos los pacientes. Recomiendan que no se administren los anti-TNF en pacientes con infección por VHB. Se debería realizar serología VHB antes del inicio de RTX y, si ésta fuera positiva estaría contraindicado el tratamiento con RTX. En caso de que se diagnostique infección por VHB durante el tratamiento con anti-TNF se debería añadir terapia antiviral profiláctica15.
ConclusionesArtritis reumatoide y virus de hepatitis B- –
Los FAME MTX y LFN no estarían recomendados. Sí estarían permitidos las sales de oro, antimaláricos y salazopirina.
- –
Los fármacos biológicos no son hepatotóxicos, pero existe un riesgo de reactivación de VHB. En pacientes con HB s Ag (+) se recomienda profilaxis antiviral (lamivudina) antes y durante el tratamiento con anti-TNF, y no se recomendaría el tratamiento con RTX. En pacientes con HB s Ag (–) se aconsejaría monitorización estrecha de enzimas hepáticas y ADN viral.
- –
Los FAME MTX y LFN presentan riesgo de hepatotoxicidad. Estarían permitidos otros FAME.
- –
Los fármacos anti-TNF y el RTX son eficaces y seguros en pacientes con AR e infección crónica por VHC, no siendo necesario profilaxis antiviral. Existen pocos casos con abatacept, aunque no se ha descrito reactivación de VHC.
- –
Permitido el tratamiento con salazopirina y antimaláricos.
- –
Se podría considerar la terapia biológica en casos seleccionados.
Nota: Sección acreditada por el SEAFORMEC con 1,7 créditos. Consultar preguntas de cada artículo en: URL: http://www.reumatologiaclinica.org.