Revisar la evidencia clínica sobre abatacept y emitir recomendaciones con objeto de aclarar su uso en Reumatología.
MétodoUn panel de expertos reumatólogos resumió de forma objetiva las pruebas existentes sobre el mecanismo de acción, modo de uso, eficacia y seguridad de abatacept y emitió recomendaciones de uso en situaciones concretas, previa revisión de la bibliografía. Se estableció el nivel de evidencia de las pruebas y el grado de apoyo de dichos datos a las recomendaciones emitidas.
ResultadosEl documento presenta 21 enunciados resumen de la evidencia encontrada o recomendaciones sobre abatacept (14 enunciados y 9 recomendaciones). El nivel de evidencia es superior a 2b según la escala de Oxford del Centro de Medicina Basada en la Evidencia en 14 ocasiones. El grado de apoyo de las recomendaciones es A en 2 recomendaciones, C en una y D en el resto. Se consideró importante realizar recomendaciones precisamente en los aspectos con menor grado de evidencia.
ConclusionesSe trata de un documento práctico como complemento a la información en ficha técnica.
To review the clinical evidence on abatacept and to formulate recommendations in order to clear up points related to its use in rheumatology.
MethodAn expert panel of rheumatologists objectively summarized the evidence on the mechanism of action, practicalities, effectiveness and safety of abatacept, and formulated recommendations following a literature review. The level of evidence and degree of recommendation was established.
ResultsThe document presents 21 statements focused on evidence or recommendations on abatacept (14 evidence summaries and 9 recommendations). The level of evidence was 2b or higher according to the Oxford Centre for Evidence-Based Medicine scale on 14 occasions. The degree of the recommendation was A in two recommendations, C in one, and D in the rest. It was considered important to make recommendations on aspects with lower levels of evidence.
ConclusionsThis is a practical document to supplement the summary of product characteristics.
Desde la aparición de los agentes biológicos, el clínico ha ido acumulando gran cantidad de información relevante en poco tiempo. Esto ha dificultado poder desentrañar las diferencias que existen entre los distintos agentes biológicos: 5 inhibidores del TNF, anakinra, rituximab, abatacept y tocilizumab. Todo ello ha llevado a una serie de conclusiones simplistas, como la de que «todos los agentes biológicos son iguales» o que, «todos tendrían un perfil de tolerabilidad y seguridad similar». A ello ha contribuido además, la ausencia de estudios comparativos directos, aunque ya existen metaanálisis basados en los ensayos clínicos, que han aportado alguna luz sobre sus diferencias1–4.
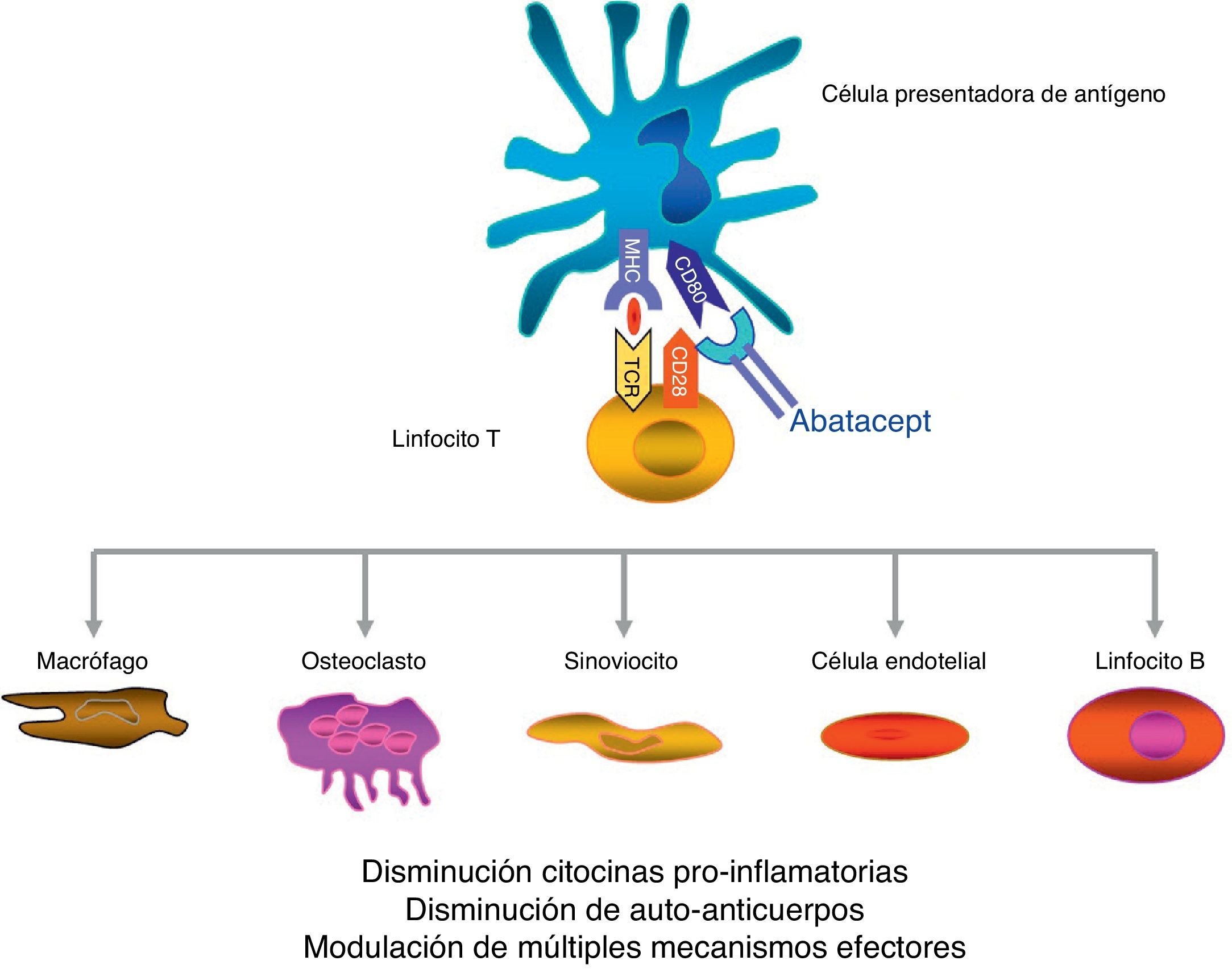
Abatacept es un fármaco de administración parenteral que se caracteriza por un mecanismo de acción diferente del resto de agentes biológicos. Se trata de una proteína de fusión formada por el dominio extracelular CTLA-4 que se expresa en el linfocito T y un fragmento modificado Fc de la inmunoglobulina humana IgG1. Esta proteína modula la coestimulación cuando la célula presentadora de antígeno se pone en contacto con el linfocito T.
Las indicaciones de abatacept están restringidas a la artritis reumatoide (AR) y a la artritis idiopática juvenil (AIJ) poliarticular. Actualmente está aprobado para aquellos pacientes con respuesta inadecuada a un tratamiento previo con uno o más fármacos modificadores de enfermedad (FAME) o un inhibidor del TNF (al menos uno en el caso de la AIJ)5.
Este documento tiene el objetivo de facilitar al clínico una revisión de la evidencia de este agente biológico, incidiendo especialmente en los aspectos más relevantes de su eficacia en la AR y en los datos existentes hasta la fecha sobre su seguridad. El documento presenta 21 enunciados centrados en evidencias o recomendaciones, cuya misión es tratar de resolver las dudas que se podrían plantear con su uso.
MétodosEl responsable principal del proyecto (EMM) seleccionó a 7 reumatólogos expertos en AR. Todos ellos tenían una experiencia dilatada en el uso de terapias biológicas, además de ser autores de artículos científicos en esta materia. Además de estas características, los panelistas fueron elegidos en función de su distribución geográfica, que trató de ser lo más ajustada posible debido a su reducido número. Hubo 2 reuniones, una primera el 20 de mayo de 2011 y otra final el 14 de noviembre de 2011. En la primera reunión se consensuaron los aspectos, el alcance y el formato que debería tener el documento y se distribuyeron tareas. Todos los expertos llevaron a cabo una revisión no sistemática de la literatura de la parcela científica asignada y se encargaron de la redacción del documento. Además, 3 revisoras (LL, CP y LC) diferentes al grupo anterior e incorporadas al proyecto desde el principio, realizaron revisiones sistemáticas de preguntas consideradas por los panelistas como sujetas a controversia y no incluidas en el metaanálisis Cochrane sobre abatacept6. En la última reunión de consenso se redactaron los enunciados finales que resumían la evidencia y su aplicabilidad clínica. El nivel de evidencia (NE) y grado de recomendación (GR) lo estableció una revisora (LC) en base a la escala del Oxford Centre for Evidence-Based Medicine7. Cuando el GR no se pudo emplear por no tratarse de una recomendación, se etiquetó como «no aplicable» (NA).
ResultadosUn resumen tabulado de las evidencias y recomendaciones se muestra en la tabla 1 junto con el nivel de evidencia y grado de recomendación si procede. A continuación se presenta la descripción de abatacept en sus distintos aspectos.
Evidencias y recomendaciones de uso de abatacept en artritis reumatoide con nivel de evidencia, grado de recomendación, acuerdo y aplicabilidad
| Evidencia o recomendación | NE | GR | |
| 1 | Abatacept se administra en forma de perfusión intravenosa de corta duración y tiene una baja incidencia de reacciones infusionales | 1b | NA |
| 2 | Abatacept es eficaz en la reducción de signos y síntomas de la artritis reumatoide en pacientes con fallo a FAME o inhibidores del TNF | 1b | NA |
| 3 | La eficacia de abatacept se mantiene a lo largo del tiempo | 2b | NA |
| 4 | Abatacept es eficaz en AR de inicio sin tratamiento previo con FAME y factores de mal pronóstico, aunque esta indicación no está aprobada | 1b | NA |
| 5 | Abatacept disminuye la progresión del daño estructural articular de forma mantenida en el tiempo | 2b | NA |
| 6 | Abatacept tiene altas tasas de retención en estudios a largo plazo | 2b | NA |
| 7 | Los datos de efectividad de abatacept en práctica clínica en los registros son consistentes con los de los ensayos clínicos | 2b | NA |
| 8 | Antes de administrar abatacept y durante la monitorización del mismo se deben seguir las recomendaciones generales propuestas para las terapias biológicas | 5 | D |
| 9 | El perfil de seguridad de abatacept y su tolerabilidad son satisfactorios | 1b | NA |
| 10 | En los ensayos clínicos las tasas de infecciones con abatacept son similares a las de los pacientes tratados con MTX y numéricamente inferiores a las de otros biológicos | 1b | NA |
| 11 | La tasa de tuberculosis en pacientes tratados con abatacept parece inferior a la de los inhibidores del TNF. No obstante, en los pacientes que van a ser tratados con abatacept se debe hacer una búsqueda de infección tuberculosa latente de acuerdo con las recomendaciones de la SER | 2b; 5 | NA; D |
| 12 | Se desconoce la seguridad de abatacept en pacientes con hepatitis B o C. Su uso debe guiarse por un control estrecho de la función hepática y la carga viral | 5; 5 | NA; D |
| 13 | El riesgo de aparición de tumores en pacientes tratados con abatacept no es superior a lo esperado en pacientes con AR | 2b | NA |
| 14 | El uso de abatacept en pacientes con insuficiencia cardiaca grado iv debe hacerse con precaución | 5 | D |
| 15 | En pacientes con EPOC, abatacept debe administrarse solo tras un análisis riguroso del balance riesgo-beneficio | 1b | A |
| 16 | No se han descrito casos de aparición de enfermedad intersticial pulmonar (EIP) en pacientes tratados con abatacept. Se desconoce su seguridad en casos de afectación preexistente | 4; 5 | NA |
| 17 | En los pacientes que padecen enfermedades desmielinizantes no está contraindicado el uso de abatacept; en caso de utilizarse, se requiere un seguimiento neurológico estrecho | 2b | D |
| 18 | Abatacept administrado por vía intravenosa es un medicamento poco inmunogénico | 4 | NA |
| 19 | En pacientes tratados con abatacept la respuesta de anticuerpos a vacunas con gérmenes inactivados o componentes celulares es inferior a la de la población general; las vacunas con gérmenes vivos atenuados deben evitarse | 4 | C |
| 20 | Abatacept se puede administrar sin realizar un periodo de lavado tras el uso de anti-TNF, pero no se debe administrar en combinación con otro agente biológico | 1b | A |
| 21 | Abatacept debería suspenderse al menos 3 meses antes del inicio de un embarazo | 5 | D |
A: aplicabilidad; GA: grado de acuerdo; NE: nivel de evidencia; GR: grado de recomendación; NA: no aplicable (por no tratarse de una recomendación).
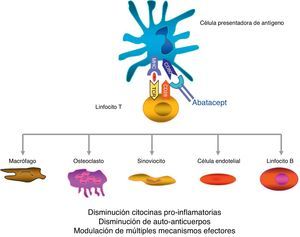
Abatacept es el primer agente terapéutico aprobado para el tratamiento de la AR que actúa de forma selectiva bloqueando la activación de la célula T mediante la interrupción de la señal coestimuladora8. La célula T juega un papel fundamental en la patogenia de la AR9,10. De una forma resumida y simplificada, la activación de la célula T requiere de 2 señales fundamentales por parte de la célula presentadora de antígeno11. La primera es la del antígeno presentado en la estructura del sistema mayor de histocompatibilidad, complejo reconocido por el receptor de la célula T. La segunda señal es la que proporcionan las moléculas coestimuladoras, como CD80 y CD86, claves en la unión a CD28 en la célula T. Esta unión a CD28 conduce a la proliferación de la célula T y a la producción de citocinas8,12. CTLA-4, expresado fisiológicamente en la superficie de la célula T activada, tiene como misión fundamental el competir con CD28 en la unión a CD80/CD86, y por ende suprimir la activación de la célula T12,13. Abatacept es una proteína de fusión formada por el dominio extracelular del CTLA-4 humano unido a un fragmento Fc de la IgG1 humana que inhibe de forma selectiva la segunda señal, bloqueando la unión de CD80/CD86 a CD28 (fig. 1).
Mecanismo de acción del abatacept.
Abatacept es una proteína de fusión, formada por el dominio extracelular CTLA-4 que se expresa en el linfocito-T y un fragmento modificado Fc de la inmunoglobulina humana IgG1, que modula la coestimulación al ponerse en contacto la célula presentadora de antígeno con el linfocito T.
Se ha demostrado, en varios modelos in vitro y en animales, que el bloqueo selectivo de la coestimulación inducida por abatacept se acompaña de una regulación de la función de las células T CD4+, de una disminución de citocinas proinflamatorias, autoanticuerpos y metaloproteasas y de un aumento de la función de las células T reguladoras14–19. Aunque los datos sobre el mecanismo de acción en pacientes con AR son limitados, se sabe que abatacept reduce el componente inflamatorio de la sinovial reumatoide y la expresión de genes implicados en la destrucción ósea18. Además, CTLA-4 tiene un efecto antireabsortivo al unirse directamente a los precursores de los osteoclastos e inhibiendo su diferenciación12,20.
El fragmento Fc de abatacept está diseñado con varias mutaciones puntuales que lo inactivan. De esta manera, abatacept no se une a los receptores de baja afinidad CD16 y CD32 y lo hace de forma subóptima al receptor de alta afinidad CD6421. Debido a esto, abatacept no se acompaña de citotoxicidad celular dependiente de anticuerpo ni del complemento.
Modo de administración y particularidadesEvidencia/Recomendación 1. Abatacept se administra en forma de perfusión intravenosa de corta duración y tiene una baja incidencia de reacciones infusionales. (NE: 1b; GR: NA)Abatacept se administra en forma de perfusión intravenosa de corta duración a una dosis aproximada de 10mg/kg. Tras la primera infusión, abatacept se administra a las 2 y 4 semanas, y posteriormente cada 4 semanas5. Los detalles sobre su posología, forma de administración, y precauciones que se deben tomar antes y durante la administración se muestran en la tabla 2. La administración intravenosa de abatacept tiene la característica de que se administra en 30 minutos y rara vez precisa del uso de premedicación, ya que las reacciones infusionales son muy poco frecuentes6,22,23. En general, la dosis y los intervalos de administración de abatacept se suelen mantener constantes en el tiempo24.
Administración de abatacept: posología, forma de administración y precauciones
| • Composición: cada vial contiene 250mg de abatacept |
| • Forma de administración: perfusión intravenosa. Cada vial se debe reconstituir con 10ml de agua para preparaciones inyectables. Posteriormente la solución reconstituida de debe diluir hasta 100ml con cloruro de sodio 9mg/ml (0,9%) solución inyectable, antes de la perfusión |
| • Duración de la perfusión: 30 minutos |
| • Premedicación antes de la perfusión: no precisa |
| • Dosificación: la dosis de abatacept es aproximadamente de 10mg/kg. Abatacept se administra en las semanas 0, 2 y 4, y posteriormente cada 4 semanas |
| Peso del paciente | Dosis | Número de viales |
| < 60kg | 500mg | 2 |
| ≥ 60kg hasta ≤ 100kg | 750mg | 3 |
| > 100kg | 1.000mg | 4 |
| • Periodo de validez: del vial cerrado: 3 años. Después de la reconstitución y dilución: 24 horas entre 2°C y 8°C |
| • Precauciones en poblaciones especiales: no precisa ajuste de dosis en pacientes ancianos. No se dispone de información en pacientes con insuficiencia renal y/o hepática |
Aunque se espera que abatacept sea aprobado para su administración subcutánea en los próximos meses25,26, en el momento actual en Europa solo existe disponible para administración intravenosa. La administración subcutánea ofrece al paciente la comodidad de administrarse la medicación en su domicilio. En cualquier caso, las preferencias del paciente al respecto de la vía de administración deben ser exploradas. Se ha comunicado que un 50% de los pacientes prefieren la vía de administración intravenosa a la subcutánea por el efecto tranquilizador de la presencia del médico, la seguridad del tratamiento en el hospital, la aversión por la autoadministración y la frecuencia de la administración, en general más espaciada que con las medicaciones subcutáneas27.
Existe un subestudio del ensayo AGREE en el que los pacientes que habían alcanzado la remisión a los 2 años (DAS28 VSG< 2,6), se aleatorizaron con un diseño doble ciego para recibir abatacept a dosis de 10mg/kg o 5mg/kg. Al año de tratamiento la proporción de pacientes con reactivación de la enfermedad fue similar en los 2 grupos5.
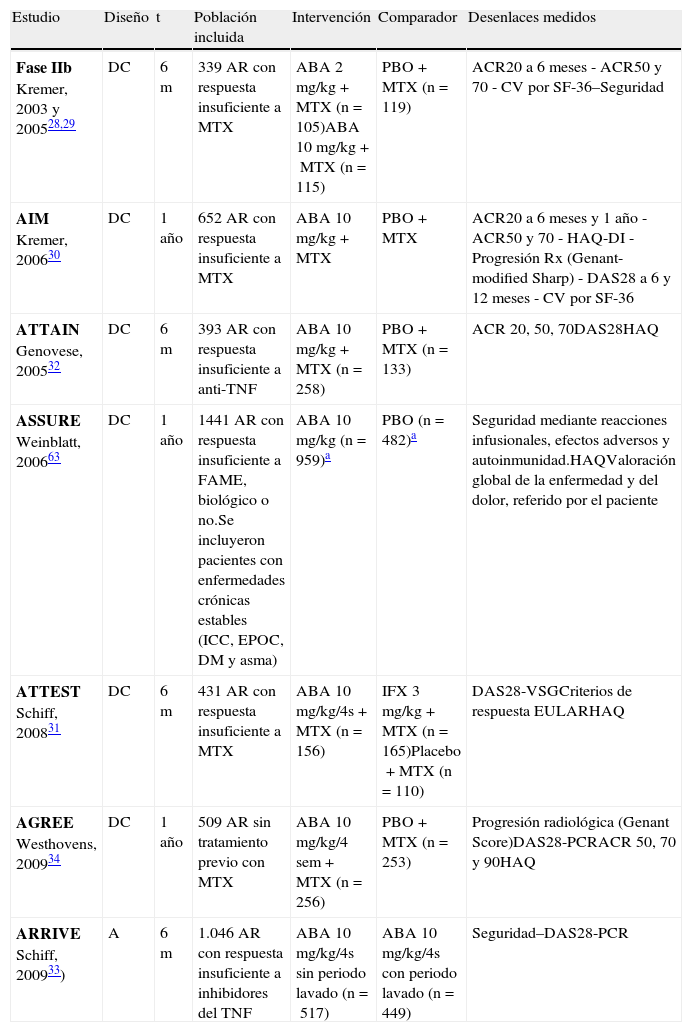
EficaciaLa eficacia de abatacept se ha demostrado tanto a corto como a largo plazo en ensayos clínicos (tabla 3) y sus estudios de extensión a largo plazo (tabla 4), y su efectividad en condiciones de práctica clínica habitual en registros.
Descripción de los ensayos clínicos de abatacept
| Estudio | Diseño | t | Población incluida | Intervención | Comparador | Desenlaces medidos |
| Fase IIb Kremer, 2003 y 200528,29 | DC | 6m | 339 AR con respuesta insuficiente a MTX | ABA 2mg/kg+MTX (n=105)ABA 10mg/kg+MTX (n=115) | PBO+MTX (n=119) | ACR20 a 6 meses - ACR50 y 70 - CV por SF-36–Seguridad |
| AIM Kremer, 200630 | DC | 1 año | 652 AR con respuesta insuficiente a MTX | ABA 10mg/kg+MTX | PBO+MTX | ACR20 a 6 meses y 1 año - ACR50 y 70 - HAQ-DI - Progresión Rx (Genant-modified Sharp) - DAS28 a 6 y 12 meses - CV por SF-36 |
| ATTAIN Genovese, 200532 | DC | 6m | 393 AR con respuesta insuficiente a anti-TNF | ABA 10mg/kg+MTX (n=258) | PBO+MTX (n=133) | ACR 20, 50, 70DAS28HAQ |
| ASSURE Weinblatt, 200663 | DC | 1 año | 1441 AR con respuesta insuficiente a FAME, biológico o no.Se incluyeron pacientes con enfermedades crónicas estables (ICC, EPOC, DM y asma) | ABA 10mg/kg (n=959)a | PBO (n=482)a | Seguridad mediante reacciones infusionales, efectos adversos y autoinmunidad.HAQValoración global de la enfermedad y del dolor, referido por el paciente |
| ATTEST Schiff, 200831 | DC | 6m | 431 AR con respuesta insuficiente a MTX | ABA 10mg/kg/4s+MTX (n=156) | IFX 3mg/kg+MTX (n=165)Placebo+MTX (n=110) | DAS28-VSGCriterios de respuesta EULARHAQ |
| AGREE Westhovens, 200934 | DC | 1 año | 509 AR sin tratamiento previo con MTX | ABA 10mg/kg/4 sem+MTX (n=256) | PBO+MTX (n=253) | Progresión radiológica (Genant Score)DAS28-PCRACR 50, 70 y 90HAQ |
| ARRIVE Schiff, 200933) | A | 6m | 1.046 AR con respuesta insuficiente a inhibidores del TNF | ABA 10mg/kg/4s sin periodo lavado (n=517) | ABA 10mg/kg/4s con periodo lavado (n=449) | Seguridad–DAS28-PCR |
A: abierto; ABA: abatacept; AR: artritis reumatoide; DC: doble ciego; ECA: ensayo clínico aleatorizado; FAME: fármaco modificador de la enfermedad; m: meses; MTX: metotrexato; PBO: placebo.
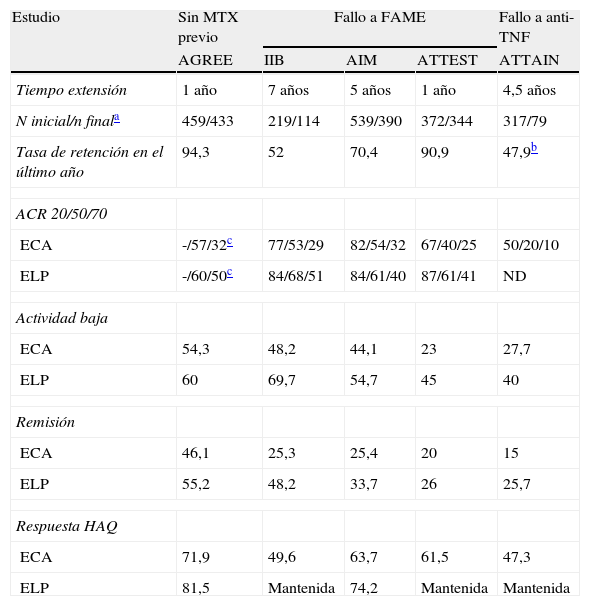
Resultados de eficacia de abatacept en los estudios de extensión a largo plazo. Proporción de pacientes que logran la medida de resultado al final del estudio de los pacientes que finalizan
| Estudio | Sin MTX previo | Fallo a FAME | Fallo a anti-TNF | ||
| AGREE | IIB | AIM | ATTEST | ATTAIN | |
| Tiempo extensión | 1 año | 7 años | 5 años | 1 año | 4,5 años |
| N inicial/n finala | 459/433 | 219/114 | 539/390 | 372/344 | 317/79 |
| Tasa de retención en el último año | 94,3 | 52 | 70,4 | 90,9 | 47,9b |
| ACR 20/50/70 | |||||
| ECA | -/57/32c | 77/53/29 | 82/54/32 | 67/40/25 | 50/20/10 |
| ELP | -/60/50c | 84/68/51 | 84/61/40 | 87/61/41 | ND |
| Actividad baja | |||||
| ECA | 54,3 | 48,2 | 44,1 | 23 | 27,7 |
| ELP | 60 | 69,7 | 54,7 | 45 | 40 |
| Remisión | |||||
| ECA | 46,1 | 25,3 | 25,4 | 20 | 15 |
| ELP | 55,2 | 48,2 | 33,7 | 26 | 25,7 |
| Respuesta HAQ | |||||
| ECA | 71,9 | 49,6 | 63,7 | 61,5 | 47,3 |
| ELP | 81,5 | Mantenida | 74,2 | Mantenida | Mantenida |
ECA, ensayo clínico; ELP: extensión a largo plazo; FAME: fármaco modificador de la enfermedad; MTX, metotrexato.
El metaanálisis de Maxwell et al. muestra una eficacia clara de abatacept frente a placebo6. Un ensayo clínico fase IIb en pacientes con AR establecida y respuesta insuficiente a metotrexato (MTX) demostró que abatacept más MTX era más eficaz que MTX en monoterapia, con porcentajes de respuesta ACR20 a los 6 meses del 60% con abatacept y 35% con placebo28. Esta mejoría clínica significativa persistió a los 12 meses de tratamiento, con índices de remisión DAS28-PCR (<2,6) más elevados en los pacientes tratados con abatacept que en los que recibieron placebo (35 frente a 10%)29. El estudio AIM30, un ensayo clínico aleatorizado fase iii multicéntrico y doble ciego, compara abatacept (+MTX) frente a placebo (+MTX) en 652 pacientes con respuesta insuficiente a MTX. La tasa de respuesta ACR20 a los 6 meses, objetivo primario del estudio, fue claramente superior en el grupo tratado con abatacept que en el grupo placebo (68 frente a 40%). Estas diferencias incluso se incrementaron ligeramente después de un año de tratamiento (73 frente a 40%). Las respuestas ACR50 y ACR70 también fueron significativamente más elevadas en el grupo tratado con abatacept que en el grupo placebo, tanto a los 6 como a los 12 meses. Las diferencias significativas entre ambos grupos se observaron a partir de los 30 días de tratamiento. También se observó una mejoría significativa de la discapacidad evaluada por el HAQ en el grupo de tratamiento activo frente al placebo, al año de seguimiento.
El estudio ATTEST31, un ensayo doble ciego, analiza la eficacia por separado de abatacept e infliximab frente a placebo en pacientes con AR y respuesta insuficiente a MTX. A los 6 meses de tratamiento, ambos agentes biológicos son superiores a placebo. Se observa una mayor rapidez de acción de infliximab en los 3 primeros meses y mayores respuestas ACR20 con abatacept al año de seguimiento. Es importante resaltar que el estudio no se diseñó para evaluar específicamente la eficacia comparativa de los 2 agentes biológicos.
El estudio ATTAIN32 es un ensayo clínico doble ciego, aleatorizado y controlado con placebo que evalúa la eficacia de abatacept frente a placebo en pacientes con fracaso a inhibidores del TNF (infliximab o etanercept). Se incluyeron 393 pacientes con AR activa que después de un periodo de lavado de los inhibidores del TNF se aleatorizaron 2:1 a tratamiento con abatacept (+MTX y/o FAME) o placebo (+MTX y/o FAME). A los 6 meses de tratamiento, las tasas de respuesta ACR20, objetivo primario del estudio, fueron significativamente superiores en el grupo tratado con abatacept que en el grupo placebo (50 frente a 20%), al igual que las respuestas ACR50 (20 frente a 4%) y ACR70 (10 frente a 2%). Se observó también una mejoría significativa de la discapacidad (mejoría HAQ>0,3) en el grupo con abatacept con respecto a los tratados con placebo (47 frente a 23%).
El estudio ARRIVE33 es un ensayo abierto con abatacept en 1.046 pacientes con AR y fallo a inhibidores del TNF, cuyo objetivo primario fue evaluar la seguridad de abatacept administrado con o sin periodo de lavado de los inhibidores del TNF, pero que analiza también su efectividad, demostrando una mejoría significativa de la actividad clínica de la AR (reducción superior a 1,2 del DAS28- PCR) en más del 50% de los pacientes a los 6 meses de seguimiento.
Evidencia/recomendación 4. Abatacept es eficaz en AR de inicio sin tratamiento previo con FAME y factores de mal pronóstico, aunque esta indicación no está aprobada. (NE: 1b; GR: NA)En el estudio AGREE, abatacept con MTX demuestra también ser más eficaz que MTX en monoterapia en pacientes con AR de reciente comienzo que no habían recibido MTX previamente y con factores de mal pronóstico, como son los autoanticuerpos positivos o las erosiones radiológicas34. La tasa de remisión (DAS28-PCR) a los 12 meses fue significativamente superior en los pacientes tratados con abatacept+MTX que en los asignados a placebo+MTX: 41 frente a 23%. Abatacept, no obstante, no tiene la indicación en la actualidad para el tratamiento de pacientes que no han recibido MTX o un FAME previo.
Evidencia/Recomendación 5. Abatacept disminuye la progresión del daño estructural articular de forma mantenida en el tiempo. (NE: 2b; GR: NA)Antes de presentar los resultados de estudios, es importante reseñar que en la valoración del daño estructural con abatacept se ha utilizado el índice de Genant en vez del de Sharp modificado por van der Heijde, que es el que se utilizó habitualmente en los ensayos de inhibidores del TNF; el índice de Genant tiene una graduación del daño inferior (puntuación de 0 a 290) que el de van der Heijde (de 0 a 448), aunque ambos se correlacionan35.
En el estudio AIM30 la diferencia en el índice de Genant de erosiones y total al año de tratamiento frente al basal, fue significativamente menor con abatacept+MTX que con placebo+MTX (índice de erosiones: 0,63 con abatacept frente a 1,14 en placebo; p=0,029; índice de Genant total: 1,21 frente a 2,32; p=0,012)30, lo que significa una reducción de la progresión radiológica del 45% para las erosiones y del 48% en el índice total. Esta reducción es inferior a la que se obtiene con los inhibidores del TNF, que se aproxima al 90%36. La diferencia probablemente no se deba al uso del índice de Genant en lugar del de van der Heijde, sino a que con abatacept la mejoría es más lenta.
Estos resultados se confirman en el estudio AGREE, en pacientes con AR sin tratamiento previo con MTX, en el que se demostró una reducción del 39% en la progresión del daño total y del 44% en el de erosiones34. Al año del estudio, un 61% de los pacientes en tratamiento con abatacept+MTX no había progresado radiológicamente frente a un 53% entre los pacientes que recibieron MTX en monoterapia, lo que representa una diferencia estimada del 8% entre grupos34. No hay datos de progresión radiológica en pacientes con fallo previo a un inhibidor del TNF ni se sabe si existe progresión radiológica significativa en pacientes sin respuesta clínica a abatacept.
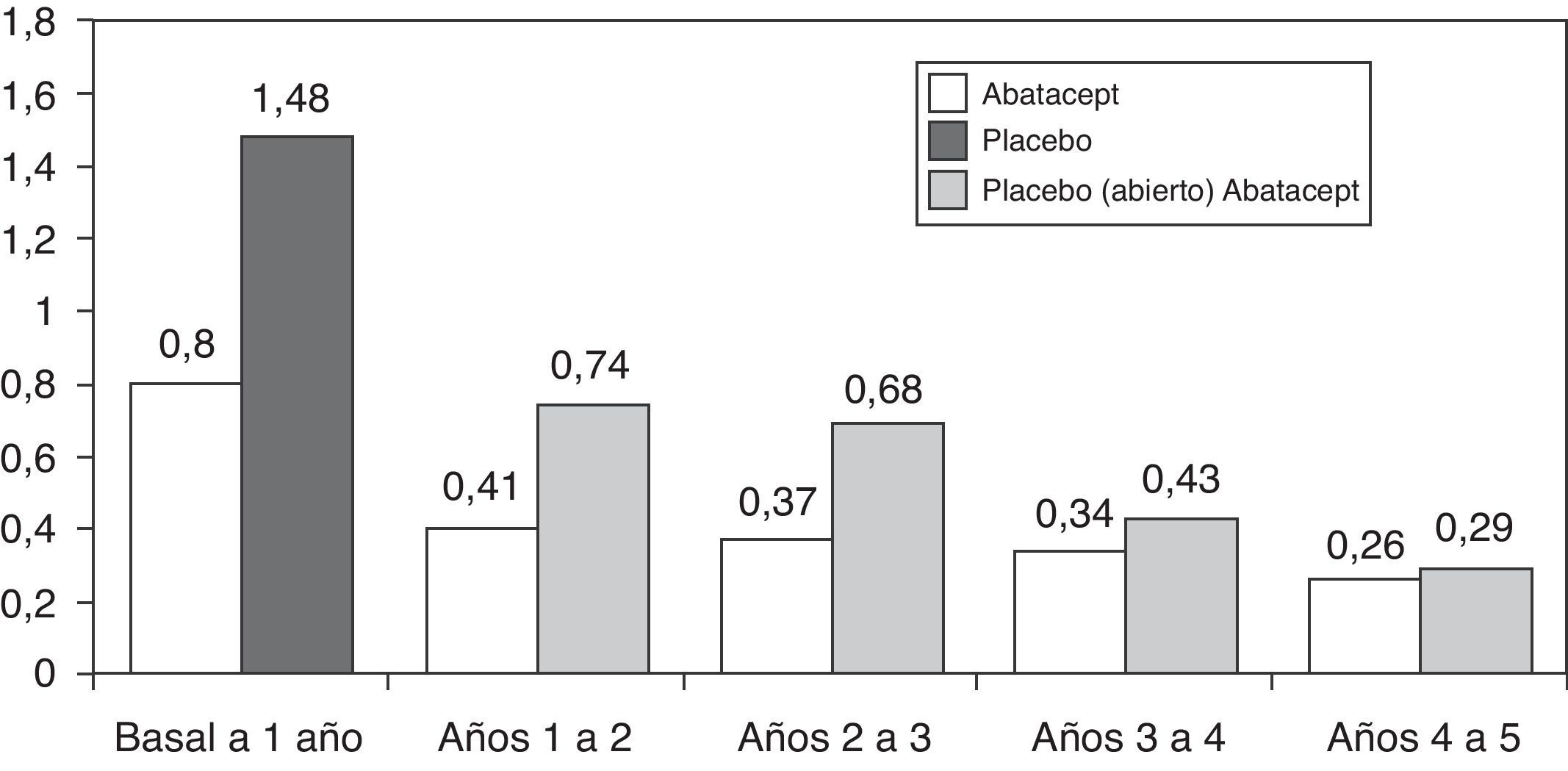
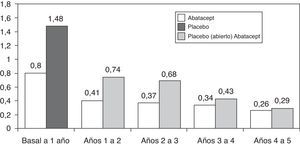
En cuanto a la progresión a largo plazo, de los 547 pacientes que completaron el estudio AIM, 539 (83%) fueron tratados con abatacept durante el periodo abierto. La progresión radiológica media se redujo significativamente en los 2 grupos de pacientes, pero más en los tratados inicialmente con abatacept: 1,07 y 0,46 frente a 2,40 y 0,75 en el 1.o y 2.o año respectivamente37. La tasa de progresión radiológica todavía se redujo más durante los 5 años de seguimiento en periodo abierto, sin embargo, hasta el 5.o año la tasa de progresión en el grupo inicialmente tratado con placebo no se igualó a los tratados inicialmente con abatacept (fig. 2)38. Los datos del estudio AGREE a 2 años confirman estos resultados. La progresión del daño estructural en el 2.o año fue un 57% menor que la del primer año en los pacientes tratados inicialmente con abatacept. A los 2 años en los pacientes que habían sido tratados con abatacept+MTX la progresión radiológica fue menor que en los que habían sido tratados solo con MTX (0,84 frente a 1,75 en la puntuación total; p<0,001)39. Recientemente se ha publicado un estudio de todos los pacientes juntos, sin distinción del tratamiento de inicio, en el que la progresión radiológica total se redujo significativamente en el 3.er año de tratamiento comparado con el 2.o año (p=0,022)40.
Cambio medio en la puntuación radiológica de Genant hasta los 5 años en el estudio AIM.
En el eje de ordenadas cambio absoluto en el índice de Genant respecto a los periodos de tiempo del estudio. En el primer año periodo ciego abatacept o placebo y a partir del primer año los pacientes en placebo pasan a tratamiento abierto con abatacept91.
Tanto los ensayos fase IIb y AIM40–43, como el ATTEST y el AGREE38,39 tienen estudios de extensión a largo plazo (tabla 4). Es importante entender que no se hace un análisis por intención de tratar si no que se analizan los resultados de los pacientes que completan el estudio.
En el fase IIb, de los 220 pacientes tratados con abatacept durante el periodo doble ciego, 152 entraron en la fase de extensión a largo plazo, en la que recibieron abatacept 10mg/kg cada 28 días41,42. De estos, 92 y 85 finalizaron el 5.° y 7.° año del estudio, con tasas de retención del 60 y 52% respectivamente. De los 73 pacientes que se retiraron, 19 lo hicieron por ineficacia, siendo este un motivo raro de retirada a partir del 2.o año del estudio de extensión, con tan solo 9 pacientes abandonando el estudio en los 6 últimos años. La respuesta obtenida en la fase doble ciego: baja actividad y función física medida mediante mHAQ, se mantuvo hasta los 7 años en aquellos pacientes que completaron el estudio39,41,42.
De los 385 pacientes tratados inicialmente con abatacept que finalizaron la fase doble ciego en el AIM, 378 entraron en la fase de extensión, recibiendo todos ellos abatacept 10mg/kg cada 28 días y finalizando 266 a los 5 años de seguimiento, lo que representa una tasa de retención del 70%43. El 20% de los 112 pacientes que se retiraron lo hicieron por pérdida de eficacia. Las respuestas obtenidas en el resto de pacientes se mantuvieron hasta el 5.o año. Una elevada proporción de pacientes que consiguieron remisión o actividad baja de la enfermedad al final del periodo doble ciego, la mantuvieron a lo largo del período de extensión44. Al final del estudio doble ciego, 116 pacientes (31%) habían normalizado el HAQ. De ellos, un 74% lo mantuvo normal a lo largo de la extensión del estudio44,45.
Tanto en el ATTEST38 como en el AGREE39 la tasa de retención a un año fue superior al 90%. Las respuestas ACR20, 50 y 70 y el HAQ confirmaron la eficacia mantenida a lo largo de los 2 años en ambos estudios. Tras la fase doble ciego de 6 meses del ensayo ATTAIN, 317 pacientes entraron en la fase de extensión46, de los cuales llegaron hasta el 5.o año 79 (25%) y 73 (23%). A lo largo del período de extensión, 165 pacientes salieron del estudio, 69 de ellos (22%) por falta de eficacia45,46.
Finalmente, en cuanto a la calidad de vida, tanto los estudios de extensión del AIM y del ATTAIN han demostrado mejoría sostenida en diversos aspectos de calidad del sueño mediante los cuestionarios MOS-Sleep y Sleep Problem Index, en las subescalas física y mental del SF36, una escala de fatiga, el número de días con actividad limitada y el «cuestionario de participación en actividades» (APaQ)47–49.
Evidencia/recomendación 7. Los datos de efectividad de abatacept en práctica clínica en los registros son consistentes con los de los ensayos clínicos. (NE: 2b; GR NA)Los datos de abatacept sobre efectividad en la práctica clínica derivada de registros han aparecido fundamentalmente en estos 3 últimos años, siendo la mayoría resúmenes de congresos (ver material suplementario). En general se puede decir que los datos se corresponden con lo ya conocido por los ensayos clínicos, aunque en estas comparaciones siempre hay que tener en cuenta los sesgos que implica el tratamiento en la práctica clínica, con pacientes muy diferentes a los que habitualmente constituyen las poblaciones de los ensayos clínicos.
Un estudio observacional retrospectivo analizó los resultados de la administración de abatacept en 100 pacientes de los cuales el 97% había recibido previamente algún inhibidor del TNF, mostrando que a los 6 meses el 80% seguía en tratamiento con abatacept y que el 44 y 34% habían alcanzado baja actividad y remisión, respectivamente50. El registro francés ORA51,52 comunicó los datos de efectividad en 133 pacientes tratados con abatacept, de los cuales solo el 9,5% no había recibido un biológico previo, mostrando que a los 6 meses el 66% había alcanzado una respuesta EULAR (buena o moderada). El registro danés DANBIO53 presentó los datos de 150 pacientes tratados con abatacept. Como en el registro anterior, solo una pequeña proporción, 5%, no había recibido inhibidores del TNF previos. El DAS28PCR en la basal y a las 24 y 48 semanas fue del 5,3; 3,4 y 3,3 respectivamente. El registro estadounidense CORRONA54 analizó pacientes tratados con abatacept y con inhibidores del TNF, que no habían recibido previamente otros biológicos. Una vez ajustadas las poblaciones, el análisis a los 2 años de tratamiento demostró que la probabilidad de suspender el tratamiento debido a una pérdida de efectividad era similar en los pacientes que recibieron abatacept o anti-TNF (HR 0,88; 95% IC 0,51-1,52). Tampoco hubo diferencias en la respuesta clínica evaluada por el paciente en lo que concernía a su situación global y dolor54. El seguimiento de pacientes tratados con abatacept en este mismo registro también ha demostrado una mejoría gradual en el cansancio y los trastornos del sueño y una tendencia a reducir la media de los días de trabajo perdidos55. Asimismo, un registro canadiense demostró que un porcentaje significativo de pacientes tratados con abatacept alcanzaron una mejoría clínicamente significativa en la capacidad funcional valorada por el HAQ (≥ 0,3); esto se produjo alrededor de los 2 meses de tratamiento y no influyó el numero de inhibidores del TNF previos que los pacientes habían recibido56. Finalmente, datos recientes del registro francés de pacientes tratados con abatacept, abogan por una respuesta superior en los pacientes que son FR/anti-CCP positivos57. No obstante, en un estudio anterior y con un análisis diferente, Buch et al.58 no habían encontrado diferencias entre ambas poblaciones.
Comparación de abatacept con otros biológicosNo hay estudios aleatorizados que permitan una comparación directa de abatacept con otros biológicos. Únicamente el estudio ATTEST31, en el cual abatacept e infliximab se comparan de forma individual con placebo, permite extraer algunos datos comparativos.
En la revisión sistemática que hemos realizado (disponible en material suplementario) incluimos y analizamos 7 estudios comparativos de eficacia o seguridad de abatacept con otros biológicos en AR. Entre estos estudios se encontraba el ATTEST, en el que la eficacia parece similar entre abatacept e infliximab (3mg/kg), con un perfil de seguridad favorable a abatacept31. Además incluyó revisiones sistemáticas con metaanálisis2,3,59,60 y una revisión de revisiones4. De estas revisiones se puede concluir que abatacept no parece muy distinto desde el punto de vista de eficacia a otros biológicos. En términos de seguridad, el metaanálisis de Singh de 20114, que además de abatacept incluye infliximab, adalimumab, etanercept, anakinra, rituximab y tocilizumab, realiza comparaciones indirectas en los casos en los que un modelo estadístico asegura poder comparar. El resultado obtenido es que tanto abatacept como anakinra se asocian significativamente con menos efectos adversos graves en comparación con los restantes; abatacept se asoció también con un número significativamente menor de infecciones graves frente a infliximab y tocilizumab.
En cuanto a las posibles comparaciones de coste-eficacia, tal como López-Olivo et al.61 ponen de manifiesto en un trabajo presentado en el congreso ACR de 2010, el 80% de los estudios financiados por la industria farmacéutica llega a la conclusión de que su intervención es rentable, en contraposición con el 54% de los estudios financiados por las agencias.
Seguridad y gestión del riesgo de abataceptEvidencia/Recomendación 8. Antes de administrar abatacept y durante la monitorización del mismo se deben seguir las recomendaciones generales propuestas para las terapias biológicas. (NE: 5; GR: D)Siguiendo las recomendaciones de la SER para la gestión de riesgos de terapias biológicas62, en todos los pacientes en los que se considere iniciar tratamiento con abatacept se debe realizar una historia clínica y exploración física detalladas en las que se incluyan datos de comorbilidades relevantes, procesos infecciosos de repetición, e infección activa (incluyendo TBC). De forma rutinaria, se debe realizar una analítica habitual además de serología de virus hepáticos, radiografía de tórax y Mantoux (+ booster) de acuerdo a las recomendaciones ya conocidas62). Antes de iniciar el tratamiento se debe valorar vacunar a los pacientes con la vacuna antigripal y antineumocócica, y otras vacunas de acuerdo a la situación de cada paciente. Se debe evitar la vacunación con gérmenes atenuados o vivos. En las pacientes en edad reproductiva se debe desaconsejar el embarazo mientras se administre abatacept. Durante el tratamiento con abatacept se debe vigilar la aparición de infecciones, cáncer, o el empeoramiento de la función respiratoria en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) (para una revisión detallada sobre EPOC, ver más adelante, en su recomendación correspondiente). En caso de cirugía mayor electiva, se debe suspender abatacept durante el periodo perioperatorio62. Las comorbilidades son muy frecuentes en pacientes con AR y pueden condicionar el tratamiento con fármacos biológicos, como abatacept.
Recomendación/Evidencia 9. El perfil de seguridad de ABA y su tolerabilidad son satisfactorios. (NE: 1b; GR: NA)En los ensayos clínicos de abatacept controlados con placebo (AIM30, ATTAIN32, ASSURE63 y ATTEST31) se notificaron reacciones adversas con abatacept en proporciones similares a pacientes tratados con placebo, entre el 55 y el 80%. Las reacciones adversas notificadas con mayor frecuencia (≥ 5%) fueron las cefaleas y náuseas5. El metaanálisis Cochrane de Maxwell y Singh muestra que los eventos adversos totales fueron significativamente mayores en el grupo con abatacept comparado con el grupo con placebo, pero el riesgo relativo fue bajo (RR 1,05; IC del 95%: 1,01 a 1,08)6.
Se han visto en ensayos clínicos unas tasas de reacciones relacionadas con la administración de alrededor de 7,7 (3,8 a 13,8) por 100 pacientes años, que es inferior a la de otros biológicos administrados por vía intravenosa5. Los acontecimientos agudos relacionados con la perfusión, con una frecuencia de 0,1 a 1% de los pacientes, incluían síntomas cardiopulmonares como hipotensión, aumento o descenso de la presión arterial, disnea, náuseas, rubor, urticaria, tos, hipersensibilidad, prurito, erupción cutánea y sibilancias. La mayoría de estas reacciones fueron de leves a moderadas5. En un ensayo clínico, 2 pacientes con abatacept interrumpieron el tratamiento debido a reacciones adversas graves que se produjeron en la primera hora de infusión30. En general, la proporción de pacientes que suspendieron el tratamiento fue ligeramente superior en los pacientes tratados con abatacept que con placebo (5 frente a 2,2%)30. En otro ensayo, en el que un número significativo de pacientes no fueron tratados de forma concomitante con MTX, las reacciones adversas relacionadas con la infusión en la primera hora de infusión fueron más frecuentes en el grupo de abatacept, aunque estas solo tuvieron intensidad leve a moderada32. Solo un paciente desarrolló anafilaxia de 2.688 pacientes tratados con abatacept durante 4.764 pacientes-año64.
Recomendación/Evidencia 10. En los ensayos clínicos las tasas de infecciones con abatacept son similares a las de los pacientes tratados con MTX y numéricamente inferiores a las de otros biológicos. (NE: 1b; GR: NA)En los ensayos clínicos de abatacept, las tasas de infecciones varían entre un 3,2 y un 89,4%, y las de las infecciones graves entre el 0,01 y el 7,8% (o 1,8 a 5 episodios por 100 pacientes-año)4. Estas cifras reflejan la heterogeneidad de las poblaciones incluidas en los estudios. En un metaanálisis de ensayos clínicos de biológicos, el riesgo de infecciones graves con abatacept era numéricamente inferior al del resto, y significativamente inferior en las comparaciones con infliximab, tocilizumab y certolizumab4. En general, parece que el riesgo de infecciones graves es menor con abatacept que con otros biológicos. Esta apreciación viene apoyada además por un trabajo que muestra que las tasas de incidencia de infecciones globales y neumonías que requirieron hospitalización, son similares en los pacientes de ensayos clínicos con abatacept que en las cohortes tratadas con FAME no biológicos65. En el metaanálisis de Singh et al., el odds ratio de infecciones graves con abatacept frente a placebo es de 0,57 (IC 95% 0,30 a 1,08)4. Como sucede con el resto de medicamentos biológicos, las neumonías son las infecciones graves más frecuentes en los pacientes con AR tratados con abatacept. Aparecen en unas tasas que varían entre 0,36 y 1,43 por 100 pacientes-año en relación al perfil del paciente (ver revisión en documento suplementario). En cualquier caso son mayores en los enfermos que han fracasado previamente al tratamiento con inhibidores del TNF, lo que probablemente refleja tasas en pacientes con una enfermedad más grave66–68. Las tasas de infecciones oportunistas por 100 pacientes-año se encuentran entre 0,01 y 0,36 y varían según la terapia previa al uso de abatacept.
Evidencia/Recomendación 11. La tasa de tuberculosis en pacientes tratados con abatacept parece inferior a la de los inhibidores del TNF (NE: 2b; GR: NA). No obstante, en los pacientes que van a ser tratados con abatacept se debe hacer una búsqueda de infección tuberculosa latente de acuerdo con las recomendaciones de la SER. (NE: 5; GR: D)En un estudio llevado a cabo en ratones a los cuales se les había provocado una infección por M tuberculosis, evocando un modelo de infección crónica tuberculosa, les fue administrado abatacept o un anticuerpo murino anti-TNF, siendo el objetivo primario del estudio la supervivencia. Mientras que todos los ratones tratados con abatacept sobrevivieron, todos los que recibieron anti-TNF fallecieron debido a una exacerbación de la tuberculosis69.
En todos los ensayos clínicos, con un total de 4.149 pacientes y una exposición de 12.132 pacientes por año, se encontraron 8 casos de tuberculosis, lo que refleja una tasa de incidencia de 0,07 [0,03–0,13] por 100 pacientes años69. Estos casos fueron: una infección con linfadenitis cervical por tuberculosis, 3 casos de tuberculosis pulmonar, un caso de enfermedad de Pott torácica, un caso de linfadenitis submandibular, 1 caso de tuberculosis latente, un caso de presunta tuberculosis con placebo y 1 caso de «sospecha» de tuberculosis. Esto representa una tasa inferior a la que aparece en los pacientes con AR tratados con inhibidores de TNF. No obstante, el número de pacientes tratados hasta el momento con abatacept y el momento en que se han tratado—después de la implantación de guías para la prevención de la reactivación de TBC— impide sacar conclusiones más contundentes.
Evidencia/Recomendación 12. Se desconoce la seguridad de abatacept en pacientes con hepatitis B o C (NE: 5; GR: NA). Su uso debe guiarse por un control estrecho de la función hepática y la carga viral. (NE: 5; GR: D)La seguridad del abatacept en pacientes con infección crónica por los virus de la hepatitis B y C no se ha estudiado en profundidad, ya que estos pacientes fueron excluidos de los ensayos clínicos, y no existen guías de consenso para su uso en estas situaciones. Existen tan solo algunas referencias a casos clínicos aislados en los que abatacept se ha utilizado en pacientes con infección no activa por el virus de la hepatitis B, en los que generalmente se asoció tratamiento profiláctico. También hay casos aislados de AR asociada a hepatitis C y tratada con abatacept, sin que se haya descrito un deterioro significativo de la función hepática70–72. Dada la falta de recomendaciones específicas para el tratamiento con abatacept en pacientes con infección crónica por los virus de la hepatitis B y C no se recomienda su uso a menos que no existan otras opciones disponibles y siempre con un control estrecho de la función hepática y la carga viral.
Evidencia/Recomendación 13. El riesgo de aparición de tumores en pacientes tratados con abatacept no es superior a lo esperado en pacientes con AR. (NE: 2b; GR: NA)En el desarrollo clínico de abatacept se excluyeron pacientes con antecedentes de cáncer en los 5 años previos y se realizaron mamografías para excluir cáncer de mama. Por otro lado es conocido que los pacientes con AR tienen un riesgo más elevado de padecer linfoma y cáncer de pulmón73. Simon et al.74 realizaron un análisis comparativo de todos los pacientes tratados con abatacept durante su desarrollo clínico (4.134 pacientes procedentes de 7 ensayos clínicos) frente a pacientes con AR procedentes de 5 cohortes (41.529 AR, con una mediana de seguimiento entre 1,8 y 9,3 años)74. En la población que fue tratada con abatacept, una vez excluidos los cánceres cutáneos diferentes del melanoma, se encontraron un total de 51 tumores: 7 cánceres de mama, 2 colorectales, 13 pulmonares y 5 linfomas, mientras que en la población control aparecieron 522 cánceres de mama, 275 colorectales, 470 de pulmón y 184 linfomas. Una vez hecho el ajuste correspondiente, se vio que el número de cánceres en los pacientes tratados con abatacept estaban dentro del rango esperado a lo que aconteció en las cohortes con AR. La tasa de incidencia de cáncer de pulmón con abatacept (0,15/100 personas-años) es similar a la de las distintas cohortes de AR (0,09-0,26); ocurre igual para el linfoma: 0,06/100 personas-año frente a 0,06-0,11. Por lo tanto, los datos no sugieren que el riesgo de estos tumores con abatacept sea distinto del esperado para una población con AR.
Evidencia/Recomendación 14. El uso de abatacept en pacientes con insuficiencia cardiaca grado iv debe hacerse con precaución. (NE: 5; GR: D)En los ensayos clínicos se excluyó a los pacientes con cardiopatía clase iv de la NYHA. En el resto de los pacientes sin cardiopatía o inferior a clase iv no existe evidencia de empeoramiento o aparición de insuficiencia cardiaca «de novo»5.
Evidencia/Recomendación 15. En pacientes con enfermedad pulmonar obstructiva crónica, abatacept debe administrarse solo tras un análisis riguroso del balance riesgo-beneficio. (NE: 1b; GR: A)En el estudio ASSURE63 los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) tratados con abatacept desarrollaron más reacciones adversas relacionadas con el aparato respiratorio que los tratados con placebo: 43 frente a 24%. Así mismo, los acontecimientos adversos graves de origen respiratorio fueron más frecuentes en los pacientes tratados con abatacept que en los que recibieron placebo: 10 frente a 0%. Entre las reacciones adversas destacaron: 2 EPOC reagudizadas, una bronquitis y una neumonía. Por tanto en estos pacientes en la práctica clínica debería indicarse abatacept solo después de un balance riguroso del riesgo/beneficio.
Evidencia/Recomendación 16. No se han descrito casos de aparición de enfermedad intersticial pulmonar en pacientes tratados con abatacept (NE: 4; GR: NA). Se desconoce su seguridad en casos de afectación preexistente. (NE: 5; GR: NA)Dos revisiones sistemáticas de la literatura dirigidas a evaluar la aparición de enfermedad intersticial pulmonar (EIP) tras la administración de distintos biológicos, no encontraron casos publicados con abatacept75,76. Por otro lado, se desconoce el efecto que abatacept tendría en pacientes con neumopatía intersticial previa. No obstante todo ello, y dada la experiencia previa con terapias biológicas, la administración de abatacept habría que hacerla con un seguimiento muy estrecho de los síntomas respiratorios y la función pulmonar del paciente.
Evidencia/Recomendación 17. En los pacientes que padecen enfermedades desmielinizantes no está contraindicado el uso de abatacept; en caso de utilizarse, se requiere un seguimiento neurológico estrecho. (NE: 2b; GR: D)Hasta el momento solo se ha comunicado un caso de enfermedad desmielinizante en AR77 y otro en artritis crónica juvenil78 en el conjunto de ensayos clínicos con abatacept, sin existir un claro aumento con respecto a las tasas esperadas de enfermedad desmielinizante. Además, el tratamiento con abatacept es seguro y pudiera ser eficaz en la esclerosis múltiple79. No obstante, tendremos que esperar a los resultados de farmacovigilancia a más largo plazo para precisar esta afirmación.
Evidencia/Recomendación 18. Abatacept administrado por vía intravenosa es un medicamento poco inmunogénico. (NE: 4; GR: NA)En 3.985 pacientes con AR tratados con abatacept durante periodos de hasta 8 años el 4,8% desarrolló anticuerpos contra abatacept durante el tratamiento5. En los pacientes en los que se evaluaron los anticuerpos después de interrumpir abatacept (> 42 días después de la última dosis) el 5,5% fueron positivos5. La presencia de anticuerpos no se asoció con reacciones adversas, incluidas las relacionadas con la administración, ni con cambios en la eficacia o concentraciones de abatacept en suero. Las tasas de ANA y anti-DNA en los ensayos clínicos no fueron diferentes de las del grupo tratado con placebo5.
En ensayos clínicos con abatacept se han descrito casos de psoriasis (tasa de 0,57 por 100 (IC95% 0,44–0,72), síndrome de Sjögren (tasa 0,19 (IC95% 0,12–0,29) y vasculitis (tasa 0,18 (IC95% 0,11–0,28)80. No se han descrito casos de LES inducido.
Evidencia/Recomendación 19. En pacientes tratados con abatacept la respuesta de anticuerpos a vacunas con gérmenes inactivados o componentes celulares es inferior a la de la población general; las vacunas con gérmenes vivos atenuados deben evitarse. (NE: 4; GR: C)La información sobre la eficacia y seguridad de diferentes vacunaciones con abatacept es limitada. No existen datos, debido a su riesgo potencial, sobre vacunaciones con gérmenes vivos atenuados como por ejemplo polio oral, triple vírica, varicela o fiebre amarilla. Sí existen algunos datos sobre vacunas con gérmenes inactivados o componentes celulares. En un ensayo a doble ciego en voluntarios sanos, se observó una respuesta a la vacunación con toxoide tetánico y neumococo algo inferior tras la administración de una dosis de abatacept que en controles81. En un subestudio del ensayo ARRIVE33 se evaluó la eficacia de la vacunación con 7 cepas de neumococo en 21 pacientes con AR. La respuesta fue positiva al menos a una cepa en el 81% de los casos, y en el 48% a 3 cepas o más82. El estudio ARRIVE también analizó la respuesta a la vacunación de la gripe (cepas H1N1, H3N2 e Influenza B) en 20 pacientes con AR; el 50% respondió al menos a 2 de estas 3 cepas83. Además, en un estudio observacional en Brasil, la tasa de seroconversión en un grupo de 11 pacientes con abatacept, comparada a la de 33 pacientes con AR tratados con MTX y 33 controles sanos, fue significativamente inferior84. Por todo ello, las vacunaciones con gérmenes vivos atenuados se consideran contraindicadas hasta 3 meses después de la suspensión del tratamiento con abatacept, o como mínimo, 2 semanas antes del inicio o la reintroducción del mismo5. Las vacunas con gérmenes inactivados o componentes celulares se pueden administrar en cualquier momento, si bien su eficacia puede estar algo disminuida. Por esta razón, en caso de que sea posible, también se recomienda su administración 3 meses después de la suspensión del mismo.
Evidencia/Recomendación 20. Abatacept se puede administrar sin realizar un periodo de lavado tras el uso de anti-TNF, pero no se debe administrar en combinación con otro agente biológico. (NE: 1b; GR: A)La administración secuencial de abatacept después del fracaso de un inhibidor del TNF no se asocia a un aumento de las tasas de acontecimientos adverso incluyendo las infecciones graves, tras 6 meses de administración del fármaco. Esto fue demostrado en el estudio ARRIVE, donde antes de administrar abatacept se realizó un periodo de lavado a antagonistas del TNF durante al menos 2 meses en 449 pacientes y no se hizo en 597, no encontrándose diferencias en las tasas de infecciones graves entre ambos grupos33. No obstante, siempre que se lleve a cabo la transición del tratamiento con un inhibidor del TNF a abatacept, los pacientes deben ser controlados estrechamente por si hubiera signos de infección.
Como es el caso con otros biológicos, el tratamiento combinado de abatacept y un inhibidor del TNF se asocia con un aumento importante de infecciones en general y de infecciones graves63,85 por lo cual está contraindicado este tipo de administración. No existe evidencia sobre la seguridad y eficacia de abatacept en combinación con anakinra o rituximab. En cuanto a la combinación con otros medicamentos, abatacept se puede combinar de forma segura con MTX, AINE, glucocorticoides, sulfasalazina, hidroxicloroquina o leflunomida, dado que en los análisis farmacocinéticos poblacionales no se detectó ningún efecto de los mismos sobre el aclaramiento de abatacept, ni se detectaron problemas de seguridad importantes con el uso de abatacept en combinación con FAME durante el desarrollo5. No es necesario ajustar la dosis cuando se utiliza en combinación con otros FAME, glucocorticoides, salicilatos, AINE o analgésicos.
Evidencia/Recomendación 21. Abatacept debería suspenderse al menos 3 meses antes del inicio de un embarazo. (NE: 5; GR: D)Abatacept cruza la barrera placentaria, si bien en estudios preclínicos no se observaron efectos indeseables embriofetales a dosis hasta 29 veces superiores a la dosis humana de 10mg/kg5. Los datos sobre mujeres que accidentalmente se quedaron embarazadas recibiendo tratamiento con abatacept son muy limitados. De 8 mujeres en los 5 estudios pivotales, 7 recibían MTX concomitante y otra leflunomida5. En 3 casos se produjeron abortos espontáneos en el primer trimestre (2 de ellas habían tenido abortos previamente) y en 2 se interrumpió el embarazo voluntariamente. En el estudio AGREE, 2 embarazos accidentales terminaron en aborto espontáneo e inducido34. Por lo tanto, el embarazo en mujeres tratadas con abatacept debe evitarse hasta 3 meses después de la suspensión del mismo.
Otros aspectos interesantes relacionados con Abatacept:
Perfil lipídicoEn un trabajo presentado como resumen a congreso se observó un aumento en el colesterol HDL medio a las 24 semanas de iniciar el tratamiento con abatacept en 17 pacientes: 1,7 a 2,1mmol/l (p=0,008) y una disminución en el índice aterogénico desde 3,0 a 2,7 (p=0,03), sin cambios en el colesterol total, triglicéridos o colesterol LDL86,87. El aumento de los lípidos sin aumento significativo del índice aterogénico parece un hecho común a infliximab, etanercept, adalimumab, abatacept, rituximab y tocilizumab88.
DiscusiónEl documento presenta 21 enunciados resumen de la evidencia encontrada o recomendaciones sobre abatacept (14 enunciados y 9 recomendaciones). El nivel de evidencia es superior a 2b según la escala de Oxford del Centro de Medicina Basada en la Evidencia en 14 ocasiones. No obstante, se consideró importante realizar recomendaciones precisamente en los aspectos con menor grado de evidencia, de ahí que a pesar de un nivel de evidencia bueno en los enunciados sin recomendación, el grado de apoyo de las recomendaciones es A en 2 recomendaciones, C en una y D en el resto. De muchos enunciados de evidencia no se extrajeron recomendaciones con objeto de que el clínico las utilice para su propia decisión; por ejemplo, el hecho de indicar que abatacept ha demostrado su eficacia en determinadas situaciones no significa que se recomiende abatacept de forma específica. Pensamos que para ciertas recomendaciones es importante tener en cuenta el arsenal terapéutico global, las características individuales del paciente y las indicaciones y secuencias terapéuticas aprobadas.
La evidencia 1 corresponde a la administración de abatacept en un corto periodo de tiempo (30 minutos) así como a la baja incidencia de reacciones infusionales. El nivel de evidencia es elevado (1b). La administración en este plazo de tiempo supone una gran ventaja debido a la sobrecarga asistencial que sufrimos y contribuiría a un uso más racional de los recursos hospitalarios de que disponemos. Además, el escaso número de reacciones infusionales supone una ventaja añadida22,23 que ha quedado detallada en la evidencia número 8. Conviene recordar además, que abatacept ha sido también desarrollado para ser utilizado por vía subcutánea25,26 y que su uso por esta vía está aprobado en EE. UU.
El desarrollo clínico de abatacept [evidencias 2 (NE: 1b) y 3 (NE: 2b)] se ha llevado a cabo mediante diversos estudios clínicos, entre los que cabe destacar el AIM30 en pacientes con respuesta insuficiente a MTX y el estudio ATTAIN32 en pacientes con fracaso previo a anti-TNF en el cual el brazo control era además de placebo, MTX u otros FAME. En ambos ensayos, abatacept se mostró significativamente superior en las variables de eficacia estudiadas con respecto al brazo control, lo cual corrobora la eficacia del fármaco. En el estudio ATTEST31, abatacept e infliximab (a la dosis fija de 3mg/kg) combinados con MTX fueron comparados con placebo (+ MTX). El objetivo de este estudio era valorar la magnitud de la respuesta de cada uno de los 2 agentes biológicos comparados con placebo (+ MTX). A los 6 meses el estudio demostró que ambos eran superiores al placebo con un tamaño de respuesta muy similar de los dos. El hecho de no poder aumentar la dosis de infliximab a 5mg/kg en aquellos pacientes no respondedores, práctica habitual en la clínica diaria, se podría considerar una de las limitaciones del estudio, pero el diseño del ensayo solo contempló administrar infliximab a la dosis aprobada, que contempla la ficha técnica; al año de tratamiento abatacept presentaba un perfil de seguridad global superior al infliximab31. Otro interesante estudio llevado a cabo en pacientes con AR precoz y factores de mal pronóstico34 demostró una tasa de remisión significativamente superior en los pacientes tratados con abatacept y MTX con respecto a los que fueron tratados únicamente con MTX [evidencia 4 (NE: 2b)]. Este estudio pone de relieve la utilidad teórica que tendría el uso de este agente biológico en fases tempranas de enfermedad. No obstante, es necesario recordar que abatacept no tiene indicación de tratamiento en estas fases de la enfermedad.
Abatacept combinado con MTX ha demostrado reducir significativamente el daño estructural a medio y largo plazo [evidencia 5 (NE: 2b)]30,38,39,41. La reducción global se estima alrededor del 48% al año de tratamiento y la disminución del daño aumenta progresivamente en los estudios a largo plazo38,39. Se ha especulado con que abatacept tuviera un impacto menor que los anti-TNF sobre el daño radiológico, ya que con estos se estima una reducción global del 90%36. Es muy posible que ese menor impacto en el daño estructural tenga escasa o nula traducción clínica, ya que la progresión radiológica en cualquiera de los casos es muy pequeña.
Los estudios de extensión después de varios años de tratamiento con abatacept han demostrado unas tasas de retención elevadas [evidencia 6 (NE: 2b)]. Así, en el estudio AIM a los 5 años de tratamiento, el 70% de los pacientes seguían recibiendo abatacept43. En otros estudios con periodos de extensión más cortos (un año) la tasa de retención ha llegado hasta el 90%38,39, mientras que en el estudio ATTAIN, en el cual, como criterio de inclusión los pacientes tenían que haber fracasado a los inhibidores del TNF y por tanto se trataba de pacientes graves y con mala respuesta terapéutica, la tasa de retención llegó al 25% al 5.o año de tratamiento46. No obstante, hay que ser cautos al interpretar las tasas de retención en los ensayos clínicos ya que existen muchos factores externos, entre ellos la accesibilidad a los agentes biológicos, que pueden influir tanto en un sentido como en otro.
La mayor parte de los datos sobre efectividad en la práctica clínica [evidencia 7 (NE: 2b)] proceden de registros que hasta la fecha solo han sido publicados en forma de resúmenes de congresos50,52–56. La lectura de los resultados confirma la eficacia del fármaco, especialmente en una población con AR grave, ya que en la mayoría de los casos abatacept fue utilizado en pacientes que habían fracasado a anti-TNF.
Por otro lado abatacept es un fármaco bien tolerado y que raras veces presenta reacciones infusionales, siendo en general leves (ver comentarios de la evidencia 1 y 8). Además en un metaanálisis publicado recientemente y que incluyó a todos los agentes biológicos comercializados con un total de 163 ensayos clínicos y 46 extensiones4, abatacept era el agente biológico, junto con anakinra, que presentaba el número menor de acontecimientos adversos graves, aunque sin significación estadística, comparado con su brazo control [Evidencia 9 (NE: 1b)]. El mismo metaanálisis también demostró que cuando el fármaco activo se comparó con su brazo control, abatacept fue el agente biológico que se asoció con el menor número de infecciones graves, significativamente menor cuando se compara con certolizumab pegol, infliximab y tocilizumab [Evidencia 10 (NE: 1b)].
Con respecto a la tuberculosis [evidencia 11 (NE: 2b)] hasta la fecha solo se han descrito 8 casos en las fases de extensión del programa de desarrollo clínico de abatacept80. Cuando se llevó a cabo la investigación clínica con abatacept ya se conocía la probabilidad de que la tuberculosis latente se reactivara tras administrar un anti-TNF. Ello hizo que en los estudios clínicos con este fármaco se hiciera un despistaje escrupuloso de la existencia de esta infección. Hasta qué punto estas medidas han podido determinar la disminución de tuberculosis no se conoce. No obstante, y como en todo paciente que va a ser tratado con agentes biológicos, la Sociedad Española de Reumatología recomienda que el despistaje para tuberculosis sea idéntico al que se hace cuando se va a administrar un antagonista del TNF, lo cual este panel apoya. [Segunda parte de evidencia 11 (NE: 5)].
No existen datos concluyentes sobre la seguridad del abatacept en pacientes con infección por virus B o C [evidencia 12 (NE: 5)] ni en los pacientes que presentan un grado de insuficiencia cardiaca avanzado [recomendación 14 (NE: 5)]. En estos casos el nivel de evidencia es 5 y tiene que ser el reumatólogo el que decida en base al riesgo/beneficio que representaría la administración de abatacept. Con respecto al incremento del riesgo de cáncer [evidencia 13 (NE: 2b)], abatacept, al igual que el resto de los agentes biológicos, no ha demostrado un incremento de nuevos tumores al recibir este agente biológico74; no obstante, no existen datos acerca de la seguridad de administrar abatacept en pacientes con antecedentes de un tumor.
Los pacientes con EPOC tratados con abatacept tienen mayor riesgo de infecciones del tracto respiratorio inferior que los pacientes tratados con placebo [evidencia 15 (NE: 1b)]63,89, por ello, en todos los pacientes con esta patología hay que valorar detenidamente el riesgo/beneficio que supone administrar abatacept.
Uno de los problemas al que se enfrenta el clínico cuando tiene que administrar un agente biológico es el riesgo de agravamiento de una EIP previa o, incluso, el riesgo que dicho fármaco podría tener como agente inductor de dicha patología [evidencia 16 (NE: 4 y 5)]. Hasta la fecha se ha descrito EIP con los anti-TNF, tocilizumab e incluso con rituximab75,76,90. Sin embargo, ni nosotros ni otros autores que han llevado a cabo una extensa revisión de la literatura han encontrado casos similares con abatacept75,76. Por esto mismo, abatacept podría ser un candidato como alternativa terapéutica en aquellos pacientes con EIP previa. No obstante, cualquier paciente en esta situación debe ser objeto de una monitorización estrecha de la función pulmonar.
Abatacept no está formalmente contraindicado en los pacientes con enfermedad desmielinizante [evidencia 17 (NE: 2b)] y de hecho se han llevado a cabo ensayos clínicos en fases muy iniciales en pacientes con esclerosis múltiple79. Asimismo, abatacept administrado por vía intravenosa es poco inmunógeno [evidencia 18 (NE: 4)] ya que tras 8 años de tratamiento los anticuerpos solo habían aparecido en un 4,8%5. Tampoco se ha detectado mayor incidencia de ANA o anti-DNA que en la población control5.
Uno de los problemas más habituales en la práctica diaria es todo lo concerniente a la vacunación de los pacientes que van a recibir un biológico [evidencia 19 (NE: 4)]. Con abatacept, como con el resto de terapias biológicas, no existen estudios con vacunas con virus vivos atenuados. Por otro lado, distintos estudios han demostrado una respuesta ligeramente disminuida con el toxoide tetánico, con el neumococo y con la vacuna de la gripe81–83. Por todo ello, al margen de estar contraindicada la vacunación con gérmenes vivos atenuados, la vacunación con neumococo debe realizarse preferiblemente, antes de la administración del abatacept. Con respecto a la vacuna de la gripe, al tratarse de una administración estacional hay que hacerla cuando corresponda, asumiendo que su eficacia puede ser menor.
Otra situación clínica muy frecuente es el paciente que precisa un cambio de terapia biológica. En el caso de que la situación que se plantee sea la de sustituir un anti-TNF por abatacept [evidencia 20 (NE: 1b)], el estudio ARRIVE33 demostró que se puede administrar abatacept de forma segura sin necesidad de período de lavado en los pacientes a los que se les ha suspendido un anti-TNF.
Finalmente en lo que concierne al embarazo [evidencia 21 (NE: 5)] únicamente se hace una recomendación basada en la prudencia y el sentido común. La evidencia sobre este aspecto, como era de esperar, es nula. Solo existen descritos algunos casos clínicos en los que el embarazo ocurrió de forma accidental y que no aportan ninguna luz sobre el posible efecto teratógeno del abatacept.
Este panel de expertos ha intentado realizar un documento práctico con un resumen comentado de las pruebas existentes con abatacept al que se han añadido recomendaciones en aspectos que aún tras revisión exhaustiva no existe un respaldo concluyente de la evidencia. Pensamos que puede ser un buen complemento a la información disponible en ficha técnica para guiar a los reumatólogos en el uso de abatacept.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste documento se ha financiado a través de una donación sin restricciones realizada al Servicio de Reumatología del Hospital Universitario La Paz (AREPAZ) por Bristol Myers Squibb (España). La elección de los expertos fue responsabilidad exclusiva del coordinador del proyecto (EMM). Ningún empleado de la compañía participó en las reuniones científicas ni conoció su desarrollo hasta que el proyecto estuvo finalizado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.