Las diferentes técnicas de imagen son empleadas en el diagnóstico, evaluación y seguimiento de las miopatías inflamatorias (MI); de ellas, las que mayor información proporcionan son el ultrasonido y las imágenes por resonancia magnética.
El electrodiagnóstico en las MI se basa principalmente en la electromiografía (EMG), que presenta diferentes patrones sobre la base del tiempo de evolución de la enfermedad. En la fase aguda se documentan potenciales polifásicos con duración y amplitud disminuidas, mientras que en la fase crónica se encuentran patrones mixtos neuropáticos y miopáticos. Posterior al tratamiento con esteroides tiende a normalizarse la EMG.
Different imaging techniques are used for the diagnosis, evaluation and follow-up of inflammatory myopathies; of these techniques, the ones that provide the largest amount of information are ultrasonography and magnetic resonance imaging.
Electrodiagnosis in inflammatory myopathies is based mainly on electromyography (EMG), which shows different patterns according to the different disease presentations. In the acute phase, polyphasic potentials with diminished amplitude and duration are seen, whereas in its chronic phases, mixed neuropathic and myopathic patterns are found. After corticosteroid treatment, EMG tends to return to normal.
En el caso de las enfermedades musculares, una variedad de técnicas de imagen pueden ser empleadas en su evaluación; éstas abarcan desde la radiología convencional (Rx) hasta las imágenes por resonancia magnética (RM) y la espectroscopia por resonancia magnética (ERM). Sin embargo, se tiene la creencia de que éstas no juegan un papel primordial en el diagnóstico o evaluación de las miopatías inflamatorias (MI). Sin embargo, en la actualidad las técnicas de imagen pueden contribuir sustancialmente a la evaluación y manejo de pacientes con MI.
El objetivo de este artículo es revisar de manera resumida el papel de las técnicas de imagen en el diagnóstico y evaluación de las manifestaciones musculoesqueléticas de los pacientes con MI.
Radiología convencionalLas anormalidades radiográficas de las MI pueden ser divididas en alteraciones de los tejidos blandos y alteraciones de las articulaciones.
Tejidos blandosLa manifestación inicial es el edema de los tejidos subcutáneos y de los músculos, lo que produce un incremento en el volumen de las masas musculares, aumento en su radiodensidad y una pobre definición de las interfases de tejidos blandos. Los músculos de la cintura escapular y pélvica son los más frecuentemente afectados y su involucro es habitualmente simétrico. En estadios avanzados, la atrofia muscular y las contracturas se hacen aparentes.
La alteración más característica de las MI son las calcificaciones de los tejidos blandos, y su incidencia es mayor en las formas infantiles1; la extensión de éstas se incrementa con la gravedad del padecimiento. El patrón más frecuente es de grandes o pequeñas placas, láminas intermusculares o nódulos en las extremidades. Otros patrones incluyen conglomerados de calcificaciones en los músculos, tejidos periarticulares y placas difusas en los músculos y tejido celular subcutáneo.
Los sitios más comúnmente afectados son los grandes músculos proximales de las cinturas escapular y pélvica. Ocasionalmente se presentan calcificaciones del tejido celular subcutáneo y tendones. La apariencia y distribución de las calcificaciones no permite distinción entre la dermatomiositis (DM) y la polimiositis (PM).
Anormalidades articularesLas manifestaciones clínicas articulares rara vez se acompañan de anormalidades radiográficas, o bien están asociadas con cambios transitorios, como edema de los tejidos blandos, osteopenia yuxtaarticular. Las manifestaciones morfoestructurales de naturaleza destructiva están presentes en forma por demás ocasional.
UltrasonidoEl ultrasonido (US) es una técnica de imagen de utilidad en la evaluación de las MI2. Un detallado análisis del valor del US3 mostró que en 70 pacientes con PM confirmada histopatológicamente, incluyendo 30 con DM, 13 pacientes con miositis por cuerpos de inclusión (MCI) y 102 controles, la sensibilidad del US para detectar los casos corroborados histológicamente fue del 83%, cifra similar a la de la electromiografía (EMG) (92%) y a la de la actividad de la creatincinasa (69%). Las diferentes MI presentaron alteraciones sugestivas pero no patognomónicas. La PM mostró hipotrofia y aumento de la ecogenicidad, predominantemente en los músculos de las extremidades inferiores. En la DM, la atrofia muscular fue rara y la ecointensidad fue mayor en los músculos del antebrazo. Una grave atrofia muscular fue el hallazgo más importante en los pacientes con MCI. El infiltrado graso muscular tuvo un mayor impacto en la ecogenicidad que la fibrosis. Los autores sugieren que el US mejora el abordaje clínico de los pacientes con MI, ya que aporta claves para efectuar diagnóstico diferencial, basadas en el tamaño de la masa muscular y la identificación de anormalidades mesenquimatosas, principalmente la infiltración de tejido graso.
Una revisión de las técnicas de imagen diagnóstica en MI4 destaca las ventajas del US, como son su disponibilidad, su alta resolución espacial, su capacidad de evaluar estructuras en movimiento, en tiempo real y la ausencia de radiación ionizante. Un estudio5 concluyó que el 45% de los diagnósticos musculoesqueléticos primarios pueden ser realizados con US y que esta herramienta de diagnóstico puede sustituir a la RM en casos apropiados, representando así un ahorro sustancial en gastos.
Los ecorrealzadores pueden ser empleados para incrementar la especificidad diagnóstica, para evaluar la actividad de la miositis y la respuesta a tratamiento6. Adicionalmente, el US es de utilidad en la detección de calcificaciones subcutáneas7. Se ha sugerido como una herramienta de utilidad para seleccionar el sitio y guiar la toma de biopsia8.
Resonancia magnética en miopatías inflamatoriasA pesar de que la biopsia muscular es esencial para el diagnóstico definitivo de las MI, la RM se ha convertido en la técnica de imagen de elección para la evaluación de las anormalidades musculares, ya que provee imágenes de alta resolución tanto para el diagnóstico como para el seguimiento y vigilancia del tratamiento9. Es altamente sensible para detectar inflamación en los tejidos blandos, especialmente con la incorporación de las técnicas con supresión de grasa10. Sus ventajas incluyen: 1) no provoca dolor como la biopsia muscular y la EMG, al ser no invasiva; 2) permite la evaluación longitudinal de diversos esquemas terapéuticos; 3) localiza áreas de tejido afectado, al evaluar amplios segmentos musculares, a diferencia de la biopsia muscular que evalúa tan sólo una porción limitada de tejido; 4) ofrece una guía para la localización del sitio ideal de toma de biopsia, y 5) es una técnica menos dependiente del operador, en comparación con la US11.
La anormalidad fundamental de las MI consiste en la presencia de alteración de la intensidad de la señal debida a un incremento en el agua libre intracelular o extracelular asociada al proceso inflamatorio o bien a infiltración grasa subyacentes.
Las alteraciones básicas en la intensidad de la señal comprenden tres patrones reconocibles: edema muscular, infiltración grasa o atrofia muscular. En la tabla 1 se presenta con detalle cada patrón. En los estadios iniciales se presenta edema muscular, localizado o difuso, con distribución bilateral, simétrica y localización preferente en la cintura pélvica, especialmente en el vasto lateral e intermedio. La intensidad del edema muscular presente en los estudios de RM se correlaciona con la gravedad del padecimiento12.
Anormalidades en resonancia magnética de las miopatías inflamatorias
| Etapa de presentación | Hallazgo RM | Traducción clínica | Otras causas | |
| Edema | Temprana | Anormalidad. Intensidad señal en T2.Focal o difuso | Actividad miopatía inflamatoria |
|
| Infiltración grasa30 | Tardía. Generalmente acompañada de atrofia | Aumento intensidad señal T1 y T2 | Etapas tardías | Estadios crónicos de:
|
| Atrofia muscular | Tardía | Pseudohipertrofia por infiltración grasa: asimetría de grupos musculares. Incremento en intensidad señal T1 | Etapas tardías | Todas las anteriores |
RM: resonancia magnética.
- A)
Uso de gadolinio: es un compuesto paramagnético que incrementa la intensidad de la señal en imágenes en T1 con técnica de supresión de grasa. Al administrarlo por vía intravenosa detecta áreas de inflamación en los diferentes grupos musculares12.
- B)
ERM: es una técnica que provee información acerca de los cambios bioquímicos que ocurren en el músculo. En las MI se utilizan moléculas de fósforo, ya que existen niveles disminuidos de fosfocreatina (FC) y ATP en reposo; esto se acentúa después del ejercicio13. La relación entre fosfato inorgánico (Pi) y FC es un indicador del estatus bioquímico y potencial energético del músculo en reposo y en ejercicio; una relación de Pi/FC aumentada sugiere miopatía14. En MI se utiliza ERM con P-3115.
- C)
RM de cuerpo entero: esta técnica permite rastrear diferentes grupos musculares e identificar aquéllos con proceso inflamatorio activo, susceptibles de ser biopsiados. Un estudio ha sugerido que el patrón y la extensión de la afección muscular de la DM difiere de la PM o de la miositis por cuerpos de inclusión, permitiendo así su diagnóstico diferencial16.
La tomografía axial computarizada (TAC) es un método de imagen que no ha sido de gran utilidad para evaluar la inflamación a nivel muscular; sin embargo, esta técnica de imagen ha sido usada ampliamente para evaluar una complicación de la DM/PM, como es la enfermedad intersticial pulmonar (EIP); diversos estudios han estimado una prevalencia superior al 30% de esta manifestación extramuscular de la DM/PM17,18. La TAC de alta resolución (TAC-AR) es utilizada actualmente como método diagnóstico no invasivo en pacientes con DM/PM que cursan con EIP. Otros usos de la TAC-AR en pacientes con DM/PM son: 1) seguimiento del tratamiento con inmunosupresores en pacientes con EIP19,20, y 2) detección de calcificaciones cutáneas21,22.
Estudios electrofisiológicos en las miopatías inflamatoriasUsualmente el electrodiagnóstico en las MI está basado en las anormalidades específicas encontradas en el estudio de EMG.
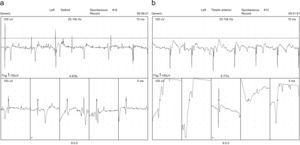
La EMG es una importante herramienta para el diagnóstico de este tipo de enfermedades e incluye cuatro fases: 1) actividad de inserción; 2) actividad espontánea; 3) contracción voluntaria mínima, y 4) contracción voluntaria máxima; aquí es donde se observan la morfología de los potenciales de acción de unidad motora (PAUM) y el reclutamiento. Las dos primeras son valoradas en el músculo en reposo. Debido al daño muscular, la actividad de inserción puede estar aumentada principalmente en la fase aguda; posteriormente, se puede encontrar normal o disminuida. La actividad espontánea es anormal donde se observan potenciales de inestabilidad de membrana o denervación (fibrilaciones, ondas positivas, descargas miotónicas, complejos de descargas repetitivas, etc.) (fig. 1). La PM y la MCI frecuentemente crean patrones complejos23,24.
En la mayoría de las miopatías hay una pérdida o disfunción individual de las fibras musculares, y como consecuencia disminuye el tamaño de las unidades motoras. El número de unidades motoras (células del asta anterior y axones) no cambia; sin embargo, en casos graves, cada fibra muscular de la unidad motora es afectada y como resultado disminuye el número efectivo de unidades motoras. Los hallazgos en las MI cambian dramáticamente con el curso de la enfermedad.
Los potenciales llegan a ser polifásicos con duración y amplitud disminuida. Estos cambios son producidos por la pérdida de fibras musculares individuales y un disparo menos sincronizado de las fibras remanentes. El reclutamiento de los potenciales usualmente es normal porque el número de unidades motoras remanente está intacto; sin embargo, cada unidad motora que contiene algunas fibras normales puede generar menor fuerza, y para compensar más unidades normales pueden disparar, lo que da origen a un patrón de reclutamiento temprano. Dependiendo de la evolución en la contracción voluntaria se puede encontrar una combinación de potenciales polifásicos con duración y amplitud disminuidas, así como con larga duración y amplitud aumentada.
Existen métodos cuantitativos que pueden ser utilizados para evaluar la duración, amplitud, giros, potenciales polifásicos y el reclutamiento, en donde la duración es el parámetro más importante25–27.
Miopatías en fase agudaEn las miopatías, el número de fibras musculares funcionando disminuye porque hay pocas fibras musculares por unidad motora; como resultado, se originan PAUM con disminución en la amplitud y duración, dando como resultado potenciales polifásicos con duración y amplitud disminuidas, con reclutamiento temprano o normal24 (tabla 2).
Anormalidades electrofisiológicas en las miopatías inflamatorias
| Neuroconducción | Electromiografía | |||||
| Motora | Sensitiva | Inserción | Actividad espontánea | Contracción. Morfología PAUM | Reclutamiento | |
| Agudas | Amplitud normal o disminuida | Amplitud normal | Aumentada | Potenciales de fibrilación, ondas positivas o mioquimia | Potenciales polifásicos. Amplitud y duración disminuida | Normal o temprano |
| Crónicas | Amplitud normal o disminuida | Amplitud normal | Aumentada o normal | Potenciales de fibrilación, ondas positivas o complejos de descargas repetitivas o normal | Potenciales polifásicos. Amplitud y duración disminuidas y/o polifásicos con duración y amplitud incrementadas | Normal, temprano o levemente disminuido |
PAUM: potenciales de acción de unidad motora.
En las miopatías crónicas, especialmente cuando hay características inflamatorias o necróticas (PM, distrofias), ocurre denervación y subsecuentemente reinervación; consecuentemente, se observan potenciales polifásicos con duración y amplitud aumentadas y potenciales satélites (por la misma regeneración), aunque estos potenciales por lo general son vistos en las neuropatías crónicas. En las miopatías crónicas, dos tipos de potenciales pueden ser observados: potenciales polifásicos con duración y amplitud aumentadas, combinado con potenciales polifásicos con duración y amplitud disminuidas, en el mismo músculo. Es muy raro que se vean sólo potenciales de duración y amplitud aumentadas. Esto es la clave en la diferenciación entre miopatías crónicas y neuropatías crónicas. En las miopatías, el reclutamiento es usualmente temprano o normal23,24.
En las etapas finales se presentan patrones mixtos: con disminución del reclutamiento con polifásicos de duración y amplitud disminuidas solos o en combinación con potenciales polifásicos con duración y amplitud aumentadas.
Tratamiento con esteroidesCuando se da tratamiento con esteroides la irritabilidad de la membrana en la fase de reposo disminuye, continúan los datos de denervación, pero el proceso de reinervación inicia y posteriormente pueden desaparecer y aparecen potenciales de corta duración. Hay un incremento en el reclutamiento porque las fibras musculares tienen más fuerza de contracción y los patrones miopáticos pueden desaparecer. La EMG se puede usar en el seguimiento de un tratamiento28,29. Los registros con fibra única muestran incremento de densidad de la fibra28.