Presentamos la actualización de las Guías de Práctica Clínica (GPC) para el tratamiento del lupus eritematoso sistémico (LES) del Colegio Mexicano de Reumatología elaboradas por un grupo de expertos en la enfermedad tanto a nivel privado como gubernamental, de acuerdo con la metodología Grading of Recommendations Assessment, Development and Evaluation (GRADE).
Se incluyen por primera vez aspectos sobre vacunación, embarazo y riesgo cardiovascular.
Herein we present the update for the Mexican Guidelines for the Treatment of Systemic Lupus Erythematosus. It involves the participation of several experts along the country, following the GRADE system.
We included aspects regarding vaccines, pregnancy and cardiovascular risk which were not presented in the previous guidelines in 2017.
En 2017, el Colegio Mexicano de Reumatología publicó las primeras Guías de Práctica Clínica (GPC) para el tratamiento de pacientes mexicanos con lupus eritematoso sistémico (LES), con el compromiso de actualizarlas periódicamente1.
Las GPC son un instrumento de enorme utilidad para orientar a los médicos sobre el tratamiento de una enfermedad específica y requieren de una metodología estricta en su desarrollo e implementación. Las guías terapéuticas requieren actualización cuando surgen nuevos fármacos con la suficiente evidencia que respalde su empleo o cuando se modifiquen las indicaciones de fármacos que ya son utilizados.
El LES es una enfermedad autoinmune prototípica, tanto por su complejidad como por su heterogeneidad. Actualmente, la estrategia terapéutica va dirigida a alcanzar objetivos específicos y a limitar, en lo posible, el daño acumulado, sobre todo cuando este sea secundario a medicamentos empleados en el tratamiento de la enfermedad. Dado las características de los pacientes con LES, las recomendaciones deben incluir el manejo del paciente en general, el tratamiento específico de las manifestaciones en órganos blanco y la vigilancia de las comorbilidades derivadas tanto del tratamiento como de la enfermedad. Igualmente, es importante considerar los factores genéticos y étnicos (como la mayor gravedad observada en mestizos), así como el acceso tanto a sistemas de salud como a terapias adecuadas.
En el presente trabajo se incluyen temas que no fueron abarcados en las guías previas, tales como el tratamiento por objetivos, el riesgo cardiovascular y el tratamiento durante el embarazo y la lactancia. Además, se actualizan todas las recomendaciones para grupos de medicamentos y manifestaciones específicas por órganos y sistemas.
MetodologíaPara realizar esta actualización se constituyó un grupo de trabajo formado por 40 médicos reumatólogos, todos certificados y miembros activos del Colegio Mexicano de Reumatología, con experiencia en el tratamiento de pacientes con LES y con actividad profesional en diferentes instituciones y regiones del país, tanto de práctica privada como gubernamental. Se contó además con el apoyo de dos médicos expertos en metodología para la elaboración de GPC.
El panel de expertos se reunió por primera vez por vía remota en septiembre de 2023. En esta reunión se definió la metodología a aplicar y el contenido de las guías se distribuyó en cuatro secciones: 1. Consideraciones generales, 2. Fármacos, 3. Tratamiento por órganos y sistemas y 4. Situaciones especiales. Se formaron equipos específicos de trabajo para cada uno de los subtemas y en conjunto se revisaron y actualizaron las preguntas de investigación con el formato PICO (paciente, intervención, comparación, resultados [outcomes]), elaborando aquellas que correspondían a temas no incluidos en las recomendaciones previas2.
Se realizó una revisión sistemática de la literatura considerando la información publicada a partir de 2017. Para esta actualización se tomaron en cuenta todos los artículos de PubMed, Registro Cochrane Central de Ensayos Controlados (CENTRAL), Google Scholar y SCIELO publicados entre enero de 2017 y diciembre de 2023 (esto teniendo en cuenta que las guías previas habían incluido publicaciones hasta diciembre de 2016). Para las preguntas elaboradas denovo se consideraron los artículos publicados a partir de enero 2010.
Se incluyeron todos los diseños de estudio, priorizándose los metaanálisis, los ensayos clínicos, los estudios de cohortes, los casos y controles y los estudios transversales. Sin embargo, en aquellas preguntas de investigación con datos muy limitados o en las cuales no hubo trabajos de suficiente calidad se tomaron en cuenta reportes de caso, revisiones narrativas o consensos.
Cada equipo recibió los mecanismos de búsqueda PICO de los responsables de la metodología, los cuales estaban adaptados al tema asignado. Posteriormente se realizó la revisión de los artículos y, con base en aquellos relacionados y las referencias consultadas, se completó la búsqueda. Los artículos seleccionados fueron aquellos que dieron respuesta clara a las preguntas de investigación planteadas. Los hallazgos obtenidos de los estudios elegibles se sintetizaron en cuadros de evidencia, utilizando el enfoque GRADE (Grading of Recommendations Assessment, Development and Evaluation)2. A partir de los cuadros de evidencia se realizaron ajustes a las recomendaciones previas o se elaboraron nuevas, estableciendo la calificación del grado de evidencia y de la fuerza de cada recomendación según el sistema GRADE.
Todas las recomendaciones iniciales se enviaron al equipo para su revisión y sugerencias, quienes dieron su retroalimentación. Los desacuerdos se resolvieron por medio del diálogo entre los miembros del equipo.
En enero de 2024 se realizó una reunión híbrida con todo el equipo de investigadores para revisar cada una de las recomendaciones emitidas, deliberar y establecer el grado de consenso, obteniendo así la versión final. Las recomendaciones se aceptaron con más del 80% de acuerdo; en los casos en los que no se logró esta cifra, se analizaron y modificaron según fuera necesario, repitiendo la votación para lograr el consenso o establecer que no se había logrado el mismo.
RecomendacionesEsta actualización de las recomendaciones para el tratamiento del LES se ha estructurado de la siguiente manera:
- 1.
Principios generales de manejo de la enfermedad.
Recomendaciones:
- 2.
Sobre las indicaciones y vigilancia de los principales grupos de fármacos empleados en el LES.
- 3.
Para el tratamiento específico de la enfermedad en los diferentes órganos y sistemas.
- 4.
Para situaciones especiales que son importantes por el impacto que tienen en el LES, como el periodo perioperatorio, vacunación, embarazo y riesgo cardiovascular.
Los principios generales de tratamiento en el LES engloban el concepto del manejo integral de una enfermedad muy compleja. Resaltan el papel del reumatólogo como líder del equipo de atención multidisciplinaria y la importancia de la evaluación periódica del paciente. Enfatizan la necesidad de un objetivo final del tratamiento (remisión o actividad baja de la enfermedad) y la prevención de recaídas, como medios principales para reducir la progresión y daño a largo plazo. Consideran la importancia de las medidas no farmacológicas, así como la selección de medicamentos en función de su mayor eficacia, seguridad, y disponibilidad. Asimismo, destacan que el paciente debe siempre participar en las decisiones terapéuticas3–6(tabla 1 y 2).
Principios generales
| A | El tratamiento óptimo de los pacientes con LES requiere de intervenciones farmacológicas y no farmacológicas a cargo de un equipo multidisciplinario coordinado por el especialista en reumatólogía3. |
| B | El tratamiento debe basarse en la toma de decisiones compartida entre el paciente y el médico. Esto facilita la adherencia, lo que a su vez mejorará el control de la enfermedad3,4,7,8. |
| C | El diagnóstico temprano y el tratamiento oportuno mejoran el pronóstico del paciente. Debe determinarse la actividad de la enfermedad en cada evaluación clínica y el daño asociado a la enfermedad, por lo menos una vez al año, empleando para ello instrumentos validados9–11. |
| D | El propósito del tratamiento es controlar la actividad de la enfermedad, limitar el daño y mejorar la calidad de vida de los pacientes10,12. El objetivo terapéutico ideal es lograr la remisión de la enfermedad y si esta no es posible, al menos un estado de baja actividad de la enfermedad (tabla 2)13,14. |
| E | El tratamiento del LES debe ser personaliado y considerar la afectación orgánica específica y su gravedad. Es necesario, además, considerar la eficacia, seguridad y disponibilidad del tratamiento, las comorbilidades del paciente, así como el impacto social, económico y familiar de la enfermedad3,7,8. |
| F | El tratamiento no farmacológico debe incluir fotoprotección, dieta equilibrada, suspensión del tabaquismo, ejercicio regular, apoyo psicológico, cálculo del riesgo cardiovascular, orientación en planificación familiar y control prenatal15–18. |
LES: lupus eritematoso sistémico.
Definiciones de remisión y actividad baja
| Dominio | Remisión DORIS | LLDAS |
|---|---|---|
| SLEDAI-2K | SLEDAI clínico=0(permite actividad serológica) | SLEDAI ≤ 4*- no actividad en órgano mayor- no anemia hemolítica ni actividad gastrointestinal- no nuevas manifestaciones de actividad, comparado con la evaluación previa |
| PGA (0-3) | <0,5 | ≤1 |
| Dosis de PDN (o equivalente) | ≤5 mg/día | ≤7,5 mg/día |
| Otras terapias | Dosis estable de antimaláricos, inmunosupresores o biológicos | |
DORIS 2021: Definition of Remission In SLE; LLDAS: Lupus Low Disease Activity State; PDN: prednisona; PGA: Physician Global Assessment; SLEDAI-2K: Systemic Lupus Erythematosus Disease Activity Index 2000.
El tratamiento del LES incluye una combinación, a menudo secuencial, de fármacos antimaláricos, glucocorticoides (GC), antinflamatorios no esteroideos (AINE), fármacos modificadores de la enfermedad, inmunosupresores y terapia biológica. La elección de los medicamentos, así como la dosis y duración de la administración, deben individualizarse en función del tipo y gravedad de las manifestaciones clínicas, la actividad de la enfermedad, de los órganos y sistemas afectados, así como de las comorbilidades asociadas.
Los antimaláricos se consideran como uno de los pilares en el tratamiento del LES; tienen efectos fotoprotectores, hipolipemiantes, antiangiogénicos, antitrombóticos, hipoglucemiantes y, además, a través de su interacción con los receptores tipo Toll (TLR), inhiben la función del factor activador de células B (BAFF) y de la fosfolipasa A2 (PLA2). Este efecto pleiotrópico los hace fármacos de elección para el tratamiento de manifestaciones cutáneas, LES con actividad leve a moderada y como tratamiento concomitante de afección a órgano mayor, así como para prevenir recaídas a largo plazo20–22.
Los GC son la piedra angular del tratamiento inmediato de la enfermedad. Su efecto antinflamatorio e inmunomodulador permite el control rápido de muchas manifestaciones del lupus. La dosis y tiempo de administración de este grupo de fármacos está determinada por la gravedad de la afección y, por consenso internacional, las dosis de prednisona (o su equivalente) se han definido como: dosis baja (< 7,5mg), dosis moderada (> 7,5mg y <30mg), dosis alta (> 30mg y <100mg) y dosis muy alta (> 100mg)23. A pesar de su indudable eficacia, debido a sus efectos adversos a corto y largo plazo los GC deben administrarse siempre en forma concomitante con otros fármacos modificadores de enfermedad o inmunosupresores para poder así reducir la dosis e incluso suspenderlos de la forma más rápida posible24.
Para el tratamiento sintomático del dolor e inflamación en los pacientes con LES suelen emplearse AINE. Generalmente, en procesos agudos se emplean a la dosis plena recomendada durante el menor tiempo posible y, en procesos crónicos, a la dosis mínima necesaria para mantener la respuesta clínica. La elección del AINE individual dependerá de la variabilidad de la respuesta y de los factores de riesgo de cada paciente para toxicidad gastrointestinal, cardiovascular, renal y hepática, entre otras. Es necesario evaluar periódicamente la indicación de continuar su uso y evaluar siempre el riesgo de interacciones y eventos adversos al emplear en forma conjunta otros fármacos de uso frecuente en los pacientes con LES (GC, antihipertensivos, hipoglucemiantes, anticoagulantes, etc.)25,26.
Los fármacos modificadores de la enfermedad, como el metotrexato y la leflunomida, son útiles cuando existen manifestaciones musculoesqueléticas27. Los inmunosupresores se emplean en diversas manifestaciones moderadas y graves de la enfermedad, aunque también en formas leves por su efecto ahorrador de GC. Los más usados son azatioprina (AZA), micofenolato de mofetilo (MFM), ciclofosfamida (CFM) e inhibidores de calcineurina (ciclosporina, tacrolimús y voclosporina). En algunas circunstancias se utiliza un esquema de inducción de la remisión seguido de una dosis menor como terapia de mantenimiento para consolidar la remisión y evitar recaídas. La elección de cada inmunosupresor dependerá del tipo de manifestación, su gravedad y el perfil individual de toxicidad. La terapia múltiple suele indicarse cada vez con más frecuencia como una forma de lograr mejores desenlaces a corto y largo plazo con menor toxicidad28–35.
La terapia biológica en LES se emplea desde hace una década, específicamente el uso de anticuerpos monoclonales dirigidos contra células B, T y, en forma más reciente, contra el interferón tipo I. Estos mecanismos de acción han demostrado ser eficaces y coadyuvan con la terapia estándar para el control de diversas manifestaciones de la enfermedad y para disminuir la frecuencia y gravedad de las recaídas, además de retrasar el daño acumulado. Aunque los resultados parecen mejores en pacientes con anticuerpos antinucleares positivos, no debe limitarse su uso a este subconjunto de pacientes. En forma reciente se ha autorizado el uso de belimumab como tratamiento concomitante en pacientes con nefritis lúpica36–41.
Actualmente, están en curso ensayos clínicos de inhibidores de cinasas de tirosina Janus en pacientes con LES, con resultados prometedores, para manifestaciones a diversos órganos, incluido el riñón. Un área novedosa de investigación se refiere al uso de células CAR-T (moléculas quiméricas capaces de redirigir la especificidad de las células T contra antígenos diana) en pacientes con LES grave y resistente, con resultados alentadores42–44.
Las tablas 3 a 5 describen las recomendaciones de tratamiento del LES con los diferentes grupos de fármacos.
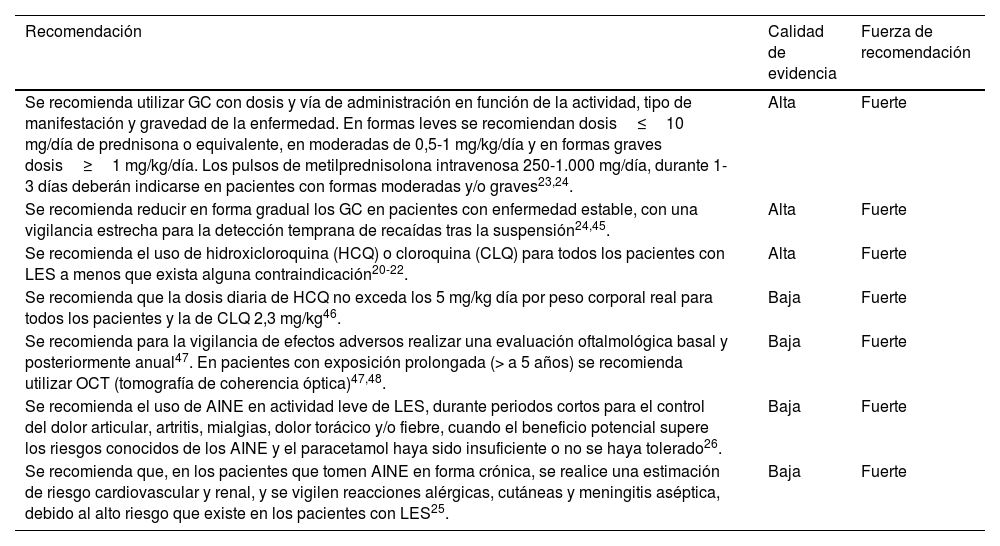
Recomendaciones para el uso de glucocorticoides, antimaláricos y AINE
| Recomendación | Calidad de evidencia | Fuerza de recomendación |
|---|---|---|
| Se recomienda utilizar GC con dosis y vía de administración en función de la actividad, tipo de manifestación y gravedad de la enfermedad. En formas leves se recomiendan dosis≤10 mg/día de prednisona o equivalente, en moderadas de 0,5-1 mg/kg/día y en formas graves dosis≥1 mg/kg/día. Los pulsos de metilprednisolona intravenosa 250-1.000 mg/día, durante 1-3 días deberán indicarse en pacientes con formas moderadas y/o graves23,24. | Alta | Fuerte |
| Se recomienda reducir en forma gradual los GC en pacientes con enfermedad estable, con una vigilancia estrecha para la detección temprana de recaídas tras la suspensión24,45. | Alta | Fuerte |
| Se recomienda el uso de hidroxicloroquina (HCQ) o cloroquina (CLQ) para todos los pacientes con LES a menos que exista alguna contraindicación20-22. | Alta | Fuerte |
| Se recomienda que la dosis diaria de HCQ no exceda los 5 mg/kg día por peso corporal real para todos los pacientes y la de CLQ 2,3 mg/kg46. | Baja | Fuerte |
| Se recomienda para la vigilancia de efectos adversos realizar una evaluación oftalmológica basal y posteriormente anual47. En pacientes con exposición prolongada (> a 5 años) se recomienda utilizar OCT (tomografía de coherencia óptica)47,48. | Baja | Fuerte |
| Se recomienda el uso de AINE en actividad leve de LES, durante periodos cortos para el control del dolor articular, artritis, mialgias, dolor torácico y/o fiebre, cuando el beneficio potencial supere los riesgos conocidos de los AINE y el paracetamol haya sido insuficiente o no se haya tolerado26. | Baja | Fuerte |
| Se recomienda que, en los pacientes que tomen AINE en forma crónica, se realice una estimación de riesgo cardiovascular y renal, y se vigilen reacciones alérgicas, cutáneas y meningitis aséptica, debido al alto riesgo que existe en los pacientes con LES25. | Baja | Fuerte |
AINE: antinflamatorios no esteroideos; GC: glucocorticoides; LES: lupus eritematoso sistémico.
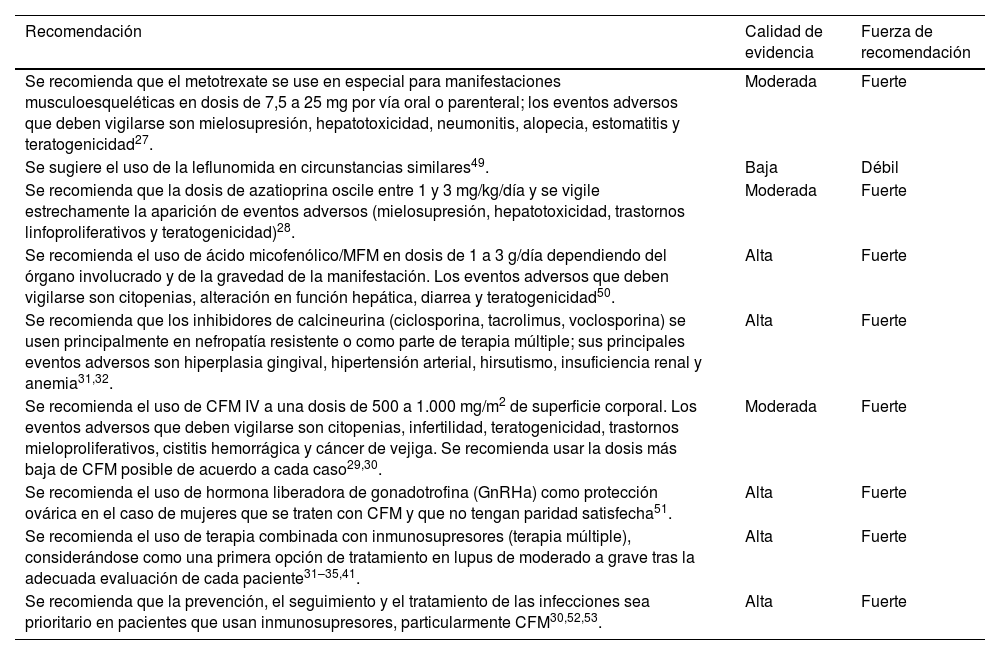
Recomendaciones para el uso de FARME e inmunosupresores
| Recomendación | Calidad de evidencia | Fuerza de recomendación |
|---|---|---|
| Se recomienda que el metotrexate se use en especial para manifestaciones musculoesqueléticas en dosis de 7,5 a 25 mg por vía oral o parenteral; los eventos adversos que deben vigilarse son mielosupresión, hepatotoxicidad, neumonitis, alopecia, estomatitis y teratogenicidad27. | Moderada | Fuerte |
| Se sugiere el uso de la leflunomida en circunstancias similares49. | Baja | Débil |
| Se recomienda que la dosis de azatioprina oscile entre 1 y 3 mg/kg/día y se vigile estrechamente la aparición de eventos adversos (mielosupresión, hepatotoxicidad, trastornos linfoproliferativos y teratogenicidad)28. | Moderada | Fuerte |
| Se recomienda el uso de ácido micofenólico/MFM en dosis de 1 a 3 g/día dependiendo del órgano involucrado y de la gravedad de la manifestación. Los eventos adversos que deben vigilarse son citopenias, alteración en función hepática, diarrea y teratogenicidad50. | Alta | Fuerte |
| Se recomienda que los inhibidores de calcineurina (ciclosporina, tacrolimus, voclosporina) se usen principalmente en nefropatía resistente o como parte de terapia múltiple; sus principales eventos adversos son hiperplasia gingival, hipertensión arterial, hirsutismo, insuficiencia renal y anemia31,32. | Alta | Fuerte |
| Se recomienda el uso de CFM IV a una dosis de 500 a 1.000 mg/m2 de superficie corporal. Los eventos adversos que deben vigilarse son citopenias, infertilidad, teratogenicidad, trastornos mieloproliferativos, cistitis hemorrágica y cáncer de vejiga. Se recomienda usar la dosis más baja de CFM posible de acuerdo a cada caso29,30. | Moderada | Fuerte |
| Se recomienda el uso de hormona liberadora de gonadotrofina (GnRHa) como protección ovárica en el caso de mujeres que se traten con CFM y que no tengan paridad satisfecha51. | Alta | Fuerte |
| Se recomienda el uso de terapia combinada con inmunosupresores (terapia múltiple), considerándose como una primera opción de tratamiento en lupus de moderado a grave tras la adecuada evaluación de cada paciente31–35,41. | Alta | Fuerte |
| Se recomienda que la prevención, el seguimiento y el tratamiento de las infecciones sea prioritario en pacientes que usan inmunosupresores, particularmente CFM30,52,53. | Alta | Fuerte |
CFM: ciclofosfamida.
Recomendaciones para el uso de terapia biológica
| Recomendación | Calidad deevidencia | Fuerza derecomendación |
|---|---|---|
| Se recomienda el uso de terapia biológica (belimumab, anifrolumab) como tratamiento adyuvante al manejo estándar en pacientes con LES activo, con anticuerpos positivos y falla a la terapia previa36,37. | Alta | Fuerte |
| Se recomienda el uso de belimumab en combinación con terapias inmunosupresoras estándar para el tratamiento de pacientes con nefritis lúpica activa38. | Alta | Fuerte |
| Se sugiere el uso de rituximab para manifestaciones de lupus moderadas a graves, con falla a tratamientos previos39,40,43,54,55. | Moderada | Débil |
LES: lupus eritematoso sistémico.
Las manifestaciones constitucionales del lupus, como suele ocurrir en muchos padecimientos sistémicos crónicos, son un fenómeno multifactorial que repercute de manera significativa en la calidad de vida de los pacientes. En el caso de la fiebre es necesario descartar procesos infecciosos antes de atribuir esta solo a actividad del padecimiento.
El tratamiento de la fatiga debe ser de tipo sintomático y holístico, incluyendo evaluaciones periódicas, programas de ejercicio e intervenciones psicoeducativas, considerando siempre otras causas relacionadas como daño o comorbilidades y teniendo en cuenta la influencia que pueden tener factores psicológicos, sociales y de estilo de vida. Las evidencias encontradas en la literatura permiten emitir las siguientes recomendaciones para este grupo de manifestaciones de la enfermedad56,57 (tabla 6).
Recomendaciones para el manejo de manifestaciones constitucionales
| Recomendación | Calidad de evidencia | Fuerza de recomendación |
|---|---|---|
| Se recomienda incluir la evaluación de la presencia e intensidad de fatiga, así como su impacto en la calidad de vida como parte de la atención clínica rutinaria del paciente con LES56-58. | Baja | Fuerte |
| Se recomienda la inclusión de un programa de ejercicios físicos, preferentemente de tipo aeróbico, como adyuvante en el tratamiento en pacientes con LES sin actividad clínica de la enfermedad59-63. | Moderada | Fuerte |
| Se recomienda la implementación y provisión de un programa educativo relacionado a la enfermedad y de apoyo64,65. | Moderada | Fuerte |
| Se sugiere la adición de belimumab para el tratamiento de la fatiga discapacitante o que interfiera gravemente con la calidad de vida en pacientes con LES, que no hayan respondido a otros esquemas de tratamiento66,67. | Alta | Débil |
| Se sugiere optimizar los niveles de vitamina D como tratamiento adyuvante68-70. | Baja | Débil |
| Se recomienda el uso de GC a dosis medias, en presencia de fiebre cuya causa sea atribuida a actividad del LES esperando remisión de la fiebre en 1 a 5 días23,71,72. | Muy baja | Fuerte |
| Punto de buena práctica clínica. Es necesario primero descartar infección o efecto tóxico de medicamentos antes de atribuir la fiebre a actividad lúpica. |
GC: glucocorticoides; LES: lupus eritematoso sistémico.
La afección mucocutánea en LES es muy frecuente y puede ocurrir en el contexto de pacientes con o sin afección sistémica; suele clasificarse en manifestaciones específicas y no específicas73. La elección del tratamiento óptimo es difícil porque la mayoría de las evaluaciones de eficacia agrupan el desenlace como «manifestaciones cutáneas» sin ninguna distinción adicional en cuanto al tipo de manifestación.
A pesar de todo ello, la información actual sobre este tópico en particular es útil para emitir una serie de recomendaciones que incluyen el manejo cada vez con menos GC, la adición de terapia tópica, el uso de antimaláricos como piedra angular y, en caso necesario, inmunosupresores y terapia biológica73-78 (tabla 7).
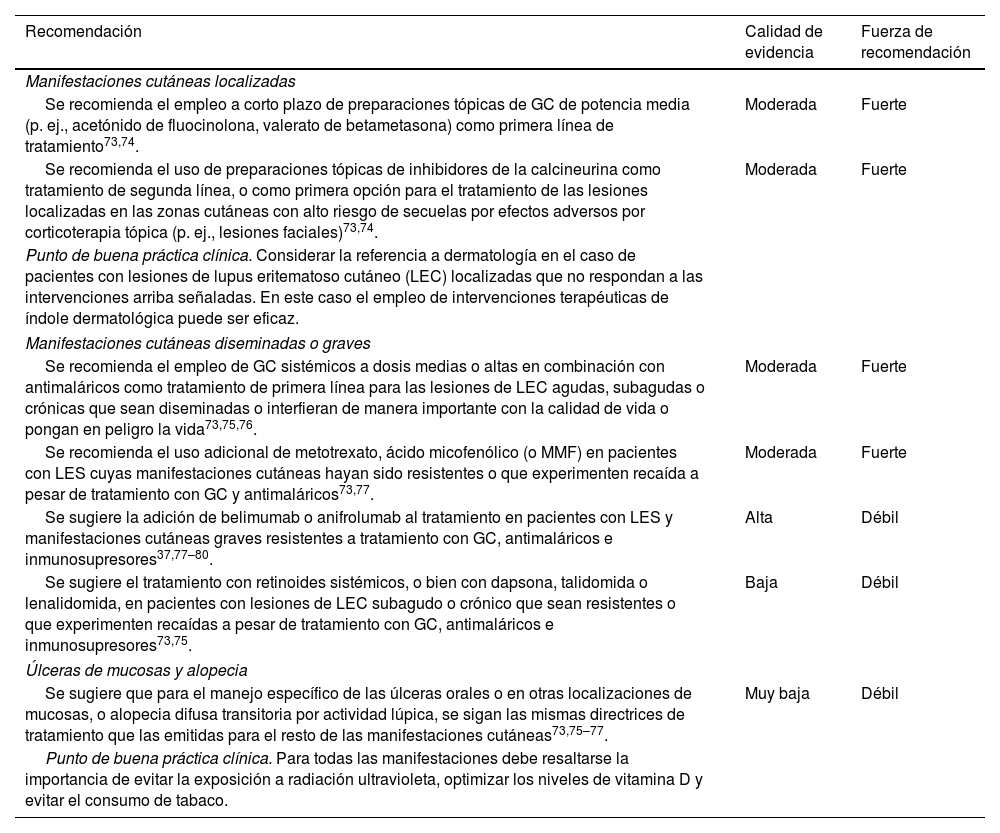
Recomendaciones para el manejo de manifestaciones mucocutáneas
| Recomendación | Calidad de evidencia | Fuerza de recomendación |
|---|---|---|
| Manifestaciones cutáneas localizadas | ||
| Se recomienda el empleo a corto plazo de preparaciones tópicas de GC de potencia media (p. ej., acetónido de fluocinolona, valerato de betametasona) como primera línea de tratamiento73,74. | Moderada | Fuerte |
| Se recomienda el uso de preparaciones tópicas de inhibidores de la calcineurina como tratamiento de segunda línea, o como primera opción para el tratamiento de las lesiones localizadas en las zonas cutáneas con alto riesgo de secuelas por efectos adversos por corticoterapia tópica (p. ej., lesiones faciales)73,74. | Moderada | Fuerte |
| Punto de buena práctica clínica. Considerar la referencia a dermatología en el caso de pacientes con lesiones de lupus eritematoso cutáneo (LEC) localizadas que no respondan a las intervenciones arriba señaladas. En este caso el empleo de intervenciones terapéuticas de índole dermatológica puede ser eficaz. | ||
| Manifestaciones cutáneas diseminadas o graves | ||
| Se recomienda el empleo de GC sistémicos a dosis medias o altas en combinación con antimaláricos como tratamiento de primera línea para las lesiones de LEC agudas, subagudas o crónicas que sean diseminadas o interfieran de manera importante con la calidad de vida o pongan en peligro la vida73,75,76. | Moderada | Fuerte |
| Se recomienda el uso adicional de metotrexato, ácido micofenólico (o MMF) en pacientes con LES cuyas manifestaciones cutáneas hayan sido resistentes o que experimenten recaída a pesar de tratamiento con GC y antimaláricos73,77. | Moderada | Fuerte |
| Se sugiere la adición de belimumab o anifrolumab al tratamiento en pacientes con LES y manifestaciones cutáneas graves resistentes a tratamiento con GC, antimaláricos e inmunosupresores37,77–80. | Alta | Débil |
| Se sugiere el tratamiento con retinoides sistémicos, o bien con dapsona, talidomida o lenalidomida, en pacientes con lesiones de LEC subagudo o crónico que sean resistentes o que experimenten recaídas a pesar de tratamiento con GC, antimaláricos e inmunosupresores73,75. | Baja | Débil |
| Úlceras de mucosas y alopecia | ||
| Se sugiere que para el manejo específico de las úlceras orales o en otras localizaciones de mucosas, o alopecia difusa transitoria por actividad lúpica, se sigan las mismas directrices de tratamiento que las emitidas para el resto de las manifestaciones cutáneas73,75–77. | Muy baja | Débil |
| Punto de buena práctica clínica. Para todas las manifestaciones debe resaltarse la importancia de evitar la exposición a radiación ultravioleta, optimizar los niveles de vitamina D y evitar el consumo de tabaco. | ||
GC: glucocorticoides; LES: lupus eritematoso sistémico.
Las manifestaciones articulares son frecuentes en los pacientes con LES, ocurriendo hasta en 85% de los casos en la evolución de la enfermedad. La mayor parte de los pacientes presenta artralgias de características inflamatorias, pero un bajo porcentaje desarrolla artritis persistente y/o erosiva. Pueden ocurrir también mialgias y, en pocos casos, miositis con debilidad y elevación de enzimas musculares, casi siempre con curso autolimitado. El tratamiento de este grupo de manifestaciones depende de la gravedad de las mismas e incluye el uso de AINE, GC, fármacos modificadores de la enfermedad y, en algunos casos, terapia biológica26,81-84 (tabla 8).
Recomendaciones para el manejo de manifestaciones musculoesqueléticas
| Recomendación | Calidad de evidencia | Fuerza de recomendación |
|---|---|---|
| Se recomienda utilizar AINE por periodos cortos para el control de las manifestaciones articulares, evaluando el riesgo/beneficio en cada paciente dependiendo de las comorbilidades. La selección entre AINE tradicional vs. inhibidor selectivo de COX-2 dependerá de cada caso y deberá individualizarse26. | Moderada | Fuerte |
| Se recomienda emplear GC para las manifestaciones articulares inflamatorias resistentes a los AINE o a los antimaláricos. Se pueden utilizar al inicio de la enfermedad o en periodos de recaída, en dosis bajas y monitorizar dosis respuesta suspendiendo una vez logrado el control de la inflamación y el dolor. En casos de inflamación monoarticular resistente, recomendamos la aplicación intraarticular de GC (descartando antes un proceso infeccioso)81. | Baja | Fuerte |
| Se recomienda usar HCQ o CLQ para el control del dolor y la inflamación articular8,82. | Moderada | Fuerte |
| Se recomienda el uso de metotrexato en pacientes con persistencia de inflamación articular a pesar de la utilización de AINE, GC a dosis baja y antimaláricos8. | Baja | Fuerte |
| Se sugiere el uso de leflunomida en pacientes con persistencia de inflamación articular a pesar de la utilización de AINE, GC a dosis bajas y antimaláricos8,49. | Baja | Débil |
| Se recomienda el uso de belimumab en los pacientes resistentes al tratamiento estándar, como tratamiento adyuvante para lograr el control de las manifestaciones articulares84. | Moderada | Fuerte |
| En casos resistentes al tratamiento previo se recomienda el uso de rituximab8,26,85. | Baja | Fuerte |
| En casos resistentes al tratamiento previo se sugiere el uso de anifrolumab86-88. | Moderada | Débil |
AINE: antinflamatorios no esteroideos; CLQ: cloroquina; GC: glucocorticoides; HCQ: hidroxicloroquina.
Las alteraciones hematológicas en el LES son muy frecuentes y ocurren en más del 90% de los pacientes89. Afectan a todas las líneas celulares y se caracterizan por comprender desde manifestaciones leves como leucolinfopenia crónica hasta cuadros graves y agudos que ponen en peligro la vida y requieren de tratamiento específico pronto, como la anemia hemolítica, la trombocitopenia autoinmune, la púrpura trombocitopénica trombótica y el síndrome hemofagocítico. Además, ocurren alteraciones multifactoriales como la anemia de la enfermedad crónica y citopenias asociadas a daño orgánico crónico (hepático o renal), eventos infecciosos y/o medicamentos90.
Dentro del rubro de las recomendaciones para el tratamiento de las manifestaciones hematológicas, se han incluido en esta actualización directrices sobre la evaluación y tratamiento del síndrome de anticuerpos antifosfolípidos (SAAF). Hasta el 30% de los pacientes con LES tienen SAAF o anticuerpos positivos, y es bien conocido el impacto de esta asociación en la morbilidad y pronóstico de los pacientes91-93 (tabla 9).
Recomendaciones para el manejo de manifestaciones hematológicas
| Recomendación | Calidad de evidencia | Fuerza de recomendación |
|---|---|---|
| Trombocitopenia | ||
| En casos de trombocitopenia moderada sin datos de sangrado, se recomienda prednisona en dosis altas hasta obtener cifras plaquetarias por arriba de 100.000 cel/μL y disminuir paulatinamente la dosis de GC hasta suspender, agregando otro inmunosupresor para disminuir el riesgo de recaída94,95. | Moderada | Fuerte |
| En casos de trombocitopenia grave (<15.000 cel/μL) o con datos de sangrado que pongan en riesgo la vida, se recomienda el uso de pulsos de metilprednisolona (1g/día por 3 a 5 días, según la gravedad del cuadro) para obtener respuestas más rápidas, asegurándose de continuar a dosis altas de prednisona o su equivalente para evitar el riesgo de recaídas. Se recomienda continuar con estas dosis hasta obtener cifras mayores de 50.000 cel/μL y agregar algún otro inmunosupresor94,96,97. | Moderada | Fuerte |
| Se recomiendan danazol (200 a 800 mg/día) y/o antimaláricos como terapia conjunta al tratamiento con GC orales94,98,99. | Moderada | Fuerte |
| En casos resistentes se recomienda el uso de rituximab100,101. | Moderada | Fuerte |
| Se recomienda inmunoglobulina IV únicamente en pacientes con pobre respuesta a GC94,102-104. | Moderada | Fuerte |
| Se recomienda CFM por 3 a 6 meses, según la gravedad de la trombocitopenia y la respuesta clínica, en pacientes que no han respondido al tratamiento previo105-107 | Baja | Fuerte |
| Se sugiere MFM en pacientes resistentes al tratamiento previo108,109. | Baja | Débil |
| Se sugiere AZA en pacientes resistentes al resto de las líneas de tratamiento95,110,111. | Baja | Débil |
| Se recomienda de manera alternativa trombopoyetina recombinante humana más dexametasona u otros GC94,112,113. | Alta | Fuerte |
| En pacientes con recuentos plaquetarios por debajo de 10.000 cel/μL, sin importar si hay o no datos de sangrado o cifras por debajo de 50.000 cel/μL con sangrado activo, se recomienda el uso de concentrados plaquetarios114. | Moderada | Fuerte |
| Se sugiere esplenectomía en casos resistentes a las cuatro líneas previas de tratamiento115,116. | Baja | Débil |
| Anemia hemolítica autoinmune | ||
| Se recomienda el empleo de GC en situaciones en donde la anemia ponga en riesgo la vida; usar pulsos de metilprednisolona, seguido de GC orales en dosis altas117,118. | Alta | Fuerte |
| Se recomienda el empleo concomitante de AZA o danazol119-121. | Moderada | Fuerte |
| En casos resistentes se sugiere el uso de MFM, CFM o terapia biológica (rituximab, belimumab, anifrolumab)87,88,117,122-130. | Baja | Débil |
| No se recomienda la transfusión de paquetes globulares, excepto en los casos en los que se encuentre en riesgo la vida, en donde deberán usarse eritrocitos lavados131. | Moderada | Fuerte |
| Neutropenia, leucolinfopenia | ||
| En neutropenia <1.000 cel/μL, asociada a fiebre o infección se recomienda iniciar factor estimulante de colonias de granulocitos (300μg/día) y continuar con la dosis mínima efectiva para alcanzar cifra de neutrófilos mayores a 1.000 cel/μL89,132-136. | Baja | Fuerte |
| Se sugieren dosis altas de prednisona o su equivalente89,132 | Baja | Débil |
| Se sugiere el empleo concomitante de AZA o MFM132,137. | Baja | Débil |
| Se sugiere el uso de rituximab en enfermedad resistente (375 mg/m2sc por cuatro semanas o 1g el día cero y el día 14)132,137. | Muy baja | Débil |
| Punto de buena práctica clínica. Descartar infección o toxicidad por medicamentos. | ||
| Púrpura trombótica trombocitopénica | ||
| Se recomienda iniciar recambio plasmático tan pronto como se sospeche el diagnóstico (en las primeras 4-8 h) y administrarlo hasta alcanzar respuesta, en combinación con GC. El reemplazo debe ser con plasma fresco congelado138. | Baja | Fuerte |
| Se recomienda administrar de primera línea pulsos de metilprednisolona (1 g/día por 5 días), seguido de GC oral con reducción progresiva de la dosis138,139. | Baja | Fuerte |
| Se sugiere el empleo en segunda línea de CFM, MFM, o bien biológicos como rituximab, belimumab o eculizumab en casos resistentes138,140,141. | Baja | Débil |
| Síndrome hemofagocítico | ||
| Se recomiendan pulsos de metilprednisolona o prednisona142,143. | Baja | Fuerte |
| Se sugiere agregar en forma concomitante ciclosporina, MFM, CFM o rituximab144,145. | Baja | Débil |
| Punto de buena práctica clínica. Debe proporcionarse tratamiento de soporte (reanimación con líquidos, antibióticos, cubrir requerimientos transfusionales), así como buscar y tratar focos infecciosos142. | ||
| Síndrome de anticuerpos antifosfolípidos | ||
| Tromboprofilaxis primaria | ||
| En todo paciente con anticuerpos antifosfolípidos, se recomienda de manera muy importante,el tratamiento o corrección de los factores de riesgo cardiovascular146,147. | Moderada | Fuerte |
| En pacientes con perfil de riesgo medio/alto (presencia de anticoagulante lúpico, títulos elevados de anticuerpos antifosfolípidos o bien doble o triple positividad) se recomienda el tratamiento con dosis antiagregantes de ácido acetilsalicílico (AAS 75-100 mg/día), de manera indefinida, siempre y cuando no exista contraindicación para su empleo148. | Baja | Fuerte |
| Punto de buena práctica clínica. En pacientes portadores de anticuerpos antifosfolípidos, en situaciones de alto riesgo trombótico (cirugía, inmovilización prolongada, puerperio entre otras), debe emplearse tratamiento con heparina de bajo peso molecular a dosis profilácticas. | ||
| Tromboprofilaxis secundaria | ||
| Para la prevención secundaria de trombosis venosa se recomienda la anticoagulación con antagonistas de la vitamina K (AVK), para lograr un INR 2,0-3,0, de manera indefinida149. | Moderada | Fuerte |
| Para la prevención de la recurrencia de trombosis arterial, se recomienda la anticoagulación con AVK (INR 2,0-3,0 o 3,0-4,0 dependiendo del riesgo trombótico/hemorrágico individual) o bien, la combinación de AVK (INR 2,0-3,0) más AAS150-153. | Baja | Fuerte |
| En caso de recurrencia trombótica (venosa o arterial) a pesar del tratamiento establecido, se recomienda aumentar la dosis de AVK para INR 3,0-4,0 o adicionar AAS en caso de no estar ya bajo dicho tratamiento. La HCQ o las estatinas pueden ser de utilidad154,155. | Baja | Fuerte |
| No se recomienda utilizar anticoagulantes orales directos (ACOD) en pacientes con SAAF91,149,156-163. | Baja | Fuerte |
| Solo en situaciones de intolerancia o ineficacia de los AVK, y únicamente en pacientes con trombosis venosa, se sugiere un uso prudente de ACOD. No deben utilizarse ACOD en triple positivos o en trombosis arterial160,161,164,165. | Baja | Débil |
AZA: azatioprina; CFM: ciclofosfamida; GC: glucocorticoides; MFM: micofenolato de mofetilo; SAAF: síndrome de anticuerpos antifosfolípidos.
La afección renal en el lupus es una de las manifestaciones más frecuentes y con mayor impacto en el pronóstico de los pacientes. Existen poblaciones, como la mexicana, en la que la nefritis lúpica se presenta a menor edad y suele ser más grave166,167.
El tratamiento óptimo de la nefritis lúpica se define tanto por los hallazgos histológicos como por el comportamiento clínico. En las nefritis proliferativas se recomienda aún un periodo de inducción a la remisión seguido de terapia prolongada de mantenimiento, aunque la terapia múltiple puede iniciarse desde un principio (p. ej., MFM o CFM más un inhibidor de calcineurina), en especial en pacientes con datos de mal pronóstico. Evidencia reciente demuestra que este esquema puede ser superior a la monoterapia en cuanto a desenlaces a largo plazo168-170. También se sugiere el uso de terapia biológica anti-Blys/BAFF (específicamente belimumab) como adyuvante al manejo estándar, al demostrarse que esta medida permite mayor supervivencia renal y menos recaídas50,171,172.
Las recomendaciones actuales hacen énfasis en detectar datos de mal pronóstico asociados (p. ej., anticuerpos antifosfolípidos) y en el manejo concomitante de los factores de riesgo de progresión de daño renal como una medida indispensable para mejorar el pronóstico a largo plazo173,174 (tabla 10).
Recomendaciones para el manejo de manifestaciones renales
| Recomendación | Calidaddeevidencia | Fuerza derecomendación |
|---|---|---|
| Nefritis en pacientes mexicanos (latinos, mesoamericanos) | ||
| Se recomienda en esta población tratamiento de inducción a la remisión con MMF (2 a 3g/día) o CFM (1g/m2sc) mensual166,175. | Moderada | Fuerte |
| Nefritis clase I y II | ||
| Se sugiere el tratamiento con inmunosupresor en el caso de nefritis clase I y II que curse con deterioro de la función renal, sedimento activo o proteinuria ≥1g/día167,176. | Baja | Débil |
| Se sugiere tratamiento con AZA, MFM (1 a 2 g/día) o CFM, por un periodo mínimo de seis meses, aunado a GC en dosis medias y reducción gradual177,178. | Baja | Débil |
| Tratamiento de inducción a remisión para nefritis clases III/IV y V con componente proliferativo | ||
| Se recomienda esquema de tratamiento de inducción a la remisión con MFM (2 a 3 g/día) o CFM (pulsos mensuales de 1 g/m2sc), combinado con GC en reducción gradual, por un periodo de seis meses168,177,178. | Alta | Fuerte |
| En caso de no haber respuesta se recomienda terapia múltiple: MFM más tacrolimus (3 a 4 mg/día) y GC168.. | Alta | Fuerte |
| Se recomienda como alternativa combinar MMF más voclosporina (23,7 mg/12 h)169,170. | Moderada | Fuerte |
| Se recomienda agregar belimumab al manejo estándar en pacientes con factores de mal pronóstico o casos resistentes172,179. | Moderada | Fuerte |
| Se sugiere agregar al manejo estándar rituximab o anifrolumab en pacientes con factores de mal pronóstico o casos resistentes50,80,171. | Baja | Débil |
| Se recomienda usar GC en pulsos o por vía oral en dosis altas como tratamiento inicial aunado al esquema inmunosupresor, con reducción gradual177,178. | Moderada | Fuerte |
| Nefritis clase V sin componente proliferativo | ||
| Se recomienda el uso de MFM (2 a 3 g/día) o AZA (1 a 3 mg/kg)177,178. | Alta | Fuerte |
| Se sugiere el uso de tacrolimus, voclosporina, ciclosporina A, CFM o rituximab en pacientes resistentes a tratamiento169,180. | Moderada | Débil |
| Terapia de mantenimiento para nefritis clases III/IV y V con componente proliferativo | ||
| Se recomienda el uso de MFM (1 a 2 g/día), AZA (1 a 3 mg/kg) o continuidad de terapia múltiple: MFM más tacrolimus. El tratamiento debe ser a largo plazo: 2 a 5 años como mínimo177,178,181. | Alta | Fuerte |
| Se sugiere el uso de CFM trimestral, tacrolimus, ciclosporina A o rituximab, en pacientes con intolerancia a MFM o AZA177,178,182. | Moderada | Débil |
| Nefritis rápidamente progresiva/con medias lunas celulares | ||
| Se recomienda tratamiento de inducción con CFM (0,750 a 1 g/m2sc) mensual, o MFM (2 a 3 g/día) por seis meses. Ambas opciones aunado a administración de pulsos de metilprednisona o prednisona en dosis altas, con reducción gradual según evolución177,178,183,184. | Alta | Fuerte |
| En caso de no haber respuesta se sugiere terapia múltiple: MFM más tacrolimus y GC184. | Moderada | Débil |
| Se sugiere el uso de rituximab o belimumab en el tratamiento de casos resistentes172,185. | Baja | Débil |
| Manejo adyuvante | ||
| Se recomienda en todos los pacientes manejo para reducir factores de riesgo renal: uso de IECA, ARA II o iSGLT2, control adecuado de la hipertensión, dislipidemia, hiperuricemia, evitar tabaquismo y control del peso corporal173. | Alta | Fuerte |
| Se recomienda HCQ de forma permanente para disminuir la probabilidad de recaída renal y por sus beneficios sobre la dislipidemia20-22. | Alta | Fuerte |
| Se recomienda evaluar la presencia de anticuerpos o SAAF y el uso de antiagregantes o anticoagulantes en pacientes con riesgo174. | Alta | Fuerte |
| Tratamiento de las recaídas | ||
| Se recomienda repetir tratamiento de inducción a la remisión previamente eficaz177,178. | Moderada | Fuerte |
| Manejo con terapia sustitutiva y trasplante renal | ||
| En pacientes con enfermedad renal crónica terminal por nefritis lúpica, se recomienda el trasplante renal como la mejor opción de tratamiento a largo plazo177,178,186. | Alta | Fuerte |
| Se recomienda la hemodiálisis sobre la diálisis peritoneal como terapia sustitutiva en pacientes con enfermedad renal crónica terminal por nefritis lúpica, ya que la diálisis peritoneal se ha asociado a mayor número de complicaciones y mortalidad177,178,187. | Moderada | Fuerte |
ARA II: antagonistas del receptor de angiotensina II; AZA: azatioprina; CFM: ciclofosfamida; GC: glucocorticoides; IECA: inhibidores de la enzima convertidora de angiotensina; MFM: micofenolato de mofetilo; iSGLT2: inhibidores del cotransportador de sodio-glucosa tipo 2.
La afección neuropsiquiátrica en LES es muy variable, con frecuencias que se reportan entre 14 y 75%188. Esta amplia variación en la frecuencia se debe a la dificultad de atribuir con certeza las manifestaciones neuropsiquiátricas a la enfermedad, tras haber descartado causas secundarias, tales como metabólicas e infecciosas189. El Colegio Americano de Reumatología publicó en 1999 la nomenclatura para las manifestaciones neuropsiquiátricas190, que incluye 18 manifestaciones; sin embargo, en LES puede presentarse virtualmente cualquier manifestación, acompañada o no de actividad en otro órgano o sistema. La afección neuropsiquátrica constituye una causa importante de mortalidad y daño acumulado (tabla 11).
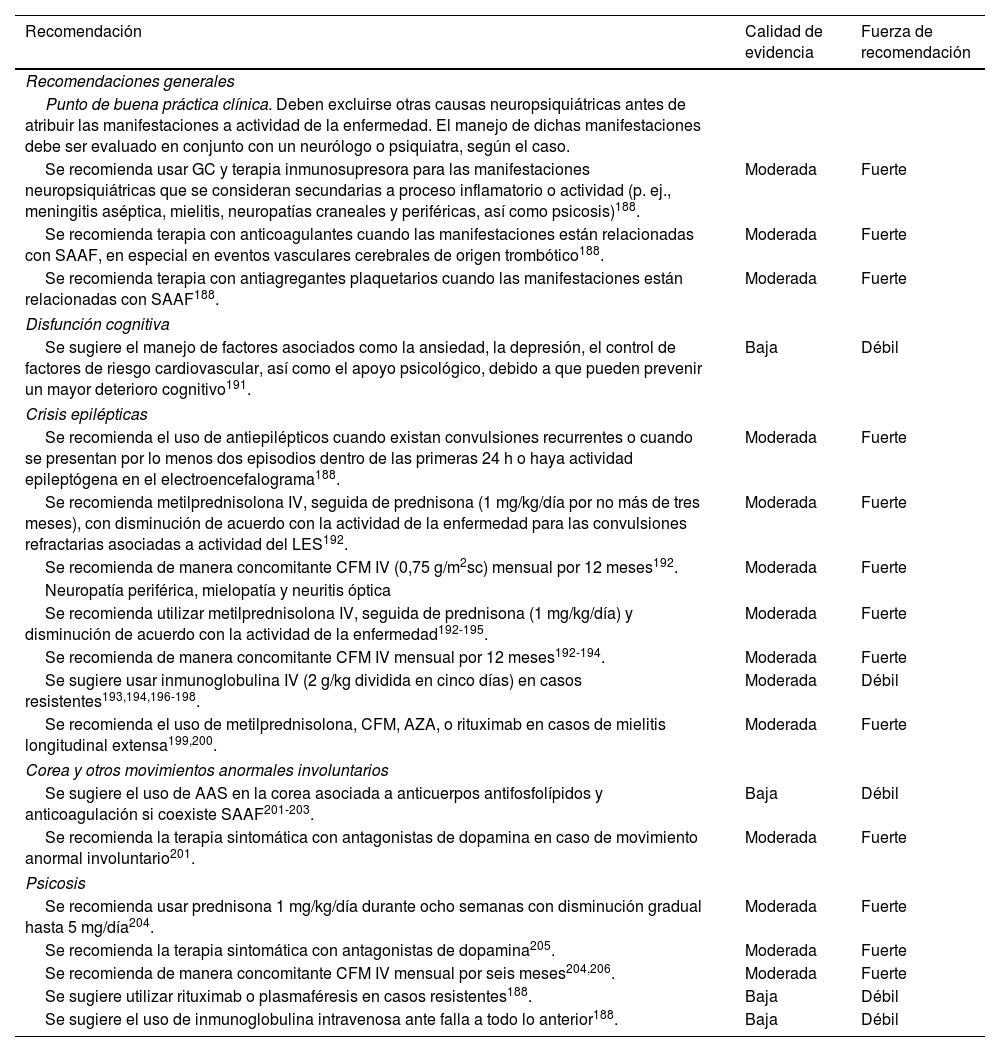
Recomendaciones para el manejo de manifestaciones neuropsiquiátricas
| Recomendación | Calidad de evidencia | Fuerza de recomendación |
|---|---|---|
| Recomendaciones generales | ||
| Punto de buena práctica clínica. Deben excluirse otras causas neuropsiquiátricas antes de atribuir las manifestaciones a actividad de la enfermedad. El manejo de dichas manifestaciones debe ser evaluado en conjunto con un neurólogo o psiquiatra, según el caso. | ||
| Se recomienda usar GC y terapia inmunosupresora para las manifestaciones neuropsiquiátricas que se consideran secundarias a proceso inflamatorio o actividad (p. ej., meningitis aséptica, mielitis, neuropatías craneales y periféricas, así como psicosis)188. | Moderada | Fuerte |
| Se recomienda terapia con anticoagulantes cuando las manifestaciones están relacionadas con SAAF, en especial en eventos vasculares cerebrales de origen trombótico188. | Moderada | Fuerte |
| Se recomienda terapia con antiagregantes plaquetarios cuando las manifestaciones están relacionadas con SAAF188. | Moderada | Fuerte |
| Disfunción cognitiva | ||
| Se sugiere el manejo de factores asociados como la ansiedad, la depresión, el control de factores de riesgo cardiovascular, así como el apoyo psicológico, debido a que pueden prevenir un mayor deterioro cognitivo191. | Baja | Débil |
| Crisis epilépticas | ||
| Se recomienda el uso de antiepilépticos cuando existan convulsiones recurrentes o cuando se presentan por lo menos dos episodios dentro de las primeras 24 h o haya actividad epileptógena en el electroencefalograma188. | Moderada | Fuerte |
| Se recomienda metilprednisolona IV, seguida de prednisona (1 mg/kg/día por no más de tres meses), con disminución de acuerdo con la actividad de la enfermedad para las convulsiones refractarias asociadas a actividad del LES192. | Moderada | Fuerte |
| Se recomienda de manera concomitante CFM IV (0,75 g/m2sc) mensual por 12 meses192. | Moderada | Fuerte |
| Neuropatía periférica, mielopatía y neuritis óptica | ||
| Se recomienda utilizar metilprednisolona IV, seguida de prednisona (1 mg/kg/día) y disminución de acuerdo con la actividad de la enfermedad192-195. | Moderada | Fuerte |
| Se recomienda de manera concomitante CFM IV mensual por 12 meses192-194. | Moderada | Fuerte |
| Se sugiere usar inmunoglobulina IV (2 g/kg dividida en cinco días) en casos resistentes193,194,196-198. | Moderada | Débil |
| Se recomienda el uso de metilprednisolona, CFM, AZA, o rituximab en casos de mielitis longitudinal extensa199,200. | Moderada | Fuerte |
| Corea y otros movimientos anormales involuntarios | ||
| Se sugiere el uso de AAS en la corea asociada a anticuerpos antifosfolípidos y anticoagulación si coexiste SAAF201-203. | Baja | Débil |
| Se recomienda la terapia sintomática con antagonistas de dopamina en caso de movimiento anormal involuntario201. | Moderada | Fuerte |
| Psicosis | ||
| Se recomienda usar prednisona 1 mg/kg/día durante ocho semanas con disminución gradual hasta 5 mg/día204. | Moderada | Fuerte |
| Se recomienda la terapia sintomática con antagonistas de dopamina205. | Moderada | Fuerte |
| Se recomienda de manera concomitante CFM IV mensual por seis meses204,206. | Moderada | Fuerte |
| Se sugiere utilizar rituximab o plasmaféresis en casos resistentes188. | Baja | Débil |
| Se sugiere el uso de inmunoglobulina intravenosa ante falla a todo lo anterior188. | Baja | Débil |
AAS: ácido acetilsalicílico; AZA: azatioprina; CFM: ciclofosfamida; GC: glucococorticoides; SAAF: síndrome de anticuerpos antifosfolípidos.
El espectro de las manifestaciones cardiopulmonares en los pacientes con LES es muy diverso, incluye desde afecciones leves, muchas veces subclínicas, como la pleuritis o la pericarditis, manifestaciones crónicas con impacto significativo en la calidad de vida tales como la neumonitis intersticial o la hipertensión arterial pulmonar (HAP), hasta eventos agudos y que ponen en peligro la vida como la hemorragia alveolar difusa207,208. La detección oportuna de estas manifestaciones obliga a tener un alto grado de sospecha clínica y, por supuesto, el tratamiento dependerá del tipo y gravedad de cada manifestación, pudiendo incluir desde un manejo sintomático hasta el uso de dosis altas de GC, inmunosupresores o incluso terapias biológicas. También se incluyen recomendaciones sobre tratamientos específicos como por ejemplo para HAP y se destaca la necesidad del manejo conjunto con cardiología y neumología209 (tabla 12).
Recomendaciones para el manejo de manifestaciones cardiopulmonares
| Recomendación | Calidad de evidencia | Fuerza de recomendación |
|---|---|---|
| Pericarditis | ||
| Se sugiere el uso de AINE en los casos de pericarditis leve, aguda o crónica, con o sin derrame, hasta la mejoría de los síntomas clínicos210,211. | Baja | Débil |
| En el caso de las pericarditis agudas o crónicas con derrame pericárdico, se recomienda el uso de prednisona en dosis 1 mg/kg/día en pacientes cuya manifestación inicial sea pericarditis de leve a moderada. En el caso de pericarditis grave o constrictiva se recomiendan pulsos de metilprednisolona211-215. | Moderada | Fuerte |
| En pacientes con pericarditis de reciente inicio o recurrente se sugiere el uso de 1 mg de colchicina en combinación con GC e inmunosupresores hasta alcanzar la remisión. Para evitar recaída se recomienda la adición de colchicina durante al menos un mes213,215,216. | Moderada | Débil |
| Punto de buena práctica. Está indicada la cirugía en caso de pericarditis resistente a tratamiento o taponamiento que no responda a tratamiento farmacológico. | ||
| Miocarditis | ||
| Se recomienda uso de pulsos de metilprednisolona en casos de miocarditis grave con arritmias y/o fracción de eyección ventricular de <55%, y tratamiento subsecuente con prednisona en dosis moderada a alta con reducción progresiva217. | Baja | Fuerte |
| Se sugiere el uso de HCQ o CLQ para la etapa de mantenimiento (salvo en casos de QT prolongado)217. | Baja | Débil |
| En el caso de manifestación grave con arritmias o fracción de eyección ventricular <40%, se sugiere el uso de CFM durante 3 a 10 meses como primera línea de tratamiento en forma conjunta con GC. Se sugiere evaluar respuesta a tres meses; si no hay mejoría, suspender para evitar riesgo de toxicidad; en caso de mejoría, se recomienda un mínimo de seis meses de tratamiento218. | Moderada | Débil |
| Se sugiere el uso de MFM como terapia de mantenimiento después de CFM, para reducir las recaídas217. | Moderada | Débil |
| Se sugiere el uso de AZA como terapia de mantenimiento después de CFM en aquellos pacientes con intolerancia a MFM217. | Baja | Débil |
| Se sugiere el uso de inmunoglobulina en aquellos pacientes con miocarditis complicadas que hayan fallado a la terapia de inducción estándar con GC y CFM217. | Baja | Débil217 |
| Hipertensión arterial pulmonar | ||
| Se recomienda uso de GC en dosis altas por cuatro semanas con reducción gradual219,220. | Moderada | Fuerte |
| Se recomienda el uso de pulsos de metilprednisolona en casos graves cuando coincidan con afección a otros órganos y en recaídas221,222. | Baja | Fuerte |
| Se recomienda el uso de CFM por 3 a 6 meses como tratamiento inmunosupresor asociado a GC, vasodilatadores, diuréticos y otras medidas de apoyo220,221,223. | Moderada | Fuerte |
| Se sugiere usar MFM como mantenimiento posterior a CFM o en caso de intolerancia o contraindicación a CFM222. | Baja | Débil |
| Se recomienda el uso de bosentan 62,5 mg dos veces al día por cuatro semanas y seguimiento con 125 mg dos veces al día por 3 a 12 meses en forma conjunta con GC e inmunosupresores como tratamiento de primera línea en pacientes con clase funcional II y III según la NYHA224-226. | Alta | Fuerte |
| Se recomienda el uso adicional de sildenafil, en dosis inicial de 20 mg tres veces al día, que se puede incrementar gradualmente a 80 mg tres veces al día de acuerdo con la tolerabilidad del paciente como tratamientoo de primera línea en pacientes con HAP y clase funcional II y III según la NYHA224,226. | Alta | Fuerte |
| Se sugiere considerar su uso en pacientes con clase funcional IV224,226-228. | Baja | Débil |
| Se sugiere el uso de selexipag en dosis de 200 a 600 mcg dos veces al día en pacientes con clase funcional I-II de la NYHA209. | Alta | Débil |
| Punto de buena práctica. En pacientes con clase funcional III y IV, según la clasificación de NYHA, el uso de epoprostenol y teprostinil deberá evaluarse de forma individual en conjunto con cardioneumología, así como el uso de terapia combinada con vasodilatadores, inhibidores de fosfodiesterasa y antagonistas de endotelina-1. | ||
| Pleuritis con o sin derrame pleural | ||
| Se recomienda el uso de AINE229,230. | Moderada | Fuerte |
| Se recomienda usar GC cuando no exista respuesta terapéutica con AINE por un lapso de 1 a 2 semanas, prednisona en dosis medias y reducción en un lapso de 2 a 3 semanas229,230. | Moderada | Fuerte |
| Punto de buena práctica. No existe suficiente evidencia sobre el uso de inmunosupresores en este contexto. | ||
| Neumonitis lúpica aguda | ||
| Se recomienda el uso de prednisona (1 mg/kg/día) por tres días y evaluar respuesta clínica; si no existe respuesta, considerar metiprednisolona IV por tres días231. | Moderada | Fuerte |
| Se sugiere considerar el uso de CFM (0,5 a 1 g/m2sc) mensual por 3 a 6 meses en casos resistentes al uso de GC231. | Baja | Débil |
| Se sugiere considerar inmunoglobulina para casos resistentes o con contraindicación para tratamiento con inmunosupresores230-232. | Baja | Débil |
| Neumopatía intersticial crónica | ||
| Se recomienda el uso de prednisona (0,5 a 1 mg/kg/día) de 2 a 4 semanas con reducción gradual233. | Moderada | Fuerte |
| Se recomienda CFM mensual por 6 a 12 meses en los casos graves232,233. | Moderada | Fuerte |
| Se sugiere rituximab en casos resistentes232,233. | Baja | Débil |
| Punto de buena práctica. Está indicada la suspensión del tabaquismo, considerar oxígeno suplementario y esquema de vacunación para influenza, neumococo, virus sincicial respiratorio y SARS-CoV-2232. | ||
| Hemorragia alveolar difusa | ||
| Se recomienda el uso de pulsos de metilprednisolona234,235. | Moderada | Fuerte |
| Se recomienda el uso de CFM mensual por 6 a 12 meses235,236. | Baja | Fuerte |
| Se recomienda el uso de MFM o AZA como terapia de mantenimiento234,236. | Baja | Fuerte |
| Se recomienda el uso de rituximab con CFM para casos resistentes237. | Baja | Fuerte |
| Se recomienda el uso de inmunoglobulina en casos resistentes al tratamiento previo236. | Baja | Fuerte |
| Se sugiere el uso de recambio plasmático (5 a 7 sesiones) en pacientes resistentes al tratamiento previo235,238. | Baja | Débil |
| Se sugiere considerar el uso de factor VIIa recombinante en casos resistentes237. | Baja | Débil |
| Punto de buena práctica. Realizar cultivos de secreción bronquial en caso de sospechar asociación con procesos infecciosos pulmonares236. | ||
AINE: antinflamatorios no esteroideos; AZA: azatioprina; CFM: ciclofosfamida; CLQ: cloroquina; GC: glucocorticoides; HAP: hipertensión arterial pulmonar; HCQ: hidroxicloroquina; MFM: micofenolato de mofetilo; NYHA: New York Heart Association.
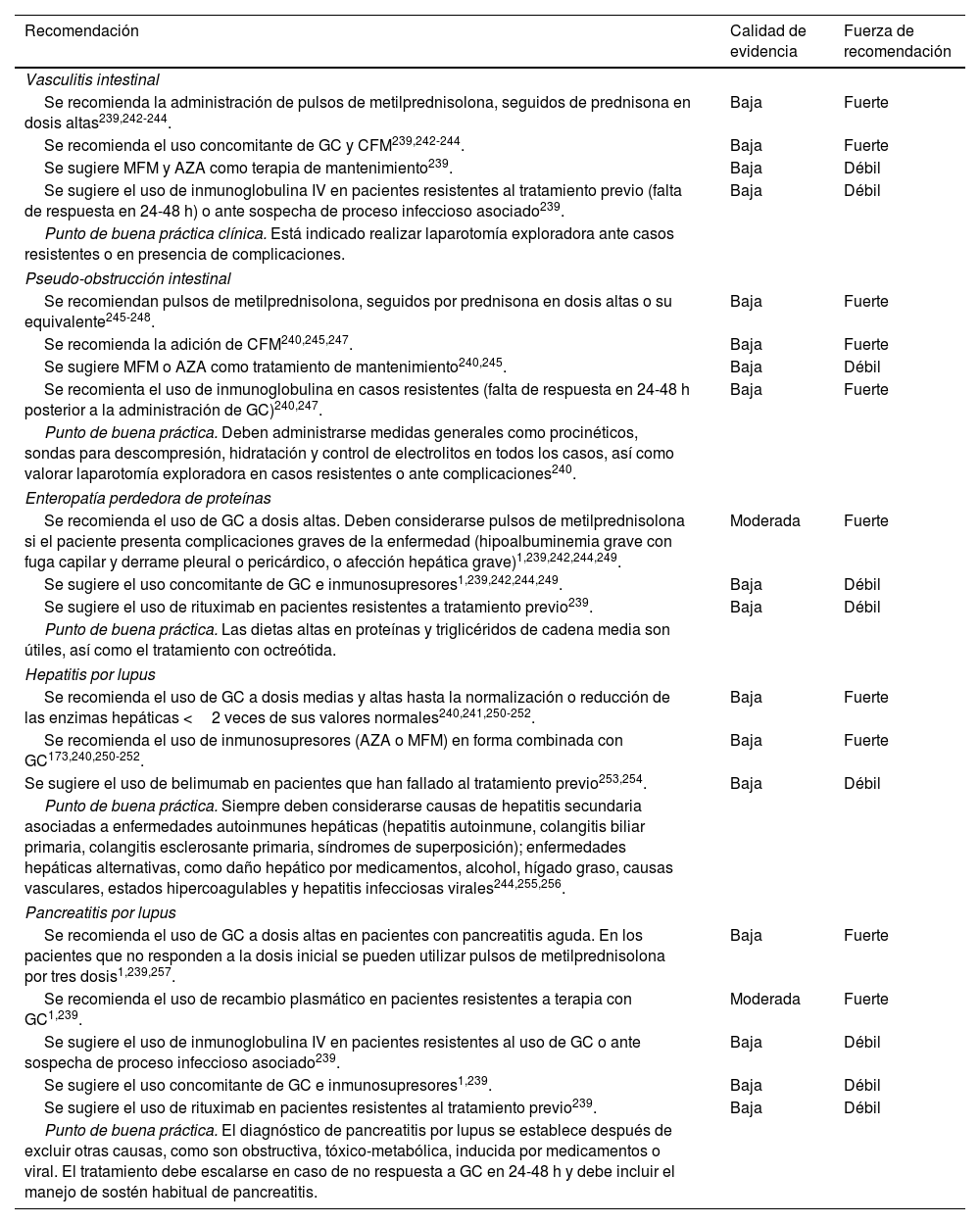
Las manifestaciones gastrointestinales y hepáticas son frecuentes en los pacientes con LES. Su evaluación y tratamiento son complejos porque muchas veces son multifactoriales. La afección gastrointestinal varía desde dispepsia asociada a fármacos hasta episodios de seudo-obstrucción intestinal y vasculitis graves239. En especial en el caso de la hepatitis y pancreatitis, estas pueden explicarse por actividad de la enfermedad, pero también pueden deberse a padecimientos autoinmunes primarios, eventos metabólicos, cuadros infecciosos o toxicidad por medicamentos239-241 (tabla 13).
Recomendaciones para el manejo de manifestaciones gastrointestinales
| Recomendación | Calidad de evidencia | Fuerza de recomendación |
|---|---|---|
| Vasculitis intestinal | ||
| Se recomienda la administración de pulsos de metilprednisolona, seguidos de prednisona en dosis altas239,242-244. | Baja | Fuerte |
| Se recomienda el uso concomitante de GC y CFM239,242-244. | Baja | Fuerte |
| Se sugiere MFM y AZA como terapia de mantenimiento239. | Baja | Débil |
| Se sugiere el uso de inmunoglobulina IV en pacientes resistentes al tratamiento previo (falta de respuesta en 24-48 h) o ante sospecha de proceso infeccioso asociado239. | Baja | Débil |
| Punto de buena práctica clínica. Está indicado realizar laparotomía exploradora ante casos resistentes o en presencia de complicaciones. | ||
| Pseudo-obstrucción intestinal | ||
| Se recomiendan pulsos de metilprednisolona, seguidos por prednisona en dosis altas o su equivalente245-248. | Baja | Fuerte |
| Se recomienda la adición de CFM240,245,247. | Baja | Fuerte |
| Se sugiere MFM o AZA como tratamiento de mantenimiento240,245. | Baja | Débil |
| Se recomienta el uso de inmunoglobulina en casos resistentes (falta de respuesta en 24-48 h posterior a la administración de GC)240,247. | Baja | Fuerte |
| Punto de buena práctica. Deben administrarse medidas generales como procinéticos, sondas para descompresión, hidratación y control de electrolitos en todos los casos, así como valorar laparotomía exploradora en casos resistentes o ante complicaciones240. | ||
| Enteropatía perdedora de proteínas | ||
| Se recomienda el uso de GC a dosis altas. Deben considerarse pulsos de metilprednisolona si el paciente presenta complicaciones graves de la enfermedad (hipoalbuminemia grave con fuga capilar y derrame pleural o pericárdico, o afección hepática grave)1,239,242,244,249. | Moderada | Fuerte |
| Se sugiere el uso concomitante de GC e inmunosupresores1,239,242,244,249. | Baja | Débil |
| Se sugiere el uso de rituximab en pacientes resistentes a tratamiento previo239. | Baja | Débil |
| Punto de buena práctica. Las dietas altas en proteínas y triglicéridos de cadena media son útiles, así como el tratamiento con octreótida. | ||
| Hepatitis por lupus | ||
| Se recomienda el uso de GC a dosis medias y altas hasta la normalización o reducción de las enzimas hepáticas <2 veces de sus valores normales240,241,250-252. | Baja | Fuerte |
| Se recomienda el uso de inmunosupresores (AZA o MFM) en forma combinada con GC173,240,250-252. | Baja | Fuerte |
| Se sugiere el uso de belimumab en pacientes que han fallado al tratamiento previo253,254. | Baja | Débil |
| Punto de buena práctica. Siempre deben considerarse causas de hepatitis secundaria asociadas a enfermedades autoinmunes hepáticas (hepatitis autoinmune, colangitis biliar primaria, colangitis esclerosante primaria, síndromes de superposición); enfermedades hepáticas alternativas, como daño hepático por medicamentos, alcohol, hígado graso, causas vasculares, estados hipercoagulables y hepatitis infecciosas virales244,255,256. | ||
| Pancreatitis por lupus | ||
| Se recomienda el uso de GC a dosis altas en pacientes con pancreatitis aguda. En los pacientes que no responden a la dosis inicial se pueden utilizar pulsos de metilprednisolona por tres dosis1,239,257. | Baja | Fuerte |
| Se recomienda el uso de recambio plasmático en pacientes resistentes a terapia con GC1,239. | Moderada | Fuerte |
| Se sugiere el uso de inmunoglobulina IV en pacientes resistentes al uso de GC o ante sospecha de proceso infeccioso asociado239. | Baja | Débil |
| Se sugiere el uso concomitante de GC e inmunosupresores1,239. | Baja | Débil |
| Se sugiere el uso de rituximab en pacientes resistentes al tratamiento previo239. | Baja | Débil |
| Punto de buena práctica. El diagnóstico de pancreatitis por lupus se establece después de excluir otras causas, como son obstructiva, tóxico-metabólica, inducida por medicamentos o viral. El tratamiento debe escalarse en caso de no respuesta a GC en 24-48 h y debe incluir el manejo de sostén habitual de pancreatitis. | ||
AZA: azatioprina; CFM: ciclofosfamida; GC: glucocorticoides; MFM: micofenolato de mofetilo.
Las evidencias actuales son claras respecto a que la mayoría de las vacunas son seguras y eficaces en los pacientes con lupus. A pesar de las controversias iniciales respecto a la posibilidad de una activación policlonal en los pacientes al ser vacunados, o las dudas respecto al nivel de seroprotección y seroconversión, está demostrado que el beneficio de la vacunación es mayor que el riesgo y actualmente se recomienda que todos los pacientes con lupus tengan un esquema de vacunación completo. Idealmente, las vacunas deben administrarse antes del inicio del tratamiento inmunosupresor, pero cuando esto no es posible deberán programarse en el momento más adecuado. Una situación especial la constituyen las vacunas de virus vivos atenuados, que pueden administrarse en pacientes con LES inactivo y que no reciben fármacos inmunosupresores258-261 (tabla 14).
Recomendaciones sobre vacunación
| Recomendación | Calidad deevidencia | Fuerza derecomendación |
|---|---|---|
| Se recomienda usar las siguientes vacunas en pacientes con LES: influenza (H1N1, H3N2, influenza tipo B)259,261-264, neumococo (vacuna conjugada pneumocócica heptavalente, vacuna antineumocócica conjugada PCV13 o vacuna antineumocócica polisacárida PPSV23)258,261,265,266, SARS-CoV-2 (ARNm)267,268, herpes zoster269-271, virus del papiloma humano (en menores de 45 años)272,273. | Moderada | Fuerte |
| Se sugiere vacunar contra hepatitis B en pacientes con LES inactivo260. | Moderada | Débil |
LES: lupus eritematoso sistémico.
La realización de procedimientos quirúrgicos en los pacientes con lupus requiere de especial atención porque con frecuencia estos pacientes son complejos desde el punto de vista médico por la actividad de la enfermedad, el daño potencial a diferentes órganos, las comorbilidades y el tratamiento inmunosupresor que reciben. Está demostrado que los pacientes con lupus sufren más complicaciones perioperatorias que la población general y es por ello que la cirugía en estos enfermos requiere, siempre que sea posible, de una planeación adecuada, ajuste del tratamiento y vigilancia cuidadosa durante y posterior al procedimiento, con un abordaje multidisciplinario. Las siguientes recomendaciones enfatizan los aspectos más importantes respecto al ajuste del tratamiento con GC, inmunosupresores y terapias biológicas durante el periodo perioperatorio274,275 (tabla 15).
Recomendaciones sobre manejo perioperatorio
| Recomendación | Calidad de evidencia | Fuerza de recomendación |
|---|---|---|
| Se sugiere continuar la misma dosis de metotrexato, antimaláricos y sulfasalazina durante el perioperatorio274,276-278. | Baja | Débil |
| En pacientes con lupus moderado que sean intervenidos con cirugía electiva, se recomienda suspender MFM, AZA y/o tacrolimus una semana antes de la cirugía y reiniciar en ausencia de infección o complicaciones en la cicatrización274,278-280. | Baja | Fuerte |
| En pacientes con lupus grave que sean intervenidos con cirugía electiva, se recomienda no suspender MFM, AZA y/o tacrolimus274,278-280. | Baja | Fuerte |
| En pacientes con tratamiento biológico con rituximab o belimumab, se recomienda retener la próxima dosis antes de la cirugía y reiniciar en ausencia de infección o complicaciones en la cicatrización281-284. | Baja | Fuerte |
| En pacientes con LES que reciben dosis moderadas o altas de GC, se recomienda utilizar dosis de estrés en el perioperatorio (50 mg de hidrocortisona cada 8 h)280. | Baja | Fuerte |
| En pacientes con LES que reciben dosis bajas de GC, no se sugiere utilizar dosis de estrés, siempre y cuando continúen su dosis habitual280. | Baja | Débil |
AZA: azatioprina; GC: glucocorticoides; LES: lupus eritematoso sistémico; MFM: micofenolato de mofetilo.
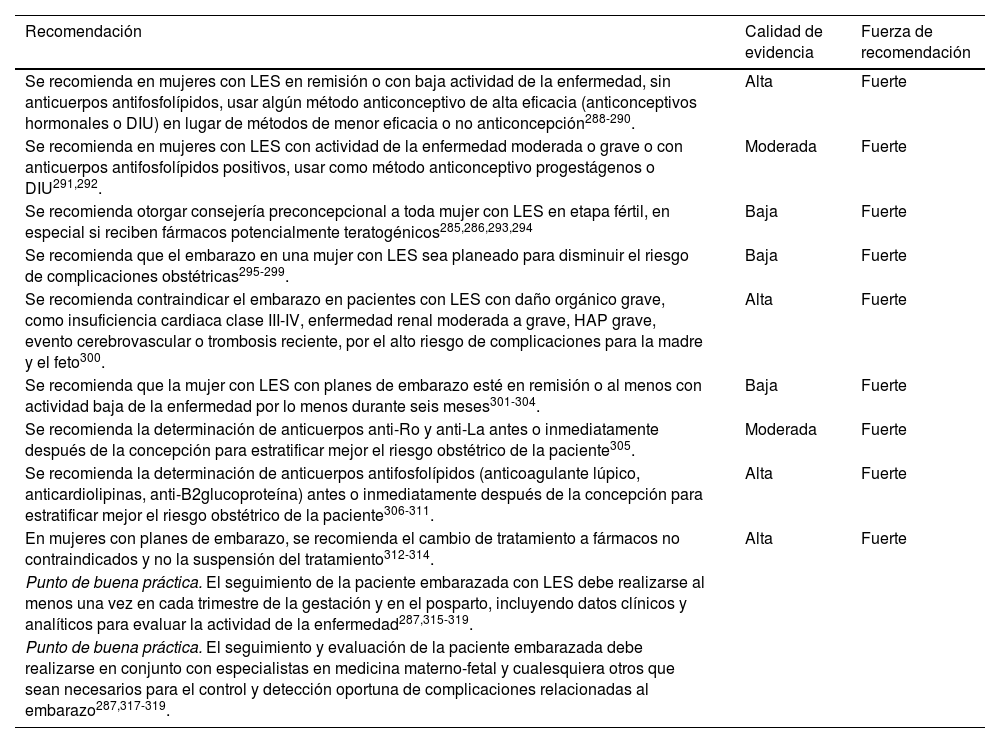
El periodo de embarazo y lactancia requiere de especial atención en las pacientes con LES asociado o no a síndrome de anticuerpos antifosfolípidos. Debido a que durante el embarazo son más frecuentes las recaídas de la enfermedad y a que existe un mayor riesgo de complicaciones tanto para la madre como para el producto, se incluyen en este documento las recomendaciones básicas para la planificación del embarazo, los métodos anticonceptivos adecuados, la vigilancia y el tratamiento de las mujeres durante este periodo285,286 (tabla 16).
Recomendaciones en el embarazo y lactancia
| Recomendación | Calidad de evidencia | Fuerza de recomendación |
|---|---|---|
| Se recomienda en mujeres con LES en remisión o con baja actividad de la enfermedad, sin anticuerpos antifosfolípidos, usar algún método anticonceptivo de alta eficacia (anticonceptivos hormonales o DIU) en lugar de métodos de menor eficacia o no anticoncepción288-290. | Alta | Fuerte |
| Se recomienda en mujeres con LES con actividad de la enfermedad moderada o grave o con anticuerpos antifosfolípidos positivos, usar como método anticonceptivo progestágenos o DIU291,292. | Moderada | Fuerte |
| Se recomienda otorgar consejería preconcepcional a toda mujer con LES en etapa fértil, en especial si reciben fármacos potencialmente teratogénicos285,286,293,294 | Baja | Fuerte |
| Se recomienda que el embarazo en una mujer con LES sea planeado para disminuir el riesgo de complicaciones obstétricas295-299. | Baja | Fuerte |
| Se recomienda contraindicar el embarazo en pacientes con LES con daño orgánico grave, como insuficiencia cardiaca clase III-IV, enfermedad renal moderada a grave, HAP grave, evento cerebrovascular o trombosis reciente, por el alto riesgo de complicaciones para la madre y el feto300. | Alta | Fuerte |
| Se recomienda que la mujer con LES con planes de embarazo esté en remisión o al menos con actividad baja de la enfermedad por lo menos durante seis meses301-304. | Baja | Fuerte |
| Se recomienda la determinación de anticuerpos anti-Ro y anti-La antes o inmediatamente después de la concepción para estratificar mejor el riesgo obstétrico de la paciente305. | Moderada | Fuerte |
| Se recomienda la determinación de anticuerpos antifosfolípidos (anticoagulante lúpico, anticardiolipinas, anti-B2glucoproteína) antes o inmediatamente después de la concepción para estratificar mejor el riesgo obstétrico de la paciente306-311. | Alta | Fuerte |
| En mujeres con planes de embarazo, se recomienda el cambio de tratamiento a fármacos no contraindicados y no la suspensión del tratamiento312-314. | Alta | Fuerte |
| Punto de buena práctica. El seguimiento de la paciente embarazada con LES debe realizarse al menos una vez en cada trimestre de la gestación y en el posparto, incluyendo datos clínicos y analíticos para evaluar la actividad de la enfermedad287,315-319. | ||
| Punto de buena práctica. El seguimiento y evaluación de la paciente embarazada debe realizarse en conjunto con especialistas en medicina materno-fetal y cualesquiera otros que sean necesarios para el control y detección oportuna de complicaciones relacionadas al embarazo287,317-319. |
DIU: dispositivo intrauterino; HAP: hipertensión arterial pulmonar; LES: lupus eritematoso sistémico.
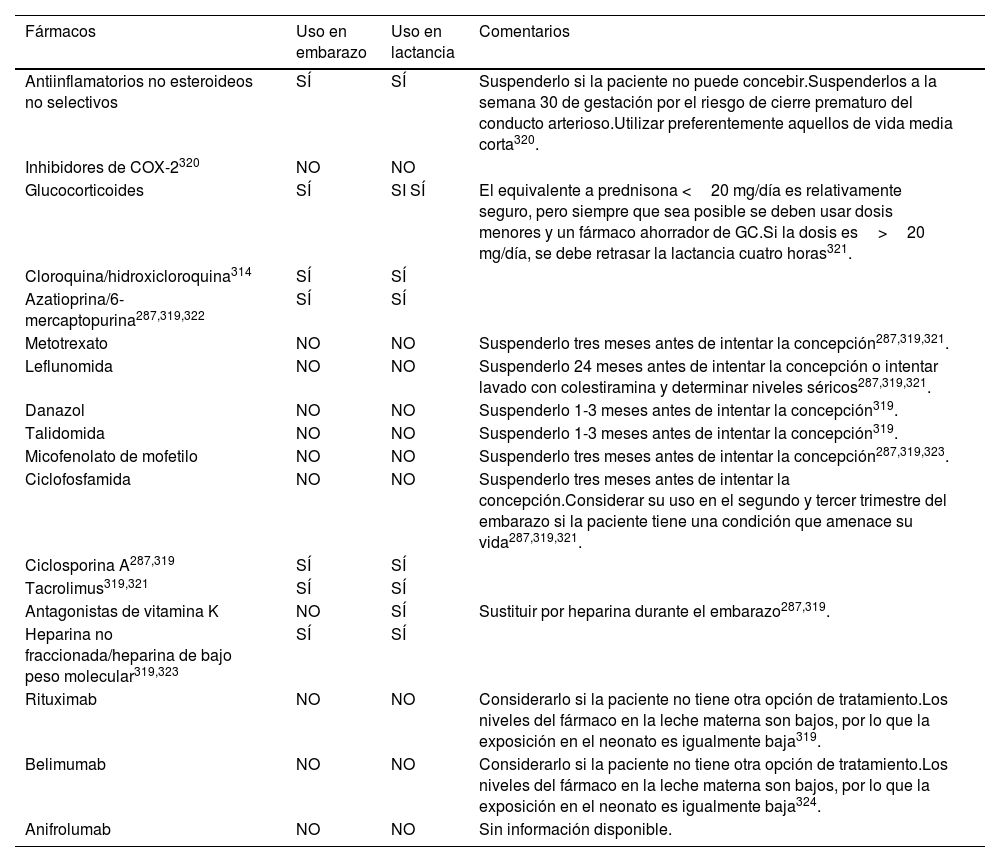
La tabla 17 resume la evidencia actual sobre seguridad de los principales fármacos empleados en esta enfermedad durante el embarazo y la lactancia. Para una descripción más extensa del tema refiérase a las GPC para el manejo del embarazo en mujeres con enfermedades reumatológicas autoinmunes287.
Uso de fármacos durante el embarazo y la lactancia en pacientes con LES
| Fármacos | Uso en embarazo | Uso en lactancia | Comentarios |
|---|---|---|---|
| Antiinflamatorios no esteroideos no selectivos | SÍ | SÍ | Suspenderlo si la paciente no puede concebir.Suspenderlos a la semana 30 de gestación por el riesgo de cierre prematuro del conducto arterioso.Utilizar preferentemente aquellos de vida media corta320. |
| Inhibidores de COX-2320 | NO | NO | |
| Glucocorticoides | SÍ | SI SÍ | El equivalente a prednisona <20 mg/día es relativamente seguro, pero siempre que sea posible se deben usar dosis menores y un fármaco ahorrador de GC.Si la dosis es>20 mg/día, se debe retrasar la lactancia cuatro horas321. |
| Cloroquina/hidroxicloroquina314 | SÍ | SÍ | |
| Azatioprina/6-mercaptopurina287,319,322 | SÍ | SÍ | |
| Metotrexato | NO | NO | Suspenderlo tres meses antes de intentar la concepción287,319,321. |
| Leflunomida | NO | NO | Suspenderlo 24 meses antes de intentar la concepción o intentar lavado con colestiramina y determinar niveles séricos287,319,321. |
| Danazol | NO | NO | Suspenderlo 1-3 meses antes de intentar la concepción319. |
| Talidomida | NO | NO | Suspenderlo 1-3 meses antes de intentar la concepción319. |
| Micofenolato de mofetilo | NO | NO | Suspenderlo tres meses antes de intentar la concepción287,319,323. |
| Ciclofosfamida | NO | NO | Suspenderlo tres meses antes de intentar la concepción.Considerar su uso en el segundo y tercer trimestre del embarazo si la paciente tiene una condición que amenace su vida287,319,321. |
| Ciclosporina A287,319 | SÍ | SÍ | |
| Tacrolimus319,321 | SÍ | SÍ | |
| Antagonistas de vitamina K | NO | SÍ | Sustituir por heparina durante el embarazo287,319. |
| Heparina no fraccionada/heparina de bajo peso molecular319,323 | SÍ | SÍ | |
| Rituximab | NO | NO | Considerarlo si la paciente no tiene otra opción de tratamiento.Los niveles del fármaco en la leche materna son bajos, por lo que la exposición en el neonato es igualmente baja319. |
| Belimumab | NO | NO | Considerarlo si la paciente no tiene otra opción de tratamiento.Los niveles del fármaco en la leche materna son bajos, por lo que la exposición en el neonato es igualmente baja324. |
| Anifrolumab | NO | NO | Sin información disponible. |
GC: glucocorticoides.
Es conocido que los pacientes con LES tienen un riesgo cardiovascular y cerebrovascular incrementado, que puede ser de más del doble que el de la población general y que es uno de los principales factores determinantes de morbimortalidad a largo plazo. Este mayor riesgo se explica por un proceso de ateroesclerosis acelerada de origen multifactorial en el que participan la disfunción endotelial, el daño inducido por autoanticuerpos, la inflamación crónica, los cambios en el perfil de lípidos y lipoproteínas, el aumento en los factores de riesgo tradicionales e incluso los efectos adversos del tratamiento con GC y AINE325-327. Por ello, en esta actualización de las recomendaciones de tratamiento del lupus se consideró indispensable incluir directrices sobre los mejores métodos de evaluación, prevención y tratamiento de los eventos cerebro y cardiovasculares (tabla 18).
Recomendaciones para disminuir el riesgo cardiovascular
| Recomendación | Calidad de evidencia | Fuerza de recomendación |
|---|---|---|
| Se recomienda evaluar el riesgo cardiovascular de acuerdo a las calculadoras de riesgo utilizadas para la población general en todos los pacientes con LES325-330. | Moderada | Fuerte |
| En pacientes con LES y riesgo cardiovascular moderado de acuerdo a las calculadoras de riesgo, se recomienda complementar el abordaje para la identificación de ateroesclerosis subclínica por medio de calcio coronario (CAC) o US carotídeo331,332. | Débil | Fuerte |
| En pacientes con LES y positividad de anticuerpos antifosfolípidos, se recomienda utilizar ácido acetilsalicílico para la prevención primaria333-337. | Baja | Fuerte |
| En pacientes con LES y evidencia de ateroesclerosis subclínica (identificada por CAC o US carotídeo) se sugiere utilizar estatinas para reducir la progresión331,332,338-340. | Alta | Débil |
LES: lupus eritematoso sistémico; US: ultrasonido.
El tratamiento de una enfermedad tan compleja como el LES se beneficia, sin duda, de guías de tratamiento que orienten a los reumatólogos y demás médicos tratantes, respecto a las mejores opciones de manejo para los pacientes con un enfoque personalizado.
Ante el avance del conocimiento y la aparición de nuevas opciones terapéuticas para el tratamiento del LES, esta nueva versión de las guías del Colegio Mexicano de Reumatología es el resultado de un trabajo colaborativo de un grupo amplio de reumatólogos expertos en el tema, que, después de revisar en forma sistemática la evidencia más reciente en la literatura, emiten recomendaciones que actualizan los lineamientos terapéuticos para las manifestaciones en los diferentes órganos y sistemas afectados por la enfermedad con base en el conocimiento más reciente.
Al incluir en estas recomendaciones principios generales sobre el manejo de la enfermedad, se enfatiza el papel del reumatólogo como líder en el tratamiento de estos pacientes, los conceptos generales que deben regir el tratamiento, teniendo siempre una estrategia con objetivos definidos (T2T), y la importancia de que el tratamiento se elija en acuerdo con el paciente considerando el perfil de beneficio/riesgo individual.
Se destaca la importancia del uso de antimaláricos siempre que no exista una contraindicación como una estrategia para controlar la enfermedad, evitar recaídas, ahorrar GC y reducir el riesgo cardiovascular. Es muy clara la necesidad de usar los GC en forma más racional, con dosis adecuadas al inicio según la manifestación y reducción lo más rápida posible, debido a las evidencias de asociación entre uso de esteroides y daño a largo plazo.
El uso oportuno de los modificadores del curso de la enfermedad o de inmunosupresores indicados según las distintas manifestaciones del padecimiento; o, incluso de terapia múltiple en el caso de la nefritis lúpica, tiene cada vez más evidencia en la literatura. Esta estrategia permite un control mejor y más rápido de la actividad de la enfermedad, favoreciendo también el ahorro de GC. Se incluyeron recomendaciones sobre el uso de nuevos fármacos como la voclosporina y otros, que han demostrado su eficacia en el tratamiento del lupus.
Actualmente, es más claro el papel que tiene la terapia biológica, aunada al tratamiento estándar e incluso en un futuro como primera línea de tratamiento, para diversas manifestaciones del lupus, por lo que se actualizaron las recomendaciones al respecto de belimumab, anifrolumab y rituximab.
La actualización aborda aspectos especiales primordiales en el tratamiento del lupus como es el tratamiento integral durante el embarazo y lactancia, así como los medicamentos seguros durante este periodo, el ajuste terapéutico durante el periodo perioperatorio y las indicaciones actuales de vacunación.
Por último, es bien conocido el mayor riesgo cardiovascular de los pacientes con lupus, explicado por un proceso de ateroesclerosis acelerada causado por el fenómeno inflamatorio de la enfermedad en sí, los factores de riesgo tradicional y como efecto secundario al uso de GC. Por ello, se incluyeron recomendaciones generales para abordar el riesgo cardiovascular.
Se pretende que estas guías actualizadas sobre el tratamiento del LES constituyan una herramienta valiosa y útil no solo para los médicos especialistas en cuanto a las decisiones de tratamiento de pacientes individuales, sino como orientación para médicos de primer contacto o de otras especialidades que en ocasiones deben iniciar o modificar tratamientos, así como referir a los pacientes a los especialistas en reumatología. Sin duda, es deseable que constituyan también la base para implementar políticas de atención en salud a nivel institucional y gubernamental para los pacientes con LES.
Por supuesto, aún existen áreas de oportunidad y los reumatólogos debemos estar preparados para enfrentarlas. Nuevas evidencias en relación con el diagnóstico de la enfermedad, los marcadores de respuesta terapéutica y el diseño de estrategias farmacológicas que permitan alcanzar la remisión, esta última una definición dinámica y que sin duda se modificará rápidamente, combinado con el creciente papel de la inteligencia artificial en el análisis de datos y el diseño farmacológico, presagian un futuro interesante y complejo para pacientes y especialistas, reto que deberemos asumir juntos.
FinanciaciónPara la realización de estas guías se recibió financiamiento irrestricto por parte de Astra Zeneca y GlaxoSmithKline.
Conflicto de interesesDeshire Alpizar-Rodriguez realizó trabajo previo con GSK México.
Lilia Andrade-Ortega fue conferencista o advisor para Astra Zeneca y GSK.
Sandra M. Carrillo-Vázquez fungió como conferencista para Abbvie, Asofarma, Astra-Zeneca, GSK, Novartis y UCB.
Sergio Durán-Barragán fue ponente para Amgen, Janssen, Novartis y Abbvie, también fue investigador principal en ensayos clínicos con Lilly, Janssen, Novartis, Pfizer, Glaxo, Abbvie, Biogen, BMS, Astra Zeneca, Merck Serono y UCB.
Fedra Irazoque-Palazuelos fue asesora y conferencista para Abbvie, Lilly y Janssen.
Javier Merayo-Chalico fungió como conferencista para Abbvie, Astra Zeneca y Janssen.
Sandra Sicsik-Ayala fue ponente para Abbvie, Lilly, UCB, Janssen y Roche.
Luis H. Silveira fungió como ponente para Johnson & Johnson, Teva y Novartis.
Daniel Xibillé-Friedmann fue conferencista y asesor para Astra Zeneca y Lilly, y realizó ensayos clínicos con BMS e IDORSIA.
El resto de los autores manifiesta no tener conflictos de interés en relación con el tema.
A la Dra. Marcela Pérez Rodríguez y a la Dra. Ivonne Roy García por su coordinación en el aspecto metodológico de estas guías.