Las terapias biológicas antifactor de necrosis tumoral (TNF) son ampliamente utilizadas para tratar enfermedades inflamatorias, como la artritis reumatoide (AR) y las espondiloartropatías (EspA)1. Se administran por vía subcutánea (sbc) o intravenosa (iv), lo cual influye sobre su biodisponibilidad. En la administración sbc hay 2 aspectos a considerar: sitio y técnica de inyección2-5, los cuales son clave para la correcta administración de las inyecciones; por ello, el entrenamiento del paciente por parte del personal de enfermería es esencial para la autoadministración de los anti-TNF por vía sbc.
El grosor del tejido celular subcutáneo (TCS) puede influir sobre la adecuada distribución de los fármacos en el organismo. Su grosor se ve afectado por: edad, sexo e índice de masa corporal (IMC)2,4-6, estos son importantes para determinar el sitio y la técnica de inyección para cada paciente. En el caso de la diabetes mellitus en pacientes insulinodependientes, existe una amplia disponibilidad de longitudes de aguja para los dispositivos de autoadministración, dependiendo del grosor del TCS, como ha sido previamente descrito en diversas publicaciones. No hay estudios, sin embargo, sobre este tema en las enfermedades reumatológicas subsidiarias de tratamiento con fármacos anti-TNF sbc. La técnica de inyección correcta facilita que el anti-TNF sbc se deposite en TCS y no en tejido intramuscular (IM) o intradérmico.
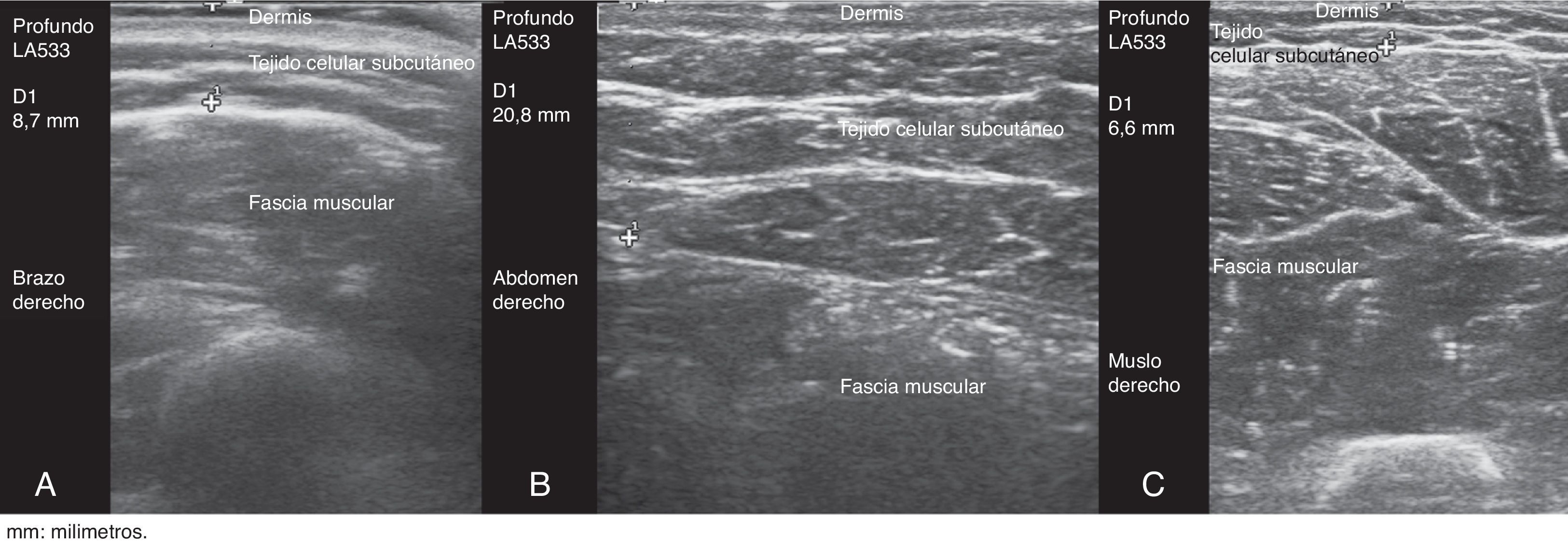
Este estudio prospectivo observacional transversal incluyó a 117 pacientes con AR (n=59) y EspA (n = 58) en tratamiento con anti-TNF sbc, autoadministrado por el paciente durante mínimo 6 meses. En todos los pacientes se midió el grosor del TCS en los sitios recomendados para la inyección sbc (brazos, abdomen, muslos), independientemente del sitio de preferencia para la autoadministración, utilizando ecografía en escala de grises (ecógrafo equipado con transductor lineal multifrecuencia de 6-18MHz). La medición ecográfica del TCS se realizó siempre con el mismo método: paciente en posición de sedestación, y aplicación de gel entre la sonda y la piel para evitar la compresión del TCS por la sonda (fig. 1); la sonda se colocó de forma transversal y longitudinal, del lado derecho e izquierdo, en los sitios recomendados para la inyección sbc. Posteriormente, calculamos la media entre ambas mediciones.
Los resultados se presentan como media ± desviación típica (DT) para variables cuantitativas y como frecuencias absolutas y porcentajes para las variables cualitativas. La comparación entre grupos independientes para variables cuantitativas se realizó por medio de la prueba t cuando se trataba de dos grupos y del ANOVA de un factor con la prueba de Tukey o la prueba de Kruskal-Wallis con la prueba de Mann-Whitney con corrección de Bonferroni para determinar los pares discrepantes, dependiendo de la asunción o el rechazo del supuesto de normalidad, respectivamente, cuando se trataba de 3 grupos. La asociación lineal entre variables independientes se estableció por medio del coeficiente de correlación de Pearson. La hipótesis de independencia para variables cualitativas se puso a prueba con la prueba exacta de Fisher cuando se trataba de 2 variables dicotómicas y con el test de la chi al cuadrado cuando alguna de las variables tenía más de 2 categorías. Se desarrollaron modelos logísticos como desenlaces dicotómicos de remisión clínica/no remisión según criterios DAS28-PCR. Se analizaron: edad, IMC, espesor del TCS en abdomen, brazos y muslos, tiempo desde el diagnóstico y en tratamiento con anti-TNF (etanercept, adalimumab, otros [por motivos de tamaño pequeño de la muestra se analizaron conjuntamente aquellos pacientes tratados con golimumab y certolizumab pegol]), tratamiento con fármacos modificadores de enfermedad concomitantes. Se presentan las odds ratio con su intervalo de confianza del 95%. Los valores p≤0,05 se consideraron significativos. Los análisis estadísticos fueron realizados con el paquete estadístico SPSS v15.0.
Por razones de tamaño muestral, nuestros pacientes fueron evaluados en conjunto (AR y EspA) según anti-TNF utilizado. Cincuenta y nueve (50,5%) pacientes estaban diagnosticados de AR y 58 (49,5%) pacientes de EspA. Los pacientes estudiados estaban en tratamiento con: etanercept 56 (47,9%) pacientes, adalimumab 52 (44,4%), golimumab 7 (6%) y certolizumab pegol 2 (1,7%). Ochenta y dos (70%) pacientes se autoadministraban el anti-TNF en el abdomen, 23 (19,7%) en el muslo y 12 (10,3%) en el brazo.
La mayoría de los pacientes fueron mujeres (n=61, 52,1%). La media ± DT (rango) de edad fue 52,77 ± 13,28 (24-82) años, de peso 74,01 ± 15,19 (46-125) kg, de talla 1,65 ± 0,08 (1,43-1,84) m, y de IMC 27 ± 4,75 (18,44-41,58) kg/m2. Se evaluó la respuesta clínica al anti-TNF utilizando criterios de remisión o actividad según: Disease Activity Score (DAS) 28 proteína C reactiva (PCR) para los pacientes con AR y Ankylosing Spondylitis Disease Activity Score (ASDAS) para los pacientes con EspA. Se consideró remisión para AR un DAS28<2,6 y no remisión DAS28 ≥ 2,6 y remisión para EspA un ASDAS<1,3 y no remisión ASDAS ≥ 1,3.
El grosor medio del TCS fue significativamente mayor en el abdomen (media±DT, 24,7±14,3mm) que en el muslo (11,6±4,9mm) y que en el brazo (9,1±4,5mm) (p<0,0005).
El lugar de la inyección se asoció significativamente a la actividad clínica de la enfermedad medida por DAS28-PCR/ASDAS. El porcentaje de pacientes con enfermedad activa fue significativamente mayor en aquellos que se autoadministraban el anti-TNF en el brazo (n=9; 75,0% de los pacientes) que en los que se autoadministraban el anti-TNF en el abdomen (n=33; 40,2% de los pacientes) o en el muslo (n=4; 17,4% de los pacientes) (p=0,004).
El grosor del TCS puede ser importante para seleccionar la longitud de la aguja y la técnica de inyección7-9, para asegurar la entrada del fármaco a TCS y no IM8,10, que a su vez influye en la respuesta terapéutica. La ecografía de alta frecuencia permite mediciones directas del grosor de TCS en cualquier sitio anatómico y es inofensivo, fácil y rápido. Nuestros resultados mostraron un porcentaje significativamente menor de remisión en el grupo que se autoadministraba anti-TNF en brazo (n=12), con un grosor significativamente menor del TCS (grosor TCS brazo en mm; media±DT, 7,5±2,3).
Proponemos la medición ecográfica del grosor del TCS en los pacientes que inician un anti-TNF o ante cambios de peso para seleccionar adecuadamente el sitio de inyección.
Conflicto de interesesLara Valor ha recibido honorarios como conferenciante de Abbvie, Roche Farma, Bristol-Myers Squibb and Pfizer.
Inmaculada de la Torre es desde febrero del 2013 un médico europeo que trabaja para la Eli-Lilly & Co.
Esperanza Naredo ha recibido honorarios como conferenciante de Abbvie, Roche Farma, Bristol-Myers Squibb, Pfizer, UCB, el General Electric Healthcare y Esaote. Esperanza Naredo ha recibido financiación de la investigación de UCB y MSD.
Agradecemos la participación de todos los pacientes sin los cuales este estudio no hubiera sido posible y a Jesús Garrido por su asistencia estadística.