Tocilizumab (TCZ) es un anticuerpo monoclonal humanizado dirigido contra el receptor de la interleucina-6 (IL-6) desarrollado entre la farmacéutica japonesa Chugai y la suiza Roche. En Japón tiene ya indicación para la enfermedad de Castleman, artritis reumatoide (AR) y artritis idiopática juvenil. El desarrollo clínico fuera de Japón es muy extenso y ha demostrado eficacia en los escenarios posibles de la AR, AR precoz (parte del estudio AMBITION), AR establecida refractaria a metotrexato (OPTION) y a otros fármacos modificadores de enfermedad (TOWARD) y AR refractaria a anti-TNF-α (RADIATE), tanto con TCZ en monoterapia (estudio AMBITION) como asociado a fármacos de fondo. También se ha comprobado la eficacia radiológica (LITHE). En consecuencia el TCZ es probablemente el fármaco biológico con el desarrollo clínico más extenso habiéndose aprobado su comercialización por la agencia europea del medicamento con las siguientes indicaciones: TCZ en combinación con MTX está indicado para el tratamiento de la AR activa de moderada a grave en pacientes adultos que han presentado una respuesta inadecuada o fueron intolerantes a terapia previa con uno ó más FAMEs o antagonistas del TNF. En estos pacientes TCZ puede ser administrado en monoterapia, en caso de intolerancia a MTX, o cuando el tratamiento prolongado con MTX es inapropiado. En esta revisión nos centraremos especialmente en la eficacia clínica, radiológica, así como en el perfil de seguridad.
Tocilizumab (TCZ) is a humanized monoclonal antibody which targets the receptor for IL-6, developed by the Japanese pharmaceutical company Chugai and the swiss company Roche. In Japan it is already under use for Castleman's disease, rheumatoid arthritis (RA) and Juvenile Idiopathic Arthritis. The clinical development outside Japan is very extensive and has shown efficacy in possible RA scenarios; early RA (part of the AMBITION study), established, MTX-resistant RA (OPTION) and RA resistant to other DMARD (TOWARD), and anti-TNF-α resistant RA (RADIATE). Both monotherapy with TCZ (AMBITION) and associated to other background drugs. Radiological efficacy has also been proven (LITHE). So TCZ is probably the biologic therapy with the most extensive clinical development before marketing in the western hemisphere. In this review we will specifically deal with clinical and radiological efficacy, as wel as its safety profile.
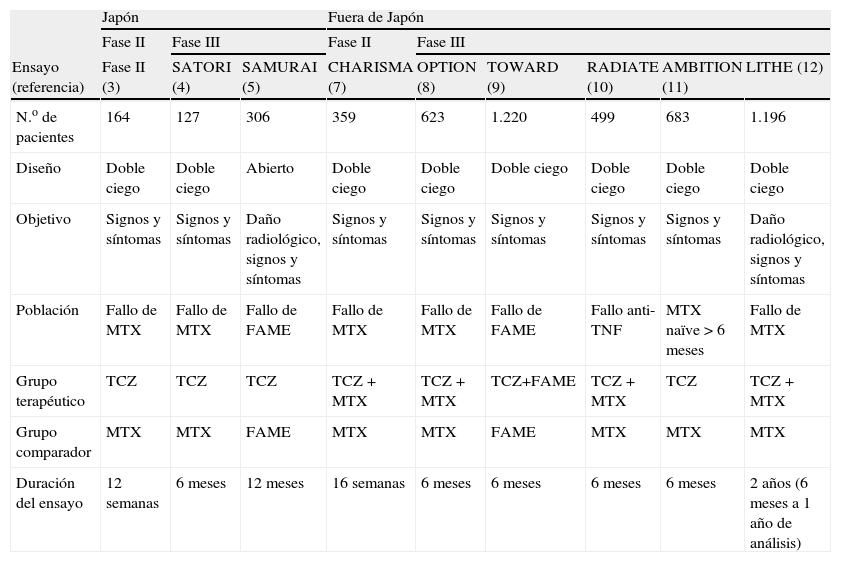
Tocilizumab (TCZ) es un anticuerpo monoclonal humanizado dirigido contra el receptor, tanto soluble como de membrana, de la interleucina-6 (IL-6). Se ha desarrollado conjuntamente entre la Universidad de Osaka, la farmacéutica japonesa Chugai y la suiza Roche. En Japón tiene indicación para la enfermedad de Castleman desde abril de 2005 y para la artritis reumatoide (AR) y artritis idiopática juvenil (AIJ) abril de 2006. Esto implica que para la AR dispongamos de estudios clínicos desarrollados dentro y fuera de Japón (tabla 1)1–12. El desarrollo clínico del TCZ en la AR en Japón es sensiblemente diferente por ejemplo, se realiza generalmente en monoterapia2–6.
Estudios clínicos más importantes de tocilizumab en artritis reumatoide
| Japón | Fuera de Japón | ||||||||
| Fase II | Fase III | Fase II | Fase III | ||||||
| Ensayo (referencia) | Fase II (3) | SATORI (4) | SAMURAI (5) | CHARISMA (7) | OPTION (8) | TOWARD (9) | RADIATE (10) | AMBITION (11) | LITHE (12) |
| N.o de pacientes | 164 | 127 | 306 | 359 | 623 | 1.220 | 499 | 683 | 1.196 |
| Diseño | Doble ciego | Doble ciego | Abierto | Doble ciego | Doble ciego | Doble ciego | Doble ciego | Doble ciego | Doble ciego |
| Objetivo | Signos y síntomas | Signos y síntomas | Daño radiológico, signos y síntomas | Signos y síntomas | Signos y síntomas | Signos y síntomas | Signos y síntomas | Signos y síntomas | Daño radiológico, signos y síntomas |
| Población | Fallo de MTX | Fallo de MTX | Fallo de FAME | Fallo de MTX | Fallo de MTX | Fallo de FAME | Fallo anti-TNF | MTX naïve > 6 meses | Fallo de MTX |
| Grupo terapéutico | TCZ | TCZ | TCZ | TCZ + MTX | TCZ + MTX | TCZ+FAME | TCZ + MTX | TCZ | TCZ + MTX |
| Grupo comparador | MTX | MTX | FAME | MTX | MTX | FAME | MTX | MTX | MTX |
| Duración del ensayo | 12 semanas | 6 meses | 12 meses | 16 semanas | 6 meses | 6 meses | 6 meses | 6 meses | 2 años (6 meses a 1 año de análisis) |
anti-TNF: anti-tumor necrosis factor ‘antifactor de necrosis tumoral’; FAME: fármacos modificadores de enfermedad; MTX: metotrexato; TCZ: tocilizumab.
En cambio, fuera de Japón, el programa clínico es mucho más extenso(1,7–12), habiéndose demostrado eficacia clara en los tres escenarios de la AR; AR precoz (rama del AMBITION), AR establecida refractaria a metotrexato (MTX) (CHARISMA, OPTION) y a otros fármacos modificadores de la enfermedad (FAMEs) (TOWARD), y AR refractaria a fármacos anti-TNF-α (RADIATE), tanto con TCZ en monoterapia (AMBITION), como asociado a MTX u otros FAMEs.
Todo esto conlleva que TCZ sea probablemente el fármaco biológico con el mayor programa de desarrollo clínico en AR (tabla 1), mostrando un buen perfil de eficacia y seguridad. En esta revisión nos centraremos en los aspectos más relevantes sobre la eficacia clínica, radiológica, así como en el perfil de seguridad.
Eficacia clínica: farmacocinética y estudios en fase i-ii, ii y iiiFarmacocinética y estudios en fase i-iiEl primer estudio aleatorizado, doble ciego, con TCZ es un fase i/ii y se desarrolla en el Reino Unido en AR y demuestra la eficacia en la segunda semana con una infusión única endovenosa (ev) de TCZ a distintas dosis1. Pero los estudios farmacocinéticos iniciales, especialmente dirigidos a la búsqueda de la dosis y pauta más adecuada, proceden de un ensayo abierto japonés de fase i-ii2. Éste se realizó en pacientes con AR a los que se les prescribieron 3 dosis ev repetidas de 2, 4 u 8mg/kg de peso corporal TCZ en intervalos de 2 semanas. Se comprobó que la vida media (t12) del TCZ se ampliaba al aumentar la dosis y con la repetición de las mismas. Así, tras la tercera infusión de 8mg/kg de TCZ la t12 se aproximó a 240h, cercana a la t12 de la inmunoglobulina G1 humana. Además, sólo con estas dosis más altas se normalizaban reactantes de fase aguda, como la proteína C reactiva (PCR) y el amiloide A. La PCR y el amiloide A séricos son proteínas en fase aguda producidas por el hígado como respuesta al estímulo de IL-6, IL-1 y TNF13,14. Los inhibidores del TNF, como el infliximab y el etanercept, también reducen la PCR, pero sólo en una proporción limitada de pacientes llega a ser totalmente normal15. Esto se debe a que probablemente la producción de muchos de los reactantes en fase aguda necessite de IL-6, y que ésta sea el mediador más importante en su regulación13,14. Se necesita una cierta concentración de TCZ sérico para inhibir las acciones de IL-6 y en ese sentido la PCR puede servir como indicador indirecto de las concentraciones plasmáticas de TCZ2. Por tanto, desde el punto de vista farmacocinético, infusiones de dosis altas de TCZ (8mg/kg) y repetidas parecen ser las más adecuadas2.
Estudios en fase iiComo complemento del anterior estudio, se desarrolla un ensayo clínico japonés doble ciego, aleatorizado, en fase ii y se comprueba la eficacia y seguridad de 3 infusiones ev de 4 y de 8mg/kg de TCZ, pero cada 4 semanas3. Se concluye que, incluso en monoterapia, una dosis de 8mg/kg ev cada 4 semanas parece el régimen terapéutico más óptimo.
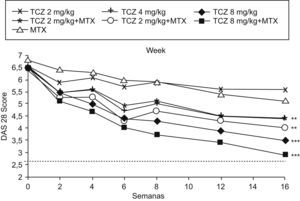
Pero es el estudio fase ii CHARISMA (Chugai Humanised Anti-human Recombinant Interleukin-Six Monoclonal Antibody) el más relevante7. De diseño multicéntrico, doble ciego, aleatorizado, es el único de los que se hace referencia en la tabla 1 que se llevó a cabo exclusivamente en Europa. Todos los pacientes tenían una AR con respuesta inadecuada a MTX a dosis estable durante al menos 4 semanas antes de la aleatorización. En cambio, en los siguientes estudios en fase iii se exigió una dosis estable de MTX al menos 8 semanas para corregir el posible efecto terapéutico del grupo placebo (grupo de MTX) observado en el estudio CHARISMA. Desde el punto de vista de la eficacia y seguridad del estudio CHARISMA se pueden obtener conclusiones muy interesantes al disponer de 7 brazos terapéuticos: 6 con dosis distintas de TCZ ev (2, 4 y 8mg/kg) cada 4 semanas en monoterapia o en combinación con MTX y un grupo con placebo sólo con MTX (grupo comparador).
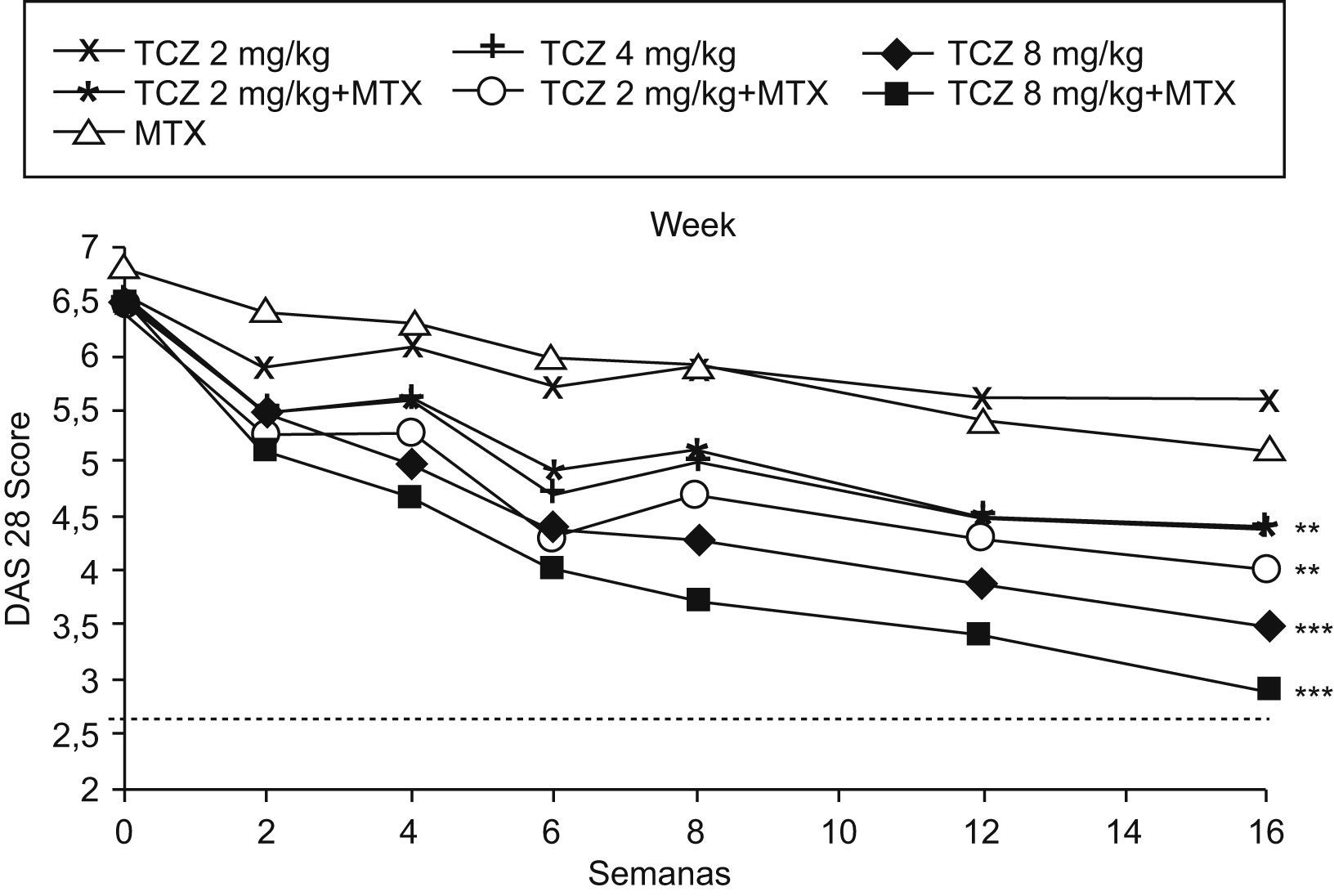
El objetivo primario del estudio fue la respuesta ACR (Colegio Americano de Reumatología) 20 en la semana 16, resultando respecto a los pacientes tratados con placebo más MTX, significativamente superior en el grupo de monoterapia con dosis de 4 y 8mg/kg de TCZ y en los 3 grupos con MTX y TCZ combinado (2, 4 y 8mg/kg). Pero el ACR50 y el ACR70 fueron significativamente más eficaces sólo en el grupo de tratamiento combinado con dosis de 8mg/kg de TCZ más MTX. Por tanto, las infusiones de TCZ (8mg/kg) cada 4 semanas combinadas con MTX lograron una mejoría significativa en todas las respuestas del ACR20, ACR50 y ACR70. Paralelamente, todos los grupos tratados con TCZ solo o combinado con MTX mostraron un mayor descenso del DAS28, siendo nuevamente el grupo de TCZ (8mg/kg) asociado a MTX en el que se obtuvo la reducción máxima del DAS28, alcanzándose en el 34% de los pacientes la remisión definida por la DAS28 (fig. 1)7.
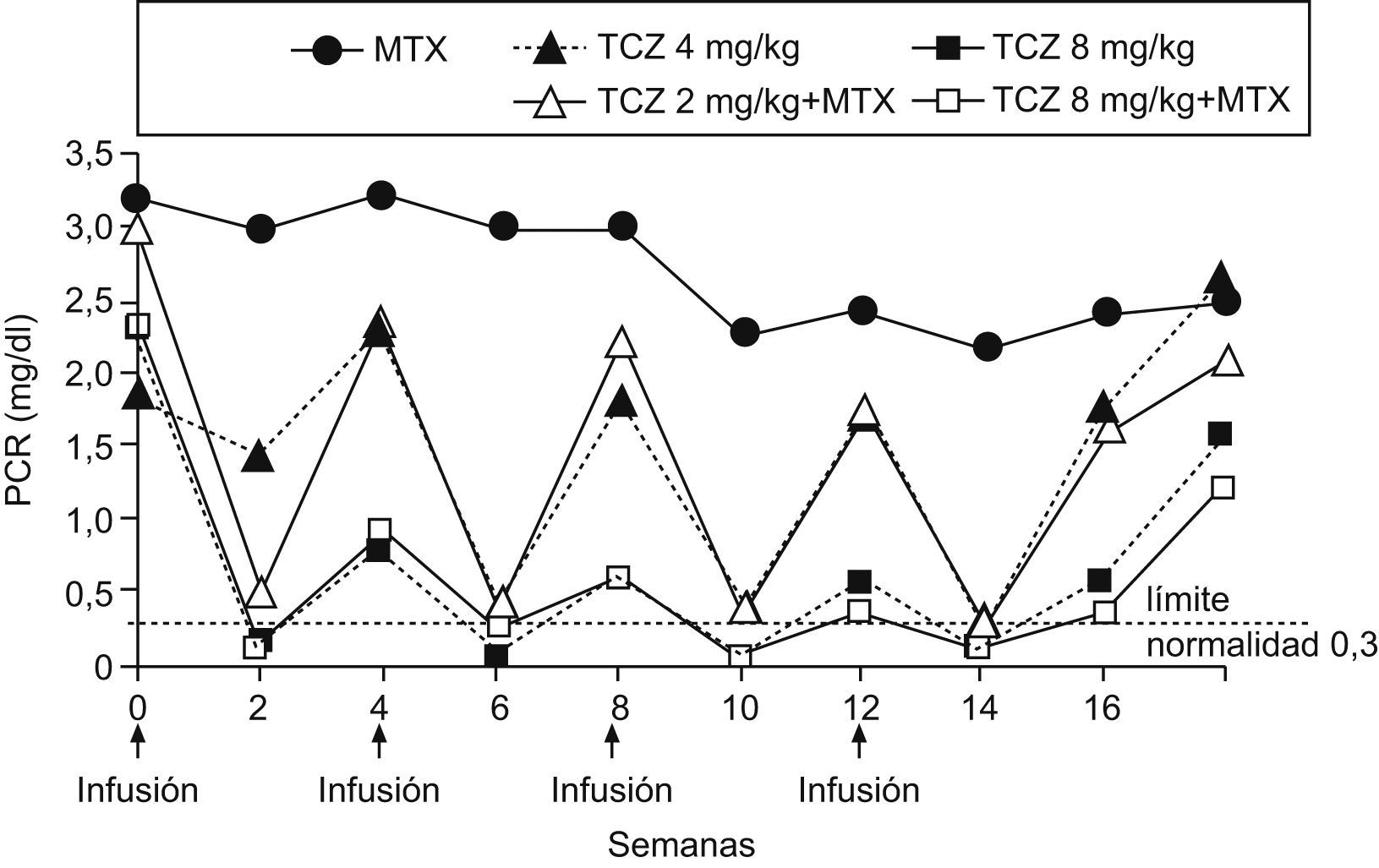
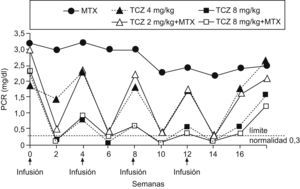
Las alteraciones analíticas de la AR están principalmente en relación con la capacidad de las citocinas proinflamatorias, en especial la IL-6, de producir reactantes de fase aguda hepáticos13,14. La corrección de la PCR mostró un modelo casi matemático, en «dientes de sierra», claramente relacionado con la dosis del TCZ e independiente del MTX (fig. 2). Se observó un descenso rápido tras la administración de TCZ ya a las 2 semanas, que es el período mínimo del que disponemos de analítica. Nuevamente, se observa que la dosis de 8mg/kg de TCZ (independiente de MTX) es la que produce un descenso más mantenido de ésta. Los cambios en la VSG, como era de esperar, aunque eficaces, son menos bruscos que en la PCR y nuevamente son mejores con las dosis mayores de TCZ13. Respecto a la anemia en la AR, se cree que uno de sus mecanismos esenciales es la hiperproducción de hepcidina, también reactante de fase aguda hepático, trascendental en la fisiología del hierro, ya que bloquea la ferroportina que es la «puerta» de entrada del hierro al torrente sanguíneo tanto desde el enterocito, una vez producida su absorción, como desde el almacén corporal de hierro (sistema retículo endotelial) para la eritropoyesis medular16. Probablemente la corrección de la anemia por TCZ se deba a la corrección de la hiperhepcidemia. Otros parámetros analíticos también se normalizaron progresivamente, como ferritina sérica, amiloide A, fracción 4 del complemento (C4), fibrinógeno, neutrófilos y plaquetas. También se observó que el perfil de seguridad de TCZ fue adecuado, como se comentará más adelante7.
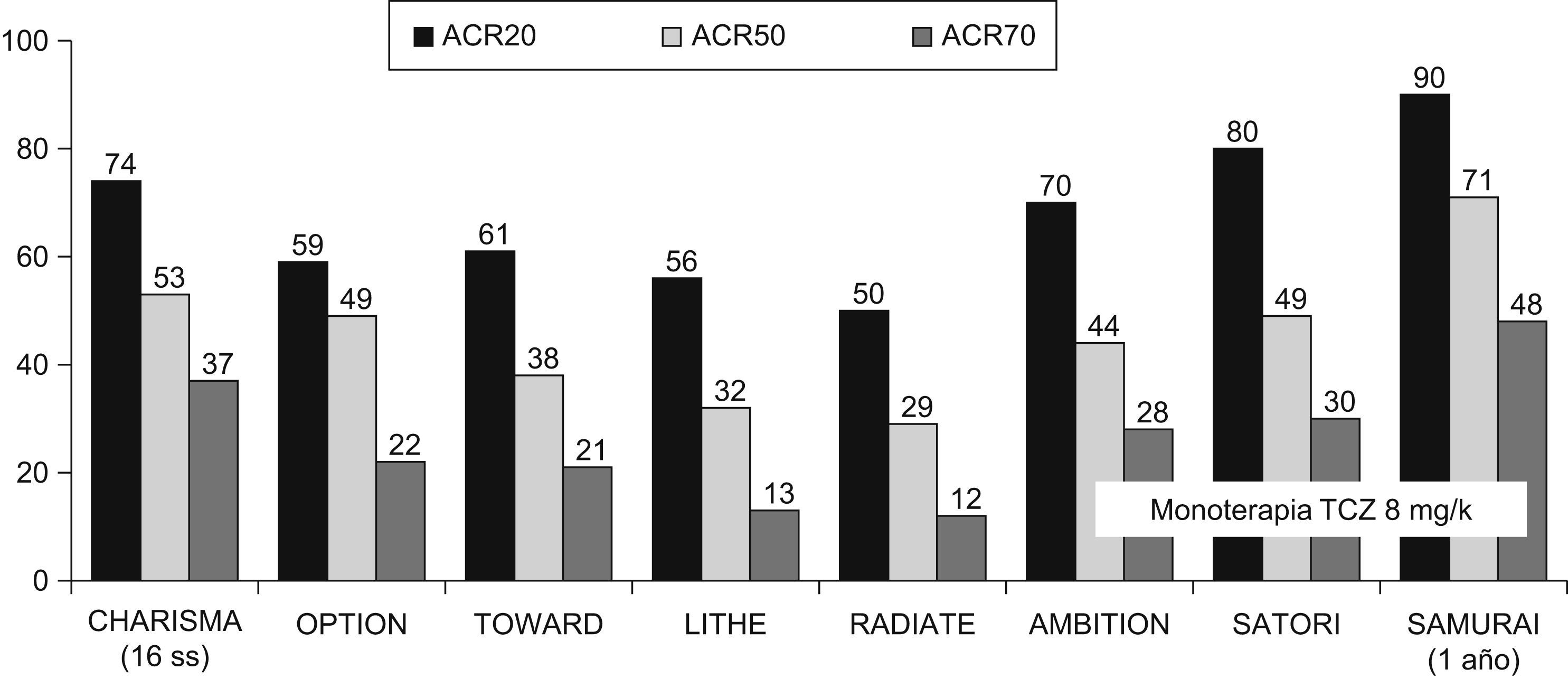
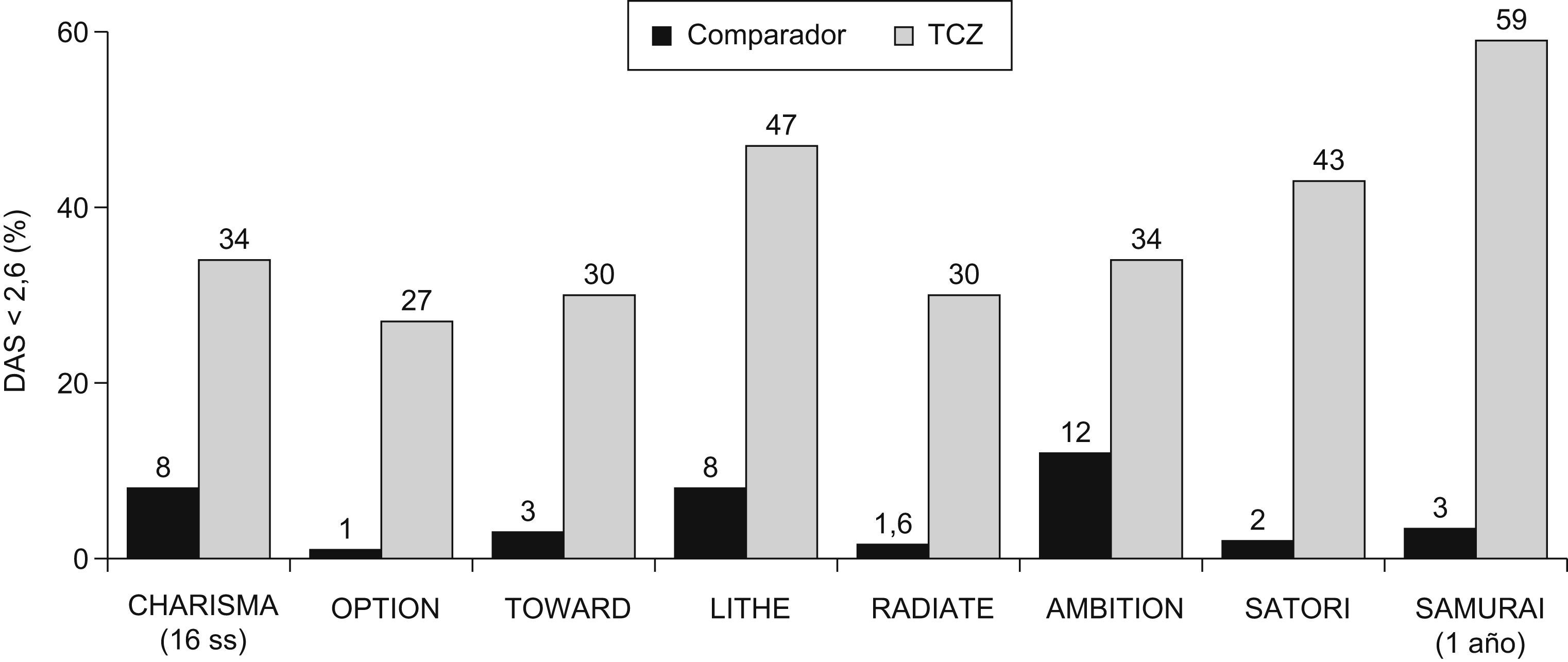
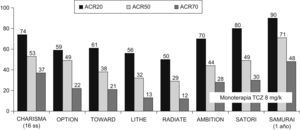
Estudios en fase iiiEstos datos preliminares en fase i-ii y ii fueron ratificados en estudios en fase iii. Fuera de Japón disponemos de 5 ensayos doble ciego (tabla 1)8–12, de los cuales 3 están ya publicados (OPTION, TOWARD y RADIATE)8–10 y los 2 últimos (AMBITION y LITHE)11,12 comunicados en los últimos congresos de Reumatología. Como mencionábamos, disponemos de estudios en los escenarios posibles de la AR. Se demuestra la eficacia de TCZ combinado con MTX u otros FAMEs, o en monoterapia, tanto en AR precoces como en AR establecidas, En los ensayos en fase iii se restringen los brazos terapéuticos a los de mayor eficacia y, además del grupo placebo, las ramas terapéuticas de TCZ son sólo la de 8mg/kg ev cada 4 semanas en los estudios TOWARD y AMBITION, y además la de 4mg/kg en los estudios OPTION, RADIATE y LITHE. En general, a las 24 semanas el objetivo primario que es la respuesta ACR20 oscila entre el 70% del estudio AMBITION y el 50% del estudio RADIATE (fig. 3), diferencias esperables, considerando las poblaciones de AR tan distintas de las que se trata (tabla 1). Los resultados de remisión clínica, que en los estudios con TCZ han utilizado la DAS28 inferior a 2,6, son igualmente óptimos oscilando alrededor de un 30% en la semana 24 incluyendo los pacientes con AR refractarias a anti-TNF del estudio RADIATE (fig. 4). Otra peculiaridad del TCZ es que se obtiene una respuesta clínica relativamente precoz ya a las 2 semanas, que es la primera evaluación clínica y analítica, y que con el paso del tiempo los datos de eficacia medida tanto como mejoría del ACR como en índices de remisión suelen aumentar progresivamente7–12,17. Otros parámetros habituales medidos como la mejoría del HAQ (Cuestionario de Evaluación de la Salud) y la FACIT (Evaluación terapéutica funcional para enfermedades crónicas) también mostraron eficacia terapéutica7–12.
Proporción de pacientes con respuestas ACR (Colegio Americano de Reumatología) 20, ACR50 y ACR70 en diferentes estudios con tocilizumab (TCZ) en artritis reumatoide. Los resultados se observaron después de 24 semanas, excepto en el estudio CHARISMA que se realizó a las 16 semanas y en el estudio SAMURAI que lo realizó después de un año. Se expresan los resultados del mejor grupo terapéutico de cada estudio, TCZ (en dosis de 8mg/kg cada 4 semanas por vía intravenosa) asociado a metotrexato o en su caso a los fármacos modificadores de enfermedad. Los estudios AMBITION, SATORI y SAMURAI, al ser en monoterapia, expresan los resultados del grupo TCZ en dosis de 8mg/kg.
Proporción de pacientes en remisión clínica (puntuación de la actividad de la enfermedad 28<2,6). Los resultados se observaron después de 24 semanas, excepto en el estudio CHARISMA que se realizó después de las 16 semanas y en los estudios LITHE y SAMURAI que se realizaron después de un año. Se expresan los resultados del mejor grupo terapéutico de cada estudio, el tocilizumab (TCZ) (en dosis de 8mg/kg cada 4 semanas por vía intravenosa) asociado a metotrexato o en su caso a fármacos modificadores de enfermedad. Los estudios AMBITION, SATORI y SAMURAI, al ser en monoterapia, expresan los resultados del grupo TCZ en dosis de 8mg/kg.
Los resultados del estudio OPTION y TOWARD son superponibles a los del estudio CHARISMA. El estudio RADIATE consigue remisiones en el grupo terapéutico de TCZ (8mg/kg) asociado a MTX de un 30% de los pacientes refractarios a anti-TNF (fig. 4), incluso en los refractarios a 2 o 3 anti-TNF10. Hasta el momento, los fármacos biológicos con indicación en AR refractaria a anti-TNF (Rituximab y Abatacept), independientemente de tratarse de estudios diferentes, obtienen resultados sensiblemente inferiores al menos de remisión (alrededor del 10%)18,19. El estudio AMBITION obtiene también resultados interesantes11. TCZ en monoterapia demuestra una eficacia clínica (ACR20, ACR50, ACR70, HAQ y remisión del DAS28) claramente superior a MTX, lo cual es diferente de lo que ocurre habitualmente con los agentes anti-TNF. Recordemos que la eficacia clínica en estudios como el TEMPO (Etanercept) o PREMIER (Adalimumab) el anti-TNF es claramente superior cuando se combina con MTX, y disminuye en monoterapia20,21. Un resultado esperable del estudio AMBITION es que en el subgrupo con AR de duración menor de 2 años, se consiguieron unos índices de remisión muy superiores a los de duración mayor de 2 años, tanto con TCZ como en el grupo de MTX.
Los estudios en fase iii japoneses SATORI y SAMURAI, ambos con TCZ en monoterapia, obtienen resultados superiores a MTX y FAMEs, respectivamente (figs. 3 y 4). Recordemos que el manejo terapéutico de la AR en Japón es sensiblemente distinto al que se realiza en Europa y EEUU así, entre otras, la dosis máxima recomendada de MTX es 8mg por semana22.
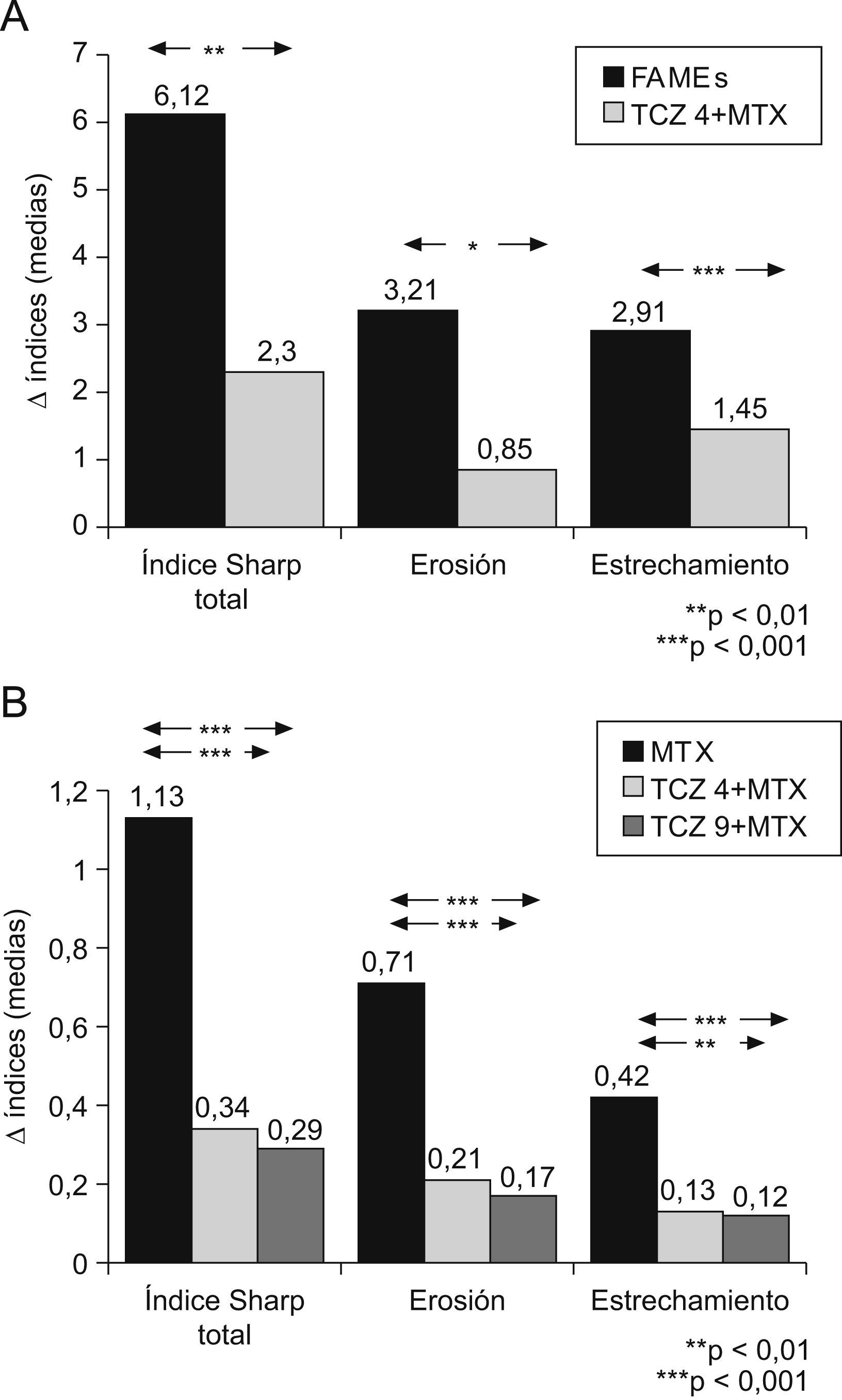
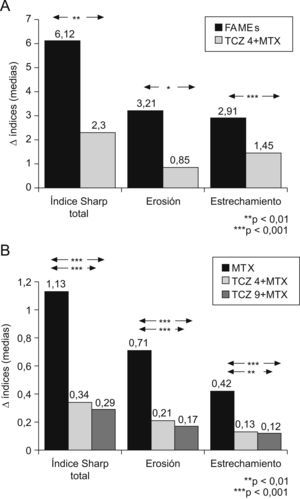
Eficacia radiológicaLa eficacia de TCZ en el daño estructural se evalúa en 2 estudios clínicos, el SAMURAI y el LITHE5,12. En el estudio SAMURAI la valoración radiológica se realiza mediante el índice de Sharp modificado. El grupo terapéutico de TCZ en dosis de 8mg/kg en monoterapia comparado con FAMEs tradicionales mostró en la semana 52 una menor progresión estadísticamente significativa, tanto en el índice de Sharp total como en sus componentes de erosión y pinzamiento articular (fig. 5A). Además, una menor proporción de pacientes del grupo de TCZ mostró progresión radiológica5. Estos resultados beneficiosos se mantienen a los 3 años6. En el estudio LITHE, se comparan también a 52 semanas las 2 ramas de tratamiento con TCZ (4 y 8 mg/kg) combinado con MTX con el grupo placebo (MTX). Se utiliza el índice de Sharp modificado por Genant. También se observa una menor evolución estadísticamente significativa en los 2 grupos terapéuticos de TCZ en el índice total, así como en sus componentes (fig. 5B)12.
A) Incremento en el índice de Sharp modificado por Van der Heijde del estudio SAMURAI a las 52 semanas. Se compara tocilizumab (TCZ) en dosis de 8mg/kg en monoterapia con los fármacos modificadores de enfermedad tradicionales. B) Incremento en índice de Sharp modificado por Genant del estudio LITHE a las 52 semanas. Se comparan TCZ en dosis de 4mg/kg y en dosis de 8mg/kg combinados con metotrexato (MTX) con el grupo placebo (MTX).
Paralelamente, en el estudio OPTION, se comprueba que TCZ, especialmente en dosis de 8mg/kg y combinado con MTX, reduce rápida y eficazmente los marcadores bioquímicos de resorción ósea, recambio cartilaginoso y metaloproteinasas de la matriz de tipo 323.
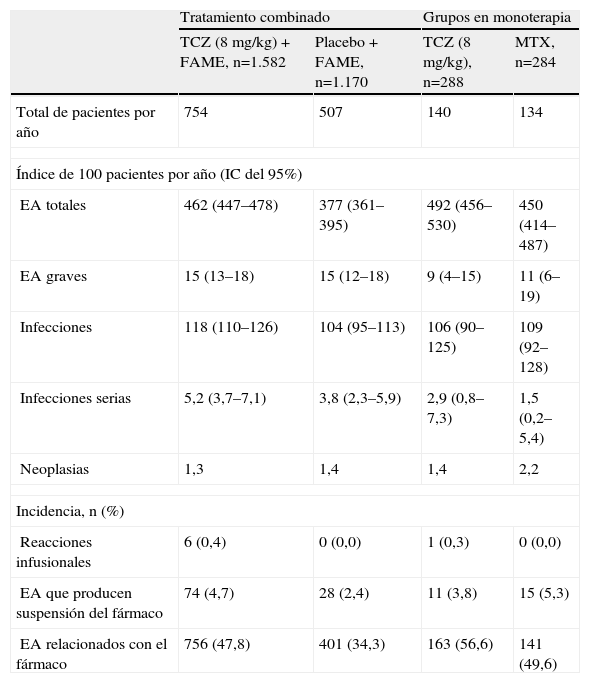
Efectos secundariosLos resultados de los diferentes ensayos clínicos demuestran que TCZ es un fármaco seguro y bien tolerado4–12. La mayoría de los efectos adversos fueron leves o moderados, siendo los más frecuentes las infecciones de vías respiratorias altas. Los resultados combinados sobre seguridad de los cinco estudios fase iii realizados fuera de Japón, que tienen una duración de 24 semanas, se han comunicado recientemente (tabla 2)24. También se dispone de datos combinados de cuatro de estos ensayos clínicos, ya en su fase abierta, a más largo plazo (mediana de seguimiento de 18 meses)25. Comentaremos a continuación ratifican los resultados de seguridad de los ensayos individuales y además se comprueba que los efectos adversos no aumentan, e incluso disminuyen, a partir de las 24 semanas25. En cualquier caso, no se observan diferencias en la tasa de efectos adversos serios entre los grupos de tratamiento con TCZ y los grupos control4–12,24,25. Se han descrito casos aislados de perforación intestinal, que están en estudio actualmente25. Comentaremos a continuación los efectos secundarios más relevantes.
Principales efectos adversos de distintos estudios clínicos de tocilizumab en artritis reumatoide. Se presentan los datos combinados de 5 ensayos clínicos en fase iii después de las 24 semanas: OPTION, TOWARD, RADIATE, AMBITION y LITHE
| Tratamiento combinado | Grupos en monoterapia | |||
| TCZ (8mg/kg) + FAME, n=1.582 | Placebo + FAME, n=1.170 | TCZ (8mg/kg), n=288 | MTX, n=284 | |
| Total de pacientes por año | 754 | 507 | 140 | 134 |
| Índice de 100 pacientes por año (IC del 95%) | ||||
| EA totales | 462 (447–478) | 377 (361–395) | 492 (456–530) | 450 (414–487) |
| EA graves | 15 (13–18) | 15 (12–18) | 9 (4–15) | 11 (6–19) |
| Infecciones | 118 (110–126) | 104 (95–113) | 106 (90–125) | 109 (92–128) |
| Infecciones serias | 5,2 (3,7–7,1) | 3,8 (2,3–5,9) | 2,9 (0,8–7,3) | 1,5 (0,2–5,4) |
| Neoplasias | 1,3 | 1,4 | 1,4 | 2,2 |
| Incidencia, n (%) | ||||
| Reacciones infusionales | 6 (0,4) | 0 (0,0) | 1 (0,3) | 0 (0,0) |
| EA que producen suspensión del fármaco | 74 (4,7) | 28 (2,4) | 11 (3,8) | 15 (5,3) |
| EA relacionados con el fármaco | 756 (47,8) | 401 (34,3) | 163 (56,6) | 141 (49,6) |
EA: efectos adversos; FAME: fármacos modificadores de enfermedad; IC: intervalo de confianza; MTX: metotrexato; TCZ: tocilizumab.
La infección grave es el efecto adverso serio más habitual; sin embargo, su frecuencia fue relativamente baja en todos los grupos terapéuticos (tabla 2)24,25. Se observa un discreto aumento en el grupo de TCZ combinado con FAME, aunque con superposición de los intervalos de confianza (IC) entre los distintos grupos. El índice de infección grave [100 pacientes-años (95% IC)] es de 5,2 (rango de 3,7-7,1)24, que es similar al comunicado con los agentes anti-TNF26. Con los datos disponibles a 18 meses no se observa incremento del riesgo al aumentar el tiempo de exposición a TCZ, si no incluso su disminución.25. Los únicos factores que predisponen al desarrollo de infección grave fueron edad superior o igual a 65 años, diabetes mellitus, historia de infección previa y el uso de esteroides27. Las infecciones graves más frecuentes fueron las neumonías, celulitis, herpes zóster, gastroenteritis y diverticulitis25. Las infecciones por gérmenes oportunistas fueron excepcionales, incluso las micobacterias24,25,27. Los estudios en AIJ han demostrado que los pacientes con TCZ pueden ser efectivamente inmunizados con la vacuna de virus influenza28.
NeoplasiasEl análisis combinado de los datos disponibles no demuestra aumento de las neoplasias con TCZ (tabla 2)24,25.
Reacciones infusionalesLas reacciones infusionales a TCZ fueron en general leves, transitorias, bien toleradas y no causaron el abandono del estudio. Las náuseas, el exantema, la hipertensión, la cefalea y el prurito son las reacciones observadas más frecuentemente. Por otra parte, TCZ se asocia a una producción baja de autoanticuerpos y de inmunogenicidad29. La presencia de HAHA (human anti-human antibodies) fue rara y su presencia no aumenta con TCZ en monoterapia.
Alteraciones analíticasNeutropeniaUn efecto peculiar del TCZ es la neutropenia, que suele ser leve, transitoria y no asociada a infecciones24,25,27. Es un efecto relativamente frecuente y un 38% de los pacientes con TCZ tiene una cifra inferior a 2,0 × 109/l, aunque en menos del 1% es inferior a 0,5 × 109/l. En cualquier caso, el análisis de los pacientes con neutropenia demostró que ésta no se relaciona con el incremento de los procesos infecciosos27. La neutropenia está relacionada con la dosis de TCZ y es independiente del MTX7. Se cree que más que un efecto adverso se trata de un efecto farmacodinámico, debido a que la IL-6 fisiológicamente aumenta la cifra circulante de neutrófilos al disminuir su reserva marginal30, por lo que su inhibición con TCZ puede producir el efecto contrario.
Elevación de las enzimas hepáticasSe pueden observar elevaciones transitorias en la alanina- ALT, AST y la bilirrubina total. El aumento de ALT y AST se observa más frecuentemente en el grupo de TCZ a dosis altas, especialmente si se combina con MTX7,31. En cambio, la elevación con TCZ en monoterapia es similar a la observada con MTX también en monoterapia31. La mayoría de los aumentos de aminotransferasas fueron leves (inferior a 3 veces el valor límite), puntuales y no se relacionaron con la elevación de la bilirrubina. No se describieron casos de hepatitis o disfunción hepática. Aunque se desconoce el mecanismo, se sabe que la IL-6 tiene una acción antiapoptótica hepática fisiológica, por lo que favorece su regeneración32.
Alteración del perfil lipídicoEl tratamiento con TCZ se asoció al aumento del colesterol total, LDL HDL, los triglicéridos, la apolipoproteína A1 y B, y del cociente LDL/HDL24,25,33. Este aumento es precoz y mantenido sin elevaciones adicionales posteriores. La elevación simultánea del HDL es un hecho diferencial con el patrón lipídico de las dislipidemias habituales en las que se reduce, y contribuye a la corrección del perfil aterogénico. El tratamiento concomitante con estatinas mejora el perfil lipídico34. La elevación de los distintos lípidos es paralela al descenso de marcadores de inflamación como PCR, amiloide A, haptoglobinas y lipoproteína A33. Es un hecho bien conocido que el proceso inflamatorio se relaciona con el desarrollo de aterosclerosis. El balance de todos estos factores (alteración lipídica y mejoría de parámetros inflamatorios) en los accidentes cardiovasculares es desconocido actualmente. Aunque en los resultados de los distintos ensayos, los pacientes con TCZ no presentaron más accidentes cardiovasculares24,25. Alteraciones similares del perfil lipídico y correctoras del proceso inflamatorio están también descritas con los agentes anti-TNF35–37. El efecto global con estos últimos fármacos también permanece en estudio, pero está descrita una disminución sustancial de los accidentes cardiovasculares, como el infarto agudo de miocardio, en los pacientes con respuesta terapéutica38.
Para concluir, en el momento de escribir esta revisión tras la aprobación de la agencia europea del medicamento y en espera de la publicación de datos a más largo plazo, se añade un nuevo fármaco biológico al arsenal terapéutico de la AR dirigido a una nueva diana terapéutica. Infusiones ev de 8mg/kg de TCZ cada 4 semanas en monoterapia o combinadas con MTX u otros FAMEs parecen la pauta más adecuada y con un perfil de seguridad adecuado. Es igualmente eficaz en los pacientes refractarios a los FAMEs tradicionales como a los anti-TNF, con índices de remisión clínica a los 6 meses de un 30%.