El interés científico en la biología del tejido adiposo blanco (TAB) se ha incrementado desde el descubrimiento de la leptina en 1994. La descripción de los efectos de la leptina (el producto del gen ob) ha empezado a aclarar el papel del tejido adiposo en la fisiopatología de las enfermedades relacionadas con la obesidad y ha ayudado a la identificación de otras muchas moléculas (denominadas adipocinas), algunas de ellas de naturaleza proinflamatoria. En las enfermedades reumáticas, las adipocinas derivadas del TAB están entre los factores más importantes relacionados con la obesidad que promueven las enfermedades inflamatorias o autoinmunes. En esta revisión se recopilarán los avances más recientes en la investigación sobre las adipocinas, y se prestará particular atención al papel de la leptina, la adiponectina, la resistina y la visfatina en enfermedades inflamatorias, autoinmunes y reumáticas.
Scientific interest in the biology of white adipose tissue (WAT) has increased since the discovery of leptin in 1994. The description of the effects of leptin, the product of the ob gene, has started to clarify the role of adipose tissue in the physiopathology of obesity related diseases and has helped in the identification of a great number of other molecules (named adipocytokines), some of them with a proinflammatory nature. In rheumatic diseases, adipocytokines derived from the WAT are among the most important factors related to obesity and promote inflammatory and/or autoimmune conditions. In this review we will present the most recent advances in adipocytokine research, with special attention to the role of leptin, adiponectin, resistin and visfatin and inflammatory, autoimmune and rheumatic diseases.
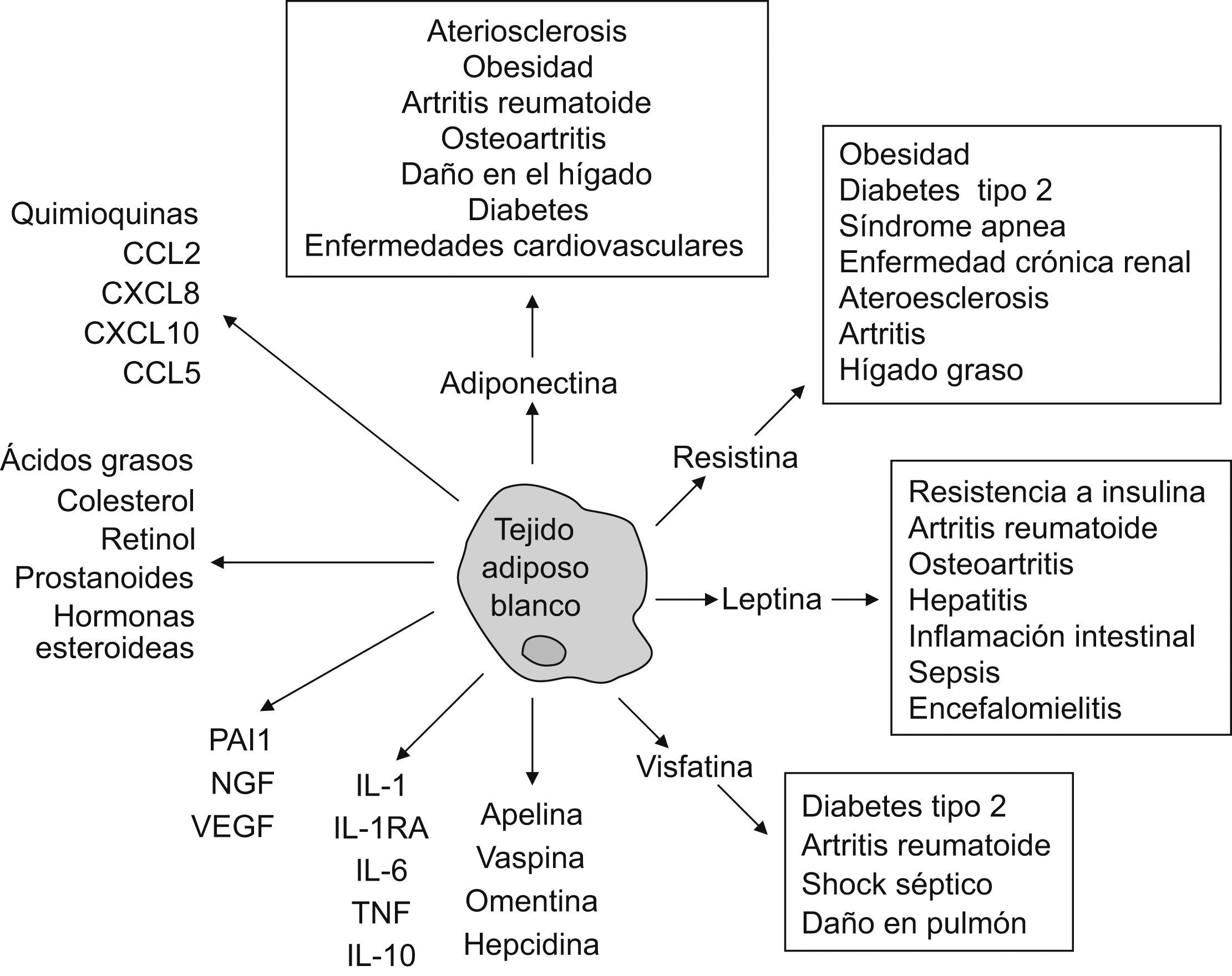
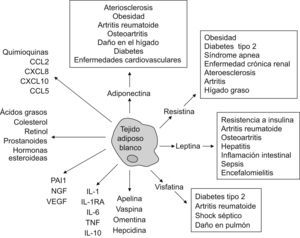
La hipótesis de que el tejido adiposo blanco (TAB) puede desempeñar otras funciones fisiológicas más allá de ser un mero depósito de grasa empezó a ser tangible tras el descubrimiento de la leptina en 19941. Esta proteína de 16kDa es el producto del gen ob (obese), que está mutado en ratones con obesidad hereditaria. En la actualidad se sabe que el TAB produce más de 50 factores con actividad parecida a la de la citocinas (correctamente denominadas adipocinas) (fig. 1). Estas adipocinas utilizan mecanismos de acción endocrinos, paracrinos, autocrinos y yuxtacrinos, e intervienen en una amplia variedad de procesos fisiológicos y patológicos, incluidas la inmunidad y la inflamación2.
Es importante subrayar el término adipocina, que está generalmente asociado a sustancias biológicamente activas encontradas en los adipocitos del TAB. Sin embargo, estos factores pueden ser sintetizados por otros tejidos y participar en funciones no relacionadas con las funciones típicas del TAB3. Durante estos últimos años, la obesidad y sus complicaciones han sido los factores principales que han estimulado las investigaciones sobre el TAB. De hecho, hoy la obesidad está considerada como un estado proinflamatorio, ya que se observó que diversos marcadores de inflamación estaban elevados en individuos obesos. Las adipocinas incluyen una gran variedad de péptidos proinflamatorios, entre los que se encuentra el TNF (tumor necrosis factor ‘factor de necrosis tumoral’); su secreción se observó incluso antes del descubrimiento de la leptina4. Estas adipocinas proinflamatorias contribuyen notablemente al «estado de inflamación subclínico» de los individuos obesos y promueven una serie de aberraciones metabólicas que incluyen complicaciones cardiovasculares y enfermedades inflamatorias autoinmunes. Cabe mencionar que la producción de adipocinas que realiza el TAB en individuos obesos está fuertemente influenciada por la presencia de macrófagos infiltrados. Estos macrófagos representan una fuente adicional de mediadores solubles que puede contribuir y perpetuar tanto la inflamación sistémica como la local5. El TAB también produce, presumiblemente como respuesta adaptativa, factores antiinflamatorios, como el antagonista del receptor de la interleucina 1 (IL-1RA) (que se une competitivamente al receptor de la IL-1 sin activarlo) y la IL-10, cuyos valores circulantes están también elevados en individuos obesos. El IL-1RA está incrementado de forma notable en individuos obesos; los datos procedentes de la experimentación en roedores sugieren que este antagonista endógeno tiene funciones centrales y periféricas importantes, incluidos el aumento de la adipogénesis y la adquisición de resistencia a la leptina.
El objetivo de esta revisión consiste en describir los hallazgos más recientes relativos a la implicación de las adipocinas en la respuesta inflamatoria e inmune, y centrar la atención en las enfermedades articulares degenerativas, como la artritis reumatoide (AR) y la artrosis.
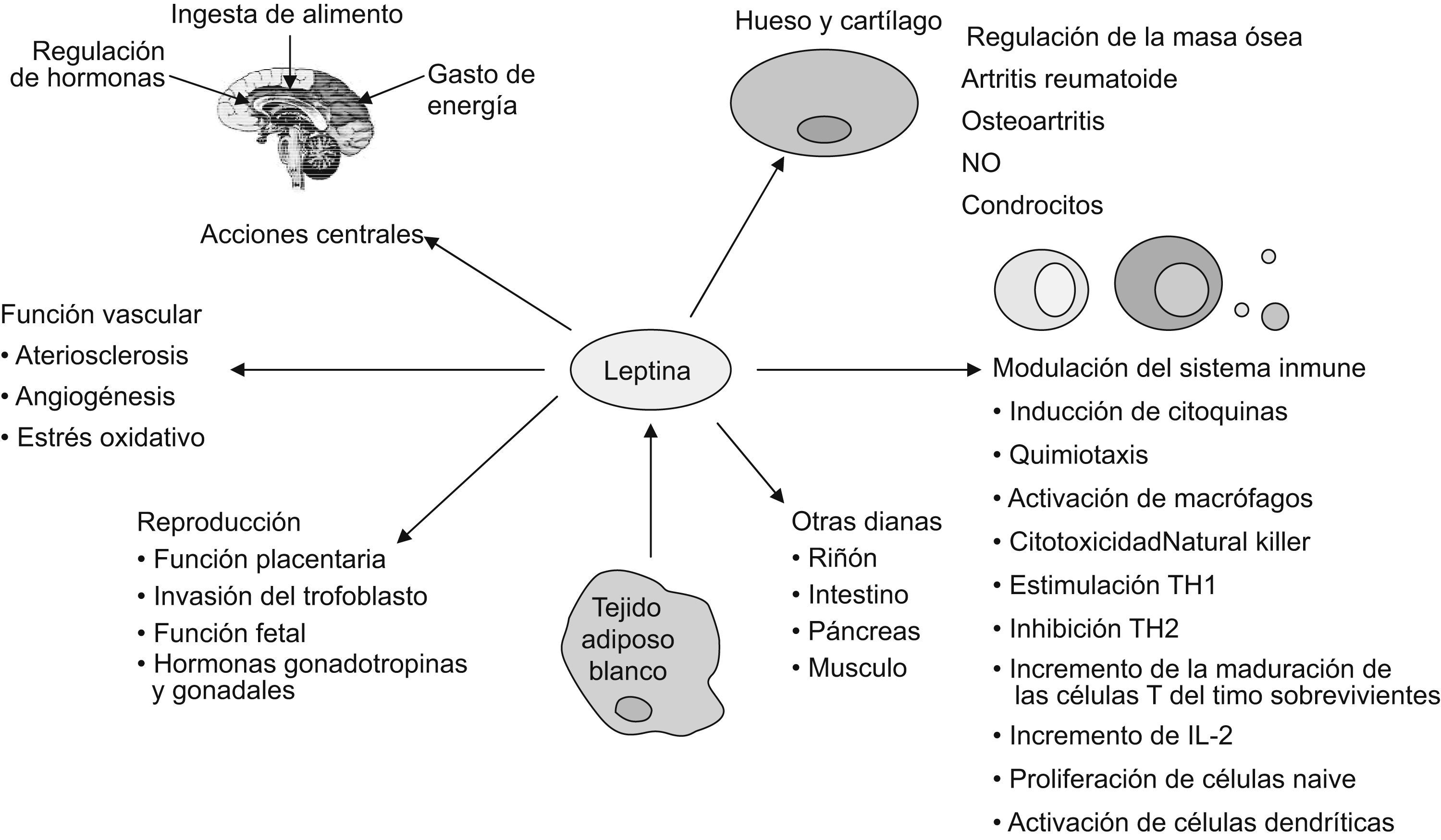
Leptina: el precursor de la superfamilia de adipocinasLa leptina es una hormona peptídica no glucosilada de 16kDa a la codificada por el gen ob, el homólogo en ratones del gen humano LEP 1. Pertenece a la familia de citocinas clase i. La leptina es producida principalmente por los adipocitos y sus valores circulantes están relacionados con la masa de TAB. La leptina disminuye la ingesta de comida y aumenta el consumo energético por medio de la inducción de factores anorexigénicos (el transcripto regulado por cocaína y anfetamina y el proopiomelanocortina) y mediante la supresión de neuropéptidos orexigénicos, como el neuropéptido Y, el péptido agouti y la orexina. Los valores de leptina son dependientes del sexo: son mayores en mujeres que en varones, incluso cuando se ajusta el índice de masa corporal. Esto puede ser relevante por la diferente susceptibilidad dependiente del sexo en determinadas enfermedades, como por ejemplo la osteoartritis, que es más frecuente en mujeres que en varones6.
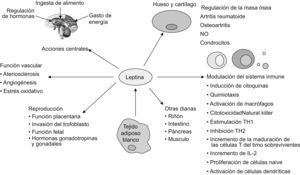
La leptina, por tanto, se define como una hormona semejante a una citocina con acciones pleiotrópicas (fig. 2). Ésta ejerce sus funciones biológicas tras la unión con sus receptores, que están codificados por el gen db (diabetes) y pertenecen a la superfamilia de receptores de citocinas clase i. El procesamiento alternativo del gen db da lugar a múltiples isoformas, pero sólo la forma larga Ob-Rb parece ser capaz de transducir la señal de la leptina. La ruta JAK-STAT parece ser la ruta principal por la que Ob-Rb transmite la señal extracelular que recibe7. Sin embargo, hay otras rutas alternativas que también están implicadas8.
Leptina: sistema inmune y respuesta inflamatoriaLos ratones db/db, deficientes de receptores de leptina, están afectados por una atrofia del timo y los ratones ob/ob que carecen de leptina son inmunodeficientes. Estos hallazgos pueden explicar por qué el sistema inmune murino se deprime con el ayuno y con una ingesta disminuida (ambas situaciones presentan concentraciones bajas de leptina) y por qué esta depresión se revierte con la administración de leptina exógena9. Las acciones conocidas de la leptina en la respuesta inmune se han revisado recientemente e incluyen la modulación de monocitos y macrófagos, neutrófilos, basófilos, eosinófilos, linfocitos citolíticos naturales y células dendríticas10. Además, la leptina modifica el equilibrio e induce la activación de las células T. Asimismo, también cambia el patrón de producción de citocinas de estas células mientras guía la diferenciación de las células T hacia una respuesta TH1, lo que explica el papel proinflamatorio de la leptina en varios modelos animales en afecciones autoinmunes e inflamatorias (tabla 1).
Efecto de las adipocinas en la inmunidad innata y la inmunidad adaptativa
| Adipocinas | ||
| Efecto en la inmunidad | ||
| Adaptativa | Innata | |
| Leptina | Activación celular TH1 | Monocito/macrófago |
| ↑ síntesis IgG2a | ↑Proliferación | |
| ↑TNF, ↑IFNγ | ↑Fagocitosis | |
| ↑IL1, IL-6, TNF | ||
| Inhibición células TH2 | Monocitos | |
| ↓síntesis IgG1 | ↑IL-1RA, CD25, CD71 | |
| Células TREG | Macrófagos | |
| ↑Anergia | ↑NOS, LTB4, COX2 | |
| ↑Hiporreactividad TCR | ||
| Timocitos | Neutrófilos | |
| ↓Apoptosis | ↑Quimiotaxis | |
| ↑Maduración | ↑Producción peróxido de hidrógeno | |
| Células T naive | Células dendríticas | |
| ↑Proliferación | ↓Apoptosis | |
| ↑Apoptosis | ↑Maduración | |
| ↑TH1, ↓TH2 | ||
| ↑IL-1β, IL-12, IL-6, TNF | ||
| Células T de memoria | Linfocitos citolíticos naturales | |
| ↓proliferación anti-CD3 | ↑Supervivencia | |
| ↑Citotoxicidad | ||
| Células B | ||
| ↓Apoptosis | ||
| ↑Pool de células periféricas | ||
| Células pro-B | ||
| ↑Linfocitopoyesis | ||
| Células hematopoyéticas de la matriz ósea | ||
| ↑Proliferación | ||
| ↑Hematopoyesis | ||
| Adiponectina | ↓Linfocitopoyesis de células B | ↓Fagocitosis |
| ↓Respuesta células T | ↓Moléculas de adherencia endotelial | |
| ↑IL-10, ↑IL-1RA, ↓IFNγ, | ||
| ↓TNF, NFκB, IL-6 | ||
| ↑IL-8 (CXCL8) forma HMW+LPS | ||
| Resistina | N/D | ↑Moléculas de adherencia endotelial |
| ↑NFκB | ||
| ↑IL-1β, IL-12, IL-6, TNF | ||
| Visfatina | N/D | ↓Apoptosis de neutrófilos |
| ↑quimiotaxis | ||
| ↑IL-1RA, IL-1β, IL8, IL-6, TNF | ||
↑: elevación o valores elevados; ↓: disminución o valores bajos.
COX2: ciclooxigenasa 2; HMW: alto peso molecular; IgG: inmunoglobulina G; IFN; interferón; IL: interleucina; LPS: lipopolisacárido; LTB4: leucotrienos B4; N/D: dato no disponible; NFκB: factor nuclear κB; NOS: óxido nítrico sintasa; TCR: receptor células T; TH: célula T colaboradora; TNF: factor de necrosis tumoral; TREG: célula T reguladora.
Un aspecto remarcable de los efectos de la leptina en el sistema inmune es su acción como citocina proinflamatoria: las células inflamatorias producen la leptina, y el ácido ribonucleico mensajero (ARNm) de ésta y sus valores circulantes se incrementan con un cierto número de estímulos inflamatorios, incluidos IL-1, IL-6 y lipopolisacárido11. Los ratones deficientes en leptina son más propensos al desarrollo de enfermedades inflamatorias que los ratones no deficientes, sin tener en cuenta si esto implica inmunidad adaptativa o inmunidad innata. Las afecciones descritas incluyen colitis experimental, encefalomielitis autoinmune experimental, diabetes de tipo 1 y hepatitis experimental2. De Rosa et al demostraron que la neutralización de la leptina invierte directamente la anergia y la hiporreactividad del receptor de células T de las células T reguladoras, lo que proporciona nuevas pistas sobre el papel de la leptina en la autoinmunidad12. Junto con otras señales neuroendocrinas, la leptina parece desempeñar un papel en enfermedades autoinmunes como la AR, aunque aún no está claro si la leptina puede proteger o dañar las estructuras articulares en la AR (tabla 2). En pacientes con AR, los valores circulantes de leptina son mayores o no se modifican si se los compara con controles sanos13,14.
Adipocinas en enfermedades reumáticas
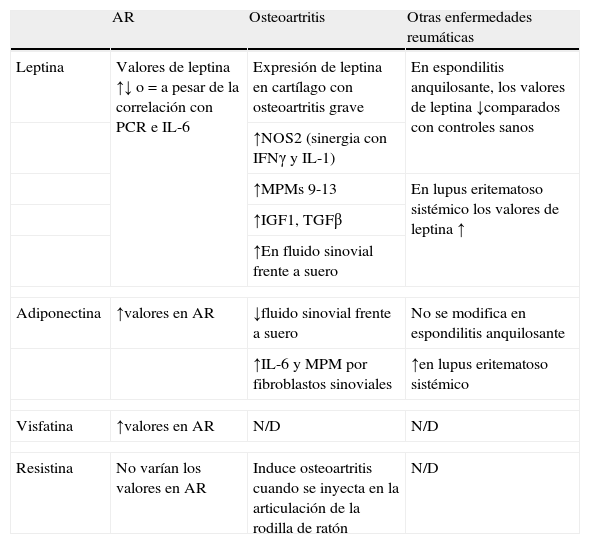
| AR | Osteoartritis | Otras enfermedades reumáticas | |
| Leptina | Valores de leptina ↑↓ o = a pesar de la correlación con PCR e IL-6 | Expresión de leptina en cartílago con osteoartritis grave | En espondilitis anquilosante, los valores de leptina ↓comparados con controles sanos |
| ↑NOS2 (sinergia con IFNγ y IL-1) | |||
| ↑MPMs 9-13 | En lupus eritematoso sistémico los valores de leptina ↑ | ||
| ↑IGF1, TGFβ | |||
| ↑En fluido sinovial frente a suero | |||
| Adiponectina | ↑valores en AR | ↓fluido sinovial frente a suero | No se modifica en espondilitis anquilosante |
| ↑IL-6 y MPM por fibroblastos sinoviales | ↑en lupus eritematoso sistémico | ||
| Visfatina | ↑valores en AR | N/D | N/D |
| Resistina | No varían los valores en AR | Induce osteoartritis cuando se inyecta en la articulación de la rodilla de ratón | N/D |
↑: elevación o valores elevados; ↓: disminución o valores bajos.
AR: artritis reumatoide; IFN: interferón; IL: interleucina; MPM: metaloproteasa de la matriz; N/D: dato no disponible; NOS: óxido nítrico sintasa;. PCR: proteína C reactiva.
En pacientes con AR, una caída en los valores de leptina circulante inducida por el ayuno está asociada a hiporreactividad de linfocitos CD4+ y con un incremento en la secreción de IL-415. La artritis experimental inducida por antígeno es menos grave en ratones deficientes en leptina ob/ob que en ratones de tipo salvaje; mientras que en artritis inducida por zymosan los ratones deficientes de leptina y de su receptor exhiben una resolución retrasada del proceso inflamatorio. Cabe destacar que la leptina disminuye la gravedad de la artritis séptica en ratón de tipo salvaje. Así, a la luz de los resultados presentes, parece difícil realizar una conclusión que no sea ambigua sobre el papel potencial de la leptina en la AR16.
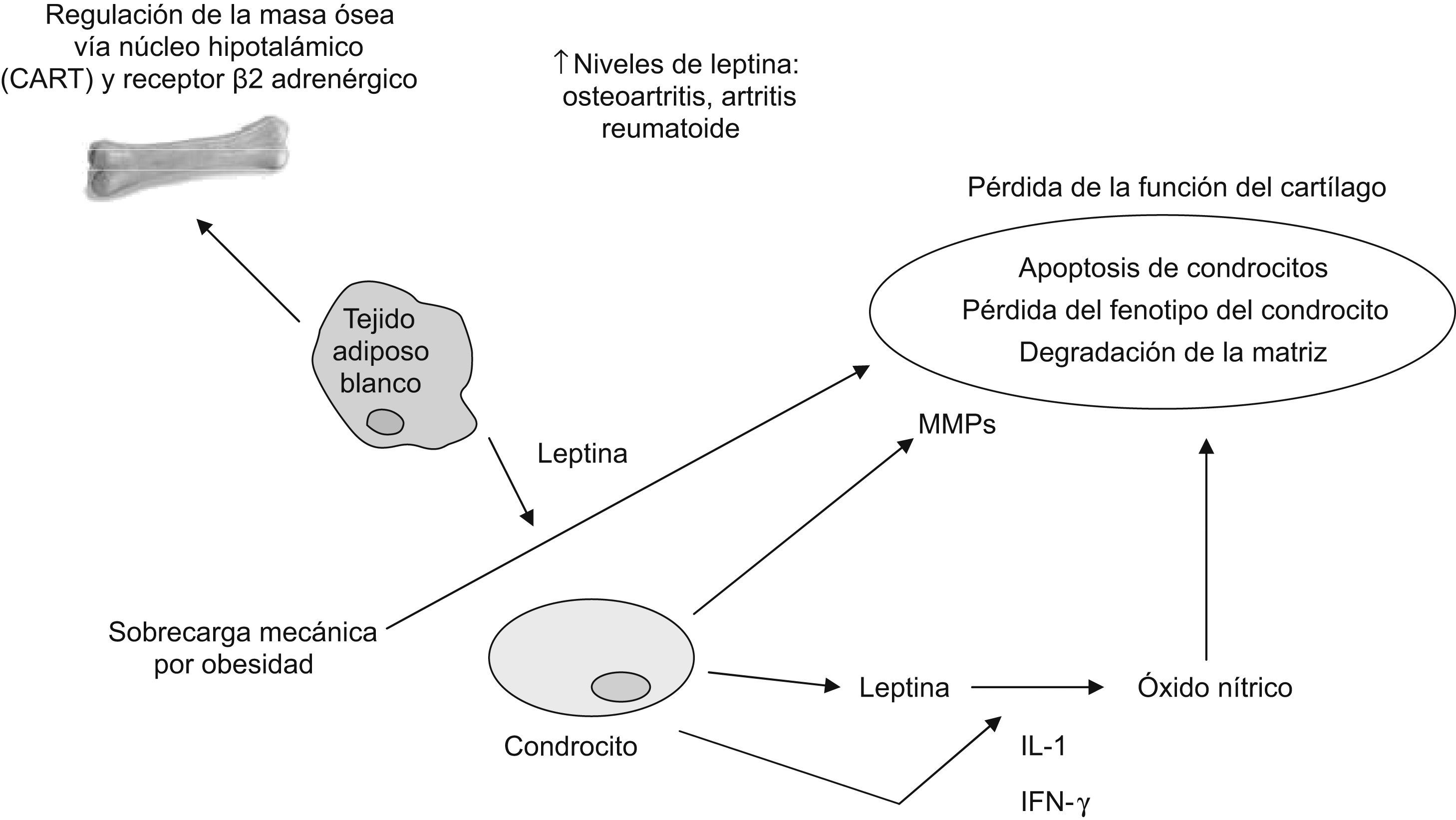
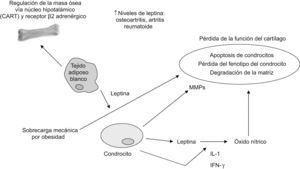
En la artrosis, la producción de leptina es mucho mayor en el cartílago humano artrósico que en el cartílago normal. El hallazgo de que la administración exógena de leptina aumenta la producción de IGF1 y TGFβ en el cartílago de rodilla de rata, demuestra que los altos valores circulantes de leptina en individuos obesos podrían proteger al cartílago de la degeneración artrósica. Sin embargo, bajo condiciones patológicas el control de la homeostasis de la matriz que realizan los condrocitos articulares se pierde y la mayor parte de las pruebas experimentales apuntan en otra dirección (fig. 3)17. En cultivos de condrocitos humanos y de ratón, la NOS2 (nitric oxide synthase ‘óxido nítrico sintasa tipo 2’) se activa a través de la combinación de leptina e interferón γ. Asimismo, NOS2 también se activa mediante la combinación de leptina e IL-1 a través de un mecanismo que involucra JAK2, PI3K, MEK1 y p3818,19. Recientemente se ha demostrado que la leptina también es capaz de inducir la síntesis de relevantes metaloproteinasas de la matriz (MPM) implicadas en el deterioro del cartílago, como pueden ser MPM9 y MPM13. Cabe mencionar que el ARN soluble de interferencia contra la leptina desactiva directamente a MPM13, la que se regula al alza tras la reactivación epigenética de la leptina20,21.
El efecto proinflamatorio de la leptina en el cartílago puede estar en consonancia con el hecho de que, en comparación con el varón, la mujer tiene mayores valores circulantes de leptina y es más propensa al desarrollo de artrosis6. Esto puede explicar también la asociación entre obesidad y enfermedades inflamatorias, especialmente las relacionadas con la alteración de la homeostasis del cartílago. Finalmente, en pacientes con espondilitis anquilosante la leptina sérica se vió disminuida en comparación con los controles sanos, mientras que en mujeres con lupus eritematoso sistémico (LES) los valores de leptina fueron mayores que en los controles sanos14.
AdiponectinaLa adiponectina (también conocida como GBP28, apM1, Acrp30 o AdipoQ) es una proteína de 244 residuos que se produce en gran medida en el TAB. Tiene homología estructural con el factor de complemento C1q y con los colágenos viii y x, y circula en sangre en concentraciones elevadas (≈10μg/ml) y en diferentes formas moleculares22,23.
Incrementa la oxidación de ácidos grasos y reduce la síntesis de glucosa en el hígado. La eliminación del gen de la adiponectina no tiene un efecto considerable en ratones que siguen una dieta normal, pero cuando éstos siguen una dieta alta en grasa o en azúcar, se desarrolla en ellos una resistencia grave a la insulina y también una acumulación de lípidos en el músculo. Los valores circulantes de adiponectina tienden a ser bajos en pacientes con obesidad mórbida y se incrementa con la pérdida de peso y con el uso de fármacos tiazolidinediónicos, que aumentan la sensibilidad a la insulina22,23.
La adiponectina actúa a través de 2 receptores descritos recientemente: AdipoR1, que se encuentra fundamentalmente en el músculo esquelético, y AdipoR2, que se encuentra en el hígado. La transducción de la señal de la adiponectina a través de sus receptores implica la activación de la proteína cinasa AMPK, PPAR α, PPAR γ y otras moléculas señalizadoras.
Adiponectina y procesos inflamatoriosAunque la adiponectina se descubrió al mismo tiempo que la leptina, su papel en la protección contra la obesidad y sus desórdenes se han empezado a conocer sólo recientemente24. La adiponectina tiene un rango amplio de efectos en enfermedades con componente inmune e inflamatorio, como las enfermedades cardiovasculares, diabetes tipo 2, síndrome metabólico y AR25. Ejerce acciones relevantes en la inmunidad innata y en la inmunidad adaptativa (tabla 1). Interfiere en la función de macrófagos inhibiendo la actividad fagocítica y la producción de IL-6 y de TNF. También reduce la linfopoyesis de células B, disminuye la respuesta de células T e induce la producción de factores antiinflamatorios importantes, como la IL-10 y el IL-1RA, por parte de los monocitos y macrófagos, y por parte de las células dendríticas en humanos5.
A pesar del papel «protector» de la adiponectina contra la obesidad y las enfermedades cardiovasculares, se ha visto que en las articulaciones puede tener un papel proinflamatorio y estar implicada en la degradación de la matriz. Las concentraciones de adiponectina en plasma de pacientes con AR son mayores que en los controles sanos, y las concentraciones de adiponectina en el fluido sinovial son mayores en pacientes con AR que en pacientes con artrosis13,25. También se han encontrado concentraciones altas de adiponectina en pacientes con LES en comparación con los controles sanos. Es digno de mención el hecho de que los pacientes con LES que presentan resistencia a la insulina, muestran concentraciones de adiponectina significativamente menores que aquellos pacientes sin resistencia a la insulina26.
En fibroblastos sinoviales humanos, la adiponectina induce 2 de los más importantes mediadores de la AR a través de la ruta p38 MAPK: la IL-6 y la MPM127. Los condrocitos también presentan receptores funcionales de adiponectina, cuya activación conduce a la inducción de la NOS2 a través de una ruta de señalización que involucra la cinasa PI3. Asimismo, los condrocitos tratados con adiponectina in vitro tienen una producción incrementada de IL-6, TNF y MCP1 (proteína 1 quimiotáctica de monocitos); sin embargo, ni la síntesis de prostaglandina E2 ni la síntesis de leucotrieno B4 se ven afectadas28. Estos resultados demuestran que la adiponectina puede considerarse como una diana importante en el tratamiento de enfermedades articulares degenerativas. Por otro lado, las concentraciones altas de adiponectina en pacientes con AR también pueden interpretarse como una respuesta adaptativa metabólica con el fin de reducir el ya conocido efecto proinflamatorio de la leptina o contrarrestar el efecto proinflamatorio del TNF y reducir la producción de IL-6 y de la proteína C-reactiva.
ResistinaLa resistina es una proteína dimérica que recibe su nombre por su supuesto efecto sobre la inducción de resistencia a la insulina en ratones. Pertenece a la familia FIZZ (found in inflammatory zone), también llamada RELM (resistin-like molecules). La resistina (FIZZ3) se ha encontrado en adipocitos, macrófagos y en otros tipos de células29.
Se ha postulado que la resistina media la resistencia insulínica, aunque su papel puede limitarse a los roedores. De hecho, el entusiasmo inicial que produjo esta teoría, que establece una conexión directa entre adiposidad y resistencia a la insulina, desapareció rápidamente debido a hallazgos contradictorios en humanos y ratones.
Resistina e inflamaciónSe ha demostrado que en humanos la resistina puede estar implicada en situaciones inflamatorias debido a que las células mononucleares la secretan en cantidades relevantes. Por ejemplo, los valores de resistina en pacientes con apnea obstructiva del sueño están mutuamente correlacionados con los valores de moléculas de adherencia celular, como ICAM1. Además, en pacientes ateroscleróticos están positivamente relacionados con otros marcadores de inflamación, como el TNF-R tipo ii y la fosfolipasa asociada a lipoproteína A230,31. Se ha descrito que el lipopolisacárido induce la expresión del gen de la resistina en macrófagos primarios, murinos y humanos, a través de una cascada que implica la secreción de citocinas proinflamatorias. En los monocitos humanos, la resistina, la IL-6 y el TNF parecen influenciarse mutuamente a través de la ruta NF-κB32,33.
La resistina puede estar implicada también en la patogénesis de la AR: se ha encontrado resistina en el plasma y en el fluido sinovial de pacientes con AR. La inyección intraarticular de resistina en ratones induce una enfermedad semejante a la artritis, con infiltración de leucocitos en los tejidos sinoviales, hipertrofia de la capa sinovial y formación de pannus33,34. Sin embargo, los valores de resistina en pacientes con AR, parecen ser similares a los valores encontrados en controles sanos. No obstante, en algunos estudios se ha observado que los valores de resistina eran mayores en el fluido sinovial que en el suero (lo que indica que los valores sistémicos de las adipocinas no reflejan necesariamente la situación local en la articulación). Esta discrepancia puede deberse simplemente al incremento de la permeabilidad de la membrana sinovial inflamada o ser un epifenómeno6,26,33.
VisfatinaLa visfatina es una adipocina que inicialmente se supuso que mimetizaba a la insulina. Originalmente se la descubrió en el hígado, el músculo esquelético y la médula ósea como un factor de crecimiento para los precursores de linfocitos B (de ahí el nombre alternativo de factor potenciador de colonias de células pre-B), aunque su actividad como factor insulinomimético es hoy motivo de debate35–37. Está incrementada en modelos experimentales de daño pulmonar agudo y sepsis37. Sus valores circulantes están íntimamente relacionados con la acumulación de TAB. Los valores de ARNm de visfatina se incrementan en el curso de la diferenciación de los adipocitos y numerosos factores regulan su síntesis, incluidos los glucocorticoides, el TNF, la IL-6 y la hormona de crecimiento. A la visfatina no la produce únicamente el TAB, también lo hacen los neutrófilos, en respuesta a la endotoxina (por vía TLR4). En estas células previene la apoptosis a través de un mecanismo mediado por las caspasas 3 y 837. Además, los pacientes con enfermedad inflamatoria intestinal tienen valores circulantes elevados de visfatina, y valores incrementados de ARNm en el epitelio intestinal. Se ha determinado que la visfatina induce quimiotaxis y la producción de IL-1β, TNF, IL-6 y la síntesis de moléculas coestimuladoras en monocitos CD14+, lo que incrementa su capacidad para inducir respuestas aloproliferativas38. En efecto, los valores circulantes de visfatina son mayores en pacientes con AR que en controles sanos13.
Actualmente se desconoce el papel fisiológico o la relevancia de la visfatina en el contexto de la AR. La visfatina puede estar involucrada en la modulación de la respuesta inmune e inflamatoria, formar parte de mecanismos compensatorios o presentar valores incrementados que fuesen simplemente un epifenómeno.
Posibles abordajes terapeúticos y conclusionesEstá claro que las adipocinas tienen múltiples e importantes funciones. El incremento del esfuerzo de investigación en esta área está revelando gradualmente la intrincada interacción mediada por adipocinas, TAB, trastornos metabólicos y trastornos inflamatorios y autoinmunes. Aunque muchas cuestiones continúan siendo confusas, en esta sección se perfilarán algunas posibles aproximaciones terapéuticas.
Hay una gran cantidad de datos acerca del efecto proinflamatorio asociado a valores elevados de leptina circulante. Por tanto, puede ser plausible controlar la cantidad de leptina circulante biodisponible y prevenir de este modo la inflamación inducida por la leptina. Esto se puede lograr por medio de moléculas solubles con gran afinidad de unión a la leptina. Sería una estrategia farmacológica análoga al tratamiento con fármacos anti-TNF para el tratamiento de la AR. Otra posibilidad consistiría en el bloqueo del receptor de leptina con anticuerpos monoclonales humanizados o moléculas de leptina mutadas que son capaces de unirse al receptor sin activarlo. Una condición obvia a tener en cuenta en este tipo de estrategia es que los receptores centrales que median la influencia de la leptina en la ingesta no deben bloquearse, ya que esto conduciría a un incremento de la hiperfagia y de la obesidad. Sin embargo, el hecho de que los receptores de leptina que controlan estos fenómenos se encuentran en el hipotálamo, es decir, al otro lado de la barrera hematoencefálica, puede hacer posible el diseño de este tipo de moléculas.
Por otro lado, los efectos antiateroscleróticos y vasoprotectores de la adiponectina pueden ser otra fuente de inspiración para posibles aproximaciones farmacológicas. En particular, una estrategia farmacológica focalizada en combatir la hipoadiponectinemia asociada a la obesidad y sus complicaciones podría representar una solución terapéutica potencial. Aunque debido a los valores elevados de adiponectina circulante, la administración exógena de esta adipocina parece una aproximación poco efectiva. Sin embargo, el tratamiento con fármacos tiazolidinediónicos, capaces de incrementar los valores circulantes de adiponectina, parece una estrategia más prometedora. Aunque si se consideran los efectos locales de la adiponectina en enfermedades inflamatorias articulares degenerativas tendría que valorarse la relación riesgo y beneficio entre la mejora de la homeostasis metabólica sistémica y los fenómenos erosivos perjudiciales inducidos por la adiponectina.
En conclusión, no debe olvidarse que la causa primordial de la obesidad y de sus complicaciones inflamatorias está generalmente influenciada por factores nutricionales y de estilo de vida, como la sobrealimentación y la inactividad física. Por tanto, el abordaje terapéutico de las enfermedades caracterizadas por la hiperproducción de adipocinas perjudiciales relacionadas con la obesidad, incluye esencialmente la corrección de estos factores.
El conocimiento de las acciones de las adipocinas (objeto de esta revisión) es todavía incompleto como para sustentar hipótesis terapéuticas bien definidas. Sin embargo, el incremento exponencial del conocimiento en este campo hará que ciertas adipocinas sean, en poco tiempo, cruciales para futuras aproximaciones farmacoterapeúticas en las enfermedades inflamatorias asociadas a la obesidad.