Las miopatías inflamatorias idiopáticas son un grupo de enfermedades de origen autoinmune que afectan al músculo estriado. Sin embargo, la gama de manifestaciones es múltiple, no sólo muscular. Este capítulo describe tanto las manifestaciones musculares como las características extramusculares de estos padecimientos.
Idiopathic inflammatory myopathies are a group of autoimmune diseases that characteristically affect striated muscle. Nevertheless their spectrum of manifestations is very broad, not only muscular. This chapter describes both muscular and extramuscular manifestations of inflammatory myopathies.
Las miopatías inflamatorias idiopáticas (MII) son un grupo heterogéneo de enfermedades caracterizadas por una inflamación adquirida del músculo estriado que ocasiona debilidad muscular de diversos grados y cuya afección es predominantemente a los músculos de la cintura escapular, pélvica y flexores del cuello. Sin embargo, otras estructuras que también están conformadas por el músculo estriado potencialmente pueden verse afectadas, como los músculos de la deglución (ocasionando disfagia alta), los músculos intrínsecos respiratorios (con exclusión del diafragma) (ocasionando dificultad respiratoria), casos raros de miopatía orbicular y, en casos de afección muy grave y/o crónica (esta última sin tratamiento), los músculos distales podrían verse afectados1.
Manifestaciones muscularesEl espectro clínico de la afección muscular en las MII es muy variable; sin embargo, la presentación más frecuente es un cuadro insidioso, progresivo, en su mayor parte no doloroso y cuya característica de localización es la afección del músculo estriado de predominio proximal (los músculos flexores del cuello, de la cintura escapular y de la cintura pélvica), esta afección puede estar manifiesta entre 3 y 6 meses, en que gran porcentaje de la masa muscular se afecta y es evidente la debilidad muscular, eventualmente puede existir atrofia. De manera general, la debilidad muscular proximal indolora se presenta en el 55% de los casos, un cuadro agudo o subagudo (aproximadamente 2 meses) en el 30%, afección insidiosa proximal y distal (entre 1 y 10 años de evolución) en el 5% y mialgia de predominio proximal como única manifestación en el 5%. Existen reportes de casos de miositis focal, aunque no son comunes, así como afección a los músculos bulbares.
Las MII se agrupan en síndromes. Dependiendo del patrón de presentación y la asociación a autoanticuerpos (que no se tocarán en este capítulo), estos diversos síndromes se caracterizan, además de la afección proximal de los grupos musculares, por afección a la piel, al pulmón y al corazón, y en algunos casos calcinosis. A continuación se describe la afección extramuscular.
Manifestaciones pulmonaresEl pulmón es un blanco de afección en diversas enfermedades del tejido conectivo2,3; en las MII es causa de un incremento en la morbilidad y mortalidad4. Se consideran tres categorías de afección pulmonar que de alguna manera son una complicación en pacientes con MII: neumonía por broncoaspiración, hipoventilación como consecuencia de un compromiso intrínseco de los músculos relacionados con la mecánica ventilatoria (con exclusión del diafragma) y la neumopatía intersticial (NI).
Son pocos los estudios de alto nivel de evidencia publicados en relación con este tema, la mayor parte de ellos son reportes o series de casos, las estadísticas reportadas varían de publicación a publicación y de población a población, situación que puede explicar la gran variabilidad en los números expresados a continuación.
Se estima que la prevalencia del involucro pulmonar en polimiositis/dermatomiositis varía entre el 5 y el 46%, situación que depende de los criterios clínicos de diagnóstico (radiológico, funcional o patológico) para documentar esta patología5–8.
La alteración pulmonar más frecuentemente observada es la NI, su presencia afecta al pronóstico y a la elección terapéutica. Un estudio tuvo como objetivo detectar NI en pacientes con MII sin síntomas clínicos de neumopatía. Se encontraron signos radiográficos y datos de neumopatía restrictiva en el 65% de los pacientes (una de las prevalencias más altas reportadas); la diferencia de este estudio fueron dos puntos importantes: casos nuevos diagnosticados y, además, ser asintomáticos (servicio de referencia para pacientes con miopatía del norte de Estocolmo). La incidencia estimada durante el período de observación fue de 8,5 por millón9–12.
Con esto se estima que el pulmón como órgano se afecta de manera temprana en los pacientes con MII. La prevalencia de NI en casos tempranos no seleccionados antes de iniciar tratamiento es desconocida.
El cuadro clínico habitual es disnea de esfuerzo con tos seca, sin embargo, aproximadamente 4 de cada 6 pacientes son asintomáticos, por tal motivo las dos variables previas pueden ser orientadoras, pero no deben de tomarse como un indicador válido de afección pulmonar; la incidencia de NI subclínica en este grupo fue del 18%.
En el transcurso de los años ha incrementado su reconocimiento gracias a los nuevos métodos de gabinete de evaluación, como la tomografía de alta resolución y las placas radiográficas de tórax, que son sensibles, pero no específicas para detectar anormalidades compatibles con NI.
La NI puede presentarse de manera concomitante a la miositis o preceder en la mitad de los casos; su presentación puede ser subclínica (18%), aguda (25%) o insidiosa (60%). Los estudios para evaluar la NI son placa radiográfica de tórax, pruebas de función respiratoria y tomografía de alta resolución, que deben ser realizadas al inicio y durante el curso clínico de la enfermedad. De acuerdo con algunos autores, hoy en día el tipo histológico de la neumopatía no se requiere generalmente, ya que hasta en el 80% de los casos la estirpe histológica reportada es una NI inespecífica. Por último, se recomienda solicitar anti-Jo-1, ya que aproximadamente el 100% de los pacientes con positividad para este autoanticuerpo desarrolla NI13.
Hoy en día se considera que el único factor predictivo positivo para el desarrollo de una NI es la positividad para anti-Jo-1; sin embargo, puede existir NI en pacientes sin estos autoanticuerpos, por tal motivo a todos los pacientes con MII se les debe realizar tamizaje para descartar esta alteración14.
Manifestaciones cardíacasConstituyen una de las causas de mayor mortalidad en los pacientes con MII. Afortunadamente, su presentación es muy rara, en contraste a esto se han reportado frecuentemente de manera subclínica anormalidades electrocardiográficas, como arritmias. Los hallazgos clínicos sintomáticos más frecuentemente reportados son insuficiencia cardíaca congestiva, anormalidades de conducción que conllevan hasta bloqueos completos y enfermedad arterial coronaria. Las manifestaciones observadas pueden ser provocadas por miocarditis (asociado a anti-SRP) y enfermedad de pequeños vasos del miocardio.
Menos frecuente ha sido el reporte de pericarditis e hipertensión arterial pulmonar (vista en pacientes con una neumopatía crónica de base)15–18.
CalcinosisLa calcificación distrófica de los tejidos blandos, mayormente conocida como calcinosis, se presenta en los tejidos dañados o desvitalizados a consecuencia de un metabolismo anormal del calcio/fósforo, y se puede presentar de manera localizada o diseminada. La calcinosis puede originar atrofia muscular secundaria, contracturas musculares, úlceras cutáneas e infecciones secundarias. No existe un estudio específico del tema, la mayor parte de los estudios publicados son reportes de casos, y hasta estos momentos parece ser que sólo un estudio realizado mediante búsqueda en MEDLINE desde 1972 hasta el año 2004 con el término “calcinosis” y “enfermedades reumáticas” demostró que esta alteración puede ser frecuente en diversas enfermedades del tejido conectivo, como lupus, esclerosis sistémica y MII, siendo estas últimas más frecuentes en los casos de inicio juvenil19.
Un estudio en Brasil demostró que los factores de riesgo para el desarrollo de calcinosis en un grupo de pacientes con dermatomiositis de inicio juvenil fueron enfermedad progresiva y agresiva (razón de momios [RM]=4,01; IC 95%: 1,08–14,87) así como daño miocárdico (RM=15,56; IC 95%: 1,59–152,2)20.
Algunos autores sugieren que el tratamiento agresivo puede disminuir la incidencia de la calcinosis21.
Manifestaciones cutáneasLas MII afectan primordialmente al músculo estriado y, como ya comentamos previamente, potencialmente al pulmón y al corazón; sin embargo, puede existir afección cutánea, motivo por lo cual en muchas ocasiones el dermatólogo resulta ser el primer médico tratante en esta entidad.
Al respecto, son pocas las revisiones y más las series de casos y casos reportados en relación con las manifestaciones cutáneas en las MII. En un estudio retrospectivo de dermatomiositis de inicio juvenil se encontró que el 25% de los pacientes acudió al médico sólo por lesiones cutáneas, de los cuales el 38% acudió al dermatólogo como médico de primer contacto, ya que los pacientes no tuvieron otra sintomatología22. Se ha observado que las manifestaciones cutáneas pueden preceder al cuadro de miositis desde varios meses hasta dos años23.
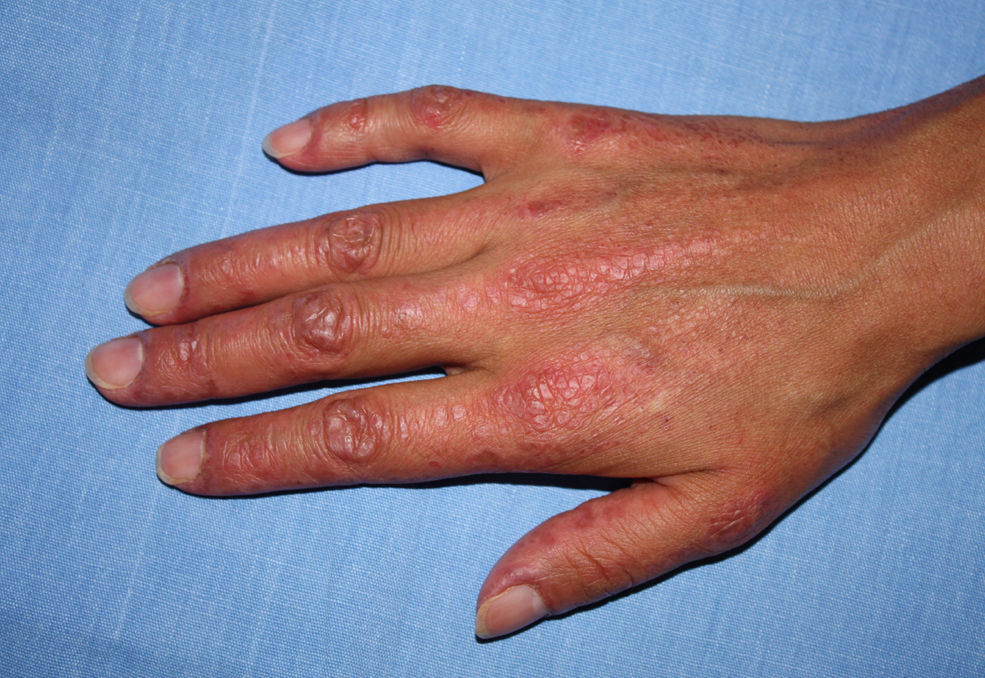
Las manifestaciones cutáneas son múltiples, algunas frecuentemente vistas, como el eritema en heliotropo y las pápulas de Gottron (fig. 1) y otras muy raras. De manera general, la clasificación de las MII se ha realizado de acuerdo con el criterio del reumatólogo o del neurólogo (como los criterios de Bohan y Peter, Tanimoto, etc.), dentro de los cuales está incluida la dermatomiositis; sin embargo, no hay una clasificación cutánea específica para tal fin. De manera general, se estima que dentro de las miopatías inflamatorias, la dermatomiositis ocupa el 20% en frecuencia de presentación, la dermatomiositis amiopática el 10%, las miopatías asociadas al tejido conectivo el 8–10%, asociadas a neoplasias el 10% y el resto a polimiositis. Existe un nuevo sistema de clasificación que define diversos subtipos de lesiones cutáneas24,25.
En las tablas 1 y 2 se enlistan las alteraciones presentes en las MII y su ponderación en relación con su presentación.
|
|
MII: miopatías inflamatorias idiopáticas.
De manera general, se estima que las lesiones patognomónicas, altamente características y características en su mayoría están asociadas a anti-Mi2 —con excepción de las manos de mecánico que están más frecuentemente asociadas a anti-Jo-1, las lesiones de vasculitis y calcinosis a las variedades de inicio juvenil—y, de acuerdo con algunos autores, la presencia de vasculitis en una variedad no juvenil y de inicio tardío debe obligar a buscar una neoplasia.
Manifestaciones gastrointestinalesLas manifestaciones gastrointestinales en las MII son diversas, siendo las más frecuentes los trastornos de la deglución (disfagia alta) debido a la naturaleza estriada de la musculatura del tercio superior del esófago. Tomando como base los resultados de una publicación canadiense, la frecuencia relativa de las principales manifestaciones gastrointestinales en las MII es: disfagia: 43%, constipación: 7%, y regurgitación: 3%26.