Describir el compromiso cutáneo (CC) en pacientes con lupus eritematoso sistémico (LES) al inicio de la enfermedad y durante el seguimiento. Determinar factores asociados a dicho compromiso al comienzo de la enfermedad.
Materiales y métodosEstudio retrospectivo, observacional y descriptivo, de centro único, en pacientes con diagnóstico de LES (ACR97 o SLICC2012). Se utilizó la clasificación de Gilliam modificada para el CC. Se realizó estadística descriptiva y análisis bivariado y multivariado para evaluar los factores asociados al compromiso cutáneo.
ResultadosSe incluyeron 149 pacientes (91,3% mujeres) con una mediana de edad al diagnóstico de 33años. El CC al inicio de la enfermedad ocurrió en 125 pacientes (83,9%), seguido por compromiso articular en 120 (80,5%). Las lesiones no específicas fueron más frecuentes que las específicas: 92,8% versus 66,4%, respectivamente. En el análisis bivariado, la mayor demora al diagnóstico, la presencia de compromiso articular, la menor presencia de trombocitopenia y la mayor puntuación de SLEDAI-2K se asociaron con la presencia de CC al inicio de la enfermedad. En el análisis multivariado, la variable que se mantuvo asociada de manera independiente fue el compromiso articular (OR: 2,8; IC95%: 1,1-7,5; p=0,04). Durante el seguimiento, 4/24 pacientes que no habían presentado CC al diagnóstico y 51/125 pacientes que sí lo presentaron tuvieron al menos un nuevo episodio cutáneo (rango: 1-5 brotes).
ConclusionesNuestro estudio demuestra la alta frecuencia de pacientes que presentan compromiso cutáneo en el LES, tanto en el diagnóstico como evolutivamente, y confirma los datos reportados previamente en cuanto a la existencia de un fenotipo cutáneo-articular.
To describe skin involvement (SI) in patients with systemic lupus erythematosus (SLE) at onset and during follow-up of the disease and to determine factors associated with SI at lupus diagnosis.
Materials and methodsRetrospective, observational, and descriptive study, from a single centre in patients diagnosed with SLE (ACR1982-97 or SLICC2012 criteria). The modified Gilliam classification for SI was used. Descriptive statistics and bivariate and multivariate analysis were performed to evaluate the factors associated with SI at diagnosis of the disease.
ResultsA total of 149 patients were included, 91.3% women, with a median age at diagnosis of 33years. SI at onset of the disease occurred in 125 patients (83.9%), followed by joint involvement in 120 cases (80.5%). Non-specific skin lesions were more frequent than specific lesions, 92.8% versus 66.4%, respectively. In the bivariate analysis, a longer delay to diagnosis, the presence of joint involvement, a lower presence of thrombocytopenia, and a higher SLEDAI-2K score were associated with the presence of SI at onset of the disease. In the multivariate analysis, the variable that remained independently associated was joint involvement (OR: 2.8: 95%CI: 1.1-7.5; P=.04). During follow-up, 4/24 patients who had not presented SI at diagnosis and 51/125 patients who had, had at least one new skin flare (range: 1-5 outbreaks).
ConclusionsOur study demonstrates the high frequency of skin involvement in SLE, both diagnostically and evolutionarily, and confirms previously reported data regarding the existence of a skin-articular phenotype.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune multiorgánica con una incidencia global que varía entre 1-10 casos por 100.000 habitantes/año1.
Dentro del amplio espectro de manifestaciones clínicas de LES, el compromiso musculoesquelético es reportado como el más frecuente (80-95%), seguido por el compromiso cutáneo en el 60-85% de los casos2-4, siendo este último el primer signo de la enfermedad en el 23-28% de los casos5,6.
Desde hace muchos años, el compromiso cutáneo en LES ha sido clasificado por Gilliam y Sontheimer7 —según la ausencia o la presencia de un patrón histológico (dermatitis de interfase)— en lesiones cutáneas no específicas de lupus eritematoso (LE) y lesiones cutáneas específicas de LE, respectivamente. Las lesiones específicas se subdividen en lupus eritematoso cutáneo (LEC) agudo (LECA), subagudo (LECS) y crónico (LECC). Esta clasificación original ha experimentado cambios a lo largo del tiempo, generando lo que se denomina actualmente Clasificación de Gilliam modificada8, la cual es utilizada en la mayoría de los estudios clínicos9,10.
En el grupo de lesiones no específicas se incluyen un gran número de manifestaciones, entre las que destacan las vasculares (vasculitis leucocitoclástica, livedo reticular, fenómeno de Raynaud y eritromelalgia), la alopecia no cicatrizal, las lesiones orales y las úlceras en los miembros inferiores8.
Un tema de interés dentro del dominio cutáneo es que se han observado asociaciones entre algunos tipos de este compromiso con otras variables clínicas, diferentes grados de actividad sistémica y la presencia de autoanticuerpos7,11,12.
El objetivo del presente estudio es describir el compromiso cutáneo en pacientes con LES tanto al comienzo como durante la evolución de la enfermedad, evaluar factores asociados a dicho compromiso al comienzo, y describir los tratamientos utilizados.
Pacientes y métodosSe realizó un estudio retrospectivo, observacional y descriptivo a partir de la revisión de historias clínicas de pacientes con LES asistidos en el servicio de Reumatología del HIGA San Martín de La Plata entre el año 2000 y el 2019. Se incluyeron pacientes mayores de 18años, con un inicio de la enfermedad de corto plazo (<12meses) y con el diagnóstico de LES realizado en nuestro centro, que cumplían los criterios de clasificación ACR1997 modificados13 o SLICC201214 para LES. Se excluyeron aquellos pacientes que tuvieron el diagnóstico de LES en otro centro, lo que no permitió obtener datos objetivos del inicio de la enfermedad. También se excluyeron pacientes con otra enfermedad del tejido conectivo asociada (esclerosis sistémica, artritis reumatoide, síndrome de Sjögren, miopatía inflamatoria idiopática, espondiloartritis y vasculitis sistémica), enfermedad cutánea primaria como psoriasis, pénfigo o vitíligo, y pacientes con lupus inducido por drogas.
Se consignaron los datos sociodemográficos, los dominios clínicos, las comorbilidades y los parámetros de laboratorio (hemograma, perfil inmunológico, complemento —C3 y C4—, eritrosedimentación [ERS] y proteína C reactiva [PCR]) al comienzo de la enfermedad. Dentro del perfil inmunológico se incluyeron: anticuerpos antinucleares (ANA) detectados por inmunofluorescencia (IF), anticuerpos anti-dsDNA, anti-Ro, anti-La, anti-RNP, anti-Smith (Sm), anti-cardiolipina (aCL), anti-beta-2 glucoproteínaI (B2GPI) detectados por ELISA y el anticoagulante lúpico (AL) mediante las técnicas sugeridas por la Sociedad Internacional de Trombosis y Hemostasia (ISTH)15.
Luego, los pacientes se clasificaron en dos grupos: con y sin compromiso cutáneo al comienzo de la enfermedad. Los tipos de compromiso cutáneo se clasificaron de acuerdo a la clasificación de Gilliam modificada5.
Se registraron los eventos cutáneos que ocurrieron a lo largo del seguimiento, en ambos grupos. Para las lesiones del subtipo LECA y las no específicas se registró como nuevo evento cuando el tipo de brote cutáneo era distinto al previo, o si era la misma lesión, cuando esta había presentado un período de remisión mínimo de 4semanas. Los tipos de LECS y LECC se consideraron como únicos eventos a lo largo del seguimiento, excepto si el nuevo episodio se presentó en otra localización o con otras características.
Se determinó al comienzo de la enfermedad el grado de actividad sistémica mediante el índice de actividad de la enfermedad LES2000 (SLEDAI-2K)16.
Consideraciones éticasEl presente estudio fue aprobado por el Comité de Ética de nuestro centro, siguiendo las recomendaciones de la Declaración de Helsinki (1964). Al tratarse de un estudio de revisión de historias clínicas, no se consideró necesario un consentimiento informado otorgando confidencialidad a los datos. Número de protocolo HSMLP2022/0069.
Análisis estadísticoSe realizó estadística descriptiva utilizando media y desvío estándar (DE) o mediana y percentilo 25-75 (p25-75) según distribución para las variables continuas; para variables dicotómicas se usó frecuencia y porcentaje (%).
Las comparaciones entre los grupos (pacientes con y sin lesiones cutáneas al inicio de la enfermedad) se realizaron utilizando chi-cuadrado (χ2) o prueba exacta de Fisher para variables dicotómicas, y prueba t de Student o Mann-Whitney para variables continuas. Se realizó una regresión logística para evaluar los factores asociados de manera independiente a la presencia de compromiso cutáneo al inicio del LES.
ResultadosSe incluyeron 149 pacientes, de los cuales 136 (91,3%) eran mujeres, con una mediana de edad al diagnóstico de 33años (22-45,5), demora en el diagnóstico de 5meses (2-12) y tiempo mediano de seguimiento de 45meses (14-72). Todos los pacientes presentaron ANA positivo. En relación con los parámetros de actividad al inicio de la enfermedad, el anti-dsDNA fue positivo en 70/138 (50,7%), C3 bajo en 74/142 (52,1%) y C4 bajo en 95/142 (66,9%). En la tabla 1 se observan los datos demográficos, las comorbilidades y el perfil inmunológico del total de pacientes. La mediana del score SLEDAI-2K al diagnóstico fue de 9puntos (6-14).
Datos demográficos, comorbilidades y perfil de anticuerpos del total de pacientes
| n=149 | |
|---|---|
| Datos demográficos | |
| Sexo femenino, n (%) | 136 (91,3) |
| Edad al diagnóstico en años, mediana (p25-75) | 33 (22-45,5) |
| Demora en el diagnóstico en meses, mediana (p25-75) | 5 (2-12) |
| Tiempo de seguimiento en meses, mediana (p25-75) | 45 (14-72) |
| Comorbilidades | |
| Hipotiroidismo, n (%) | 26 (17,4) |
| Hipertensión, n (%) | 17 (11,4) |
| Dislipemia, n (%) | 6 (4) |
| Diabetes, n (%) | 4 (2,7) |
| Tabaquismo, n (%) | 14 (9,4) |
| Perfil de anticuerpos | |
| ANA, n (%) | 149 (100) |
| Anti-Smith, n (%) | 59/142 (41,5) |
| Anti-Ro, n (%) | 53/142 (37,3) |
| Anti-La, n (%) | 22/141 (15,6) |
| Anti-RNP, n (%) | 50/138 (36,2) |
| aCL, n (%) | 35/107 (32,7) |
| AL, n (%) | 29/97 (29,9) |
| B2GPI, n (%) | 18/100 (18) |
aCL: anti-cardiolipina; AL: anticoagulante lúpico; ANA: anticuerpos antinucleares; B2GPI: anti-beta-2 glucoproteínaI.
En cuanto a las manifestaciones clínicas presentadas al comienzo de la enfermedad, el compromiso cutáneo se presentó en 125 pacientes (83,9%), siendo el más frecuente, seguido en orden de menor frecuencia por el compromiso articular en 120 (80,5%), constitucional en 68 (45,6%), linfopenia en 49 (32,9%), renal en 40 (26,8%), serositis en 35 (23,5%), leucopenia en 34 (22,8%), trombocitopenia en 31 (20,8%), anemia hemolítica en 17 (11,4%), sistema nervioso en 16 (10,7%), pulmonar en 2 (1,3%) y gastrointestinal en 1paciente (0,7%).
En relación con los tipos de compromiso cutáneo al inicio (tabla 2), las lesiones inespecíficas fueron más frecuentes que las específicas: 92,8% versus 66,4%, respectivamente. En 74 pacientes (59,2%) se presentaron combinaciones de ambos tipos de lesiones. Cuarenta y dos de los pacientes presentaron solo manifestaciones inespecíficas, y 9, solo específicas. En cuanto a las lesiones específicas, la más frecuente fue el subtipo agudo en 79/125 (63,2%), seguido por el crónico en 6/125 (4,8%) y el subagudo en 2/125 (1,6%). Dentro de las lesiones no específicas se observó alopecia en 77/125 (61,6%), fenómeno de Raynaud en 48/125 (38,4%), úlceras orales en 47/125 (37,6%), y en menor frecuencia livedo reticular, vasculopatía, vasculitis leucocitoclástica, úlceras en miembros inferiores, urticaria, tromboflebitis y telangiectasias periungueales. Todos los casos de vasculitis leucocitoclástica, LECS y LECC fueron diagnosticados por biopsia. En el resto de los pacientes el diagnóstico fue clínico. Los hallazgos histológicos no se describen, ya que no se encontraba dentro de los objetivos del presente estudio.
Tipos y frecuencia de compromiso cutáneo al inicio de la enfermedad
| Manifestaciones cutáneas | n=125 (100%) |
|---|---|
| Lesiones cutáneas específicas de LE | 83 (66,4) |
| LECA | 79 (63,2) |
| o Rash malar | 73 (58,4) |
| o Eritema generalizado | 13 (10,4) |
| LECS | 2 (1,6) |
| LECC | 6 (4,8) |
| o Discoide clásico | 5 (4) |
| o Paniculitis | 1 (0,8) |
| Lesiones cutáneas no específicas de LE | 116 (92,8) |
| Vasculitis leucocitoclástica | 5 (4) |
| Vasculopatía | 7 (5,6) |
| Livedo reticular | 18 (14,4) |
| Fenómeno de Raynaud | 48 (38,4) |
| Úlceras mucosas | 47 (37,6) |
| Alopecia | 77 (61,6) |
| Urticaria | 1 (0,8) |
| Úlceras en miembros inferiores | 2 (1,6) |
| Tromboflebitis | 1 (0,8) |
| Telangiectasias periungueal | 1 (0,8) |
LE: lupus eritematoso; LECA: lupus eritematoso cutáneo agudo; LECC: lupus eritematoso cutáneo crónico; LECS: lupus eritematoso cutáneo subagudo.
En el análisis bivariado (tabla 3), la mayor demora al diagnóstico, la presencia de compromiso articular, la menor presencia de trombocitopenia y una mayor puntuación de SLEDAI-2K se asociaron con la presencia de compromiso cutáneo al inicio de la enfermedad. No se encontraron diferencias en cuanto a: edad al diagnóstico, sexo, tabaquismo, ANA, anti-Ro, anti-La, anti-Sm, anti-RNP, anti-dsDNA, hipocomplementemia, aCL, AL, B2GPI, FR, ERS, PCR, serositis, compromiso constitucional, renal y sistema nervioso, anemia hemolítica, leucopenia y linfopenia (p>0,05). En el análisis multivariado (tabla 3), la variable que se mantuvo asociada de manera independiente fue el compromiso articular (OR: 2,8; IC95%: 1,1-7,5; p=0,04), mientras que no se mantuvo la asociación con retraso al diagnóstico y trombocitopenia.
Factores asociados al compromiso cutáneo al inicio de la enfermedad. Análisis bivariado y regresión logística
| Variables | Con compromiso cutáneo (n=125) | Sin compromiso cutáneo (n=24) | p | Análisis multivariado | |
|---|---|---|---|---|---|
| OR (IC95%) | p | ||||
| Retraso diagnóstico en meses, mediana (p25-75) | 5,5 (3-12) | 2 (1-3,5) | 0,04 | 1 (0,96-1) | 0,72 |
| Compromiso articular, n (%) | 105 (84) | 15 (62,5) | 0,015 | 2,8 (1,1-7,5) | 0,04 |
| Trombocitopenia, n (%) | 22 (18) | 9 (37,5) | 0,028 | 0,4 (0,15-1) | 0,64 |
| SLEDAI-2K mediana (p25-75) | 9 (6-15) | 6 (15,5-11,5) | 0,023 | − | − |
aCL: anti-cardiolipina; AL: anticoagulante lúpico; ANA: anticuerpos antinucleares; B2GPI: anti-beta-2 glucoproteínaI; ERS: eritrosedimentación; FR: factor reumatoide; PCR: proteína C reactiva; SAF: síndrome antifosfolipídico.
No se encontraron diferencias estadísticamente significativas en el uso de tratamientos tanto para el CC como para otras manifestaciones entre ambos grupos al inicio (p>0,05), siendo los más utilizados la hidroxicloroquina (130/145 [89,7%]) y los corticoides orales (121/145 [83,4%]), seguidos con mucha menor frecuencia por ciclofosfamida (27/145 [18,6%]), metotrexato (11/145 [7,6%]), azatioprina (10/144 [6,9%]) y micofenolato (5/145 [3,4%]).
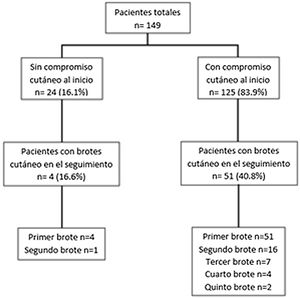
Durante el seguimiento, el rango de brotes cutáneos fue de 1-5, siendo mayor en aquellos pacientes con compromiso cutáneo al inicio de la enfermedad. En la figura 1 se muestra la distribución y el número de brotes cutáneos.
En relación con el primer brote, la mediana de tiempo de aparición desde el diagnóstico de LES fue de 22 meses (12-44), siendo el LECA (30/55 [54,5%]) la lesión específica más frecuente; las lesiones no específicas aparecieron en 41/55 (74,5%), presentando alopecia en 21/55 (38,2%), úlceras orales en 17/55 (30,9%) y fenómeno de Raynaud en 11/55 (20%). Un segundo brote cutáneo se observó en 17 pacientes, con una mediana de tiempo desde el diagnóstico de 41meses (26-59), presentando el mismo porcentaje tanto de lesiones específicas como no específicas. Siete pacientes presentaron un tercer brote con una mediana de tiempo desde el diagnóstico de 50meses (33-80). En este caso, las manifestaciones específicas (85,7%) fueron más frecuentes que las no específicas (57,1%). Un cuarto y quinto brote se encontraron en 4 y 2 pacientes, respectivamente, con una media de tiempo de 98meses (DE: ±36) y 117meses (DE: ±71), respectivamente. En ambos casos el LECA fue el más frecuente. En los 85 brotes cutáneos totales registrados, los pacientes se encontraban, previo a dicho evento, en tratamiento para el LES en 69 (81,2%) casos con hidroxicloroquina, en 35 (41,2%) con glucocorticoides en dosis mayor de 7,5mg/día, en 33 (38,8%) en dosis menor de 7,5mg/día, en 26 (30,6%) con azatioprina, y en menor frecuencia con micofenolato en 11 (13%), con metotrexato en 10 (11,7%), con ciclofosfamida en 6 (7%), y en un solo paciente con belimumab.
DiscusiónEn este estudio de pacientes con LES se observó que el compromiso clínico más frecuente al inicio de la enfermedad fue el cutáneo, seguido por el articular, con el cual se encontró una asociación estadísticamente significativa.
Una posible explicación a la mayor frecuencia de CC al inicio se encontraría asociada a que los pacientes incluidos en nuestra cohorte debían tener un inicio de su enfermedad de corto plazo, lo que puede derivar en una mayor atención y búsqueda por parte de los médicos de dicho compromiso en estos pacientes.
En relación con el tipo de lesiones y de acuerdo con los datos hallados por Gronhagen et al.9, registramos que las lesiones no específicas de LE predominaron, incluso al inicio de la enfermedad, probablemente debido a que se asociaron a estados activos17-19, como ocurre generalmente al momento de inicio del LES. Consistentemente con este hallazgo observamos que los pacientes cursaron en más del 50% de los casos con anticuerpos anti-DNA positivo e hipocomplementemia, y la mediana del score SLEDAI-2K fue de 9 puntos.
En cuanto a las lesiones cutáneas específicas, el LECA fue el subtipo predominante al inicio de la enfermedad, mostrando valores superiores a descripciones previas, que varían entre el 30 y el 50%5,7,11,20. La alta incidencia observada de rash malar coincide con lo descrito en la literatura, representando típicamente una de las primeras manifestaciones de LES, asociado a actividad sistémica3,4.
La frecuencia de LECS y LECC en nuestro estudio fue inferior a lo reportado6,11,17,21, hallazgo que puede estar relacionado a que ambos subtipos son más comúnmente observados como entidades cutáneas aisladas y se encuentran asociados a baja actividad sistémica de la enfermedad2,3,9,11, lo cual podría redundar en una menor derivación a un servicio de reumatología. Por otra parte, el LECC presenta un bajo porcentaje de progresión a LES3,4,22, lo que explicaría, en nuestra cohorte de lupus sistémico, la baja prevalencia. Además, ambos subtipos se han observado con mayor frecuencia en pacientes con LES de inicio tardío (>50años), grupo etario que no predominó en nuestro estudio5.
La alopecia fue la lesión no específica hallada en mayor porcentaje, al igual que en otros estudios, que informan una frecuencia entre el 40 y el 83% en pacientes con LES9,17. Esta manifestación suele indicar actividad de la enfermedad5, y generalmente se asocia a otras manifestaciones cutáneas12, como ocurrió en nuestro trabajo. La prevalencia del fenómeno de Raynaud y de úlceras orales coincidió con lo reportado previamente2,9,23.
Si bien en la cohorte general el retraso en el diagnóstico fue bajo debido a los criterios de inclusión, los pacientes que presentaron compromiso cutáneo al inicio se asociaron a una mayor demora al diagnóstico, a compromiso articular, a menor presencia de trombocitopenia y a un mayor puntaje de SLEDAI-2K; sin embargo, en el análisis multivariado solo el compromiso articular se mantuvo asociado de forma independiente. Resultado similar se observó en un estudio realizado por Ghosh et al.18, donde evaluaron el perfil clínico e inmunológico de 55 pacientes con LES con compromiso cutáneo al debut de la enfermedad y encontraron que la manifestación sistémica asociada más frecuente fue el compromiso articular. Dos estudios que evaluaron patrones clínicos en LES utilizando un análisis de grupos obtuvieron la misma asociación. El primero, de Font et al.20, realizado en una cohorte de 600 pacientes con LES, encontró superposición clínica entre el compromiso cutáneo y articular, junto con el compromiso renal, este último no objetivado en nuestro caso. El segundo estudio, llevado a cabo por To et al.24 mediante un procedimiento de conglomerados, halló tres grupos clínicos, de los que uno de ellos se caracterizaba por la presencia de compromiso cutáneo y articular, con baja prevalencia de serositis, manifestaciones hematológicas y compromiso renal. Sumado a lo anterior, un estudio reciente de Zhou et al.4, enfocado en la progresión de LEC a LES, describe mayor frecuencia de compromiso articular (artralgias y artritis) en aquellos pacientes con lupus de inicio cutáneo que luego progresan a compromiso sistémico. La asociación de estos dos compromisos, generalmente no graves, ha sido clásicamente relacionada con un grupo de pacientes que presentan menor compromiso orgánico severo y mejor pronóstico10,20.
A lo largo del seguimiento, 55 (36,9%) pacientes presentaron al menos un brote cutáneo, y la mayoría de ellos habían tenido igual compromiso al diagnóstico. Durante los diferentes brotes, los tipos de compromiso cutáneo que se encontraron con mayor porcentaje fueron el LECA y las lesiones cutáneas inespecíficas, las cuales suelen estar asociadas a recaídas de la enfermedad. Observamos que la mayoría de los pacientes al momento del brote se encontraban en tratamiento con hidroxicloroquina y/o corticoides. En la literatura se encuentran estudios sobre manifestaciones cutáneas refractarios a antipalúdicos25 que requieren la combinación de estos agentes, y en algunos casos esta falta de respuesta se asoció al tabaquismo26. Este análisis no estuvo entre los objetivos de nuestro estudio, pero como mencionamos anteriormente, la mayoría de los brotes en el seguimiento ocurrieron en los pacientes con compromiso cutáneo al inicio, los cuales tenían un porcentaje mayor, aunque no significativo, de tabaquismo.
Entre las limitaciones de este estudio podemos mencionar el tipo de diseño retrospectivo y, en algunos casos, la ausencia de datos relacionados con las variables de interés en un periodo de tiempo cercano a cada nuevo brote cutáneo. Por esta razón no pudimos evaluar factores asociados a dichos brotes en el seguimiento. Finalmente destacamos que no se utilizó el score CLASI de evaluación cutánea, que, entre otras características, permite analizar manifestaciones agudas y crónicas o propias del daño irreversible.
Como fortalezas podemos mencionar que es un estudio realizado con pacientes de la vida real en un centro único de derivación terciaria, con seguimiento a largo plazo desde el inicio de la enfermedad.
En conclusión, nuestro estudio demuestra el impacto que presenta el compromiso cutáneo en los pacientes con LES, tanto en el diagnóstico como evolutivamente. Así mismo confirma los datos reportados previamente en cuanto a la existencia de un fenotipo cutáneo-articular, el cual amerita estrategias de educación médica para un diagnóstico temprano y un manejo adecuado. Surge la necesidad de realizar estudios de cohorte prospectiva para poder determinar la incidencia y no solo la prevalencia del CC en el LES, y establecer mejor la asociación causal entre los factores asociados y las recaídas.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses con respecto a la publicación de este artículo.