Los fármacos biológicos dirigidos contra el factor de necrosis tumoral α (TNFα) son ampliamente utilizados en la actualidad en el tratamiento de la artritis reumatoide (AR) y otras enfermedades inflamatorias inmunomediadas, habiendo demostrado ser muy eficaces y tener buen perfil de seguridad1, pero también se asocian con eventos adversos (EA) cutáneos, incluyendo la psoriasis y las lesiones psoariasiformes2. Presentamos un paciente diagnosticado de AR que desarrolló pustulosis palmoplantar (PPP) durante el tratamiento con certolizumab pegol (CZP) y revisamos los casos publicados de psoriasis inducida por este fármaco.
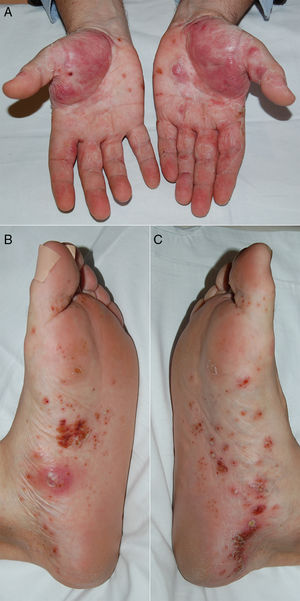
Un varón de 57 años con antecedentes de diabetes mellitus e hipertensión arterial fue diagnosticado a los 50 años de AR en función de su poliartritis en las articulaciones pequeñas de las manos, aumento de reactantes de fase aguda y positividad para factor reumatoide y anticuerpos anti-péptido cíclico citrulinado. Fue tratado inicialmente con metotrexato (dosis máxima 20mg/semana, vía subcutánea), con mejoría clínica y buena tolerancia, pero tras 5 años presentó empeoramiento progresivo de la clínica inflamatoria en manos y elevación persistente de reactantes de fase aguda (actividad de la enfermedad medida por DAS28: 5). Debido a esto se decidió añadir CZP (200mg cada 2 semanas, vía subcutánea), lográndose buena respuesta articular y analítica dentro de los 2 primeros meses. Tras 3 meses de tratamiento anti-TNFα acudió a urgencias por presentar de forma brusca un brote de lesiones pustulosas milimétricas, confluyentes e indoloras en ambas palmas y plantas (fig. 1), sin signos de infección ni lesiones en otras localizaciones. La biopsia de una lesión palmar fue compatible histopatológicamente con PPP. Se retiró CZP, pero se mantuvo metotrexato, iniciándose corticoterapia tópica con betametasona en crema, que se cambió luego a clobetasol crema con vendajes oclusivos y sesiones de láser, con desaparición completa de las lesiones tras 4 meses de suspensión del anti-TNFα. El paciente se ha mantenido en remisión tras un período de observación de 6 meses, continuando solo con metotrexato 25mg/semana vía subcutánea, sin necesidad de reiniciar el tratamiento biológico.
La aparición de novo o empeoramiento de la psoriasis preexistente es un EA asociado con todos los fármacos anti-TNFα, que puede ocurrir en cualquier momento (desde días hasta años tras del inicio del tratamiento), sin predilección respecto a sexo y edad2,3. Se ha descrito en casi todas las enfermedades tratadas con anti-TNFα, aunque hasta un 75% de casos corresponden a enfermedad inflamatoria reumatológica2. Un metaanálisis reciente que incluyó 216 casos de psoriasis de novo inducida por anti-TNFα encontró una frecuencia por fármaco: infliximab 62%, adalimumab 21,8%, etanercept 14,4%, CZP 1% y golimumab 0,5%3. Esto más que reflejar una diferencia entre ellos puede ser debido a un mayor número de pacientes-años de exposición de los primeros anti-TNFα aprobados respecto a CZP y golimumab, considerándose actualmente un efecto de clase de estos fármacos2,3.
En la revisión de la literatura (PubMed) encontramos 9 casos de psoriasis inducida por CZP, 2 en AR y 7 en enfermedad de Crohn (tabla 1). Los casos ocurridos en AR correspondieron a PPP; en el primero de ellos fue un EA recurrente (primer evento tras etanercept)4, mientras en el segundo apareció de novo y progresó a psoriasis pustulosa generalizada (PPG)5. En ambos se retiró CZP y tras tratamiento dermatológico presentaron buena evolución clínica de las lesiones. Todos los casos ocurridos en enfermedad de Crohn fueron de novo (3 con CZP como primer anti-TNFα y 3 como segundo) y los tipos de psoriasis que presentaron fueron: psoriasis en placas (3)6, psoriasis guttata (1)7, PPP+psoriasis en placas (1)8, PPP+psoriasis guttata (1)9 y no especificada (1)10. En 5 casos se suspendió CZP, 4 tuvieron buena respuesta con corticoterapia tópica y en 2 casos se requirió adicionalmente fotoquimioterapia y acitetrina.
Características de los pacientes con psoriasis inducida por certolizumab
| Estudio | Edad (años) | Sexo | Enfermedad de base | AP/AF de psoriasis | Tratamientos previos | Esquema de tratamiento con CZP | Tipo de psoriasis | Tiempo hasta aparición de psoriasis inducida | Evolución |
|---|---|---|---|---|---|---|---|---|---|
| Shelling et al.4 | 78 | H | AR | No/no | MTX, ETN | 400mg cada 2 semanas, sc | PPP | 10 semanas con ETN6 semanas con CZP | Mejoría tras suspensión de CZP y tratamiento con corticoides tópicos de alta potencia |
| Koizumi et al.5 | 71 | M | AR | No/no | MTX, IFX | 200mg cada 4 semanas, sc | PPP → PPG | 122 días hasta el desarrollo de PPP157 días hasta el desarrollo de PPG | Sin respuesta tras suspensión de CZP y tratamiento con corticoides tópicosMejoría rápida de las lesiones (una semana) con etetrinato oral (20mg/día), pero sin desaparecer completamente |
| Eickstaedt et al.6 | 14 | H | EC | No/no | IFX | ND | PsoP | 29 meses con IFX3 meses con CZP | Remisión de primer brote tras suspensión de IFX y tratamiento tópico con triamcinolona y calcipotrieno y apósitos con ácido acéticoRemisión del segundo brote tras suspensión de CZP y tratamiento tópico con hidrocortisona |
| 17 | M | EC | No/no | IFX | ND | PsoP | 6 meses con IFXTiempo no especificado con CZP | Remisión de primer brote tras suspensión de IFX y tratamiento tópico con triamcinolona e hidrocortisonaRemisión del segundo brote tras suspensión de CZP y tratamiento con MTX e hidrocortisona tópica | |
| 18 | M | EC | No/no | ADA | ND | PsoP | Tiempo no especificado con ADA6 meses con CZP (+MTX) | Remisión de primer brote tras suspensión de ADA y tratamiento tópico con hidrocortisona y betametasonaRemisión con tratamiento tópico con flucinolona y calcipotrieno | |
| Fischer et al.7 | 38 | H | EC | PsoP/no | ND | ND | PsoG | Una semana hasta el desarrollo de PsoG | Remisión tras suspensión de CZP y tratamiento tópico con triamcinolonaInició IFX y PDN oral para EC, sin recurrencias de PsoG |
| Mocciaro et al.8 | 42 | M | EC | No/no | MTX, IFX | 400mg cada 4 semanas, sc | PPP+PsoP | 29 semanas hasta el desarrollo de PPP | Sin respuesta tras suspensión de CZP y tratamiento con corticoides tópicosRemisión completa de las lesiones con CSA (3mg/kg/día) y acitetrina (10mg/día) orales |
| Klein et al.9 | 26 | M | EC | No/no | ND | ND | PPP+PsoG | 4 meses hasta el desarrollo de PPP | Mejoría inicial de lesiones postulares con suspensión de CZP y PDN oral 30 mg/díaMejoría de PsoG con MTX (25mg/semana), que tuvo que ser cambiado a 6-MPRecurrencia de PPP que mejoró con fototerapia UBV y tratamiento tópico con betametasona y calcipotrieno |
| Protic et al.10 | ND | ND | EC | No/no | ND | ND | NE | ND | ND |
| Caso actual | 57 | H | AR | No/no | MTX | 200mg cada 2 semanas, sc | PPP | 3 meses hasta el desarrollo de PPP | Remisión tras suspensión de CZP y tratamiento tópico con betametasona y clobetasol y sesiones de láser |
ADA: adalimumab; AF: antecedentes familiares; AP: antecedentes personales; AR: artritis reumatoide; CSA: ciclosporina A; CZP: certolizumab pegol; EC: enfermedad de Crohn; ETN: etanercept; H: hombre; IFX: infliximab; M: mujer; MTX; metotrexato; ND: datos no disponibles; NE: no especificado; PPG: psoriasis pustulosa generalizada; PPP: pustulosis palmoplantar; PsoG: psoriasis guttata; PsoP: psoriasis en placas; sc: vía subcutánea; UBV: rayos ultravioleta B.
En la literatura los tipos de psoriasis inducida por anti-TNFα más descritos son: en placas 44,8%, PPP 36,3%, PPG 10,9% y guttata 8%3. La elevada frecuencia con que ocurre la PPP en pacientes tratados con anti-TNFα respecto a la población general (prevalencia 0,12%) sugiere que se trata de un EA específico de estos fármacos. Aunque no siempre es indispensable la retirada del tratamiento, las formas graves como PPP y PPG pueden responder mejor si se discontinúa el anti-TNFα6.
En conclusión, CZP puede asociarse con el desarrollo de psoriasis inducida, al igual que otros fármacos anti-TNFα, independientemente de la indicación, siendo la PPP una de sus formas de presentación más frecuentes.