Actualizar las recomendaciones para el manejo de pacientes con espondiloartritis (EspA) en la población mexicana e identificar las variables que podrían influir en el manejo del paciente.
Material y métodosUn grupo de 15 expertos en EspA tradujo, analizó y modificó las recomendaciones del Colegio Mexicano de Reumatología (CMR) y del grupo Sociedad Internacional de Evaluación de las Espondiloartritis (ASAS)/Liga Europea contra el Reumatismo (EULAR) del 2016 a través de la revisión sistemática de la literatura realizada por dos revisores externos en el período de 2015 a 2018 utilizando los niveles de GRADE y Oxford y el porcentaje de concordancia (Delphi).
ResultadosEn comparación con las recomendaciones anteriores, no hubo cambios significativos desde el año 2015. Sin embargo, modificamos los 5 principios fundamentales y reducimos el número de recomendaciones a 10 por la incorporación de la primera en el texto, la combinación de 5 recomendaciones en 2 y la adición de una nueva. Confirmamos la tendencia del uso de glucocorticoides para pacientes con actividad inflamatoria y escaso acceso a productos biológicos. Se identificaron las características sociodemográficas y clínicas de los pacientes con EspA y su posible influencia en la aplicación de las recomendaciones.
ConclusionesLas 10 recomendaciones del CMR y el análisis de las características de los pacientes mexicanos con EspA se centran en el tratamiento escalonado con medios farmacológicos y no farmacológicos, fácilmente accesibles, o por el contrario sustancias de alta tecnología para un pequeño porcentaje de la población.
To update the recommendations for the management of patients with Spondyloarthritis (SpA) in the Mexican population, and identify which variables could influence patient management.
Material and methodsA group of 15 experts in SpA translated, analyzed and modified the recommendations of the Mexican College of Rheumatology (CMR) and the International Society for the Assessment of Spondyloarthritis (ASAS)/European League Against Rheumatism (EULAR) 2016 group through a systematic review of the literature by two external reviewers during the period from 2015 to 2018 using the grade of recommendation, Oxford levels of evidence, percentage of concordance (Delphi).
ResultsCompared to previous recommendations, there were no significant changes from the year 2015. However, we modified the five fundamental principles and reduced the number of recommendations to ten by incorporating the first item in the text and combining five recommendations into two and adding a further recommendation. We confirmed the tendency to use glucocorticoids for patients with inflammatory activity and scarce access to biologicals. We identified the sociodemographic and clinical characteristics of patients with SpA and their influence on the application of the recommendations.
ConclusionsThe ten recommendations of the CMR and the analysis of the characteristics of the Mexican patients with SpA focussed on step therapy, including pharmacological and non-pharmacological therapies, in a spectrum from easily accessible to high-tech substances available to a small percentage of the population.
Las recomendaciones o guías para el manejo o tratamiento de las enfermedades reumáticas se han convertido en documentos fundamentales para la identificación de enfermedades, la evaluación de manifestaciones clínicas y terapéuticas apoyadas en evidencias. El beneficio de contar con este tipo de documentos se refleja en el control oportuno de la enfermedad, la salud del paciente, un mejor aprovechamiento de los recursos y una reducción del costo del tratamiento1,2.
En 2005, publicamos una revisión de la literatura acerca de la eficacia y seguridad de los agentes biológicos en pacientes con espondilitis anquilosante (EA)3. Un año después, las Guías y Recomendaciones del Colegio Mexicano de Reumatología (CMR) para el uso de agentes biológicos en enfermos reumáticos que incluyeron la artritis reumatoide, la artritis psoriásica (APs), la artritis idiopática juvenil, el lupus eritematoso generalizado y particularmente la EA4. bEn dicho estudio encontramos que el 61% de los expertos mexicanos estuvieron de acuerdo con la propuesta hecha por la Sociedad Internacional de Evaluación de las Espondiloartritis (ASAS, por sus siglas en inglés) y la Liga Europea Contra el Reumatismo (EULAR, por sus siglas en inglés) para la administración inicial de agentes biológicos modificadores del curso de la enfermedad (FARMEb)5. Después, encuestamos a 253 reumatólogos certificados por el Consejo Mexicano de Reumatología A.C. y encontramos que más del 75% de ellos estuvieron de acuerdo con las 10 recomendaciones de ASAS/EULAR6.
El presente es un documento que actualiza las recomendaciones para el tratamiento y manejo de las epondiloartritis axial (EspAax) radiográfica (EspAax-r) y no radiográfica (EspAax-nr) y la espondiloartritis periférica (EspAper), sin incluir la APs, basado en las recomendaciones desarrolladas y publicadas por el grupo ASAS/EULAR en el 20167. Este trabajo cumple además con nuestro papel como vectores de dichas recomendaciones, ya que este documento trata de los aspectos educativo y académico del médico y la necesidad de información y conocimientos acerca del paciente para tomar decisiones junto a sus familiares y médicos. Avaladas por el CMR, estas recomendaciones se constituyen en la postura oficial de nuestra agrupación en la propuesta más importante para su implementación en los sistemas de salud correspondientes.
Material y métodosGrupo de expertosSe conformó un grupo de 14 reumatólogos con conocimientos y publicaciones en cualquiera de las siguientes áreas: EspAax, recomendaciones y guías terapéuticas, práctica clínica en los diversos estados y sistemas de salud del país. El comité ejecutivo (CE) estuvo integrado por los investigadores principales, la coordinadora del proyecto y dos vocales. Sus funciones consistieron en la planeación y la ejecución del proyecto, la elaboración de las agendas de trabajo y la edición de las recomendaciones. La revisión sistemática de la literatura (RSL) fue llevada a cabo por dos investigadores independientes.
El CE seleccionó el equipo de expertos, los temas y subtemas relacionados con la definición, el concepto y la clasificación de la EspA, similitudes o discrepancias demográficas y clínicas en comparación con otras poblaciones, incluyendo su impacto global. Asimismo, elaboró las preguntas clínicas y de investigación tomando el modelo de ASAS/EULAR8, pero no limitándose a él, para llevar a cabo la RSL inicial.
Revisión sistemática de la literaturaEl CE y los investigadores independientes transformaron las preguntas clínicas en preguntas de investigación abarcando los siguientes temas: actividad inflamatoria, deterioro estructural, mejoría, remisión parcial, enfermedad inactiva, actividad moderada, actividad alta, actividad muy alta, mejoría clínica importante, mejoría clínica muy importante, calidad de vida y estado de salud. Además, optaron por recuperar información sobre la seguridad y eficacia de tratamientos farmacológicos, no farmacológicos y quirúrgicos de estudios posteriores a la RSL realizada para la actualización ASAS/EULAR del año 20167.
El período de búsqueda de literatura en las bases de datos se situó entre enero del 2015 y marzo del 2018, considerando que la mayor parte de la información previa a enero del 2015 fue obtenida, analizada y publicada por ASAS/EULAR7-9. Se eligieron metaanálisis, revisiones sistemáticas, ensayos clínicos controlados y aleatorizados, ensayos clínicos controlados y ensayos clínicos de extensión identificados en PubMed, Ovid-Medline, Cochrane Library, Scopus, Science Direct y CINAHL.
De acuerdo con la estructura PICO (por sus siglas en inglés de Patient or problem, Intervention, Comparison, Outcomes), la elegibilidad de los artículos se basó en: 1) pacientes >18 años con diagnóstico de EspA; 2) intervención terapéutica farmacológica con agentes sintéticos modificadores del curso de la enfermedad convencionales o biológicos (FARMEsc o FARMEb, respectivamente), antiinflamatorios no esteroideos (AINE), glucocorticoides y otros, no farmacológica (ejercicio y programas de información) y quirúrgica; 3) comparación de las intervenciones con diferente régimen o dosis, placebo o ninguna; 4) desenlaces, incluyendo Ankylosing Spondylitis Disease Activity Score (ASDAS, por sus siglas en inglés), Bath Ankylosing Spondylitis Disease Activity Index (BASDAI, por sus siglas en inglés) y funcionalidad Bath Ankylosing Spondylitis Functional Index (BASFI, por sus siglas en inglés), criterios de mejoría ASAS 20, ASAS 40, ASAS 5/6, ASAS-remisión parcial (PR, por sus siglas en inglés), dolor, proteína C reactiva (PCR), índices radiográficos como el Bath Ankylosing Spondylitis Radiology Index (BASRI, por sus siglas en inglés), modified Stoke Ankylosing Spondylitis Spinal Score (mSASSS, por sus siglas en inglés), Radiographic Ankylosing Spondylitis Spinal Score (RASS, por sus siglas en inglés) e índices para la resonancia magnética del grupo especial de ASAS, Berlin and Leeds, y el Spondyloarthritis Research Consortium of Canada (SPARCC, por sus siglas en inglés)10-18.
La calidad de evidencia de los artículos se evaluó de acuerdo con el documento Calificación de Recomendaciones, Desarrollo y Evaluación (GRADE, por sus siglas en inglés), basado en el riesgo de sesgo, consistencia, resultados directos, heterogeneidad, precisión y sesgo de publicación, y el nivel de evidencia del Centro de Medicina Basada en la Evidencia de Oxford (OCEBM, por sus siglas en inglés)19,20.
Reuniones de trabajoEn la primera reunión, los expertos presentaron las características y definiciones principales en el manejo de las EspA al pleno del comité, se discutieron las circunstancias y opciones terapéuticas que existen en México y se dieron indicaciones para la RSL con base en diferentes preguntas de investigación.
En la segunda, se revisaron los resultados de la RSL y se siguieron las 13 recomendaciones de la actualización ASAS/EULAR de forma estructurada, discutiendo la actualidad de las evidencias7. La coordinadora del estudio presentó al pleno cada tema, subtema y recomendación; acto seguido, cedió la palabra a cada uno de los expertos para que en menos de 5 minutos expusieran los motivos para votar a favor o en contra de lo propuesto. La votación siguió la técnica Delphi en forma positiva o negativa de acuerdo con los siguientes niveles (>80% en la primera vuelta, <75% en la segunda y <60% en la tercera). Se siguió un orden prioritario de recomendaciones con adaptación al conocimiento del contexto nacional, experiencia de los expertos y evidencia actualizada.
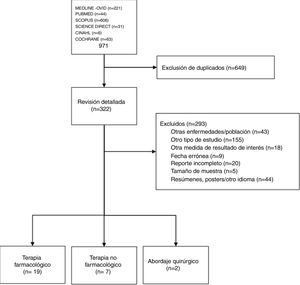
ResultadosRevisión sistemática de la literaturaObtuvimos 322 artículos para revisarlos a profundidad (fig. 1). De estos, 28 artículos cumplieron criterios para ser incluidos en la revisión final: 19 acerca del tratamiento farmacológico (material suplementario, anexo 1), 7 sobre terapia no farmacológica y 2 sobre el abordaje quirúrgico (material suplementario, anexo 2).
Principios fundamentales y recomendacionesEl formato ASAS/EULAR incluye 5 principios fundamentales para el manejo de pacientes con EspA y 13 recomendaciones desarrolladas a partir de ellos. Aunque este formato está presente en todos los juegos de recomendaciones elaboradas por EULAR, nuestro grupo prefirió no separar y sí incluir los principios fundamentales como parte del texto de las recomendaciones ya que si bien tratan de principios genéricos no consideramos que existiese una gran diferencia con respecto a las recomendaciones individuales.
Se analizaron el significado de las preguntas y las respuestas actualizadas. La información concerniente a las recomendaciones 1, 2, 3, 4, y 5 excedió la capacidad de la RSL y no fue suficiente para modificar su sentido. Por otro lado, no encontramos información actualizada sustancial relacionada con las recomendaciones 6, 7, 8, 9, 10, 11, 12 y 13. Las tablas y los detalles de exclusión y de cada estudio incluido se presentaron en la segunda reunión presencial con los expertos. Es así que la RSL que incluyó los artículos de los últimos 2 años no llevó a cambios importantes con relación a las recomendaciones de ASAS/EULAR 20167. Pero, el grupo de expertos mexicano dejó en claro la recomendación, modificación, cambio o sustitución de alguna de las recomendaciones ASAS/EULAR en la tabla 1, que muestra las 10 recomendaciones mexicanas y el porcentaje de acuerdo.
Recomendaciones mexicanas para el manejo de las espondiloartritis
| Recomendación | Nivel de evidencia | Grado de recomendación | Acuerdo (%) | |
|---|---|---|---|---|
| 1 | Individualizar el tratamiento de la EspAax según síntomas y signos presentes en la visita (manifestaciones axiales, periféricas y extraarticulares), características del paciente, comorbilidades y factores psicosociales | 5 | D | 80 |
| 2 | Monitorizar el efecto del tratamiento, según lo reporte el paciente, hallazgos clínicos, pruebas de laboratorio y estudios de imagen obtenidos con instrumentos apropiados. La frecuencia del monitorización será individual, dependiendo de los síntomas, su gravedad y tratamiento | 5 | D | 100 |
| 3 | Guiar el tratamiento hacia un blanco terapéutico previamente determinado | 5 | D | 100 |
| 4 | Promover el aprendizaje del paciente con respecto a la enfermedad; alentar su participación en actividades que impliquen ejercicio constante y evitar que fumea | 2, 5, 1a | B, D, A | 100 |
| 5 | Evitar la prescripción de FARMEsc en pacientes que solo tengan síntomas axiales. Considerar el uso de sulfasalazina en pacientes con artritis periférica | 4 | C | 100 |
| 6 | Prescribir AINE —primera línea de tratamiento, dosis máxima recomendable, tomando en cuenta riesgos y beneficios— para la reducción del dolor y la rigidez articular. En los pacientes que mejoraron, prescribir el tratamiento con AINE de acuerdo con la reaparición de los síntomas. Prescribir paracetamol y medicamentos parecidos a los opioides en caso de dolor residual cuando otros tratamientos estén contraindicados o sean poco tolerados | 1a, 5 | A, D | 80 |
| 7 | Considerar la aplicación de glucocorticoides inyectables en sitios de inflamación músculo-esquelética, específicamente articulaciones, bolsas y vainas sinoviales. Recomendar el uso de glucocorticoides por la vía oral o intramuscular en pacientes con actividad inflamatoria persistente, altamente discapacitante. En ambos casos, la prescripción de glucocorticoides solo será recomendable cuando los tratamientos con AINE, analgésicos parecidos a los opioides, descanso, terapia física o rehabilitación estén contraindicados o sean poco tolerados por el paciente y especialmente cuando el paciente no tenga acceso a FARMEbb | 2, 5 | B, D | 100 |
| 8 | Considerar el uso de FARMEb en pacientes con actividad persistente a pesar de haber recibido tratamientos convencionales. Hasta ahora, se suele iniciar el tratamiento indistintamente con iFNT e iIL-17A como primera línea. En el paciente que no haya mejorado o que haya recaído, se deberá considerar el uso de iFNT diferente o iIL-17A. Considerar la reducción de FARMEb en caso de que la actividad de la enfermedad se encuentre en una etapa de remisión sostenida. Considerar la prescripción de biocomparables en cuanto se tenga información pertinente acerca de su eficacia y seguridad | 1a, 1b | A | 80 |
| 9 | Considerar el reemplazo de cadera y la osteotomía vertebral correctiva en pacientes con dolor y discapacidad persistentes, alteraciones radiográficas graves, independientes de la edad, en centros y personal con experiencia | 4 | C | 100 |
| 10 | Considerar la situación socioeconómica, el nivel educativo y la opinión del enfermo y sus familiares en el proceso de decidir el manejo de los problemas del enfermo | 4 | C | 100 |
Niveles de evidencia. Evidencia proveniente de 1a: Metaanálisis de ensayos clínicos controlados aleatorizados; 1b: Por lo menos un ensayo clínico controlado aleatorizado; 2a: Por lo menos un ensayo clínico controlado sin aleatorización; 2b: Por lo menos un estudio cuasi-experimental; 3: Estudios descriptivos; 4: Reporte, opiniones y/o experiencia clínica de autoridades (expertos) en el tema de referencia; 5: Cualquiera de los anteriores, útil para reportar grado de recomendación no concluyente de forma independiente del nivel de evidencia.
Grado de recomendación. A: Estudios nivel 1; B: Estudios nivel 2 o 3 o extrapolaciones de estudios nivel 1; C: Estudios nivel 4 o extrapolaciones de estudios niveles 2 o 3; D: Evidencia inconsistente o no concluyente de estudios de cualquier nivel.
En los últimos años, se han comunicado resultados sobre diferentes programas de ejercicios supervisados, en casa y otros, los resultados son todavía inconsistentes en términos de diseño, sin embargo, todos presentan resultados favorecedores (material suplementario, anexo 2).
En México, el acceso a FARMEb es limitado, los expertos del presente estudio coincidieron en que consiste en una alternativa que debe comunicarse.
Fuente: Basadas en las recomendaciones emitidas por ASAS/EULAR, el documento de acuerdo de los reumatólogos mexicanos del año 2006 y la revisión sistemática de la literatura de los últimos 2 años y reunión de expertos llevada a cabo ex profeso en el año 2018.
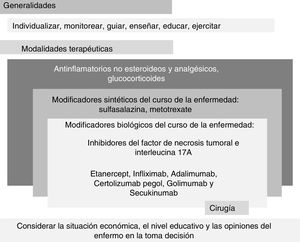
Además, a través del análisis de las 10 recomendaciones se estratificó la información en el modelo conocido como palimpsesto (fig. 2).
Esquema en estilo «palimpsesto» de las recomendaciones mexicanas para el manejo de la espondiloartritis que resulta del texto de la tabla 1. El esquema está dividido en dos grandes partes, «Generalidades» y «Modalidades terapéuticas». La primera está relacionada con los principios fundamentales; la segunda, con las modalidades terapéuticas.
A diferencia del flujograma tradicional en el que la sustitución de una modalidad terapéutica por otra es una constante y en la que por ende los cambios son absolutos y escalonados —por ejemplo, el enfermo que no mejoró con antiinflamatorios cambia a modificadores sintéticos de la enfermedad; y si tampoco mejora con estos se sustituye por modificadores biológicos, pasando de un escalón a otro—, nuestro esquema se basa en la agregación y superposición en remembranza del estilo palimpsesto. Con este modelo, se presentan las recomendaciones y los cambios terapéuticos en un formato muy cercano a la práctica clínica. En general, dicho cambio implica agregar y quizá luego sustituir las modalidades terapéuticas. Por ejemplo, no cambiamos prednisona por sulfasalazina, ni esta por etanercept antes de haberse demostrado la pérdida de eficacia del primero y la certeza de la eficacia del segundo, sino que agregamos una modalidad novedosa y con mayor eficacia a otra ya pasada en la cual no se obtuvo la eficacia esperada. De acuerdo con la opinión de los expertos, la proporción de enfermos que es tratada con los medicamentos que aparecen en las recomendaciones 5 a 8 es mucho mayor que la proporción que es tratada con cirugía. Asimismo, la proporción que recibe sulfasalazina es mayor que la que recibe modificadores sintéticos de la enfermedad. Aunque parece contradictorio, los modificadores sintéticos de la enfermedad no reducen o detienen el empeoramiento progresivo de la enfermedad. Con respecto a los biológicos, el efecto antiinflamatorio puede ser tan grande que la velocidad y deterioro en la estructura de las articulaciones y entesis sea menor. La recomendación 10 es de suma importancia ya que se refiere al acceso de la población con la enfermedad a los tratamientos con mayor eficacia, seguridad e inductor de la remisión.
Los temas relacionados con el perfil de los pacientes mexicanos con EspA abarcan la definición, el concepto y la clasificación, las similitudes o discrepancias demográficas y clínicas. En parte, el propósito de este apartado fue investigar las características de nuestra población y los aspectos estructurales y logísticos para determinar si existía o no compatibilidad con las recomendaciones terapéuticas del grupo ASAS/EULAR.
I. Definición, concepto y clasificación. Se tomó en cuenta el cambio en la definición y el concepto del grupo ASAS. EspAax es el término definitorio de la entidad caracterizada por inflamación aguda y crónica en la membrana sinovial y proliferación ósea en las entesis de las articulaciones sacroilíacas, intervertebrales, interapofisiarias y sitios periféricos7,21,22. Las manifestaciones predominantes determinan la EspAax21,23,24 o la forma periférica (EspAper)25, las alteraciones en las articulaciones sacroilíacas, en las variedades radiográfica, específicamente la EA16,21,26, y la no radiográfica (EspAax-nr)21,23. Las entidades incluidas en el grupo de EspA continúan en forma independiente, específicamente APs, artritis reactiva y artritis asociada a enfermedades inflamatorias intestinales y EspA indiferenciada. Los cambios en la clasificación, específicamente APs, no han sido aceptados por todos los expertos27,28. En este trabajo, adoptamos la clasificación del grupo ASAS23,25, conservamos la nomenclatura, definición y clasificación de las EspA realizadas por el Grupo Europeo para el Estudio de las Espondiloartropatías (ESSG, por sus siglas en inglés)29 y la definición de EA de acuerdo con la modificación de los criterios de New York26.
II. Manifestaciones sociodemográficas y clínicas de relevancia: comparación con otras poblaciones. En nuestro país, la EspAax ocurre con mayor frecuencia en hombres que tienen el antígeno de histocompatibilidad HLA-B27 y alrededor de 30 años al inicio de los síntomas30-33. Entre las mujeres, el espectro clínico es más amplio e incluye la afección de sitios periféricos, superposición con fibromialgia y menor respuesta a FNTi (factor de necrosis tumoral, inhibidor). En comparación con las poblaciones europea y latinoamericana, se ha observado que, en las dos últimas, existe una mayor prevalencia de síntomas axiales y menor en sitios periféricos, así como más años al inicio de los síntomas30-35. Sin embargo, el grupo de expertos consideró que, en general, no existen diferencias importantes entre las EspA que se identifican en el resto del mundo.
III. Impacto epidemiológico. La prevalencia de las EspA (ESSG) en México es del 0,6% (IC95%: 0,4, 0,9); la de EspAax es del 0,3% (abordaje con estudios de imagen) y del 0,09% (con HLA-B27 como abordaje)36. La prevalencia de EA es del 0,1% (IC95%: 0,02, 0,2). Las EspAax se encuentran en las primeras 5 causas de atención en clínicas especializadas37. La prevalencia del HLA-B27 en la población general y en controles sanos en los estudios de asociación es del 1 al 4%38,39.
IV. Capacidad funcional, calidad de vida y estado de salud. En un porcentaje importante, el efecto de la EspA en la capacidad funcional, la calidad de vida y el estado de salud representa una carga que afecta al paciente y su entorno. Estudios, dentro y fuera de las instituciones de asistencia médica, han reportado que el costo de las EspA ocupa un alto porcentaje cuando se mide a través de gastos de bolsillo y empobrecimiento, costos directos e indirectos y finalmente invalidez temporal y permanente. El estado de salud de los pacientes con EspAax es menor en comparación con la población general (aceptado para publicación). Más de la mitad de los pacientes con EspA en México considera que su estado de salud es malo40,41.
V. Supervivencia y comorbilidad. Con respecto a la supervivencia, no se cuenta con información precisa acerca de este tema. Las enfermedades concomitantes más frecuentes son: osteoporosis, enfermedad ácido-péptica y afectación cardiovascular42,43. Aunque se desconoce con exactitud, dada la alta prevalencia de obesidad y diabetes, además del subdiagnóstico de hipertensión arterial en México, es posible que la prevalencia de síndrome metabólico en mexicanos con EspA sea importante44.
VI. Acceso a tratamientos de alta eficacia y costo elevado. Es un hecho que no existe equidad terapéutica en nuestro país. Alrededor del 50% de la población mexicana tiene acceso a los sistemas de salud con cobertura completa como es el caso del Instituto Mexicano del Seguro Social, el Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado, Petróleos Mexicanos, la Secretaría de la Defensa Nacional, sistemas de prepago a bancos y otras organizaciones y sistemas de cobertura estatal y municipal. Sin embargo, la segunda mitad de la población no cuenta con un servicio médico que cubra el costo de este tipo de enfermedades; para ellas, existen el seguro popular y la Secretaría de Salud las cuales no tienen la capacidad necesaria para costear enfermedades crónicas como la EspA y muchas más. El costo de este tipo de tratamientos corre a cargo del paciente y su familia; en el caso de la artritis reumatoide y posiblemente EspA, mientras mayor sea el porcentaje de gasto de bolsillo en las familias, mayor es el empobrecimiento39,40,45.
DiscusiónCon el respaldo del CMR, se reunió un grupo de expertos en aspectos clínicos, evaluación y tratamiento de las EspA y desarrolló las recomendaciones correspondientes a partir del análisis, la corrección, edición y la adaptación transcultural de las publicadas por el grupo ASAS/EULAR en el 20167. En el año 2006, más del 75% de 253 reumatólogos certificados por el Consejo Mexicano de Reumatología estuvieron de acuerdo con las 10 recomendaciones de ASAS/EULAR6. Las recomendaciones mexicanas actuales concuerdan con resultados previos y con las recomendaciones actuales.
La diseminación y adaptación de las recomendaciones del grupo ASAS/EULAR ha sido una labor importante desde su primera edición46-54. Nuestra versión no profundizó en los 5 principios fundamentales, un apartado «europeo» que aparece en todas las recomendaciones terapéuticas en las que participa EULAR, ya que para nosotros resultó ser una redundancia. La redacción de las recomendaciones mexicanas es sencilla y puntual, lo que las hace accesibles a la mayoría de los médicos y no médicos interesados que participen en labores administrativas y en la toma de decisiones.
El hallazgo de 6 de los temas con mayor influencia en el manejo de los pacientes en México con EspA nos permitió dimensionar la enfermedad y sus repercusiones y conceptualizar la EspA en una alta proporción de adultos jóvenes con síntomas y signos en articulaciones y entesis periféricas, un gran impacto en el estado de salud, la calidad de vida y el gasto por la enfermedad40. Desafortunadamente, se coincidió en la certeza de que el acceso limitado a las terapias actuales en México es un determinante importante en el estado de salud del enfermo.
A pesar de los avances en el tratamiento, desde la edición previa de los criterios ASAS/EULAR, no encontramos cambios importantes. La mayor parte de las diferencias estuvo relacionada con la adición de dos recomendaciones y la incorporación del esquema de tratamiento dirigido al blanco (T2T, por sus siglas en inglés). Al respecto, es importante señalar que T2T es sujeto de controversia en el momento actual ya que no se encuentra definido el blanco de tratamiento en las EspA debido a que en realidad se podría referir a dos fenómenos asincrónicos: la inflamación como fenómeno inicial y la proliferación ósea como un fenómeno tardío. Mientras que el uso de FARMEb es capaz de reducir la inflamación al bloquear citocinas proinflamatorias, lo segundo aún no se ha logrado55.
La RSL de los 2 últimos años que alimentó el presente consenso integró nuevos elementos: 1) la plataforma con datos acerca del perfil del paciente de nuestro país; 2) el uso de glucocorticoides; 3) la eficacia del primer bloqueador de IL-17A, secukinumab, y 4) la posibilidad de usar biocomparables como parte del tratamiento. Además, la RSL incorporó ciertas precisiones en algunas recomendaciones (tabla 1). Entre estas, se encuentran la falta de eficacia de FARMEsc, que excluye la posibilidad de tratamiento con sulfasalazina, metotrexato y leflunomida. Sin embargo, alrededor del 40% de los reumatólogos en el mundo parecen estar convencidos de su eficacia de una u otra manera56-58.
Por otro lado, y a diferencia de ASAS/EULAR, los reumatólogos mexicanos consideran que la administración oral y parenteral de glucocorticoides tiene un lugar importante en el manejo de las EspA. Es necesario precisar, sin embargo, que nuestro grupo desalienta el uso de infiltraciones o inyecciones de glucocorticoides en las entesis, vainas tendinosas o tendones. No así en el interior de las articulaciones o bursas sinoviales que en opinión de los expertos son eficaces en el caso de inflamación. Aún más, el uso sistémico (oral o parenteral) de glucocorticoides se encuentra indicado en casos graves que no respondieron al tratamiento habitual, como por ejemplo, manifestaciones oculares, intestinales y renales. La dosis y la duración del tratamiento dependen del sitio afectado.
Aunque, en general, las guías para el tratamiento de la EA del Colegio Americano de Reumatología, la Asociación Nacional de EA y la Red para el Tratamiento e Investigación de las EspA llegan a las mismas conclusiones que las recomendaciones del grupo ASAS/EULAR, nos llamó la atención que el uso sistémico de cualquier forma de glucocorticoides estuviera prohibido en pacientes con EA59. La experiencia del reumatólogo en México indica que el uso de glucocorticoides por las vías oral, parenteral y local resulta en la disminución de la intensidad de la inflamación y síntomas asociados, especialmente en pacientes con artritis y entesitis periféricas, y aún más, en casos de afección inflamatoria en la columna vertebral y en las articulaciones sacroilíacas6. Es importante señalar que la controversia acerca del uso de glucocorticoides no se encuentra sustentada en evidencias sino en la experiencia individual, especialmente en pacientes sin acceso a FARMEb. Las recomendaciones de la Sociedad Española de Reumatología para uso de TNFi y otros biológicos sigue esta corriente en forma esencial60.
Las recomendaciones ASAS/EULAR dedican tres apartados al uso de FARMEb que, en la contraparte mexicana, se encuentran en uno solo y que incluye una nota breve acerca de los biosimilares. Los criterios para iniciar el tratamiento con FARMEb siguen siendo los mismos: 1) diagnóstico de EspA (por un reumatólogo) y 2) aumento en la concentración sérica de PCR y/o sacroilitis en la RM (edema óseo en secuencias con supresión de grasa) y/o en las radiografías (grado 2 bilateral o 3 o 4 unilateral). Además, haber usado dos AINE por 2 semanas cada uno en todos los pacientes; en aquellos con manifestaciones periféricas, haber probado una inyección local y sulfasalazina por un tiempo razonable sin mejoría. Finalmente, deberá confirmarse un grado alto de actividad con ASDAS (mayor de 2.1) y BASDAI (mayor de 4)5.
En la primera línea de tratamiento FARMEb se encuentran los bloqueadores del FNT y el inhibidor de IL-17A. Tratándose del control de la actividad inflamatoria y síntomas asociados, han demostrado ser eficaces a corto y largo plazo. Pero, algunos reportes con poca evidencia aducen la pérdida de la eficacia de los FNTi a lo largo de los años a mecanismos poco claros, entre los que se encuentra la neutralización de la molécula del biológico por anticuerpos61,62. Aun así, está justificado el cambio a otro agente con el mismo blanco o con el inhibidor de IL-17A.
La RSL de lo publicado en los 2 últimos años confirmó la eficacia y seguridad de FNTi e inhibidores de IL-17 en comparación con placebo. En la mayoría de los pacientes, el efecto benéfico de FNTi se mantiene a largo plazo63-66. En las radiografías, el empeoramiento parece retrasarse; en la RM, la mejoría es importante. La interpretación de estos datos ha sido difícil, pero mientras el efecto del biológico sobre la inflamación sigue siendo notable, el efecto sobre el deterioro desde el punto de vista radiográfico es aún incierto (material suplementario, anexo 1).
La remisión sostenida, de 6 a 12 meses, medida a través de los criterios de remisión parcial de ASAS o el índice ASDAS podría considerarse como suficiente motivo para reducir la dosis o alargar el intervalo entre las aplicaciones como primer paso en la interrupción o suspensión definitiva del biológico62-67. Sin embargo, aún no se han definido la recaída y mucho menos los criterios para el re-tratamiento. Con relación al uso de «biocomparables», la información es aún escasa; básicamente se refiere a la comparación de infliximab y su biosimilar, en la que no se encontraron diferencias significativas entre los grupos68.
Finalmente, dos artículos abordan la corrección de deformidades graves en la columna vertebral utilizando técnicas diferentes. Los resultados reportados han sido buenos, pero la aparición de complicaciones graves es relativamente frecuente (material suplementario, anexo 1).
ConclusionesLas 10 recomendaciones para el manejo de los pacientes con EspA tratan del análisis, la corrección, edición y adaptación transcultural de las recomendaciones publicadas recientemente por ASAS/EULAR y las surgidas en la discusión de los expertos mexicanos. Pensamos que las recomendaciones originales y las que incorporan el CMR reflejan el perfil del paciente con EspA en nuestro país.
Esperamos que esta edición no solamente responda al tratamiento científico de problema, sino que las autoridades mexicanas tengan los elementos demográficos, socioeconómicos y clínicos para implementarlas en el sistema de salud mexicano.
FinanciaciónLa compañía Novartis otorgó una financiación al «comité ejecutivo para la elaboración de recomendaciones para el manejo de las espondiloartropatías» para los gastos de transportación, hospedaje, búsqueda y análisis bibliográfico. Asimismo, declaramos que ninguno de los miembros del comité para la elaboración de las recomendaciones para el manejo de las espondiloartritis ni miembros de la mesa directiva del Colegio Mexicano de Reumatología recibieron compensación o pago alguno.
Conflicto de interesesNinguno en relación con el presente consenso.
El comité para el desarrollo de las Recomendaciones mexicanas para el manejo de las espondiloartritis muestra su agradecimiento al Colegio Mexicano de Reumatología AC, a los doctores Wayra Paz y Joaquín Herrera de la compañía Elsevier por el análisis y revisión bibliográfica y a la compañía Novartis por el apoyo irrestricto a las labores de nuestro comité.
La postura del Colegio Mexicano de Reumatología con respecto a la terminología es utilizar «medicamento biotecnológico innovador» y «medicamento biocomparable» en lugar de «biológico» y «similar». http://go.medicaleconomics.com/acton/attachment/12262/f-000a/1/-/-/-/-/BIOCOMPARABLES 2015 -FINAL- JAT (6).pdf
- Inicio
- Todos los contenidos
- Publique su artículo
- Acerca de la revista
- Métricas
- Read in English
- Descargar PDF
- Bibliografía
- Material adicional