Analizar la eficacia y la seguridad de los antiinflamatorios no esteroideos (AINE) en ancianos.
MétodosRevisión sistemática. Se definió una estrategia de búsqueda bibliográfica sensible en MEDLINE (desde 1961), EMBASE (desde 1980) y Cochrane Library (hasta diciembre de 2007); se definió la población (ancianos: sujetos mayores de 60 años, con enfermedades reumáticas), la intervención (AINE) y los resultados; variables de eficacia (dolor, función, calidad de vida) y de seguridad (toxicidad gastrointestinal, renal y cardiovascular). Se incluyeron ensayos clínicos (EC) de 4-5 en la escala de Jadad y estudios de cohortes de máxima calidad.
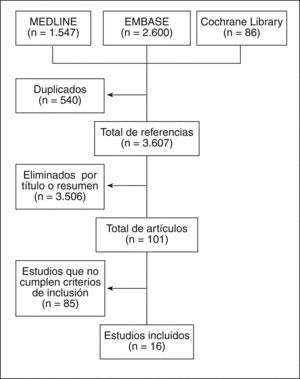
ResultadosSe seleccionaron 101 artículos para lectura en detalle, de los que se incluyeron 16, que analizaron más de 50.000 ancianos, con un seguimiento que varió desde 1 semana a 4 años. Destaca la gran diversidad en cuanto al tipo de AINE y las medidas de desenlace. Se incluyeron 4 metaanálisis, 9 EC, 2 estudios de cohortes y un estudio de prevalencia. La mayoría de estos estudios analizaron a pacientes con osteoartrosis o artritis reumatoide. Los AINE en el anciano se han mostrado eficaces para el control del dolor de origen reumático, la rigidez y la función articular, pero presentan un riesgo aumentado de cualquier evento grave, especialmente gastrointestinal (muerte, hospitalización, hemorragia, ulcus u obstrucción digestiva). Este riesgo disminuye al asociarse un protector gástrico.
ConclusionesDe acuerdo con la evidencia recogida, el uso de AINE es eficaz para el tratamiento de ancianos con enfermedades reumáticas, aunque también presenta un riesgo aumentado de evento adverso grave, sobre todo de origen gastrointestinal.
To analyze the efficacy and safety of nonsteroidal anti-inflammatory drugs (NSAID) in the elderly.
MethodsWe performed a systematic review using a sensitive search strategy. All studies published in MEDLINE (since 1961), EMBASE (since 1961) and Cochrane Library (up to December 2007) were selected. We defined the population (elderly as subjects aged 60 years or above with musculoskeletal diseases), the intervention (use of NSAID), and the results related to efficacy (pain, function and quality of life) and safety (gastrointestinal, cardiovascular or renal toxicity).
Randomized clinical trials (RCT), (Jadad 4 or 5) and high quality cohort studies were included.
ResultsA total of 101 studies were analyzed in detail, and 16 were included. More than 50,000 patients aged 60 years or above were analyzed from 1 week, up to 4 years. Different NSAID were included as well as different outcomes. Four meta-analyses, 9 RCT, 2 cohort studies, and one cross-sectional study were included. NSAID are effective for the treatment of musculoskeletal pain, stiffness or joint function. However, NSAID are associated with an increased risk of any serious adverse events, especially serious gastrointestinal adverse events (death, hospitalization, bleeding, ulcers, obstruction). This risk decreased with the use of proton pump inhibitors.
ConclusionsBased on the evidence, NSAID in the elderly are effective for the treatment of different musculoskeletal diseases, although the risk of serious adverse events (mainly gastrointestinal) is also clearly increased.
El uso de antiinflamatorios no esteroideos (AINE) es muy frecuente en pacientes con enfermedades reumáticas, especialmente en procesos degenerativos como la artrosis, y en enfermedades inflamatorias como la artritis reumatoide.
De acuerdo con estudios en población general, los ancianos parecen ser más susceptibles a desarrollar eventos adversos relacionados con el uso de AINE, especialmente de origen digestivo, de hecho, algunos estudios han puesto de manifiesto que los ancianos tienen un riesgo 5 veces mayor de toxicidad gastrointestinal por estos fármacos1–3. Múltiples factores parecen estar implicados en el desarrollo de la toxicidad gastrointestinal inducida por los AINE en ancianos. Entre éstos destacan el daño directo en la mucosa digestiva, la inhibición de prostaglandinas protectoras endógenas, el aumento del tiempo de hemorragia y la posible disminución de la capacidad de eliminación de estos fármacos que produciría mayores concentraciones sanguíneas4,5.
Pero además, y en probable relación con la inhibición de prostaglandinas, en pacientes ancianos se han descrito alteraciones en la función renal relacionadas con los AINE, que pueden causar importantes cambios en el filtrado glomerular y en la presión arterial, y en pacientes con disfunción ventricular, un mayor riesgo de desarrollar insuficiencia cardíaca congestiva6,7.
A todo lo previamente comentado hay que añadir el hecho de que en los ancianos es muy frecuente la asociación de otras enfermedades y medicamentos que pueden influir en la toxicidad inducida por los AINE. Por todo ello, el uso de AINE en poblaciones de alto riesgo, como los ancianos, es de máximo interés y prioridad en nuestro medio, y éste es el objetivo de la presente revisión sistemática.
Material y métodosSe realizó una revisión sistemática para analizar la seguridad del uso de AINE en ancianos. Los criterios de selección de estudios fueron:
- 1.
Estudios que incluyeran ancianos con dolor de origen reumático de más de 1 mes de duración. Se definió anciano como persona con edad o media de edad > 60 años.
- 2.
Estudios en que los pacientes tomaran algún AINE. No hubo restricción en cuanto al tipo y la dosis del fármaco, pero se excluyeron los estudios en que los sujetos tomaran AINE a dosis antiagregantes y no analgésica/antiinflamatoria, así como los tratamientos tópicos.
- 3.
Para evaluar la eficacia de los AINE, se buscaron artículos que analizaran el dolor, la función o la calidad de vida de los ancianos (no se puso restricción en cuanto al tipo de variable empleada para medir estos parámetros). A continuación, y para valorar la seguridad del AINE, se incluyeron estudios en los que analizaran algunas de las siguientes variables: toxicidad gastrointestinal, renal o cardiovascular (tampoco se puso restricción en cuanto al tipo de variable empleada en la medición).
- 4.
En relación con el diseño de los estudios, se incluyeron ensayos clínicos (EC) Jadad 4–5 y estudios de cohortes de máxima calidad. Se excluyeron los estudios en sujetos sanos voluntarios, así como estudios en animales. Finalmente, en relación con el idioma, se seleccionaron artículos en inglés y español.
Se buscó en las siguientes bases de datos electrónicas hasta diciembre de 2007: MEDLINE (desde 1960), EMBASE (desde 1980) y Cochrane Library (Central). Se buscaron tanto términos MeSH como en formato texto libre. No se pusieron límites en cuanto a la fecha de publicación. La estrategia de búsqueda específica se detalla en las tablas 1 y 2. No se realizó búsqueda manual en lo publicado en congresos nacionales (SER) o internacionales (ACR, EULAR) dado el gran volumen de artículos rescatados en las bases de datos electrónicas. Un único revisor analizó los artículos resultantes de la estrategia de búsqueda, así como el análisis en detalle de los artículos incluidos. El resultado de la búsqueda primeramente se depuró por título y resumen o por artículo entero en caso de que no tuviera resumen, mediante sesiones de 20min de duración máxima. Tras este proceso, los artículos restantes se analizaron en detalle. Finalmente, se realizó una búsqueda manual con las referencias de los artículos seleccionados para su análisis en detalle. Todas las referencias se recuperaron de internet y se introdujeron en el programa Procite 5.1 para facilitar su gestión.
Estrategia de búsqueda y resultados en MEDLINE
| Estrategia de búsqueda | Resultados | |
| 1 | Search elderly OR aged OR Oldest Old OR Centenarians OR Centenarian OR Nonagenarians OR Nonagenarian OR Octogenarians OR Octogenarian OR Frail Elders OR Elders, Frail OR Frail Elder OR Frail Older Adults OR aging OR elder OR geriatric OR gerontology OR gerontological OR geriatrics | 2.997.247 |
| 2 | NSAID OR Nonsteroidal Anti-Inflammatory Agents OR Nonsteroidal Antiinflammatory Agents OR Analgesics,Anti Inflammatory OR Non-Steroidal Anti-Rheumatic Agents OR Non-Steroidal Antirheumatic Agents OR Aspirin-LikeAgents OR Agents, Aspirin-Like OR naproxen* OR ibuprofen* OR dexibuprofen OR dexketoprofen OR flurbiprofenOR Ketoprofen OR Ketorola* OR aceclofenac OR diclofenac OR lornoxicam OR meloxicam OR piroxicam OR tenoxicamOR indometacin OR sulindac OR tolmetin OR fenilbutazon OR Phenylbutazone OR nabumeton OR celecoxib OR etoricoxibOR parecoxib OR rofecoxib OR valdecoxib OR lumiracoxib OR salicylic acid OR acetylsalicylic acid OR diflunisalOR Cyclooxygenase 2 Inhibitors OR COX-2 Inhibitors OR COX2 Inhibitors, OR Coxibs | 154.508 |
| 3 | Randomized [All Fields] OR random allocation”[TIAB] NOT Medline[SB]) OR “random allocation”[MeSH Terms] OR randomized[Text Word] OR controlled[All Fields] AND (“clinical trials as topic”[MeSH Terms] OR trial[Text Word]) OR placebo OR blinded | 819.404 |
| 4 | 1 y 2 y 3 | 10.959 |
| 5 | (Musculoskeletal diseases OR Polymyalgia Rheumatica OR Lupus Erythematosus, Systemic OR vasculitis OR polymyositis OR dermatomyositis) OR (musculoskeletal diseases [tiab] OR polymyalgia[tiab] OR “lupus erythematosus systemic”[tiab] OR vasculitis[tiab] OR polymyositis[tiab] OR dermatomyositis[tiab]) | 731.817 |
| 6 | 4 y 5 | 3.081 |
| 7 | acute [All Fields] OR post-operative [All Fields] OR post-surgical[All Fields] OR postsurgical [All Fields] OR Postoperative Complications [MeSH] OR Intraoperative Complications [MeSH] dysmenorrhoea[All Fields] OR orthodontic [All fields] OR Cancer OR neoplasm OR cancers OR tumor OR tumors OR Benign Neoplasms OR metastasis OR metastases | 2.248.303 |
| 8 | 6 NOT 7 | 2.855 |
| 9 | 8 Limits: Humans, Clinical Trial, Meta-Analysis, Randomized Controlled Trial, Clinical Trial, Phase I, Clinical Trial, Phase II, Clinical Trial, Phase III, Clinical Trial, Phase IV, Comparative Study, Controlled Clinical Trial, English, Spanish, Aged: 65+ years, 80 and over: 80+ years | 1.549 |
Estrategia de búsqueda y resultados en EMBASE
| Estrategia de búsqueda | Resultados | |
| 1 | aged.mp. or aged/ or aged hospital patient.mp. or aged hospital patient/ or frail elderly.mp. or frail elderly/or very elderly.mp. or very elderly/ or elder.mp. or geriatrics.mp. or geriatrics/ or aging.mp. or aging/ | 1.090.777 |
| 2 | nsaid.mp. or Nonsteroid Antiinflammatory Agent/ or Nonsteroidal Anti-Inflammatory Agents.mp. or (coxib or Cyclooxygenase 2 Inhibitor).mp. or Acetylsalicylic Acid/ or Aspirin-Like Agents.mp. or naproxen.mp. or NAPROXEN/or ibuprofen.mp. or IBUPROFEN/ or dexibuprofen$.mp. or DEXIBUPROFEN/ or dexketoprofen.mp. or DEXKETOPROFEN/ or flurbiprofen.mp. or FLURBIPROFEN/ or Ketoprofen.mp. or KETOPROFEN/ or KETOROLAC/ or Ketorolac.mp. or aceclofenac.mp. or ACECLOFENAC/ or diclofenac.mp. or DICLOFENAC/ or lornoxicam.mp. or LORNOXICAM/ or meloxicam.mp. or MELOXICAM/ or PIROXICAM/ or piroxicam.mp. or PIROXICAM/ or piroxicam.mp. or tenoxicam.mp. or TENOXICAM/ or INDOMETACIN/ or indometacin.mp. or sulindac.mp. or SULINDAC/ or tolmetin.mp. or TOLMETIN/ or Phenylbutazone.mp. or PHENYLBUTAZONE/ or nabumetone/ or nabumeton.mp. or celecoxib.mp. or CELECOXIB/ or etoricoxib.mp. or ETORICOXIB/ or parecoxib.mp. or PARECOXIB/ or rofecoxib.mp. or ROFECOXIB/ or salicylic acid.mp. or Salicylic Acid/ or acetylsalicylic acid.mp. or Acetylsalicylic Acid/ or diflunisal.mp. or DIFLUNISAL/ or valdecoxib.mp. or VALDECOXIB/ or lumiracoxib.mp. or LUMIRACOXIB/ | 207.945 |
| 3 | exp clinical trial/ or evidence based medicine/ or outcomes research/ or crossover procedure/ or double blind procedure/ or single blind procedure/ or prospective study/ or major clinical study/ or exp comparative study/ or placebo/ or “evaluation and follow up”/ or follow up/ or randomization/ | 1.964.112 |
| 4 | controlled study/ not case control study/ | 2.568.695 |
| 5 | 3 o 4 | 3.774.593 |
| 6 | ((clinic$ adjs trial$) or ((singl$ or doubl$ or trebl$ or tripl$) adj (blind$ or mask$)) or random$ or placebo$).ti,ab. | 489.355 |
| 7 | 5 o 6 | 3.890.101 |
| 8 | exp musculoskeletal disease/ or musculoskeletal disease.mp. or rheumatic polymyalgia.mp. or polymyalgia/ or lupus erythematosus systemic.mp. or systemic lupus erythematosus/ or vasculitis/ or vasculitis.mp. or polymyositis.mp. or polymyositis/ or dermatomyositis.mp. or dermatomyositis/ | 669.390 |
| 9 | perioperative period.mp. or PERIOPERATIVE PERIOD/ or perioperative care.mp. or SURGERY/ or surgery.mp. or SURGICAL TECHNIQUE/ or surgical procedures.mp. or PEROPERATIVE CARE/ or preoperative care.mp. or intraoperative care.mp. or PEROPERATIVE COMPLICATION/ or POSTOPERATIVE COMPLICATION/ or dysmenorrhoea.mp. or Dysmenorrhea/ or orthodontic.mp. or Orthodontics/ or exp malignant neoplastic disease/ or cancer/ or exp metastasis/ or exp mixed tumor/ or exp “neoplasms of uncertain behavior”/ or exp neoplasms subdivided by anatomical site/ or exp “oncogenesis and malignant transformation”/ or exp paraneoplastic syndrome/ or exp “precancer and cancer-in-situ”/ or adolescent.mp. or adolescent/ or hospitalized adolescent/ or juvenile.mp. or juvenile/ or child.mp. or child/ or boy.mp. or boy/ or gifted child/ or girl.mp. or girl/ or handicapped child/ or hospitalized child/ or preschool child/ or school child/ or infant.mp. or infant/ or baby.mp. or baby/ or high risk infant/ or hospitalized infant/ or newborn.mp. or newborn/ or suckling.mp. or suckling/ or pediatric.mp. or review/ or guideline.mp. | 3.370.213 |
| 10 | 1 y 2 y 7 y 8 | 4.449 |
| 11 | 10 no 9 | 2.997 |
| 12 | Limit 11 to humans | 2.965 |
| 13 | Limit 12 to abstracts | 2.668 |
Para evaluar la calidad metodológica de los estudios incluidos, se utilizó: a) para los EC, la escala de Jadad8 (1 a 5; se consideró de buena calidad los estudios con Jadad de 3–5), y b) para los estudios de cohortes, la escala de calidad de Oxford.
ResultadosLos resultados de la búsqueda se detallan en la figura 1. Finalmente se incluyeron 16 estudios que incluyeron a más de 50.000 ancianos, con un seguimiento que varió desde 1 semana a 4 años. Destaca la gran diversidad en cuanto al tipo de AINE y las medidas de desenlace. Se incluyeron 4 metaanálisis (calidad 1a-b), 9 EC (Jadad 4), 2 estudios de cohortes (calidad 2a) y un estudio de prevalencia (calidad 2a). La mayoría de estos estudios incluyó a pacientes con osteoartrosis (OA) o artritis reumatoide (AR). En muchos de los estudios no estaba permitido el uso de protectores gástricos o no consta que los tomaran. Los principales resultados de los estudios incluidos están descritos en la tabla 39–25, los artículos excluidos y el motivo de su exclusión, en la tabla 426–106.
Características de los estudios incluidos
| Estudio | Resultados | Participantes e intervención |
| Bakshi et al13, EC a doble ciego controlado con placebo. Seguimiento, 4 meses. Jadad 4 | 314 OA cadera/rodilla/manos, 186 (60%) mujeres, 60-80 años, duración media de la OA 6,4 años. CE: alergia a AINE, úlcera o sangrado digestivo previo, enfermedad hemática, hepática o insuficiencia cardíaca. Diclofenaco 150mg/día, 4 semanas (n = 208). Placebo, 4 semanas (n = 106) | Eficacia: en comparación con placebo el diclofenaco fue mejor en: dolor en reposo (p < 0,001), dolor en movimiento (p < 0,001), dolor a la presión local (p = 0,040), rigidez en reposo (p = 0,008). Sin diferencias en dolor en actividad diaria. Seguridad: eventos adversos leves-moderados: diclofenaco (n = 30), placebo (n = 18) (p = 0,551) |
| Chan et al14, EC a doble ciego controlado con placebo. Seguimiento, 6 meses. Jadad 5 | 222 pacientes con artriris (52% mujeres; media de edad, 67,1 años). CI: ulcus sangrante previo curado, Helicobacter pilori negativo. CE: esteroides, anticoagulantes, cirugía gástrica o duodenal, esofagitis erosiva, obstrucción gástrica, insuficiencia renal. Celecoxib 400mg/día + placebo 6 meses (n = 116). Diclofenaco 150mg/día + omeprazol 20mg/día 6 meses (n = 106) | Seguridad: a) sangrado gastrointestinal: celecoxib (n = 7), diclofenaco (n = 9) (p = 0,511); b) ulcus gastroduodenal recurrente: celecoxib (n = 20), diclofenaco (n = 26) (p = 0,180); c) sin dispepsia o mínima: celecoxib (n = 100), diclofenaco (n = 98) (p = 0,720); d) dispepsia significativa: celecoxib (n = 16), diclofenaco (n = 18) (p = 0,572) |
| Cheatum et al25, estudio transversal, calidad 2a | 1.826 pacientes (1.009 AR, 817 OA), 67,3% mujeres; media de edad, 54,3 años. Consumo de AINE | Seguridad: a) prevalencia de úlcera gastroduodenal: 60-69 años (29%), 70-79 años (34%), > 80 años 32%); b) prevalencia de úlcera gastroduodenal en AR: 60-69 años (24%), 70-79 años (27%), > 80 años (14%); c) prevalencia de úlcera gastroduodenal en OA: 60-69 años (35%), 70-79 años (41%), > 80 años (37%) |
| Detora et al15, metaanálisis, 3 EC (Jadad 4), seguimiento 6 semanas. Calidad 1a | 1.491 OA (73% mujeres, media de 62 años) Rofecoxib 12,5mg/día 6 semanas (n = 288). Rofecoxib 25mg/día 6 semanas (n = 607). Placebo 6 semanas (n = 596) | Eficacia en comparación con placebo: a) valoración global del paciente (VAS): rofecoxib 12,5mg, –1 (–1,3 a –1,8); rofecoxib 25mg, –1,1 (–1,3 a –0,9), sin diferencias entre los 2 rofecoxib; b) dolor al caminar (VAS): Rofecoxib 12,5mg, –16,9 (–21,7 a –12,1); rofecoxib 25mg, –18,1 (–22,8 a –13,4); sin diferencias entre los 2 rofecoxib |
| Earl et al15, EC a doble ciego, seguimiento 4 semanas. Jadad 5 | 59 OA (73% mujeres, media de edad, 71 años). CI: OA cadera/rodilla, capaces de andar y de autocuidado. CE: tratamientos para el dolor diferentes de AINE, anemia, ulcus, alcohol, disfunción renal o hepática. Ibuprofeno 1.600mg/día 4 semanas (n = 38). Piroxicam 20mg/día 4 semanas (n = 21) | Eficacia: sólo el ibuprofeno mejora la flexión de cadera/rodilla (p < 0,050). Ninguno: rotación interna de cadera; los 2: dolor articular, horas de sueño (p > 0,050). Seguridad: eventos adversos: ibuprofeno (n = 6), piroxicam (n = 7) (p > 0,050) |
| Eisen et al10 (2005), metaanalisis, 5 EC (Jadad 4-5), seguimiento 12 semanas. Calidad 1a | 4.394 AR/OA (28% mujeres, media de edad, 59 años). CE: enfermedad gastrointestinal grave, malignidad. Valdecoxib 10-40mg/ día 12 semanas (n = 2.236). Otros AINE 12 semanas (n = 1.185): naproxeno 1.000mg/día, ibuprofeno 2.400mg/día, diclofenaco 150mg/día. Placebo 12 semanas (n = 973) | Seguridad: comparado con grupo AINE riesgo de síntoma gastroduodenal moderado/severo; valdecoxib (cualquier dosis), HR = 0,59 (IC del 95%, 0,47-0,74); valdecoxib 10mg, HR = 0,69 (IC del 95%, 0,53-0,90); valdecoxib 20mg, HR = 0,43 (IC del 95%, 0,32-0,60); valdecoxib 40mg, HR = 0,73 (IC del 95%, 0,49-1,08); placebo, HR = 0,63 (IC del 95%, 0,47-0,83) |
| Fries et al23 (1991), cohorte prospectiva, seguimiento medio 4 años. Calidad 2a | 2.747 AR (76,7% mujeres, media de edad 60 años, duración media de enfermedad 17 años). AINE | Seguridad: a) riesgo de hospitalización/muerte por evento adverso gastrointestinal: > 45 años, OR = 7 (2,21-22,4); > 50 años, OR = 4,4 (2,01-9,52); > 60 años, OR = 2,7 (1,70-4,30); > 65 años, OR = 2,4 (1,56-3,55); > 70 años, OR = 2 (1,30-3,08); > 75 años, OR = 2,2 (1,28-3,85) |
| Hawkey et al16,17, EC a doble ciego, doble-dummy, multicéntrico, seguimiento 52 semanas. Jadad 4 | 3.959 OA, > 65 años (76% mujeres). CI: dolor articular moderado. CE: protectores gástricos, ulcus 30 días previos, sangrado/perforación/ obstrucción intestinal. Lumiracoxib 400mg/día (n = 3.980). Naproxeno 1.000mg/día (n = 2.098). Ibuprofeno 2.400mg/día (n = 1.861) | Seguridad: riesgo de ulcus gastroduodenal: AINE, HR = 1,79 (1,33-2,42); lumiracoxib, HR = 1,26 (0,82-1,95) |
| Kaarela et al18, EC a doble ciego, seguimiento 14 días. Jadad 4 | 31 AR (84% mujeres), 18 > 65 años. Indometacina 150mg/día 14 días | Eficacia: mejoría de la rigidez matutina (p = 0,001), sin diferencias en comparación con los jóvenes |
| Koch et al19, EC a doble ciego controlado con placebo, seguimiento 6 meses. Jadad 4 | 8.840 AR (mujeres, media de edad 68 años). CI: > 52 años, tomar AINE para 6 meses. CE: ulcus péptico 30 días antes, otras enfermedades digestivas graves, diátesis hemorrágica. AINE + misoprostol 6 meses n = 4.404). AINE + placebo 6 meses (n = 4.404) | Seguridad: riesgo de complicación gastrointestinal (ulcus, hemorragia, obstrucción) > 65 años. Grupo misoprostol, RR = 0,70; placebo, RR = 1,16 (reducción del riesgo del 40%) |
| Le Loet24, cohorte prospectiva, multicéntrica, seguimiento 4 semanas. Calidad 2a | 19.880 pacientes > 60 años (media, 72 años), 66% mujeres con enfermedad reumática (93% enfermedad degenerativa). CE: contraindicación del uso de AINE, enfermadad hepática, renal o hemática severa. Ketoprofeno 400mg/día 4 semanas | Eficacia: a) VGM buena/excelente, 74,4%; b) tolerabilidad según paciente buena/excelente, 85%. Seguridad: a) eventos adversos: ketoprofeno, 15,3% |
| Lisse et al11, metaanálisis, 3 EC (Jadad 3-4), seguimiento 12 semanas. Calidad 1b | 786 OA de cadera o rodilla, > 70 años, 68% mujeres. Celecoxib 200mg/día 12 semanas (n = 191). Celecoxib 400mg/día (n = 183). Naproxeno 1.000mg/día 12 semanas (n = 206). Placebo 12 semanas (n = 188) | Eficacia: comparado con placebo los 3 AINE mejoraron más el WOMAC (p < 0,001) y el SF-36 (p < 0,010). No hubo diferencias entre los 3 AINE. Seguridad: a) al menos un evento adverso grave: celecoxib 200mg (n = 7), celecoxib 400 (n = 9), naproxeno 1.000mg (n = 4), placebo (n = 8) (p > 0,050); b) evento adverso gastrointestinal: celecoxib 200mg (n = 49), celecoxib 400mg (n = 37), naproxeno (n = 62), placebo (n = 32). Mayor en naproxeno comparado con placebo y celecoxib 200mg |
| Regula et al20 (2006), EC a doble ciego, seguimiento 6 meses. Jadad: 4 | 595 AR, OA, espondilosis, espondilitis (71% mujeres, media de edad 66 años). CI: ≥ 1 factor de riesgo de toxicidad gastrointestinal. CE: ulcus activo/complicado, cirugía digestiva, bridas esofágicas, Zollinger-Ellison, enfermedad grave. AINE + pantoprazol 20mg/día 6 meses (n = 196). AINE + pantoprazol 40mg/día 6 meses (n = 199). AINE + omeprazol 20mg/día 6 meses (n = 200) | Seguridad: ulcus péptico: pantoprazol 20mg/día (n = 7), pantoprazol 40mg/día (n = 3), omeprazol 20mg/día (n = 4) (p > 0,050); sin diferencias: síntomas gastrointestinales, esofagitis por reflujo, 10 o más erosiones o petequias, eventos adversos graves |
| Schiff et al12, metaanálisis de 2 EC (Jadad 4), Seguimiento 1 semana. Calidad 1b | 198 OA de rodilla, > 65 años, 62% mujeres. CI: OA activa con dolor al menos moderado. CE: protectores gástricos, otras enfermedades reumatológicas, historia de ulcus péptico en 9 meses previos, cirugía digestiva, trastornos en la absorción. Naproxeno 400mg/día 1 semana (n = 66). Ibuprofeno 1.200mg/día 1 semana (n = 66). Placebo 1 semana (n = 66) | Eficacia: naproxeno e ibuprofeno mejores que placebo en: dolor en reposo, movimientos pasivos nocturnos, rigidez matutina, tiempo en caminar 20m (p < 0,050), dolor diario (p < 0,010), a la carga (p = 0,064). Seguridad: a) cualquier evento adverso: naproxeno 440mg/día (n = 14), ibuprofeno 1.200mg/día (n = 14), placebo (n = 17) (p = 0,538); b) eventos adversos graves: naproxeno 440mg/día (n = 3), ibuprofeno 1.200mg/día (n = 4), placebo (n = 8) (p = 0,115); c) evento adverso gastrointestinal: naproxeno 440mg/día (n = 11), ibuprofeno 1.200mg/día (n = 10), placebo (n = 9) (p = 0,627) |
| Silverstein et al21, EC a doble ciego, controlado con placebo, seguimiento 6 meses. Jadad 4 | 8.840 AR (mujeres, media de edad 68 años). CI: > 52 años, tomar AINE para 6 meses. CE: ulcus 30 días previos, enfermedades digestivas graves, protectores gástricos, diátesis hemorrágica. AINE + misoprostol 6 meses (n = 4.404). AINE + placebo 6 meses (n = 4.404) | Seguridad: asociación (ajustada) a complicación gastrointestinal (úlcera, hemorragia, obstrucción) en > 75 años en la cohorte (OR = 2,48; IC del 95%, 1,48-4,14) |
| Whelton et al22, EC a doble ciego, seguimiento 6 semanas. Jadad 5 | 1.092 OA (62% mujeres, media de edad 73 años). CI: > 65 años, OA clase funcional I-III, HTA estable con dosis fija de antihipertensivos en 3 meses previos, beneficio del uso de AINE. CE: protectores gástricos, enfermedades severas. Celecoxib 200mg/día 6 semanas (n = 543). Rofecoxib 25mg/día 6 semanas (n = 549) | Seguridad: a) ↑ en PAS > 20 y PAS > 140mmHg: celecoxib (n = 38), rofecoxib (n = 81) (p < 0,001); b) ↑ en PAD > 15 y PAD > 90mmHg: celecoxib (n = 7), rofecoxib (n = 12) (p = 0,257); c) edema clínicamente significativo: celecoxib (n = 26), rofecoxib (n = 42) (p = 0,045); d) insuficiencia cardíaca congestiva (primer episodio): celecoxib (n = 2), rofecoxib (n = 3) (p = 0,663) |
AINE: antiinflamatorios no esteroideos; AR: artritis reumatoide; CE: criterios de exclusión; CI: criterios de inclusión; EC: ensayo clínico; HTA: hipertensión arterial; HZ: hazard ratio; IC: intervalo de confianza; OA: osteoartrosis; OR: odds ratio; PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica; RR: riesgo relativo; VGM: valoración global del médico.
Estudios excluidos y causas de exclusión
| Estudio | Causas de exclusión |
| Admani et al26 (1983) | Insuficiente calidad del estudio |
| Ahern et al27 (1992) | Insuficiente calidad del estudio |
| Arone28 (1989) | Insuficiente calidad del estudio |
| Bacon29 (1994) | Insuficiente calidad del estudio |
| Bauer et al30 (1996) | Insuficiente calidad del estudio |
| Blardi et al31 (1992) | Insuficiente calidad del estudio |
| Browning et al32 (1994) | Insuficiente calidad del estudio |
| Busson33 (1986a) | Insuficiente calidad del estudio |
| Busson34 (1986b) | Insuficiente calidad del estudio |
| Calin35 (1993) | Insuficiente calidad del estudio |
| Caughey et al36 (1989) | Insuficiente calidad del estudio |
| Cordaro et al37 (1988) | No hay datos de pacientes mayores de 60 años |
| Cummings et al38 (1988) | Insuficiente calidad del estudio |
| Currie et al39 (1984) | Insuficiente calidad del estudio |
| Davis et al40 (1987) | Insuficiente calidad del estudio |
| Dominick et al41 (2003) | No relacionado con la pregunta de investigación |
| Dreiser et al42 (1993) | Insuficiente calidad del estudio |
| Famaey et al43 (1976) | Insuficiente calidad del estudio |
| Fossaluzza et al44 (1989) | Insuficiente calidad del estudio |
| Fries45 (1992) | No hace un análisis estrictamente de mayores de 60 años |
| Fries et al46 (2004) | No relacionado con la pregunta de investigación |
| Fullerton et al47 (1993) | Insuficiente calidad del estudio |
| Gabriel et al48 (1997) | Insuficiente calidad del estudio |
| Geczy et al49 (1987) | Insuficiente calidad del estudio |
| Girawan et al50 (2004) | Insuficiente calidad del estudio |
| Goldstein et al3 (2003) | Sujetos sanos |
| Grace et al51 (1987) | Insuficiente calidad del estudio |
| Grigor et al52 (1987) | No se sabe si el AAS se utiliza a dosis de antiagregante, analgésico o antiinflamatorio |
| Halici et al53 (2002) | Insuficiente calidad del estudio |
| Hart et al54 (1965) | Insuficiente calidad del estudio |
| Hart et al55 (1983) | Insuficiente calidad del estudio |
| Hawkey et al56 (2001) | No aporta datos suficientes de mayores de 60 años |
| Henry et al57 (1997) | Insuficiente calidad del estudio |
| Hochain et al58 (1995) | Insuficiente calidad del estudio |
| Horackova et al59 (2005) | Insuficiente calidad del estudio |
| Innes60 (1977) | Insuficiente calidad del estudio |
| Jackson et al61 (1987) | No aporta datos concretos en mayores de 60 años |
| Janke et al62 (1984) | Insuficiente calidad del estudio |
| Johnson et al63 (1993) | Insuficiente calidad del estudio |
| Laine et al64 (2002) | Insuficiente calidad del estudio |
| Lai et al65 (2005) | Insuficiente calidad del estudio |
| Lane et al66 (1997) | Insuficiente calidad del estudio |
| Layton et al67 (2003) | Insuficiente calidad del estudio |
| Le Loet et al68 (1997) | Insuficiente calidad del estudio |
| Littman et al69 (1995) | Insuficiente calidad del estudio |
| Mamdani et al70 (2002) | Insuficiente calidad del estudio |
| Mann et al71 (2004) | La población de estudio es general |
| McNeil72 (1993) | Insuficiente calidad del estudio |
| Meurice73 (1983) | Insuficiente calidad del estudio |
| Montrone et al74 (1990) | Insuficiente calidad del estudio |
| Morgan et al75 (1993) | Insuficiente calidad del estudio |
| Morgan et al2 (2001) | Insuficiente calidad del estudio |
| Morton et al76 (1998) | No hay datos concretos de pacientes mayores de 60 años |
| Motsko et al77 (2006) | Insuficiente calidad del estudio. Población general |
| Nesher et al78 (1995) | Insuficiente calidad del estudio |
| Niccoli et al7 (2002) | Insuficiente calidad del estudio |
| Nietert et al79 (2003) | Insuficiente calidad del estudio |
| O'Brien80 (1983) | Insuficiente calidad del estudio |
| Perpignano et al81 (1994) | Insuficiente calidad del estudio |
| Puccetti et al82 (1991) | Insuficiente calidad del estudio |
| Rabenda et al83 (2005) | La población de estudio es general |
| Rabenda et al84 (2006) | No hay datos concretos de pacientes mayores de 60 años |
| Rahme et al85 (2002) | Insuficiente calidad del estudio |
| Rahme et al86 (2007a) | Insuficiente calidad del estudio |
| Rahme et al87 (2007b) | Insuficiente calidad del estudio |
| Roth et al88 (1993) | Insuficiente calidad del estudio |
| Roth et al89 (1995) | Insuficiente calidad del estudio |
| Scharf et al90 (1998) | Insuficiente calidad del estudio |
| Schattenkirchner91 (1991) | Insuficiente calidad del estudio |
| Schattenkirchner92 (1993) | Insuficiente calidad del estudio |
| Sheldon et al93 (2005) | No hay datos concretos de pacientes mayores de 60 años |
| Sheridan et al94 (2005) | Insuficiente calidad del estudio |
| Smalley et al95 (1995) | Insuficiente calidad del estudio.Población general |
| Sontag et al96 (1994) | No hace un análisis estrictamente de mayores de 60 años |
| Stewart et al97 (1988) | Insuficiente calidad del estudio |
| Theiler et al98 (2002) | Insuficiente calidad del estudio |
| Todesco et al99 (1994) | Insuficiente calidad del estudio |
| Truitt et al100 (2001) | Insuficiente calidad del estudio |
| Vetter101 (1985) | Insuficiente calidad del estudio |
| Vonkeman et al102 (2007) | Insuficiente calidad del estudio |
| Whelton et al103 (2006) | No hace un análisis estrictamente de mayores de 60 años |
| Williams104 (1985) | Insuficiente calidad del estudio |
| Williams et al105 (1989) | Insuficiente calidad del estudio |
| Yajima et al106 (2007) | Insuficiente calidad del estudio |
Según la evidencia de la presente revisión sistemática, generalmente, los AINE se han mostrado eficaces en el anciano para el control del dolor de origen reumático (en reposo, con el movimiento, nocturno), la rigidez y la función articular9,11–13,15,18,24, sin poder precisarse qué AINE tiene un efecto mayor que otro. En cuanto a los eventos adversos, cabe destacar que presentan riesgo aumentado de cualquier evento gastrointestinal grave de cualquier origen11,12, en especial los de origen gastrointestinal: muerte u hospitalización23, hemorragia digestiva14,19,21, ulcus16,17,19–21,25 u obstrucción digestiva19,21; sin poder realizar comparaciones entre todos los AINE. Este riesgo disminuye al asociarse un protector gástrico14,19–21. En cuanto a los efectos cardiovasculares, únicamente se pudo objetivar que el uso de rofecoxib se asoció a edema clínicamente significativo y aumento en la presión arterial (PA) sistólica.
Principales resultados de los metaanálisisSegún Detora et al9, en ancianos con OA/AR, el uso de rofecoxib (12,5/25mg/día) fue más eficaz que el placebo para mejorar su valoración global y el dolor al caminar.
Eisen et al10 analizaron a ancianos con AR/OA, en los que valdecoxib (10, 20 o 40mg/día), en comparación con naproxeno 1.000mg/día, ibuprofeno 2.400mg/día y diclofenaco 150mg/día, se asoció a menor riesgo de síntomas gastrointestinales moderados-severos.
Lisse et al11 objetivaron que en ancianos con OA, el celecoxib (200 o 400mg/día) o el naproxeno 1.000mg/día mejoraron más el índice WOMAC que el placebo, sin diferencias entre ellos. No hubo diferencias en el número de eventos adversos graves. El naproxeno tuvo mayor número de eventos adversos gastrointestinales que el placebo y que el celecoxib 200mg/día.
En el metaanálisis de Schiff et al12, en ancianos con OA, el naproxeno 1.000mg/día o el ibuprofeno 1.200mg/día mejoraron el dolor en reposo o con los movimientos pasivos, el nocturno, el tiempo empleado para caminar 20m y la rigidez matutina más que el placebo. No hubo diferencias en el número, el tipo o la severidad de los eventos adversos.
Principales resultados de los EC (no incluidos en los metaanálisis)Bakshi et al13 analizaron a ancianos con OA, en los que diclofenaco 150mg/día fue superior en cuanto a la mejoría del dolor en reposo, dolor con el movimiento, dolor a la presión y la rigidez en reposo que el placebo. No hubo diferencias en cuanto al dolor en la actividad diaria ni en el número de eventos adversos (leves-moderados).
Chan et al14, en pacientes ancianos con artritis y episodio de ulcus previo, no objetivaron diferencias entre el celecoxib 400mg/día y el diclofenaco 150mg/día + omeprazol 20mg/día en sangrado gastrointestinal, ulcus recurrente o dispepsia.
Por otro lado, Earl et al15, en pacientes con OA, observarn que ibuprofeno 1.600mg/día o piroxicam 20mg/día mejoraron el dolor articular y las horas de sueño. Sólo el ibuprofeno mejoró la flexión de la cadera y la rodilla, y ninguno la rotación interna de la cadera. No hubo diferencias en el número de eventos adversos y abandonos en el grupo con AINE.
Según Hawkey et al16,17, en ancianos con OA, el lumiracoxib 400mg/día no se asoció con el ulcus gastroduodenal, pero sí el naproxeno 1.000mg/día y el ibuprofeno 2.400mg/día.
En el estudio de Kareela et al18, ancianos con AR e indometacina 150mg/día mejoraron su rigidez matutina. No hubo diferencias en comparación con los pacientes menores de 65 años.
Según Koch et al19, en ancianos con AR el uso de AINE con misoprostol disminuye en un 40% el riesgo de complicación gastrointestinal grave en comparación con el AINE solo.
Regula et al20 estudiaron a ancianos con AR/OA con AINE y pantoprazol 20 o 40mg/día u omeprazol 20mg/día, sin objetivar diferencias en la aparición de eventos adversos gastrointestinales leves o graves.
En el EC de Silverstein et al21, en ancianos con AR, el uso de AINE se asoció a mayor riesgo de evento adverso grave (ulcus, hemorragia, obstrucción), odds ratio [OR] = 2,48 (intervalo, 1,48-4,14).
Whelton et al22, en ancianos con OA, no encontraron diferencias en el aumento de PA diastólica ni en la aparición de insuficiencia cardíaca (primer episodio) entre los que tomaron celecoxib 200mg/día o rofecoxib 25mg/día. Sí hubo más pacientes con edema clínicamente significativo y aumento de la PA sistólica en el grupo rofecoxib.
Principales resultados de los estudios de cohortesEn el estudio de Fries et al23 el riesgo de hospitalización o muerte por evento gastrointestinal de los AINE de los pacientes con AR fue: en mayores de 60 años, OR = 2,7; en mayores de 65 años, OR = 2,4; en mayores de 70 años, OR = 2,0, y en mayores de 75 años, OR = 2,2 (todos los resultados son estadísticamente significativos).
En la cohorte de Le Loet24, en ancianos con enfermedad reumática que habían tomado ketoprofeno 400mg/día, la valoración global del médico fue buena/excelente en un 74,4%, y según los pacientes, la tolerabilidad del fármaco fue buena/excelente en un 85%. Hubo eventos adversos relacionados con el fármaco en el 15,3% de los pacientes.
Estudio de prevalenciaSegún Cheatum et al25, en pacientes con AR/OA en tratamiento con AINE, la prevalencia de ulcus gastroduodenal fue: en el grupo de 60–69 años, del 29%; en el de 70–79 años, del 34%, y en los mayores de 80 años, del 32%.
DiscusiónHemos analizado los resultados de eficacia clínica (en el tratamiento del dolor y función y calidad de vida) y de seguridad (gastrointestinal, cardiovascular, renal) de los AINE en el tratamiento de enfermedades reumáticas en ancianos, mediante la revisión sistemática de la literatura. El objetivo es contribuir con la evidencia científica publicada a la hora de generar un consenso sobre el uso de AINE en ancianos.
En cuanto a la eficacia, según los resultados obtenidos, hay datos que apoyan el uso de los AINE para el dolor y otros síntomas de origen reumático en ancianos9,11–13,15,18,24. Pero, dada la diversidad de AINE empleados en los estudios y las distintas variables utilizadas para medir la eficacia, es difícil definir si un AINE es claramente más eficaz que otro en los ancianos con dolor reumático. Tampoco queda muy clara la magnitud de sus efectos que, en general, según lo publicado, no parece muy llamativa, aunque hay que tener en cuenta el contexto en el que se utilizan (básicamente ancianos con artritis reumatoide y artrosis).
En cuanto a su seguridad, en primer lugar es de destacar que, según un estudio transversal25, la prevalencia de ulcus gastroduodenal en ancianos con enfermedad reumática en tratamiento con AINE es considerable, mayor en el grupo de 70–79 años de edad. Este hecho se complementa con los datos que se desprenden de un estudio de cohortes y de otros EC, en que se evidencia un riesgo aumentado de cualquier tipo de evento adverso grave, especialmente los de origen gastrointestinal (hospitalización o muerte23, hemorragia digestiva14,19,21, ulcus16,17,19–21,25 u obstrucción digestiva19,21). En estudios de población general, el riesgo descrito de evento gastrointestinal grave es incluso mayor3. Esto pudiera deberse a que actualmente en reumatología se prescribe AINE a los ancianos en momentos de dolor agudo y no tanto como tratamiento continuo y crónico. Sólo un artículo de los incluidos analizó eventos adversos cardiovasculares22, donde no hubo diferencia significativa de aumento de PA diastólica ni en la aparición de insuficiencia cardíaca (primer episodio) entre celecoxib y rofecoxib. Pero hubo más pacientes con edema clínicamente significativo y aumento en la PA sistólica en el grupo rofecoxib. De nuevo es difícil establecer qué AINE presenta un mejor perfil de seguridad.
Por último, cabe señalar que en los artículos seleccionados el uso de protectores gástricos se asoció a reducción del riesgo de ulcus gastroduodenal en ancianos19–21. Aunque al igual que con la eficacia y la seguridad, es difícil establecer cuáles son mejores que otros.
Pero todos estos resultados hay que tomarlos con cautela por los siguientes motivos: una de las principales dificultades de la revisión ha sido la falta de definición homogénea del concepto anciano, es decir, actualmente a qué edad y/o qué condiciones consideramos las propias de un ser humano anciano. Otra dificultad añadida es que, en general, en los EC y en otros estudios, suele ser muy escaso el número de ancianos incluidos, lo que hace que se muestren pocos datos de ellos, por lo que puede que no se esté describiendo correctamente lo que sucede en la práctica diaria con este grupo de población. En la presente revisión, se puso un corte en los 60 años, cuando es posible que sea diferente (en términos de eficacia y seguridad de los AINE) tener 60 o 79 años. Y como se ha visto, hay pocos análisis de subgrupos de edad entre ancianos que puedan estudiar este fenómeno. Otra posible limitación es que la dificultad para ajustar por todas las variables que en el anciano con enfermedad reumática puedan influir en las variables de resultado estudiadas, que pueden potencialmente modificar los resultados expuestos (uso concomitante de otras medicaciones, enfermedades, etc.). Por último, comentar también la falta de estudios de calidad que confirmen el efecto en las funciones renal y cardíaca en ancianos que toman AINE, en artículos ya publicados en otro tipo de poblaciones.
En conclusión, los AINE son eficaces en los ancianos para el tratamiento del dolor de origen reumático, si bien el riesgo de evento adverso grave es mayor, por lo que sería recomendable, por un lado, el uso de gastroprotectores siempre que se utilicen, además de individualizar en cada caso el uso de los AINE, ya que hay otras alternativas de tratamiento del dolor de origen reumático que se han demostrado muy seguras y eficaces en los ancianos, como los analgésicos o los esteroides a dosis bajas.