Abatacept y rituximab son 2 fármacos biológicos aprobados para su utilización en pacientes con artritis reumatoide con respuesta inadecuada o intolerancia a otros fármacos antirreumáticos modificadores de la enfermedad, incluidos uno o más tratamientos con inhibidores del factor de necrosis tumoral.
La indicación actual es la única cosa que los 2 fármacos tienen en común, ya que se trata de moléculas distintas (abatacept es una molécula de fusión y rituximab es un anticuerpo monoclonal), con mecanismos de acción distintos y pautas de administración distintas.
Ambos tratamientos han demostrado su eficacia clínica, la detención del daño estructural y la seguridad a medio plazo en estudios aleatorizados y doble ciego.
En este trabajo, se revisará la estructura y los mecanismos de acción de ambos fármacos, se presentarán los estudios en los que se basan sus datos de eficacia y seguridad y al final se plantearán diversas cuestiones controvertidas en la utilización de estos fármacos.
Abatacept and rituximab are two biologic drugs approved in patients with rheumatoid arthritis who have an inadequate response or intolerance to other disease modifying antirheumatic drugs, including one or more tumor necrosis factor (TNF) inhibitors.
The current indication for use is the only thing that both drugs have in common because they are different molecules (abatacept is a fusion molecule and rituximab a monoclonal antibody) with different mechanisms of action and different patterns of administration.
Both treatments have shown their clinical efficacy, the stop of structural damage and medium term safety in randomized, double-blind clinical trials.
In this paper we will review the structure and mechanisms of action of both drugs, presenting studies in which the efficacy and safety data are based and will finally postulate different controversial questions in the use of these drugs.
En los últimos 10 años, hemos vivido la irrupción de los agentes biológicos en el tratamiento de la artritis reumatoide (AR), lo cual ha cambiado de forma significativa nuestra perspectiva sobre el tratamiento. Los inhibidores del factor de necrosis tumoral (anti-TNF) fueron los primeros biológicos que se incorporaron a los recursos terapéuticos. Después de estos fármacos han aparecido nuevos fármacos biológicos con distintos mecanismos de acción, como son la depleción de linfocitos B (como el rituximab) o la modulación de la coestimulación de los linfocitos T (como abatacept).
La aparición de estos nuevos tratamientos con distintas dianas terapéuticas ha permitido que tengamos diversas opciones de tratamiento en la AR. Esta revisión tratará sobre los 2 últimos fármacos biológicos aprobados para el tratamiento de la AR, abatacept y rituximab. Se revisará su estructura y mecanismos de acción, sus datos de eficacia y seguridad, su papel actual en el tratamiento de la AR y, como conclusión, una prospección de futuro de estos 2 fármacos en los próximos años.
Estructura y funciónRituximabRituximab es un anticuerpo monoclonal quimérico compuesto por 2 regiones variables FAV de origen murino, que se unen específicamente al receptor CD20 de los linfocitos B, y una región constante inmunoglobulina (Ig) G1 de origen humano que facilita la activación eficaz de los mecanismos mediados por complemento. Se trata de un anticuerpo que depleciona de forma selectiva los linfocitos B CD20 positivo1,2, esto es, los linfocitos B desde su fase madurativa pre-B hasta las células de memoria, con lo que se preserva tanto los progenitores (célula madre y linfocito pro-B), como las células ya diferenciadas (células plasmáticas de vida larga)3.
El mecanismo de acción de rituximab no queda claro. Se ha postulado que puede actuar de 3 formas distintas. Una vez unido el anticuerpo al antígeno CD20, rituximab puede: iniciar la lisis celular mediada por complemento, iniciar la citotoxicidad celular mediada por macrófagos y linfocitos citolíticos, o inducir la apoptosis de los linfocitos B4.
Sea cual sea su mecanismo de acción, el resultado final es la depleción de los linfocitos B, lo que produce una disminución de las acciones de los linfocitos B, entre las que se encuentran la secreción de citocinas proinflamatorias5, la presentación de antígenos, el mantenimiento de la activación de los linfocitos T y la producción de anticuerpos.
Como consecuencia de la disminución de la acción de los linfocitos B en el foco inflamatorio, se produce una disminución de la inflamación sinovial y una disminución de la destrucción del cartílago articular.
AbataceptPor su parte, abatacept es una molécula de fusión construida a partir de la unión de la fracción extracelular del receptor CTLA-4 con la fracción FC de una IgG1 humana6. Su acción consiste en bloquear el receptor CD80/86 de la célula presentadora de antígeno, de forma que no puede unirse al receptor CD28 del linfocitos T y, por tanto, evita la coestimulación del linfocitos T, a pesar de la presentación del antígeno por moléculas del complejo mayor de histocompatibilidad. De esta forma, disminuye la activación y la proliferación de los linfocitos T, disminuye la secreción de citocinas proinflamatorias de macrófagos sinoviales activados, así como la producción de autoanticuerpos, con la atenuación de la expansión clonal de las células B. Todo ello produce una disminución de las citocinas inflamatorias hasta valores fisiológicos, evita la inflamación sinovial y el daño estructural5,6.
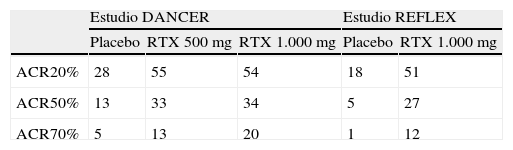
Eficacia y seguridadRituximabLos estudios pivotales de eficacia y seguridad de rituximab son los estudios DANCER7 y REFLEX8. En el estudio DANCER se incluyeron a pacientes con AR activa, a pesar de estar recibiendo tratamiento con metotrexato y que previamente se habían tratado con otros fármacos modificadores de la enfermedad y/o agentes biológicos. El objetivo fue investigar la eficacia y la tolerabilidad de 2 pautas de rituximab (ciclos de 2 infusiones de 500 o 1.000mg en combinación con metotrexato) con distintas pautas de corticoides. La variable principal de desenlace fue la respuesta ACR20 a los 6 meses. Como variables secundarias, se analizaron la respuesta ACR50 y ACR70, la respuesta EULAR y DAS28.
El estudio REFLEX fue un ensayo en el que se incluyeron pacientes con AR y respuesta inadecuada a anti-TNF. La variable principal del desenlace fue la consecución de la respuesta ACR20 en la semana 24; como variables secundarias se incluyeron ACR50 y ACR70. Otras variables analizadas fueron medidas de calidad de vida y medidas del cambio radiológico, utilizando la puntuación de Sharp modificada por Genant.
En la tabla 1 pueden verse los resultados de ambos estudios. En resumen, alrededor del 55% de los pacientes consiguieron respuestas ACR20; el 33%, ACR50, y aproximadamente el 20%, ACR70, el estudio DANCER7, siendo el estudio REFLEX el 51% ACR20; el 27%, ACR50, y el 12%, ACR70, todas ellas estadísticamente superiores al placebo8. Cuando se analizó la respuesta EULAR a los 6 meses (estudio REFLEX) se observó que habían conseguido una respuesta buena/moderada el 65% los pacientes (con respuesta buena el 15% de los pacientes)8. El estudio de la progresión radiológica mostró una diferencia significativa de los pacientes que habían recibido rituximab frente a los pacientes que habían recibido placebo, y se observó que el 68% de los pacientes tratados con rituximab no habían progresado al cabo de 2 años de tratamiento frente al 54% de los pacientes tratados con metotrexato.
En cuanto a las reacciones adversas, pudo observarse que si bien en las primeras infusiones se producían efectos adversos infusionales (prurito, fiebre, urticaria, mareos, edema, todos, broncoespasmo, etc.) hasta en el 26% de los pacientes, estas reacciones disminuían con la segunda infusión del curso y con los cursos sucesivos. De forma que, en el quinto ciclo, las reacciones infusionales se producían en el 10% de los pacientes en la primera infusión y en el 2% de los pacientes en la segunda infusión.
La tasa de infecciones se mantuvo estable con los ciclos de tratamiento. La tasa de infecciones graves se situó alrededor del 5% de los pacientes. No se observó un aumento de la tasa de neoplasias en pacientes tratados con rituximab9.
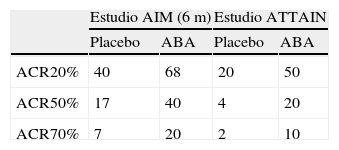
AbataceptLos estudios pivotales de abatacept son los estudios AIM10 y ATTAIN11.
En el estudio AIM se evaluó a pacientes con AR activa, a pesar del tratamiento con metotrexato. Las variables de desenlace principales fueron: respuesta ACR20 a los 6 meses, mejoría de la función física y cambio estructural respecto a radiografías basales al cabo de un año.
En el estudio ATTAIN se incluyeron pacientes con AR activa, a pesar de tratamiento con anti-TNF tras un período de lavado entre 28 y 60 días.
Los resultados pueden observarse en la tabla 2. A modo de resumen, podemos decir que en el estudio AIM el 68% de los pacientes consiguieron respuestas ACR20 a los 6 meses y el 73%, a los 12 meses, y las respuestas ACR50 se situaron en el 40–48% y ACR70, en el 20-29%, respectivamente. Las tasas de respuesta se mantuvieron estables durante la fase abierta del estudio y se observó que a los 3 años se mantenía una respuesta ACR20 en el 85%, ACR50 en el 63% y ACR70 en el 37,5% de los pacientes12.
Las tasas de respuesta del estudio ATTAIN a los 6 meses fue ACR20 en el 50%, ACR50 en el 20% y ACR70 en el 10% de los pacientes, una respuesta significativamente mejor que en el grupo placebo. De forma similar a lo que se observaba en el estudio AIM, estas respuestas se mantuvieron estables en la fase abierta, y a los 2 años fueron de ACR20 en el 56%, ACR50 en el 33% y ACR70 en el 16% de los pacientes.
En el estudio AIM pudo observarse una progresión radiológica menor en los pacientes que habían seguido tratamiento con abatacept, respecto a los pacientes que había seguido tratamiento con placebo, una progresión que fue significativa12.
Las tasas de efectos adversos de abatacept mostraron que sólo el 9,8% de los pacientes presentaba reacciones infusionales agudas, frente al 6,7% de los pacientes tratados con placebo, y sólo el 0,4% los pacientes abandonó los estudios por reacciones a las infusiones. La tasa de infecciones graves se situó en el 4,2/100 pacientes/año en el primer año y en el 3,2/100 pacientes/año a los 3 años. No se observó un aumento de las tasas de infección con el incremento del tiempo de exposición al fármaco13. Asimismo, pudo observarse que la tasa de incidencia estandarizada de neoplasias no era distinta a la publicada en la población general.
En cuanto a la seguridad tanto de rituximab, como de abatacept, cabe destacar el artículo publicado por Saillot et al14, en el que después de analizar los datos de seguridad obtenidos de los distintos ensayos clínicos los autores concluyen que no hay datos que indiquen un aumento significativo del riesgo de infecciones graves durante el tratamiento. En este mismo trabajo, se pone de manifiesto un aumento de este riesgo cuando se utilizan dosis altas de anakinra14.
Controversias actuales en la utilización de abatacept y rituximabHay diversas cuestiones que siguen siendo controvertidas en la actualidad respecto a los 2 fármacos, como por ejemplo, ¿cuándo realizar un retratamiento con rituximab?, ¿se deben utilizar estos fármacos tras el fallo a un primer anti-TNF?, y por último, ¿qué hacer cuando ya ha fallado abatacept y/o rituximab?
¿Cuándo realizar un retratamiento con rituximab?La cuestión de si realizar tratamientos a intervalos fijos con rituximab o realizar tratamientos a demanda está establecida en el trabajo presentado por Teng et al EULAR 2008. En él compara la respuesta al tratamiento entre 2 grupos de pacientes, uno con retratamiento a intervalos fijos frente a un grupo de pacientes retratados a demanda (esto es, cuando se detecta un rebrote de la enfermedad). En este trabajo se muestra que un porcentaje mayor de pacientes en el grupo de retratamiento a períodos preestablecidos alcanza un porcentaje mayor de respuestas ACR20 y ACR50, respecto a los pacientes tratados a demanda. Estas diferencias se sustentan sobre todo en los pacientes que habían obtenido una respuesta moderada tras de la primera infusión de rituximab.
Si bien, a partir del trabajo comentado, parece claro que el retratamiento a períodos fijos es mejor que el retratamiento a demanda, no queda tan claro cuál debe ser el intervalo entre retratamientos.
No hay ningún trabajo que explore el intervalo óptimo para el retratamiento. Sin embargo, hay trabajos, como el de Finckh et al15, en el que al analizar a los pacientes que después del tratamiento con rituximab (una sola dosis) precisaban un nuevo retratamiento (por aumento de la actividad de la enfermedad), estos pacientes iniciaban un aumento de la actividad clínica a los 6 meses después del ciclo de tratamiento, y hacia los 12 meses llegaban a la actividad previa a la infusión de rituximab. En este mismo trabajo, se puede observar que un grupo no despreciable de pacientes permanecía con actividad baja a los 12 meses y no precisaba retratamiento.
Por otro lado, al analizar por separado los trabajos de Emery y Keyston, se puede observar que el tiempo medio hasta el retratamiento fue de 49 semanas en los pacientes en los que se había indicado el tratamiento tras fallo a fármacos antirreumáticos modificadores de la enfermedad (FAME), y de 38 semanas en pacientes en los que el rituximab se inició tras fallo a un anti-TNF. Si tenemos en cuenta que rituximab no alcanzará su máximo efecto hasta al menos 12 semanas tras su administración, el tiempo óptimo para la mayoría de los pacientes deberá calcularse utilizando estos tiempos y restándoles las 12 semanas que tardará rituximab en tener su máxima acción, o sea, el retratamiento se debería realizar a las 24–37 semanas. De todas formas, y teniendo en cuenta que un grupo de pacientes permanecía con una actividad baja de la enfermedad a las 52 semanas16, son necesarios estudios dirigidos a establecer el período óptimo para el retratamiento con rituximab.
¿Se deben utilizar estos fármacos tras el fallo a un primer anti-TNF?Otra de las grandes cuestiones actuales es si después del fracaso de un primer anti-TNF es mejor el cambio de diana terapéutica (utilizar rituximab o abatacept) o seguir con la misma diana terapéutica (switching de anti-TNF).
No hay trabajos aleatorizados que permitan contestar esta cuestión. En los trabajos pivotales, se puede observar que ambos fármacos son efectivos en pacientes tras el fallo a uno o más anti-TNF, pero no se comparan los resultados con la introducción de un anti-TNF distinto.
El único trabajo que aborda esta cuestión es el de Finckh et al16, en el que en un estudio abierto se comparan 2 cohortes de pacientes: aquellos que tras fallar uno o varios anti-TNF reciben un nuevo anti-TNF (199 pacientes [56 adalimumab, 25 etanercept y 19 infliximab]) frente a 101 que recibieron rituximab. Hay que destacar que, al no ser un estudio aleatorizado, había diferencias entre los 2 grupos al inicio del estudio en el número de anti-TNF previos y en el DAS28. Si bien los autores intentan compensar estas diferencias mediante el estudio estadístico, siempre habrá que tenerlas en cuenta a la hora de interpretar los resultados.
Al final, los autores concluyen que la utilización de rituximab disminuye en mayor medida el DAS28 a los 9 meses16. En un trabajo presentado como abstract en EULAR 2008, estos mismos autores analizan si la respuesta es la misma, dependiendo de la causa de retirada del anti-TNF previo. En este trabajo, se aprecia que cuando el anti-TNF se retira por efecto secundario, no hay diferencias significativas en el descenso del DAS28 entre los grupos estudiados. En cambio, cuando la retirada es por ineficacia (sea primaria o secundaria), las diferencias entre el nuevo anti-TNF y el rituximab se hacen mucho más evidentes. Como conclusión a este trabajo, podríamos decir que el cambio a rituximab tras el fallo de un anti-TNF no es inferior a la utilización de otro anti-TNF, y parece superior cuando la retirada del anti-TNF es por fallo (primario o secundario) al anti-TNF17.
¿Qué hacer cuando falla rituximab y/o abatacept?Tanto rituximab como abatacept han demostrado su eficacia y seguridad tras haber fallado un fármaco anti-TNF; sin embargo, un porcentaje no despreciable de pacientes tampoco responde a la utilización de estos fármacos, por lo que, después de iniciar el tratamiento, en ocasiones nos planteamos cambiar a otro tratamiento. En este punto, volvemos a encontrarnos problemas. No hay ningún estudio que muestre los resultados en eficacia y seguridad del paso de rituximab a abatacept o de abatacept a rituximab (aunque es una práctica que no es extraña para los que tratamos artritis refractarias). Así, ¿qué evidencias hay de tratamientos después del fallo a abatacept o rituximab?
Hasta el momento, no hay ningún trabajo que investigue la eficacia y la seguridad de las alternativas terapéuticas después del fallo a abatacept. En cuanto a rituximab, el único trabajo que investiga la seguridad de utilización de FAME o anti-TNF tras la utilización de rituximab es el presentado por Genovese et al18 en ACR 2007. En este estudio se analizan los pacientes a los que se incluyó en los estudios aleatorizados con rituximab y que, por alguna razón, tuvieron que ser retirados del estudio. En estos pacientes, se realizó un seguimiento de seguridad. Como parte del tratamiento, a estos pacientes se administró un nuevo FAME (n=46) o un nuevo anti-TNF (n=107). La mediana de tiempo hasta la introducción del nuevo tratamiento fue de 6 semanas, con un rango entre 14 y 820 días. La mayoría de los pacientes que recibieron un nuevo anti-TNF seguían presentando una depleción de las células B (87%).
La tasa de infecciones graves entre los pacientes que recibieron un nuevo anti-TNF fue ligeramente superior (9,2/100 pacientes/año) a los que siguieron con rituximab (5,9/100 pacientes/año), sin llegar estas diferencias a la significación estadística18.
En la actualidad tenemos poca información sobre qué hacer tras fallos a rituximab o abatacept, aunque sin duda en los próximos años dispondremos de más información a este respecto.
¿Hay la posibilidad de realizar tratamientos combinados de estos fármacos entre ellos o con anti-TNF?Después de los decepcionantes resultados con la combinación de anti-TNF y anakinra, es una de las cuestiones que sin duda se plantean.
En este sentido, es ilustrativo el trabajo que Weimblat et al19 publicaron sobre un estudio aleatorizado de pacientes a los que se administró abatacept o placebo mientras estaban recibiendo tratamiento con etanercept. La conclusión de este estudio fue que la combinación de abatacept a la dosis de 2mg/kg durante la fase ciega del estudio, y de 10mg/kg durante su fase abierta, se asoció con un aumento de los efectos adversos (que incluyeron infecciones graves) con efectos clínicos limitados. Los autores concluyen que la combinación de etanercept y abatacept no debe utilizarse para el tratamiento de la AR, su limitada eficacia y en el aumento de los efectos adversos que incluían infecciones graves.
De forma contraria, en un estudio piloto presentado en el ACR de 2007 por Brickmann et al20, 4 pacientes refractarias a FAME recibieron un primer ciclo de rituximab a dosis estándar (1.000mg), y, tras 6 semanas, se les administró etanercept 25mg 2 veces a la semana. En estas pacientes, se produjo un descenso de linfocitos según lo esperado y no se recuperó durante el período de observación. Se observó un descenso del DAS28 desde 6,3 hasta 3,0 en la semana 28 (p=0,003). No se observaron infecciones graves en las pacientes. Si bien se trata de un estudio con muy pocos pacientes, éste indica la posibilidad de la utilización de forma secuencial de un anti-TNF (etanercept) después de una depleción de linfocitos B en pacientes con AR grave que no responden a FAME.
Tratamiento temprano con rituximab o abataceptEn cuanto a la utilización de abatacept y rituximab como biológicos de primera línea de tratamiento, es decir, su utilización después del fracaso de tratamiento con FAME clásicos, el estudio AIM9 demuestra la eficacia y la seguridad de abatacept después del fracaso de FAME. Además, la utilización de forma temprana de abatacept parece ofrecer mejores resultados, como proponen Yazici et al21 en su trabajo presentado en EULAR 2008, en el que muestran que los pacientes con un tiempo de evolución menor (evolución inferior o igual a 2 años) presentaban unas tasas de respuesta superior a los pacientes con más de 10 años de evolución de AR. Si bien se trata sólo de resultados preliminares, y habrá que esperar a la publicación del trabajo definitivo, los datos presentados indican que el tratamiento temprano con abatacept podría ser muy efectivo, ya que más de dos terceras partes de los pacientes tratados estaban en remisión a los 3 años.
Asimismo, Emery et al22 presentaron un trabajo interesante en el que demostraban que la administración de abatacept en pacientes con artritis indiferenciada y riesgo alto de desarrollo de AR producía un descenso significativo de los pacientes que desarrollaban AR al cabo de un año. Como ocurre con el trabajo anterior, deberemos esperar la publicación definitiva del trabajo para sacar conclusiones, aunque parece indicar que la utilización de abatacept de forma temprana podría interferir en la fisiopatología del desarrollo de AR.
Si bien actualmente no disponemos de estudios publicados con rituximab sobre la utilización del fármaco como fármaco de primera línea, o la utilización en artrititis tempranas o indiferenciadas, me consta que se están llevando a cabo estudios en esta dirección y que, por tanto, en breve dispondremos de información al respecto.
ConclusionesComo conclusión, me gustaría realizar una reflexión, quizás algo filosófica.
Rituximab y abatacept son fármacos eficaces y seguros a la hora de tratar a los pacientes con AR. El hecho de que presenten dianas terapéuticas distintas ofrece la posibilidad de tratar a pacientes en los que, anteriormente, el tratamiento ha fracasado; sin embargo, a pesar de los tratamientos de los que disponemos en la actualidad, hay un número no despreciable de pacientes con una respuesta subóptima.
La fisiopatología de la AR es compleja y no está totalmente esclarecida. El hecho que obtengamos resultados globalmente similares (respuestas ACR50 entre el 30 y el 50%) con fármacos que actúen frente a distintas dianas terapéuticas (anti-TNF, depleción linfocitaria B, inhibición de coestimulación de células T, etc.), hace que quizá tengamos que plantearnos (a la hora de realizar un tratamiento) no el hecho de si el fármaco va a ser más eficaz (ya que la eficacia global va a ser similar con los distintos tratamientos), sino qué paciente va a responder de un modo más probable a cada uno de los fármacos. Dado que en la actualidad no disponemos de factores pronósticos individuales de respuesta, actuamos mediante la técnica de ensayo y error. Sin embargo, no debemos olvidarnos del reto que se presenta en los próximos años, esto es, intentar esclarecer factores pronósticos de respuesta, de forma que, ante un paciente determinado (con un tipo de AR determinada), podamos iniciar el tratamiento con el fármaco al que responderá mejor para así evitar pruebas terapéuticas innecesarias, con el ahorro económico y de seguridad que ello conllevará. Nos queda un largo camino que recorrer.