Las vasculitis asociadas a ANCA son enfermedades autoinmunes crónicas que se caracterizan por inflamación y destrucción de vasos de pequeño tamaño. El rituximab es un tratamiento efectivo para la fase de inducción de estas patologías. Durante los últimos años, varios estudios no controlados han reportado que también es eficaz durante la fase de mantenimiento terapéutico. En estas series, el fármaco se administró solo durante las recaídas, a intervalos fijos o sobre la base en cambios en algunos biomarcadores. Los resultados del estudio MAINRITSAN mostraron que el rituximab es superior a la azatioprina como terapia de mantenimiento en estas enfermedades. Este trabajo de revisión resume la información más reciente sobre el uso de rituximab como opción para la fase de mantenimiento de las vasculitis asociadas a ANCA, detallando su efectividad, los diversos protocolos de administración, el perfil de seguridad y el uso potencial de biomarcadores para guiar el tratamiento.
ANCA-associated vasculitides (AAV) are chronic autoimmune diseases characterized by inflammation and destruction of small vessels. Rituximab is now licensed for use as a remission-induction agent in the treatment of these disorders. During recent years, several non-controlled studies have suggested that rituximab may be of value in maintaining disease remission in AAV. In these series, 3 techniques have been tried: “watch-and-wait”, repeated cycles in fixed intervals, or administration based on proposed biomarkers. More importantly, the results of the MAINRITSAN trial showed that this anti-CD20 agent is superior to azathioprine for preventing major relapses in AAV. This review summarizes current information regarding the effectiveness, timing, dosing, duration and safety of rituximab as a valid option for remission maintenance.
Las vasculitis asociadas a anticuerpos dirigidos contra antígenos del citoplasma de los neutrófilos (ANCA) son un grupo de enfermedades multisistémicas que se caracterizan por inflamación necrosante de vasos de diámetro pequeño1. Bajo el término de vasculitis asociadas a ANCA (VAA) se incluyen la granulomatosis con poliangitis (GPA, Wegener), la poliangitis microscópica (PAM) y la granulomatosis eosinofílica con poliangitis (GEPA, Churg-Strauss)1.
El rituximab (RTX), un anticuerpo monoclonal quimérico que integra la región variable anti-CD20 de una inmunoglobulina (Ig) murina con la región constante de una IgG1 humana, es una de las alternativas terapéuticas aprobadas para la fase de inducción tanto en la GPA como en la PAM2. Durante los últimos años, algunos estudios han evaluado el uso de RTX como tratamiento de mantenimiento en estas vasculitis.
En este trabajo de revisión se detalla la información existente sobre la efectividad del RTX para mantener la remisión en las VAA. Para ello, se realizó una búsqueda en la base de datos de la Librería Nacional de Medicina de Estados Unidos de América (PubMed) de artículos en inglés o castellano publicados entre enero del 2001 y enero del 2015. Los términos incluidos en ambos idiomas fueron: ANCA, vasculitis, granulomatosis con poliangitis, poliangitis microscópica y granulomatosis de Wegener en combinación con rituximab, anti-CD20, tratamiento de mantenimiento y terapia biológica. Los artículos relevantes se obtuvieron en su versión completa y fueron revisados y analizados por ambos autores. También se identificó información destacada en los resúmenes de los congresos internacionales de reumatología realizados durante los últimos 5 años. Este trabajo no incluye el empleo de RTX en GEPA, que ha sido revisado recientemente en esta misma revista3.
Tratamiento de mantenimiento de las vasculitis asociadas a anticuerpos dirigidos contra antígenos del citoplasma de los neutrófilosEl tratamiento de la GPA y PAM incluye 2 etapas distintas, una de inducción (con inmunosupresión intensa) y una de mantenimiento. El objetivo esta última es prevenir las recaídas y limitar la toxicidad farmacológica.
A pesar de que el tratamiento inicial con ciclofosfamida (CFM), RTX o metotrexato (MTX) en combinación con dosis elevadas de glucocorticoides (GC) consigue la remisión parcial o completa del 75-90% de los pacientes con VAA4,5, el 11-57% de los mismos presentan recaídas mientras se encuentran en tratamiento con azatioprina (AZA) o MTX6-8. Aunque la mayoría son leves, algunas pueden ser graves, lo que puede provocar daño orgánico agregado, secuelas funcionales permanentes o incluso la muerte. Además de las complicaciones inherentes de la enfermedad, el 40% de los pacientes presentan efectos adversos relacionados directamente con la terapia empleada, por ejemplo, infecciones, osteoporosis o complicaciones cardiovasculares9,10.
Con este panorama, es claro que existe la necesidad de mejorar ciertos aspectos de la terapia de mantenimiento. Entre las asignaturas pendientes destacan: 1) optimización en la reducción de dosis y duración de la terapia de los fármacos que la constituyen, ya que la mayoría de las recaídas ocurren durante el descenso de los GC/inmunosupresores (IS) o después de su suspensión11; 2) identificación temprana de pacientes con alto riesgo de recaídas, por ejemplo aquellos con GPA, enfermedad del tracto respiratorio alto, positividad de PR3-ANCA, colonización nasal por Staphylococcus aureus o persistencia de ANCA en el momento de iniciar AZA12-16; 3) desarrollo de tratamientos individualizados donde se tomen en cuenta no solo las diferencias clínicas y étnicas, sino las asociaciones histológicas, serológicas y genéticas11,17, y 4) evaluación de nuevos fármacos, como abatacept (clinicaltrials.gov, NCT02108860o), belimumab (estudio BREVAS, NCT01663623) o el fármaco evaluado en este trabajo, RTX.
Fundamentos para el uso de rituximab en las vasculitis asociadas a anticuerpos dirigidos contra antígenos del citoplasma de los neutrófilosLa evidencia a distintos niveles indica que los linfocitos B tienen un papel muy importante en las VAA: 1) el número de células B activadas se asocia a la actividad y la gravedad de la enfermedad18; 2) los ANCA, anticuerpos posiblemente involucrados en la patogénesis de estas vasculitis, son producidos por linfocitos B19,20; 3) en biopsias nasales, pulmonares y tejido orbitario de pacientes con GPA se han identificado células B autorreactivas, adyacentes a células PR3-ANCA positivas, que forman estructuras semejantes a folículos linfoides, que desaparecen después del tratamiento con RTX21-24, y 4) los linfocitos B son el blanco principal de la CFM, fármaco fundamental en el tratamiento de estas vasculitis25.
La unión del RTX al CD20 provoca la depleción rápida y sostenida de los linfocitos B premaduros y maduros (reduciendo los precursores de células plasmáticas) por diversos mecanismos, que incluyen citotoxicidad celular dependiente de anticuerpos (mediada por macrófagos y células asesinas naturales), lisis mediada por complemento, inducción de apoptosis y sensibilización a GC y citotóxicos26. Además, el fármaco es capaz de inhibir la interacción entre células B y T autorreactivas e incrementa la población de linfocitos T reguladores27-30.
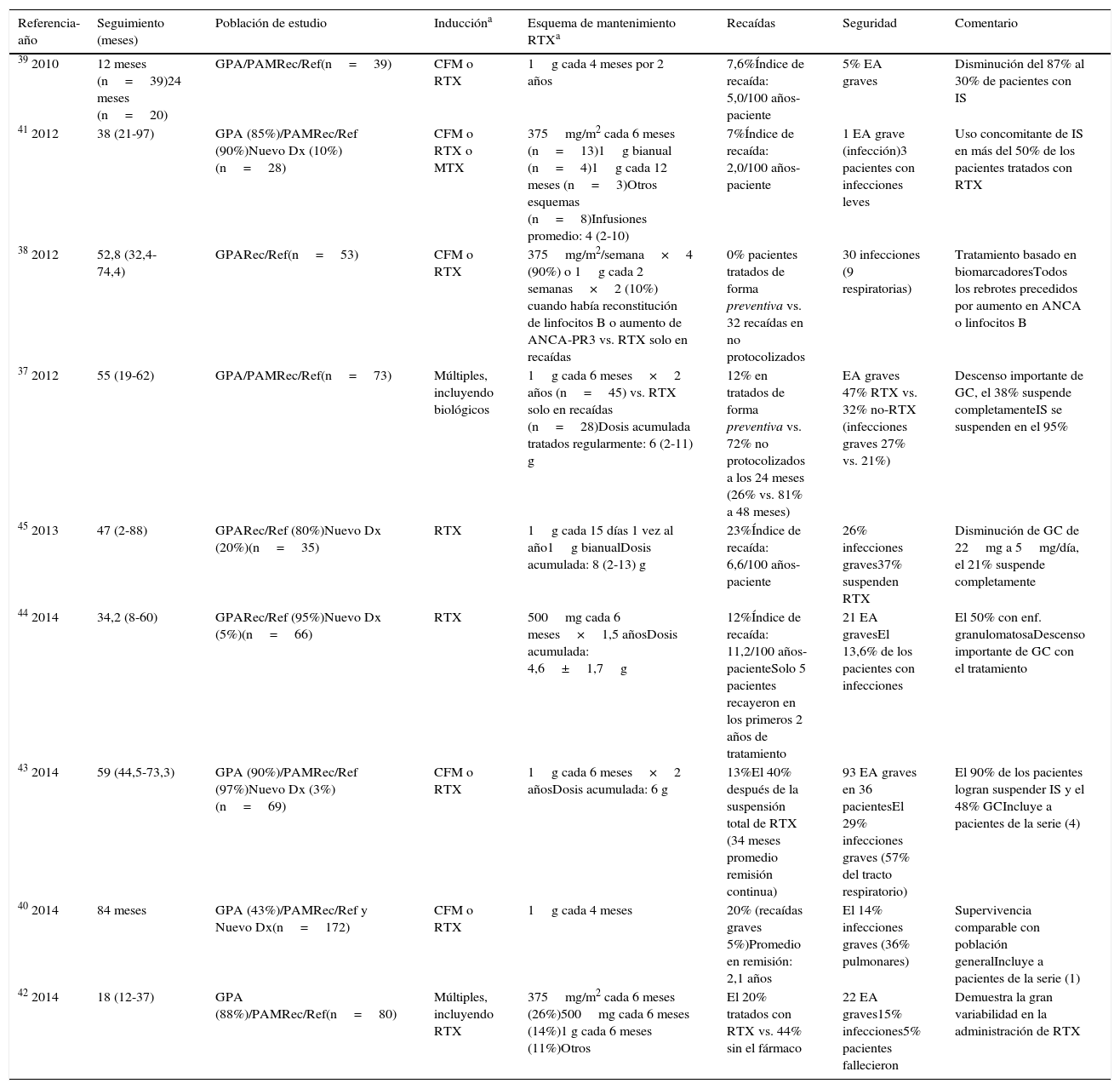
Terapia de mantenimiento con rituximabLa información sobre el uso de RTX como tratamiento de mantenimiento deriva de un reciente ensayo clínico aleatorizado (MAINRITSAN) y de algunos estudios observacionales (tabla 1).
Estudios relacionados al tratamiento de mantenimiento con RTX (intervalos fijos)
| Referencia-año | Seguimiento (meses) | Población de estudio | Induccióna | Esquema de mantenimiento RTXa | Recaídas | Seguridad | Comentario |
|---|---|---|---|---|---|---|---|
| 39 2010 | 12 meses (n=39)24 meses (n=20) | GPA/PAMRec/Ref(n=39) | CFM o RTX | 1g cada 4 meses por 2 años | 7,6%Índice de recaída: 5,0/100 años-paciente | 5% EA graves | Disminución del 87% al 30% de pacientes con IS |
| 41 2012 | 38 (21-97) | GPA (85%)/PAMRec/Ref (90%)Nuevo Dx (10%)(n=28) | CFM o RTX o MTX | 375mg/m2 cada 6 meses (n=13)1g bianual (n=4)1g cada 12 meses (n=3)Otros esquemas (n=8)Infusiones promedio: 4 (2-10) | 7%Índice de recaída: 2,0/100 años-paciente | 1 EA grave (infección)3 pacientes con infecciones leves | Uso concomitante de IS en más del 50% de los pacientes tratados con RTX |
| 38 2012 | 52,8 (32,4-74,4) | GPARec/Ref(n=53) | CFM o RTX | 375mg/m2/semana×4 (90%) o 1g cada 2 semanas×2 (10%) cuando había reconstitución de linfocitos B o aumento de ANCA-PR3 vs. RTX solo en recaídas | 0% pacientes tratados de forma preventiva vs. 32 recaídas en no protocolizados | 30 infecciones (9 respiratorias) | Tratamiento basado en biomarcadoresTodos los rebrotes precedidos por aumento en ANCA o linfocitos B |
| 37 2012 | 55 (19-62) | GPA/PAMRec/Ref(n=73) | Múltiples, incluyendo biológicos | 1g cada 6 meses×2 años (n=45) vs. RTX solo en recaídas (n=28)Dosis acumulada tratados regularmente: 6 (2-11) g | 12% en tratados de forma preventiva vs. 72% no protocolizados a los 24 meses (26% vs. 81% a 48 meses) | EA graves 47% RTX vs. 32% no-RTX (infecciones graves 27% vs. 21%) | Descenso importante de GC, el 38% suspende completamenteIS se suspenden en el 95% |
| 45 2013 | 47 (2-88) | GPARec/Ref (80%)Nuevo Dx (20%)(n=35) | RTX | 1g cada 15 días 1 vez al año1g bianualDosis acumulada: 8 (2-13) g | 23%Índice de recaída: 6,6/100 años-paciente | 26% infecciones graves37% suspenden RTX | Disminución de GC de 22mg a 5mg/día, el 21% suspende completamente |
| 44 2014 | 34,2 (8-60) | GPARec/Ref (95%)Nuevo Dx (5%)(n=66) | RTX | 500mg cada 6 meses×1,5 añosDosis acumulada: 4,6±1,7g | 12%Índice de recaída: 11,2/100 años-pacienteSolo 5 pacientes recayeron en los primeros 2 años de tratamiento | 21 EA gravesEl 13,6% de los pacientes con infecciones | El 50% con enf. granulomatosaDescenso importante de GC con el tratamiento |
| 43 2014 | 59 (44,5-73,3) | GPA (90%)/PAMRec/Ref (97%)Nuevo Dx (3%)(n=69) | CFM o RTX | 1g cada 6 meses×2 añosDosis acumulada: 6 g | 13%El 40% después de la suspensión total de RTX (34 meses promedio remisión continua) | 93 EA graves en 36 pacientesEl 29% infecciones graves (57% del tracto respiratorio) | El 90% de los pacientes logran suspender IS y el 48% GCIncluye a pacientes de la serie (4) |
| 40 2014 | 84 meses | GPA (43%)/PAMRec/Ref y Nuevo Dx(n=172) | CFM o RTX | 1g cada 4 meses | 20% (recaídas graves 5%)Promedio en remisión: 2,1 años | El 14% infecciones graves (36% pulmonares) | Supervivencia comparable con población generalIncluye a pacientes de la serie (1) |
| 42 2014 | 18 (12-37) | GPA (88%)/PAMRec/Ref(n=80) | Múltiples, incluyendo RTX | 375mg/m2 cada 6 meses (26%)500mg cada 6 meses (14%)1 g cada 6 meses (11%)Otros | El 20% tratados con RTX vs. 44% sin el fármaco | 22 EA graves15% infecciones5% pacientes fallecieron | Demuestra la gran variabilidad en la administración de RTX |
Todas las series reportadas son cohortes observacionales de un único centro, excepto (9) (retrospectiva multicéntrica).
CFM: ciclofosfamida; Dx: diagnóstico; EA: eventos adversos; Gc: glucocorticoides; GPA: granulomatosis con poliangitis; IS: inmunosupresores; MTX: metotrexato; PAM: poliangitis microscópica; Rec/Ref: recidivante/refractaria; Ref: referencia; RTX: rituximab.
Tanto el tratamiento de inducción como el de mantenimiento incluyeron GC.
Modificada de Keogh et al.54 y McAdoo y Pusey84.
El MAINRITSAN es el primer y único estudio aleatorizado que comparó RTX y AZA como tratamiento de mantenimiento en pacientes con GPA (n=87), PAM (n=23) o vasculitis limitada al riñón (n=5)31. El estudio (controlado, abierto y multicéntrico) incluyó a 115 pacientes (80% con nuevo diagnóstico, 20% con enfermedad recurrente) en remisión completa, después de terapia de inducción con GC y CFM. El protocolo de mantenimiento se basó en la administración de prednisona (aproximadamente 5mg/día durante al menos 18 meses) en combinación con AZA (n=58, 2mg/kg/día durante un año, 1,5mg/kg/día por 6 meses y 1,0mg/kg/día durante los últimos 4 meses) o RTX (n=57, 500mg inicialmente en los días 0 y 14 y después cada 6 meses, totalizando 5 aplicaciones). El porcentaje de pacientes con recaídas graves (reaparición o empeoramiento de la vasculitis con manifestaciones que ponían en riesgo la vida o que afectaban un órgano esencial, como el cerebro o el corazón) al mes 28 de seguimiento (desenlace primario) fue del 5% (n=3) en pacientes tratados con RTX y del 29% (n=17) en los tratados con AZA, demostrándose una clara superioridad del anticuerpo monoclonal (p=0,002). Entre los pacientes que recayeron con AZA, 8 lo hicieron durante el primer año, 2 entre los meses 12-22 y 7 después la suspensión total del medicamento (meses 24-28). En el caso de RTX, los pacientes recayeron al mes 8, 22 y 24. En cuanto a recaídas menores, la frecuencia de sucesos adversos o la incidencia de infecciones, no se encontraron diferencias significativas entre ambos grupos.
Aunque los resultados del estudio con RTX son muy prometedores, con uno de los índices de recaídas más bajos reportados en estas vasculitis, resulta llamativo que el 41% de los rebrotes registrados en el grupo de la AZA ocurrieron cuando el medicamento había sido suspendido, subestimando posiblemente el efecto terapéutico del medicamento. Sin embargo, el protocolo de mantenimiento con AZA es semejante al que se utilizó previamente en 2 ensayos clínicos a gran escala con el mismo tipo de pacientes y cuyos resultados son semejantes a lo observado en el MAINRITSAN5,8. Como ocurre con otros IS32, es posible que el tratamiento con AZA o RTX por un período más prolongado que el evaluado en el MAINRITSAN se relacione con un mayor índice de remisiones sostenidas, lo cual deberá evaluarse en estudios clínicos con mayor tiempo de seguimiento.
En resumen, MAINRITSAN demostró que la combinación de dosis bajas de GC y RTX a intervalos fijos (cada 6 meses, duración promedio del efecto terapéutico33) puede considerarse una alternativa válida, eficaz y segura para mantener la remisión de pacientes con VAA, principalmente enfermos con GPA de nuevo diagnóstico. Actualmente, se encuentran en desarrollo 2 estudios clínicos que evaluarán RTX como terapia de mantenimiento. El primero, el MAINRITSAN 2 (Clinicaltrials.gov NCT01731561), comparará 2 estrategias de administración de RTX (500mg fijo cada 6 meses vs. 500mg en caso de aumento en los niveles de linfocitos CD19+ o ANCA). El otro estudio, RITAZAREM (NCT01697267), evaluará a pacientes con VAA refractaria a quienes se les administrará RTX (1 g de cada 4 meses) o AZA durante 2 años.
Estudios observacionalesExisten algunas diferencias y limitaciones de los estudios que a continuación se revisan, que deben ser tomadas en cuenta para una correcta interpretación de las conclusiones derivadas de los mismos. Estas series han evaluado poblaciones heterogéneas, la dosis y la forma de administración del RTX ha sido variable, y hay diferencias con el protocolo de mantenimiento reportado, ya que el medicamento se utilizó: 1) a intervalos fijos, estrategia denominada de prevención; 2) dependiendo de marcadores serológicos, como la elevación del nivel de ANCA o la reconstitución de linfocitos B, o bien 3) solo al momento de las recaídas.
Rituximab a intervalos fijos (preventivo)Esta estrategia se ha convertido en la más utilizada durante los últimos años, reportándose porcentajes de remisión sostenida (seguimiento 36-48 meses) del 74-100% (en comparación con el 19-56% en pacientes no tratados con RTX de manera regular)34-45. En la tabla 1 se resumen las características de los principales estudios.
Aunque las dosis e intervalos son variables, la administración de 1 g cada 4-6 meses durante 2 años es la que se ha utilizado con mayor frecuencia37,39-41,42. En algunos protocolos el RTX se continuó por más de 24 meses, por lo que estos pacientes podían haber recibido ≥ 10 ciclos del medicamento38,40,43. A diferencia del ensayo clínico aleatorizado MAINRITSAN, en la gran mayoría de los estudios observacionales la población de estudio predominante fue de pacientes con GPA recurrente o refractaria (edad promedio de 40,5-52 años), con un número menor de pacientes con nuevo diagnóstico37,41,44.
Con esta forma de administración, el tiempo promedio entre las recaídas y la primera y última dosis del anticuerpo monoclonal es de 11-29 y 9-15 meses, respectivamente34,37,42-45. De manera interesante, un estudio con un amplio período de seguimiento (5 años) demostró que después de suspender el medicamento (24 meses), el 50% de los pacientes se mantuvieron en remisión sostenida, mientras que el resto recayó en los 3 años posteriores a la última dosis de RTX43.
En cuanto a la toxicidad farmacológica, aunque la dosis acumulada del medicamento es mayor en estos pacientes, la frecuencia de efectos adversos (incluyendo infecciones), es semejante a la reportada en estudios donde el RTX se administraba solo durante las recaídas34-45. Sin embargo, debe remarcarse que una limitación de la administración preventiva de mantenimiento con RTX es que se corre el riesgo de sobretratar a aquellos pacientes (aproximadamente el 40%) que experimentarían remisión prolongada tras un único ciclo de inducción con RTX46. Desafortunadamente, por el momento no existen medios identificar a estos pacientes.
Otro dato importante derivado de estos estudios es que el uso preventivo de RTX permitió, en la mayoría de los pacientes reportados, la reducción de la dosis de PDN (inicialmente de 20-30mg/qd a < 5mg/qd)34,40,41,43,44. Además, el 70-95% de los enfermos tratados fueron capaces de suspender totalmente otra terapia inmunosupresora (micofenolato de mofetilo, AZA o MTX) y el 21-48% el tratamiento con GC37,39,41,43,45.
En este sentido, es importante señalar el papel coadyuvante que podrían tener los IS clásicos en el tratamiento de mantenimiento con RTX, fundamentalmente en pacientes con enfermedad recurrente o refractaria. La administración de AZA, MTX, leflunomida o micofenolato de mofetilo en combinación con RTX como tratamiento de mantenimiento se ha reportado en algunos estudios no controlados39,40,44,45,47. Un estudio con un importante número de enfermos con GPA (n=89) reportó que después de 2 años de seguimiento, aquellos pacientes tratados con AZA o MTX en combinación con RTX tenían un índice de recaídas significativamente menor que aquellos tratados solo con RTX (55% vs. 70%, p=0,04)47. Estos resultados contrastan con el subanálisis de 40 pacientes de la serie de Rhee et al.39, donde la suspensión sistemática de los inmunosupresores antes del inicio de RTX no se asoció a un aumento en la frecuencia de rebrotes. En cuanto a las complicaciones terapéuticas, algunos estudios han reportado que el uso concomitante de micofenolato de mofetilo y principalmente CFM está relacionado con una mayor predisposición a infecciones graves45, mientras que en otras series no hubo un aumento en el número de eventos adversos47. Por el momento, los datos disponibles no permiten formular conclusión clara sobre el uso coadyuvante de los IS y el RTX; sin embargo, es recomendable evitar la combinación del fármaco con CFM a dosis plenas, debido al aumento en el número de efectos adversos graves48.
Rituximab con base en niveles de biomarcadoresUn estudio retrospectivo de pacientes con GPA (n=53) con enfermedad refractaria (actividad granulomatosa 40%, vasculítica 60%) comparó la administración de RTX solo en caso de nuevas recaídas (36%) contra un protocolo individualizado (64%) con infusión del medicamento con base en el aumento de PR3-ANCA o linfocitos B en mediciones seriadas38. Al final del período de seguimiento (mediana 4,4 años, rango intercuartil 2,7-6,2), no hubo ningún episodio de reactivación entre los pacientes tratados con base en el cambio del título de ANCA o repoblación de linfocitos B (promedio de 4 ciclos recibidos de RTX) en contraste con 32 recaídas (índice de recaídas 13,8/100 años paciente) en el grupo de pacientes que no recibieron el medicamento de manera regular.
Rituximab en recaídasEl seguimiento de los pacientes tratados con un único ciclo de RTX en el ensayo clínico RAVE demostró que si bien esta terapia tiene resultados semejantes a los obtenidos con la combinación de CFM/AZA, no es suficiente para mantener una remisión prolongada, pues aproximadamente el 60% de los enfermos recaerán durante el seguimiento (18 meses)13,46.
Ante esta evidencia, en algunos centros se adoptó como medida terapéutica el retratamiento con RTX solo en casos de recaídas, observándose que el medicamento (a dosis de linfoma o de artritis reumatoide [AR]) suele ser igual de efectivo (y seguro) que la terapia anti-CD20 inicial23,36,49. En la fase abierta del RAVE5,50, 26 pacientes (92% GPA) recibieron RTX ante recaídas graves entre los meses 6 a 18 de iniciado el estudio, lográndose la remisión en aproximadamente el 90% de los casos (el 50% también logró suspender el uso concomitante de GC). Estos estudios también han demostrado que el RTX es más efectivo que la CFM en mantener la remisión en pacientes con enfermedad recurrente previa46.
Aunque parece ser que el tratamiento de las recaídas con RTX es efectivo, esta modalidad de administración tiene la desventaja de exponer a los pacientes al daño derivado de la enfermedad y posiblemente a mayores dosis acumuladas de PDN (fármaco que suele incrementarse como medida inicial). Además, ya que el RTX suele administrarse a dosis plenas de inducción, esto podría conllevar un coste económico adicional cuando se compara con dosis menores únicas administradas 1 o 2 veces al año, como se hace en los protocolos de prevención.
Predictores de recaídas después del tratamiento con rituximabUn interrogante persistente es si existen biomarcadores capaces de pronosticar con exactitud aquellos pacientes que recaerán durante el tratamiento con RTX. Hasta el momento, la evaluación de las 2 pruebas de laboratorio más ampliamente exploradas (niveles de linfocitos B y ANCA) ha arrojado conclusiones poco claras36,39,45,51, con publicaciones que abogan a favor38,49,52,53 y en contra de su utilidad36,37.
Determinación de anticuerpos dirigidos contra antígenos del citoplasma de los neutrófilosEn la inmensa mayoría de las series reportadas no ha podido establecerse una asociación entre el cambio en los niveles de ANCA y el desarrollo de recurrencias5,34,36,37,39,41,44,45,50,54-56. En estos estudios, el porcentaje de pacientes en quienes estos anticuerpos se tornaron positivos o incrementaron sus niveles, sufriendo recaídas o manteniéndose en remisión fue del 33-77% y del 38-66%, respectivamente, haciendo poco sensible su uso para guiar el tratamiento de mantenimiento. En el único estudio que encontró una asociación entre los niveles de ANCA y las recurrencias se reportó que la seroconversión de estos autoanticuerpos durante el período postratamiento con RTX se asoció a un riesgo 7 veces mayor de presentar recaídas graves43.
En cuanto a la especificidad de los ANCA, recientemente se ha publicado que la presencia de PR3-ANCA, pero no un cambio en el nivel de estos anticuerpos, se relacionó con más riesgo de recaídas a largo plazo37,43,46,50.
Una conclusión importante derivada de los estudios de extensión del RAVE es que la posibilidad de desarrollar una recaída en pacientes tratados con RTX es extremadamente baja si los ANCA son negativos y los linfocitos B permanecen indetectables en sangre periférica46,50. De hecho, solo uno de los 76 pacientes reportados en estos estudios desarrolló un rebrote mientras ambos marcadores estuvieron por debajo del nivel de detección46,50.
Linfocitos BAl igual que en el caso de los ANCA, las cifras en sangre periférica de estas células no han mostrado ser una prueba con la precisión necesaria para anticipar rebrotes31,37,39,41,44,56. Dependiendo del trabajo analizado, se ha descrito que aproximadamente el 50% de las recaídas ocurren antes de la repoblación de células B, que el 44-88% de los pacientes que recaen tienen linfocitos B detectables y que entre el 25 y el 66% de aquellos pacientes en quienes se detectan valores normales de linfocitos B no experimentan recaídas5,34,36,37,45,46. Además, el tiempo entre la reconstitución y el desarrollo de recaídas tampoco es constante, pues algunos pacientes recaen coincidiendo con la repoblación linfocitaria, mientras que otros lo hacen tiempo después (promedio 80±85 días)57.
En una de las pocas series donde se encontró una buena correlación entre la reactivación de la VAA y la repoblación de los linfocitos B se reportó que el desarrollo de los rebrotes (n=32) estaba siempre precedido por la detección periférica de estas células, con una mediana entre ambos eventos de 8,5 meses38. De manera interesante, en este trabajo todas las recurrencias fueron precedidas o asociadas con aumento de PR3-ANCA.
Un reporte reciente halló que los pacientes cuyos linfocitos B eran detectables durante el primer año después del tratamiento con RTX tenían períodos de remisión más breves en comparación con aquellos que tuvieron repoblación en un tiempo mayor a 12 meses43.
Entre las posibles hipótesis que existen para explicar la mala correlación entre el número de linfocitos B y la actividad de las VAA se incluyen: 1) la existencia de nichos de células B autorreactivas en tejidos o sitios con inflamación activa (principalmente granulomatosa)24; estos grupos celulares estarían protegidos de la actividad farmacológica del RTX, persistiendo activos antes de observarse un aumento linfocitario a nivel periférico21,58; 2) una dinámica alterada de los niveles de células B debido al efecto sinérgico entre el RTX y otros IS convencionales, como la AZA o la CFM, utilizados frecuentemente en pacientes con enfermedad resistente o refractaria59; 3) diferencias raciales entre las poblaciones estudiadas, ya que la eliminación de los linfocitos B depende no solo de la dosis de RTX, sino también de polimorfismos en los receptores de superficie celular (FcγRIIIa)60, y 4) definiciones heterogéneas entre los estudios con diversos valores absolutos de células B en sangre periférica y diversos fenotipos evaluados (CD19+ o CD20+), resultado del uso de técnicas de detección (citometría de flujo) con mayor o menor sensibilidad36.
Nuevos biomarcadoresRecientemente se ha publicado que el análisis fenotípico detallado de subpoblaciones de linfocitos B podría tener potencial para la predicción de recaídas. En un estudio de 54 pacientes con AAV se observó que cuando la repoblación de linfocitos B estaba constituida con < 30% de células CD5+ (posiblemente B reguladoras), el tiempo a la primera recurrencia era menor. Esta subpoblación celular también se correlacionó negativamente con la actividad general de la enfermedad61. De manera semejante, se ha reportado que cuando la reconstitución de linfocitos B se compone principalmente de células de memoria existe un riesgo aumentado de recurrencias53. Esto es similar a lo que ocurre en el lupus eritematoso generalizado, donde la repoblación con una mayor proporción de linfocitos B CD27+ (de memoria) se ha relacionado con un mayor riesgo de rebrotes62,63.
SeguridadLa experiencia acumulada en el tratamiento de las neoplasias hematológicas y de la AR indica que el RTX tiene un buen margen de seguridad. En el caso de las VAA, esto parece ser semejante, aunque la seguridad a largo plazo con administraciones repetidas de RTX aún no ha sido demostrada pues la mayoría de los estudios tienen un tiempo de seguimiento relativamente corto.
En los estudios de mantenimiento, el tratamiento anti-CD20+ provocó efectos adversos en el 13-60% de los pacientes37,42,43, siendo las infecciones graves, hipogammaglobulinemia, neutropenia grave o falta de eficacia las principales causas de suspensión, temporal o definitiva, del fármaco44,45.
Reacciones asociadas a la administraciónLas reacciones alérgicas leves son el efecto adverso más frecuentemente observado (10-50% de los enfermos)33,64,51. Estas ocurren usualmente durante las 24h posteriores a su aplicación, manifestándose con fiebre, escalofrío, hiper o hipotensión, fatiga, cefalea, eritema, urticaria, náusea o vómito33,51.
InfeccionesSon la complicación de mayor importancia, reportándose episodios leves o graves en el 7-50% de los enfermos (incidencia de 2,6-15,5/100 años paciente, similar a la CFM)5,36,37,42,46,49,50,56,57,65-67. Las infecciones respiratorias (principalmente de origen viral) y de las vías urinarias son las más frecuentes, seguidas por infecciones mucocutáneas (herpes simple, zóster o candidosis)33,36,37,41,46,49,50,65. Aunque la mayoría de los episodios son leves, el 14-27% de los casos presentan infecciones graves y el 3-29% desarrollan infecciones crónicas36,42-45. Las infecciones por microorganismos oportunistas son raras, siendo el medicamento seguro en pacientes con historia de tuberculosis38,39,68.
Los factores de riesgo reportados para el desarrollo de infecciones graves en estos pacientes son: altas dosis acumuladas de CFM y combinación de RTX con otros citotóxicos45,69. Aunque la presencia de neutropenia o hipogammaglobulinemia podría asociarse con mayor susceptibilidad a complicaciones infecciosas, por el momento no existe evidencia contundente que lo demuestre37,38,44.
HipogammaglobulinemiaEste efecto adverso se ha reportado en el 26-41% de los pacientes durante algún momento del mantenimiento con RTX, siendo en más del 50% de los casos un evento transitorio y autolimitado37,43,70. En la mayoría de los enfermos, el descenso más notorio en el nivel de inmunoglobulinas se observó en los primeros ciclos del tratamiento (60% del total de los episodios con dosis totales ≤ 2 g y 70% con dosis ≤ 6 g)71.
Aunque la hipogammaglobulinemia suele ser leve a moderada, aproximadamente el 7% de los enfermos presentan deficiencia grave y/o permanente, que requiere la suspensión del fármaco y sustitución con gammaglobulina por vía intravenosa43,44,57,65,72. En este sentido, este efecto adverso no se ha relacionado directamente con un aumento en el desarrollo de infecciones graves37,38,44, aunque podría ser un elemento que contribuya en pacientes con otras condiciones predisponentes73.
Entre los factores de riesgo que se han asociado con la presencia de hipogammaglobulinemia destacan una dosis acumulada elevada de CFM (previa al inicio de RTX), concentración basal baja de inmunoglobulinas y linfocitos CD4+ y el uso concomitante del anticuerpo monoclonal con citotóxicos57,70. De manera interesante, algunos estudios han reportado que la hipogammaglobulinemia se relaciona con el número de ciclos de RTX74,75. Sin embargo, en series con mayor seguimiento, este dato no ha sido corroborado57,65,70,71.
Neutropenia de inicio tardíoSe presenta en el 3-5% de los pacientes, siendo generalmente de carácter transitorio5. En la mayoría de los casos no existen repercusiones clínicas, aunque puede haber casos que requieran del empleo de factor estimulador de colonias40,44,76,77.
Otros efectos adversosEn pacientes con VAA, se han publicado casos de pancitopenia33,39, edema macular78 o complicaciones pulmonares graves (enfermedad intersticial)48. Además, existen reportes de pacientes con lupus eritematoso generalizado y AR con leucoencefalopatía multifocal progresiva79,80. En VAA, ya hay un caso (no publicado) con esta complicación48.
ConclusionesEl RTX ha demostrado ser un medicamento efectivo y seguro en el tratamiento de mantenimiento de las VAA, tanto en enfermedad de reciente diagnóstico como en pacientes con recaídas frecuentes48. Sobre la base de lo publicado hasta el momento, la administración de 500mg a intervalos fijos (2 veces al año) podría ser el modo de administración a recomendar, por su alta eficacia y seguridad, más también es posible que dosis menores puedan ser eficaces en mantener remisión, como se ha descrito en otras enfermedades81,82, o a intervalos mayores de aplicación, lo cual podría ser guiado con el empleo de mejores biomarcadores, así como la respuesta individual al tratamiento.
Aún queda por resolver si el medicamento es más efectivo en grupos específicos, por ejemplo mujeres en edad fértil o pacientes susceptibles de recaídas frecuentes o con mayor riesgo de infecciones. También debe explorarse cuál es la duración idónea del mantenimiento con RTX. En este sentido, y por analogía con el tratamiento convencional, se recomienda que sea un período entre 18 a 24 meses, aunque no se tiene certeza al respecto en la actualidad48. Finalmente, aún queda por saber cuál es el efecto de la dosis acumulada o el impacto económico de diferentes protocolos de administración83.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.