Algunos pacientes con granulomatosis eosinofílica con poliangitis (EGPA) y factores de mal pronóstico son refractarios o presentan efectos adversos al tratamiento de inducción (glucocorticoides [GC] y ciclofosfamida [CF]), o recaen durante el mantenimiento (GC y azatioprina), haciendo necesaria la búsqueda de alternativas terapéuticas. En ensayos clínicos, el rituximab (RTX) demostró ser eficaz para el tratamiento de las vasculitis asociadas al ANCA; sin embargo, los pacientes con EGPA no fueron incluidos.
ObjetivoRevisar y analizar la bibliografía sobre la uso de RTX para el tratamiento de la EGPA.
MétodosLa búsqueda se realizó en MEDLINE y LILACS (1965 y 1986, respectivamente, hasta febrero del 2014).
ResultadosSe incluyó a 27 pacientes. La indicación de RTX fue por enfermedad refractaria (n=20), recaída (n=5) y nuevo diagnóstico (n=2). Los órganos afectados fueron los pulmones, el sistema nervioso periférico, el riñón y los ojos. Se observó remisión en 16 y respuesta en 8 pacientes.
ConclusionesEl RTX fue eficaz y bien tolerado para el tratamiento de la EGPA.
The general consensus is that for patients with EGPA with poor prognosis, intensive therapy with both GC and CF is indicated. The maintenance of remission is made with GC and AZA. A considerable number of patients with EGPA are refractory to first line therapy, experience dose-limiting side effects or relapse. In clinical trials, RTX was effective for the treatment of ANCA-associated vasculitis. However, patients with a diagnosis of EGPA were not included.
Objectiveto review and analyze the published literature regarding the use of RTX in the treatment of EGPA.
MethodsThe literature search was performed in MEDLINE and LILACS from 1965 and 1986 respectively until february 2014.
Results27 patients were included. RTX treatment was due to refractory disease (n=20), relapse (n=5) and with newly diagnosed (n=2). The affected organs were the lungs, peripheral nervous system, kidney and the eyes. Sixteen patients had clinical remission and 8 patients had clinical response.
ConclusionsRTX was effective and well tolerated for the treatment of EGPA.
La EGPA es una vasculitis necrosante que afecta principalmente a vasos pequeños y medianos, y se la define como una enfermedad inflamatoria granulomatosa y necrosante rica en eosinófilos que frecuentemente afecta al tracto respiratorio y se caracteriza por la presencia de asma y eosinofilia. Junto con la granulomatosis con poliangitis (granulomatosis de Wegener [GPA]) y la poliangitis microscópica (MPA), forman parte de las vasculitis asociadas a anticuerpos anticitoplasma de neutrófilo (ANCA) (VAA)1.
El consenso general es tratar las formas graves de EGPA, definidas como una puntuación de los 5 factores (FFS) igual o mayor a 1, con GC y CF hasta lograr la remisión clínica. El mantenimiento de la remisión se hace con GC y AZA. Las formas clínicas leves (FFS de 0) se tratan solo con GC. Sin embargo, la elevada tasa de eventos adversos, la falta de respuesta al tratamiento de inducción y las recaídas frecuentes observadas con los tratamientos de primera línea hacen necesaria la búsqueda de alternativas terapéuticas2-4.
El rituximab (RTX) es un anticuerpo monoclonal quimérico que se une específicamente al antígeno CD20, una fosfoproteína de transmembrana no glucosilada, expresada en los linfocitos pre-B y B. El uso razonable de este fármaco en la EGPA se basa principalmente en sus buenos resultados en comunicaciones de casos y pequeñas series de pacientes refractarios al tratamiento de primera línea, y además es apoyado por su eficacia probada en ensayos clínicos aleatorizados en las VAA (GPA y MPA)5-8. Como no se incluyó a pacientes con EGPA en estos ensayos clínicos, la aprobación del RTX no se extendió a EGPA.
El propósito del presente estudio es revisar y analizar los estudios publicados en la literatura médica sobre el uso RTX en el tratamiento de la EGPA.
Materiales y métodosEstrategia de búsqueda bibliográfica: consultamos las bases de datos Medical Literature Analysis and Retrieval System on Line (MEDLINE)/National Library of Medicine (NLM)-Biblioteca de Medicina de los Estados Unidos y Literatura Latinoamericana y del Caribe en Ciencias de la Salud (LILACS) desde los años 1965 y 1986, respectivamente, hasta febrero del año 2014. Los términos de búsqueda, en español y en inglés, fueron síndrome de Churg-Strauss (Churg-Strauss syndrome), granulomatosis eosinofílica con poliangitis (eosinophilic granulomatosis with polyangiitis), angeítis granulomatosa alérgica (allergic granulomatous angiitis), RXT y anticuerpo monoclonal anti-CD20 (anti-CD20 monoclonal antibody).
Se analizaron los siguientes datos: edad, sexo, órganos/sistemas afectados cuando se indicó RTX, estado clínico de la enfermedad (definido como recaída, refractariedad al tratamiento o nuevo diagnóstico), determinación de ANCA, recuento de eosinófilos y de linfocitos B en sangre periférica, número de fármacos inmunodepresores utilizados antes y durante el tratamiento con RTX, posología utilizada de RTX, evolución clínica de los pacientes y eventos adversos.
Fueron excluidas para el análisis final todas aquellas publicaciones que no contaron con los datos anteriormente detallados.
Análisis estadístico: las variables cualitativas se presentaron como n y porcentaje, y las cuantitativas como media ± desviación estándar o mediana y sus valores mínimos y máximos.
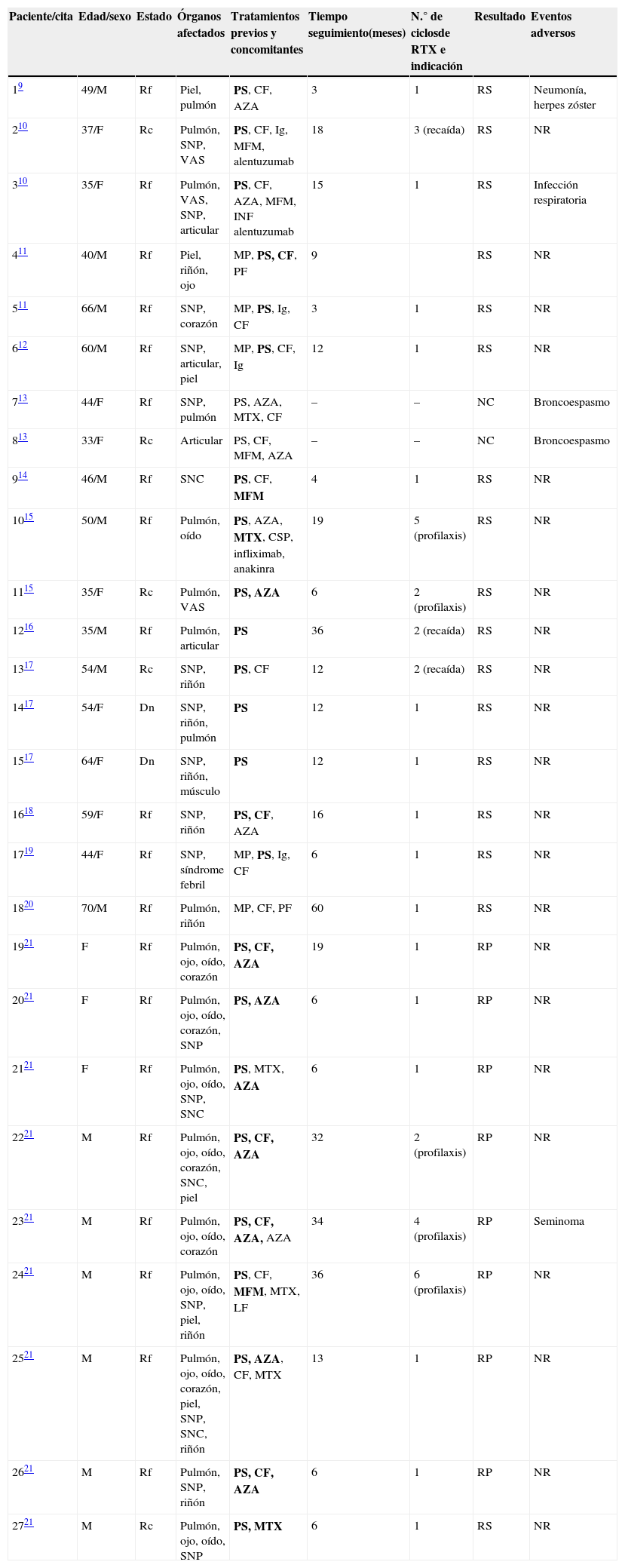
ResultadosEn la tabla 1 se detallan las características generales de los 27 pacientes con diagnóstico de EGPA incluidos para el análisis. Quince (55,5%) fueron de sexo masculino y 12 (44,5%) de sexo femenino. La mediana de seguimiento fue de 15 meses (3-60 meses). La indicación de RTX fue por enfermedad refractaria en 20 (74,1%), recaída en 5 (18,5%) y nuevo diagnóstico en 2 (7,4%) pacientes.
Características generales de los 27 pacientes con EGPA tratados con RTX hasta febrero del año 2014
| Paciente/cita | Edad/sexo | Estado | Órganos afectados | Tratamientos previos y concomitantes | Tiempo seguimiento(meses) | N.° de ciclosde RTX e indicación | Resultado | Eventos adversos |
|---|---|---|---|---|---|---|---|---|
| 19 | 49/M | Rf | Piel, pulmón | PS, CF, AZA | 3 | 1 | RS | Neumonía, herpes zóster |
| 210 | 37/F | Rc | Pulmón, SNP, VAS | PS, CF, Ig, MFM, alentuzumab | 18 | 3 (recaída) | RS | NR |
| 310 | 35/F | Rf | Pulmón, VAS, SNP, articular | PS, CF, AZA, MFM, INF alentuzumab | 15 | 1 | RS | Infección respiratoria |
| 411 | 40/M | Rf | Piel, riñón, ojo | MP, PS, CF, PF | 9 | RS | NR | |
| 511 | 66/M | Rf | SNP, corazón | MP, PS, Ig, CF | 3 | 1 | RS | NR |
| 612 | 60/M | Rf | SNP, articular, piel | MP, PS, CF, Ig | 12 | 1 | RS | NR |
| 713 | 44/F | Rf | SNP, pulmón | PS, AZA, MTX, CF | – | – | NC | Broncoespasmo |
| 813 | 33/F | Rc | Articular | PS, CF, MFM, AZA | – | – | NC | Broncoespasmo |
| 914 | 46/M | Rf | SNC | PS, CF, MFM | 4 | 1 | RS | NR |
| 1015 | 50/M | Rf | Pulmón, oído | PS, AZA, MTX, CSP, infliximab, anakinra | 19 | 5 (profilaxis) | RS | NR |
| 1115 | 35/F | Rc | Pulmón, VAS | PS, AZA | 6 | 2 (profilaxis) | RS | NR |
| 1216 | 35/M | Rf | Pulmón, articular | PS | 36 | 2 (recaída) | RS | NR |
| 1317 | 54/M | Rc | SNP, riñón | PS, CF | 12 | 2 (recaída) | RS | NR |
| 1417 | 54/F | Dn | SNP, riñón, pulmón | PS | 12 | 1 | RS | NR |
| 1517 | 64/F | Dn | SNP, riñón, músculo | PS | 12 | 1 | RS | NR |
| 1618 | 59/F | Rf | SNP, riñón | PS, CF, AZA | 16 | 1 | RS | NR |
| 1719 | 44/F | Rf | SNP, síndrome febril | MP, PS, Ig, CF | 6 | 1 | RS | NR |
| 1820 | 70/M | Rf | Pulmón, riñón | MP, CF, PF | 60 | 1 | RS | NR |
| 1921 | F | Rf | Pulmón, ojo, oído, corazón | PS, CF, AZA | 19 | 1 | RP | NR |
| 2021 | F | Rf | Pulmón, ojo, oído, corazón, SNP | PS, AZA | 6 | 1 | RP | NR |
| 2121 | F | Rf | Pulmón, ojo, oído, SNP, SNC | PS, MTX, AZA | 6 | 1 | RP | NR |
| 2221 | M | Rf | Pulmón, ojo, oído, corazón, SNC, piel | PS, CF, AZA | 32 | 2 (profilaxis) | RP | NR |
| 2321 | M | Rf | Pulmón, ojo, oído, corazón | PS, CF, AZA, AZA | 34 | 4 (profilaxis) | RP | Seminoma |
| 2421 | M | Rf | Pulmón, ojo, oído, SNP, piel, riñón | PS, CF, MFM, MTX, LF | 36 | 6 (profilaxis) | RP | NR |
| 2521 | M | Rf | Pulmón, ojo, oído, corazón, piel, SNP, SNC, riñón | PS, AZA, CF, MTX | 13 | 1 | RP | NR |
| 2621 | M | Rf | Pulmón, SNP, riñón | PS, CF, AZA | 6 | 1 | RP | NR |
| 2721 | M | Rc | Pulmón, ojo, oído, SNP | PS, MTX | 6 | 1 | RS | NR |
AZA: azatioprina; CF: ciclofosfamida; CSP: ciclosporina; Dn: nuevo diagnóstico; F: femenino; Ig: inmunoglobulina; M: masculino; MFM: micofenolato mofetilo; MP: metilprednisolona; MTX: metotrexate;NC: no corresponde; NR: no reportado; PF: plasmaféresis; PS: prednisona; Rc: recaída; Rf: refractaria; RP: respuesta; RS: remisión; SNC: sistema nervioso central; SNP: sistema nervioso periférico; RTX: rituximab; VAS: vías aéreas superiores.
Los órganos afectados que motivaron el uso de RTX fueron los pulmones (n=18, 66,6%) (asma, infiltrados pulmonares o hemorragia alveolar), el sistema nervioso periférico (n=16, 59,3%) (mono o polineuropatía), el riñón (n=9, 33,3%), los ojos (n=9, 33,3%) y el corazón (n=6, 22,2%) (tabla 1).
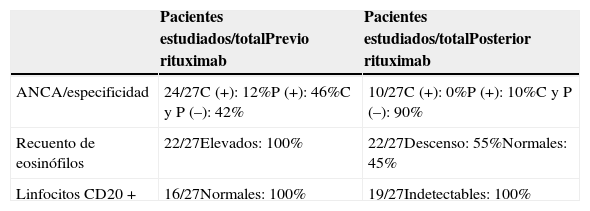
Los ANCA se reportaron en 14 pacientes (51,8%), 11 (78,6%) con patrón perinuclear (P-ANCA) y 3 (21,4%) con patrón citoplasmático (C-ANCA). En 10 (33,1%) pacientes, el ANCA fue negativo y en 3 (11,1%) el estatus del ANCA no fue comunicado. El número de eosinófilos, antes del comienzo del tratamiento con RTX, estaba elevado en todos los pacientes (tabla 2).
Detalles de la presencia de ANCA, recuento de eosinófilos y linfocitos CD20 + antes y después del tratamiento con RTX
| Pacientes estudiados/totalPrevio rituximab | Pacientes estudiados/totalPosterior rituximab | |
|---|---|---|
| ANCA/especificidad | 24/27C (+): 12%P (+): 46%C y P (–): 42% | 10/27C (+): 0%P (+): 10%C y P (–): 90% |
| Recuento de eosinófilos | 22/27Elevados: 100% | 22/27Descenso: 55%Normales: 45% |
| Linfocitos CD20 + | 16/27Normales: 100% | 19/27Indetectables: 100% |
La mediana de fármacos inmunodepresores (incluidos los GC) utilizados antes del comienzo del tratamiento con RTX fue de 3 (rango 1-6).
Los esquemas posológicos de RTX utilizados fueron: 1) 375mg/m2 de superficie corporal cada 7 días, total 4 infusiones (n=8); 2) 1.000mg cada 15 días, total 2 infusiones (n=13) y variantes de los anteriores (n=4). En 2 pacientes la infusión de RTX debió suspenderse por reacción adversa, no pudiendo completarse el esquema posológico.
Excluyendo el uso de GC, en 14 pacientes se utilizó concomitantemente otro fármaco inmunodepresor junto a RTX (CF, AZA, metotrexato y micofenolato mofetilo).
Respuesta al tratamientoSe observó remisión clínica de la enfermedad en 16 (59,2%) pacientes y respuesta en 8 (29,6%) pacientes (tablas 1 y 3).
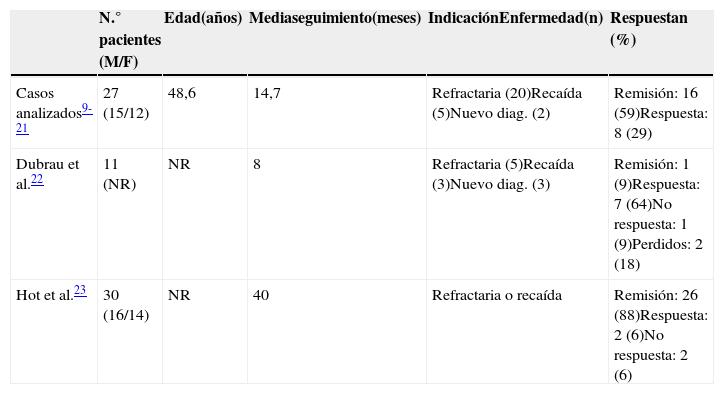
Detalle de la respuesta al tratamiento con RTX en EGPA de los casos analizados y de 2 series recientes comunicadas en forma de resúmenes
| N.° pacientes (M/F) | Edad(años) | Mediaseguimiento(meses) | IndicaciónEnfermedad(n) | Respuestan (%) | |
|---|---|---|---|---|---|
| Casos analizados9-21 | 27 (15/12) | 48,6 | 14,7 | Refractaria (20)Recaída (5)Nuevo diag. (2) | Remisión: 16 (59)Respuesta: 8 (29) |
| Dubrau et al.22 | 11 (NR) | NR | 8 | Refractaria (5)Recaída (3)Nuevo diag. (3) | Remisión: 1 (9)Respuesta: 7 (64)No respuesta: 1 (9)Perdidos: 2 (18) |
| Hot et al.23 | 30 (16/14) | NR | 40 | Refractaria o recaída | Remisión: 26 (88)Respuesta: 2 (6)No respuesta: 2 (6) |
NR: no reportado.
En 3 (12%) pacientes se observó una recaída, las manifestaciones clínicas fueron menores y en 2 de ellos coincidió con la reaparición de linfocitos B CD20 + en sangre periférica. Los 3 pacientes fueron tratados nuevamente con RTX, observándose respuesta clínica.
En la tabla 2 se detalla la evolución de los ANCA, el recuento de eosinófilos y la determinación de linfocitos B CD20 + en los pacientes antes y después de la administración de RTX.
Los eventos adversos comunicados se detallan en la tabla 1. En 2 pacientes debió suspenderse la primera infusión de RTX por broncoespasmo grave; los restantes eventos adversos fueron infecciones respiratorias y un episodio de herpes zóster. A un paciente se le diagnosticó un seminoma 12 meses después de recibir RTX. No hubo muertes.
DiscusiónLa EGPA forma parte del grupo de las VAA junto a la GPA y MPA; sin embargo, se diferencia de ellas en varios aspectos. El régimen de tratamiento actual de la EGPA es similar al de las restantes VAA, pero difiere en que el RTX no tiene una indicación definida como en la GPA y la MPA, ya que no se incluyó a pacientes con EGPA en los ensayos clínicos aleatorizados, como el RAVE y el RITUXVAS5,6. Hasta el momento, solo existen publicaciones de casos anecdóticos de EGPA tratados con RTX, lo cual hace difícil valorar la eficacia terapéutica de este fármaco en esta entidad.
El análisis de la literatura muestra que la mayoría de los pacientes con EGPA tratados con RTX eran refractarios a los tratamientos de primera línea o que presentaron una recaída durante el tratamiento inmunodepresor de mantenimiento. Solo 5 pacientes recibieron RTX como tratamiento de inducción en primera línea (tabla 3).
En todos los pacientes se observó una respuesta rápida después del tratamiento con RTX; 2 pacientes no completaron la infusión del fármaco por una reacción adversa grave durante la misma12. En la mayoría de los pacientes se observó remisión clínica de la enfermedad. Tres pacientes presentaron una o más recaídas, pero respondieron a un nuevo ciclo de RTX. En la tabla 3 se detalla la respuesta al tratamiento con RTX de los casos analizados junto con 2 series de casos recientemente comunicadas en forma de resúmenes22,23.
Un aspecto importante en los pacientes con EGPA es la persistencia de los síntomas del asma a pesar del tratamiento y la morbilidad que conlleva la dependencia de los GC a largo plazo. Si bien en los trabajos analizados no se especifica la respuesta terapéutica del RTX sobre el asma, recientemente en una comunicación presentada en el 16th International Vasculitis & ANCA Workshop (París, Francia) por Hot et al. se encontró que el 39% de los pacientes con EGPA tratados con RTX continuaban con requerimientos de GC por persistencia del asma23.
Los valores de eosinófilos en sangre periférica disminuyeron o se normalizaron después del tratamiento con RTX, independientemente del régimen posológico utilizado, en la mayoría de los pacientes. Este hallazgo pone en consideración la estrecha relación que tienen las diferentes células del sistema inmunitario, y en particular la importante interacción existente entre el linfocito Th2, a través de la secreción de citocinas (IL-4, IL-5 y IL-13), con el linfocito B y la posterior producción y secreción de eotaxina-1, IgG4, IgE y de los ANCA2,24. La IgE está elevada en el suero de los pacientes con EGPA. Esta inmunoglobulina, que es producida por células plasmáticas, se encuentra unida a receptores (Fc¿R1) en la superficie de los eosinófilos, que, al unirse a antígenos, induce su intervención en la respuesta inflamatoria. Por otro lado, la eotaxina-1 participa en el reclutamiento de los eosinófilos al sitio de inflamación2. Estos mecanismos podrían explicar en parte el descenso de los eosinófilos después del tratamiento con RTX.
Los linfocitos CD20 + circulantes después del uso de RTX fueron indetectables y persistieron de ese modo por tiempo variable. El periodo hasta la repoblación de células CD20 + no fue uniforme y en algunos pacientes no se correlacionó con la evolución clínica de la enfermedad. En el estudio RAVE6, en un elevado porcentaje de pacientes el recuento sérico de linfocitos B CD20 + era indetectable después de la infusión de RTX (al igual que el grupo que utilizó CF) y el tiempo hasta la repoblación de los mismos era variable. Aún más importante fue el hallazgo de que la repoblación de linfocitos B CD20 + como variable aislada no predijo sobre el riesgo de recaída en el paciente individual. Sin embargo, aquellos pacientes que después del uso de RTX permanecían con los valores séricos de linfocitos B CD20 + indetectables y el ANCA negativo tenían pocas probabilidades de presentar una recaída.
Los ANCA no son el único mecanismo involucrado en la patogénesis de esta vasculitis; los pacientes con EGPA tendrían una fuerte respuesta de tipo IgG4 independientemente del estatus del ANCA; la evidencia del diálogo entre el linfocito B y el eosinófilo, y la capacidad de la célula B de secretar eotaxina-1, la cual interviene en el reclutamiento de los eosinófilos en los sitios de inflamación24-26 podrían ser otras vías patogénicas involucradas en la respuesta mediada por el RTX; por tanto, el hecho de que un paciente sea ANCA negativo no predice la falta de respuesta al tratamiento con RTX.
El RTX fue bien tolerado; solo 2 pacientes presentaron reacciones adversas durante su infusión. Los eventos adversos fueron menores, generalmente infecciones respiratorias de manejo ambulatorio. No se reportaron muertes directamente atribuidas al RTX. Esto coincide con los efectos adversos comunicados en grandes series y estudios clínicos extensos que demostraron la seguridad de RTX en el tratamiento de las VAA5-8.
Los esquemas posológicos más utilizados fueron: 1.000mg de RTX cada 15 días (total 2 infusiones) y 375mg/m2 de RTX por semana (total 4 infusiones). Si bien ambos esquemas no fueron comparados formalmente, parecen ser igualmente eficaces para la inducción de la remisión en las VAA; la recomendación de expertos sobre el uso de RTX en VAA es la utilización indistinta de ambos esquemas por igual27.
Este estudio tiene limitaciones; el número de pacientes es pequeño, el tiempo de seguimiento es limitado, las definiciones de actividad y daño no fueron uniformes —solo en algunos trabajos fue utilizado el Birmingham Vasculitis Activity Score y en diferentes versiones—, los inmunodepresores y los esquemas posológicos de RTX difieren entre los pacientes. Además, no encontramos publicaciones de pacientes con EGPA que no respondieran al RTX.
Sin embargo, existe una tendencia generalizada a reconsiderar los estándares de tratamiento de las VAA, incluyendo la EGPA, tanto en la inducción como en el mantenimiento28,29.
Finalmente, el RTX parece ser eficaz y seguro para el tratamiento de la EGPA refractaria, la recaída y con nuevo diagnóstico independiente del estatus del ANCA. Es necesaria la realización de estudios clínicos aleatorizados para confirmar esta observación.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesNinguno.