Caracterizar a una cohorte de pacientes con espondiloartritis (SpA) precoz, demostrar la utilidad de la ecografía de entesis en el diagnóstico y seguimiento, y desarrollar un modelo para predecir actividad persistente.
Pacientes y métodosEstudio prospectivo a 1 año de los pacientes con SpA del EStudio PIloto de Derivación de pacientes con Espondiloartritis Precoz (ESPIDEP). Se llevó a cabo una evaluación clínica, radiológica y ecográfica. La ecográfica de entesis se realizó con el MAdrid Sonographic Enthesis Index (MASEI), y su utilidad diagnóstica se determinó con el punto de corte ≥ 18. Se examinó la evolución clínica, radiológica y del MASEI. Finalmente se desarrolló un modelo a partir de los factores que predicen actividad persistente.
ResultadosSe realizó el seguimiento durante 1 año a 32 pacientes. El MASEI basal alcanzó una sensibilidad y especificidad de 78,12% y 83,37%, un valor predictivo positivo y negativo del 83,3% y el 79,41%, y una razón de verosimilitud positiva y negativa de 5 y 0,26, respectivamente. La mejoría del BASMI y el MASEI fue significativa (p = 0,001 y p = 0,007, respectivamente). Las mujeres tuvieron más afectación periférica desde el inicio y los hombres mayor progresión radiológica axial y PCR más elevada (p < 0,05). El modelo que mejor predijo actividad persistente estaba formado por dolor axial nocturno, BASDAI y PCR.
ConclusionesLa ecografía de entesis puede ser útil en la evaluación inicial y el seguimiento de las SpA precoces. El patrón de enfermedad difiere según el sexo. Predecir actividad persistente en estadios precoces apoya la utilización de tratamientos más intensivos.
To characterize a cohort of early spondyloarthritis (SpA) patients, to demonstrate the usefulness of enthesis ultrasonography for the diagnosis and follow up, and to develop a statistical model to predict persitent activity.
Patients and methodsA 1 year prospective study with clinical, radiological and ultrasonographic evaluations was performed in patients with SpA from the Pilot Study for the Referral of Patients with Early SpA (ESPIDEP). Enthesis ultrasonography was explored by the MAdrid Sonographic Enthesis Index (MASEI), and its diagnostic utility was determined to be a cutoff score of ≥ 18 points. The clinical, radiological and MASEI scores were studied. Finally, a statistical model from factors predicting persitent activity was developed.
ResultsA 1 year follow-up of 32 patients was carried out. The baseline MASEI reached a sensitivity and specificity of 78,12% and 84,37% respectively, positive and negative predictive value was 83,3% and 79,41% respectively, and positive and negative likelihood ratios were 5 and 0,26, respectively. The improvement of BASMI and the MASEI scores were significant (p = 0,001 and p = 0,007, respectively). From the beginning, women had more peripheral affectation, and men had higher axial radiological progression and higher CRP (p < 0,05).The statistical model that best predicted persitent activity was constituted by nocturnal back pain, BASDAI and CRP.
ConclusionsEnthesis ultrasonography can be useful when begining the evaluation and follow-up of early SpA. Disease patterns are different according to sex. The ability to predict persitent activity in early stages supports the use of more intensive treatments.
En la actualidad existen diferentes líneas de investigación orientadas al diagnóstico precoz de los pacientes con espondiloartritis (SpA) y a conocer las peculiaridades que pueden presentar respecto a las formas establecidas de enfermedad. En algunos países, incluyendo el nuestro, se han descrito características clínicas y radiológicas de pacientes con SpA precoz1,2. Sin embargo, se trata de estudios transversales de cohortes prospectivas generales (tanto enfermedad precoz como tardía). Son escasos los trabajos relacionados con unidades especializadas que utilicen criterios de derivación3,4. En este sentido, el EStudio PIloto de Derivación de pacientes con Espondiloartritis Precoz (ESPIDEP) es la primera experiencia en España e introduce la derivación desde atención primaria a unidades especializadas utilizando los siguientes criterios: pacientes menores de 45 años con lumbalgia inflamatoria y/o artritis asimétrica de miembros inferiores de 3 a 24 meses de duración5. Se demuestra por primera vez en práctica clínica la utilidad de unos criterios consensuados con atención primaria. Al mismo tiempo se describen las características clínicas iniciales de los pacientes que cumplieron los criterios de derivación y tienen SpA5.
La entesitis es una lesión anátomo-clínica que puede aparecer en todas las formas y fases evolutivas de las SpA. La ecografía nos permite su evaluación de manera más sensible y específica que el examen clínico6–8. Recientemente se ha demostrado la validez de la ecografía de entesis en la correcta clasificación entre EspA y sujetos sanos, mediante el MAdrid Sonographic Enthesis Index (MASEI)9. Este índice evalúa lesiones elementales de 6 entesis bilaterales utilizando ecografía en modo B y power-Doppler.
En toda enfermedad inflamatoria crónica y discapacitante como la SpA, conseguir reconocer a los pacientes que van a tener una evolución más grave desde las fases iniciales de la enfermedad nos puede ayudar a tomar decisiones terapéuticas correctas.
Los objetivos de este estudio son definir las características clínicas y radiológicas de la cohorte de SpA precoz «ESPIDEP» tras un año de evolución, y demostrar la utilidad de la ecografía de entesis en el diagnóstico y seguimiento. Finalmente se propone un modelo para predecir actividad persistente de forma temprana.
Pacientes y métodosEstudio longitudinal y prospectivo a 1 año de la cohorte de pacientes con SpA precoz del estudio ESPIDEP. Estos pacientes habían sido correctamente derivados desde atención primaria del área 5 de Madrid a la unidad de SpA del Hospital Universitario la Paz (HULP). El diagnóstico se había realizado con los criterios del Grupo Europeo para el Estudio de las Espondiloartropatías10. A lo largo del seguimiento se aplicaron de nuevo estos criterios por si algún paciente había modificado su diagnóstico. Este estudio fue aprobado por el comité de ética del HULP.
Se llevó a cabo un protocolo que incluía:
- 1)
Variables relacionadas con la derivación a la unidad de SpA de inicio: a) duración y número de síntomas; b) número de criterios de derivación según el estudio ESPIDEP; c) presencia de: lumbalgia inflamatoria, artritis asimétrica, dolor alternante de nalgas, sacroilitis radiológica e historia familiar de SpA; d) antecedente de: psoriasis, enfermedad inflamatoria intestinal, tendinitis aquílea, fascitis plantar, diarrea/uretritis, uveítis y e) ser HLA B27 positivo.
- 2)
Variables clínicas y de laboratorio basales, a los 3, 6 y 12 meses: número de articulaciones dolorosas (NAD), número de articulaciones tumefactas (NAT), valoración global de la enfermedad por el paciente (VGP), dolor axial nocturno (DOLOR) en escala visual analógica de 0-100 mm, rigidez matutina (RM), Bath Ankylosing Spondylitis Disease Activity Index (BASDAI)11, Bath Ankylosing Spondylitis Functional Index (BASFI)12, Bath Ankylosing Spondylitis Metrology Index (BASMI)13, grado de expansión torácica en centímetros, número de entesitis dolorosas según el Maastricht Ankylosing Spondylitis Enthesitis Score (MASES)14, VSG y PCR.
- 3)
Valoración ecográfica de la entesis basal, a los 6 y 12 meses, para determinar el índice ecográfico MASEI9. Se utilizó un ecógrafo Acuson Antares Medical systems con sonda lineal 5-13 MHz.
- 4)
Variables radiológicas basales y a los 12 meses: se realizaron radiografías de columna cervical, dorsal y lumbar anteroposterior y lateral, y de pelvis anteroposterior. Uno de los reumatólogos del estudio leyó y puntuó las radiografías utilizando el índice radiológico Bath Ankylosing Spondylitis radiology index (BASRI) total15,16.
Tanto el reumatólogo que realizó las ecografías como el que leyó las radiografías desconocían datos clínicos o de diagnóstico.
Los tratamientos se instauraban de acuerdo a las recomendaciones de la Sociedad Española de Reumatología (SER) y al documento consenso de la SER sobre el uso de antagonistas del factor de necrosis tumoral (FNT)17.
El análisis estadístico incluyó:
- a)
Estudio de la validez de el MASEI en la correcta clasificación de SpA, utilizando como punto de corte un valor ≥ 18 y como controles 32 sujetos sanos pareados por edad y sexo. Se determinó la sensibilidad, especificidad, valor predictivo positivo (VPP) y negativo (VPN), razón de verosimilitud positiva (RVP) y negativa (RVN) en la visita basal.
- b)
Estudio temporal de la evolución por visitas de las variables clínicas, de laboratorio e índice ecográfico determinando las posibles diferencias mediante el ANOVA de medidas repetidas junto con el test de Greenhouse-Geisser y a posteriori de Bonferroni cuando fue preciso.
- c)
Determinación del grado de progresión radiológica al año mediante la diferencia entre el BASRI total al año y basal utilizando el test no paramétrico de Wilcoxon para datos pareados.
- d)
Estudio bivariante de las diferencias en las características clínicas, de laboratorio, ecográficas y radiológicas según: sexo, HLA B27 y presentar el MASEI basal ≥ 18. Se utilizó laU de Mann-Whitney para variables cuantitativas y el test de la chi cuadrado o test exacto de Fisher para las cualitativas.
- e)
Análisis de actividad persistente:
- •
Definición de actividad persistente: tener indicación de anti-FNT-α a lo largo del año en base a las recomendaciones de la SER17.
- •
Factores que predicen actividad persistente al año: se realizó un análisis univariante para determinar las variables basales que se asociaban con actividad persistente al año, seguido de un análisis multivariante utilizando regresión logística por pasos para conocer qué variables, entre las que habían sido significativas en el análisis univariante, se asociaban de forma independiente a actividad persistente al año.
- •
Desarrollo de un modelo predictor de actividad persistente: en el desarrollo del modelo se incluyeron variables objetivas como PCR, VSG e índice MASEI, y variables obtenidas de la valoración del paciente como BASDAI, BASFI, VGP, DOLOR y RM. Para evaluar si el modelo mejoraba la capacidad predictiva se utilizó el área bajo la curva Receiver operating characteristic (ROC) de los modelos logísticos.
Todos los análisis se realizaron con SPSS versión 11.5. Se consideraron significativos los resultados con p ≤ 0,05.
El protocolo de estudio fue aprobado por los comités éticos locales correspondientes siguiendo las directrices de la declaración de Helsinki.
Todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en el mismo.
ResultadosEvaluación de las características clínicas, de laboratorio y ecográficasDe los 35 pacientes del estudio ESPIDEP diagnosticados de SpA, en dos se perdió el seguimiento y en otro no se confirmó el diagnóstico inicial, por lo que no fueron incluidos. De los 32 pacientes incluidos, el 50% eran HLA B27 positivo y el 50% de sexo masculino, todos mantuvieron el mismo diagnóstico inicial al final del año de seguimiento (tabla 1).
Distribución de los 32 pacientes según diagnóstico, sexo y HLA B27
| Diagnósticos | n (%) | Varones (%) | HLA B27 (%) |
| SpA indiferenciada | 23 (71,87) | 12 (52,17) | 11 (47,82) |
| Espondilitis anquilosante | 4 (12,5) | 1 (25) | 3 (75) |
| Artritis reactiva | 2 (6,25) | 2 (100) | 2 (100) |
| Artritis psoriásica | 2 (6,25) | 0 (0) | 0 (0) |
| SpA asociada a colitis ulcerosa | 1 (3,12) | 1 (100) | 0 (0) |
| Total | 32 (100) | 16 (100) | 16 (100) |
Para el análisis de validez del índice MASEI se incluyó a 32 controles sanos (16 hombres y mujeres) con una edad de 31,8 ± 7,6 años, similar a la de los pacientes. En la visita basal, 25 pacientes (78,12%) y 5 controles (15,62%) tuvieron un MASEI ≥ 18, con un valor medio de 26,17 ± 13,68 y 13,34 ± 7,97 en pacientes y controles respectivamente (p < 0,001). El MASEI utilizado como único criterio para clasificar correctamente entre SpA y controles sanos alcanzó una sensibilidad del 78,12%, una especificidad del 84,37%, un VPP del 83,3%, un VPN del 79,41%, una RVP y una RVN de 5 y 0,26, respectivamente.
La descripción de las variables clínicas, de laboratorio y el MASEI en cada visita se muestran en la tabla 2. Las variables mejoran desde el inicio salvo el valor de la RM, el BASMI y el BASFI que empeoran a los 3 meses para posteriormente mejorar en el resto de visitas respecto de la basal. El comportamiento del NAT es fluctuante, aunque en la visita final mejora respecto de la basal. La evolución hacia la mejoría del BASMI y del índice MASEI a lo largo de las visitas es significativa (p = 0,001 y p = 0,007, respectivamente).
Variables clínicas, de laboratorio y ecográficas en cada visita
| Basal | 3 meses | 6 meses | 12 meses | p | |
| NAD, media (DE) | 0,83 (2,35) | 0,50 (1,35) | 0,50 (1,44) | 0,29 (1,04) | 0,42 |
| NAT, media (DE) | 0,25 (0,53) | 0,04 (0,20) | 0,33 (0,91) | 0,04 (0,20) | 0,17 |
| VGP, media (DE) | 50,58 (23,24) | 44,67 (22,55) | 42,08 (21,86) | 43,54 (18,56) | 0,47 |
| DOLOR, media (DE) | 40,58 (35,28) | 35,75 (32,46) | 31,67 (34,47) | 33,75 (33,33) | 0,63 |
| RM, media (DE) | 26,46 (32,01) | 31,88 (58,02) | 23,54 (35,03) | 24,38 (25,25) | 0,63 |
| BASDAI, media (DE) | 4,49 (1,81) | 3,97 (1,93) | 4,13 (1,94) | 4,06 (1,84) | 0,61 |
| BASFI, media (DE) | 2,63 (2,22) | 2,67 (1,85) | 2,41 (1,55) | 2,44 (1,56) | 0,74 |
| GET, media (DE) | 5,17 (1,88) | 5,37 (1,37) | 5,65 (1,61) | 5,69 (1,49) | 0,19 |
| BASMI, media (DE) | 1,50 (1,03) | 1,63 (0,96) | 1,24 (1,01) | 1,08 (0,69) | 0,001 |
| N.° ENTESIS, media (DE) | 1,27 (2,86) | 0,82 (1,59) | 0,45 (1,14) | 0,59 (1,29) | 0,31 |
| VSG, media (DE) | 20,84 (24,45) | 12,47 (7,92) | 13,42 (4,46) | 11,42 (6,09) | 0,15 |
| PCR, media (DE) | 12,74 (19,88) | 5,99 (7,02) | 5,93 (4,98) | 4,25 (2,12) | 0,12 |
| MASEI, media (DE) | 26,17 (13,68) | 24,97 (12,93) | 20,55 (8,34) | 0,007 |
BASDAI: Bath Ankylosing Spondylitis Disease Activity Index; BASFI: Bath Ankylosing Spondylitis Functional Index; BASMI: Bath Ankylosing Spondylitis Metrology Index; DOLOR: dolor axial nocturno; GET: grado de expansión torácica; MASEI: MAdrid Sonographic Enthesis Index; NAD: número de articulaciones dolorosas; NAT: número de articulaciones tumefactas; PCR: proteína C reactiva; RM: rigidez matutina; VGP: valoración global de la enfermedad por el paciente; VSG: velocidad de sedimentación globular.
Respecto a los tratamientos utilizados: 15 pacientes (46,9%) precisaron ≥ 2 AINE, 13 pacientes algún FAME (40,6%), 7 pacientes algún biológico (21,9%) y 5 pacientes infiltraciones locales (15,62%). Los FAME fueron: en 10 pacientes salazopirina, en 2 pacientes metotrexato y en 3, ambos. Los biológicos fueron etanercept e infliximab en 4 y 3 pacientes, respectivamente.
Se realizó el análisis de las variables en la visita inicial para determinar diferencias según el sexo, ser HLA B27 y presentar el MASEI basal ≥ 18, destacando:
- –
El mayor NAT en las mujeres (0,50 ± 0,63 vs 0,06 ± 0,63; p = 0,01).
- –
El MASEI superior en hombres (33,07 ± 15,05 vs 22 ± 11,87; p = 0,03).
- –
El valor más elevado de la VGP (53,5 ± 24,35 vs 28,57 ± 18,64; p = 0,02) y el BASFI (3,2 ± 2,44 vs 0,98 ± 0,93; p = 0,01) en los pacientes con MASEI basal ≥ 18.
Posteriormente se repitió el análisis y se aplicó al área bajo la curva (ABC) de cada variable durante el año, o en el caso del NAD y el NAT a la suma anual. Se obtuvo de forma significativa (p < 0,05) (tablas 3 y 4):
- –
El NAT superior entre las mujeres.
- –
La PCR más elevada en los hombres y los pacientes con el MASEI basal ≥ 18.
- –
El índice MASEI con tendencia a estar significativamente más incrementado entre los hombres (p = 0,07).
Variables clínicas, ecográficas y radiológicas en las que el sexo influye en su comportamiento durante el año
| NATa, media (DE) | PCRb, media (DE) | MASEIb, media (DE) | Progresión radiológica, media (DE) | |
| Sexo varón | ||||
| Sí | 0,33 (1,15) | 40,92 (25,99) | 55,82 (24,82) | 3,09 (1,81) |
| No | 1,00 (1,27) | 14,73 (4,54) | 41,71 (15,90) | 1,62 (1,98) |
| P | p = 0,02 | p = 0,01 | p = 0,07 | p = 0,04 |
MASEI: MAdrid Sonographic Enthesis Index; NAT: número de articulaciones tumefactas; PCR: proteína C reactiva.
Variables clínicas, ecográficas y radiológicas en las que presentar MASEI basal ≥ 18 influye en su comportamiento durante el año
| PCRa, media (DE) | MASEIa, media (DE) | Progresión radiológica, media (DE) | |
| MASEI basal ≥ 18 | |||
| Sí | 28,38 (22,21) | 54,22 (21,57) | 2,787 (2,07) |
| No | 12,15 (0,13) | 29,7 (7,5) | 0,83 (0,75) |
| P | p = 0,03 | p = 0,002 | p = 0,03 |
MASEI: MAdrid Sonographic Enthesis Index; PCR: proteína C reactiva.
Respecto al índice BASRI total, la puntuación basal fue de 1,58 ± 1,38 y al año de 3,88 ± 1,72. No encontramos diferencias en el valor del BASRI total basal según el sexo, ser HLA B27 o el MASEI basal ≥ 18 (p > 0,05). El grado de progresión radiológica del BASRI total fue significativo respecto del basal: 2,29 ± 2,01 (IC 95% 1,44-3,14; p = 0,00).
Al analizar diferencias en el grado de progresión radiológica al año, se confirmó que es significativamente superior en los hombres respecto de las mujeres y en los pacientes con MASEI basal ≥ 18 (tablas 3 y 4).
Análisis de actividad persistenteLos 7 pacientes tratados con anti-FNT-α durante el año cumplieron el criterio de actividad persitente.
- a)
Factores que predicen actividad persistente al año:
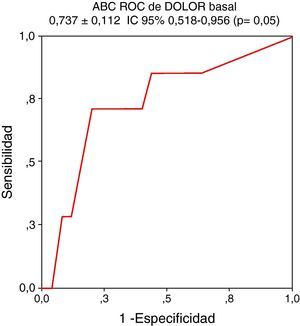
Para realizar el análisis se utilizaron las variables basales que se encuentran en la tabla 5. El análisis univariante mostró que el DOLOR basal (p = 0,05), la RM basal (p = 0,03), el BASDAI basal (p = 0,02) y el número de entesitis basal (p = 0,007) están asociados de forma significativa a actividad persistente al año. El análisis multivariante demostró que de las anteriores variables el DOLOR basal es la única que predice actividad persistente de forma independiente con un ABC ROC de 0,737 ± 0,112, IC 95% 0,518-0,956 (p = 0,05) (fig. 1).
Tabla 5.Variables basales para análisis de actividad persistente
Sexo masculino, n (%) 16 (50%) Edad, media (DE) 33,47 (8,23); rango (15-45) Duración de síntomas (meses), media (DE) 11,19 (6,73); rango (3-24) N.° de síntomas de SpA, media (DE) 3,03 (1,37); rango (1-7) Criterios de derivación, n (%) Solo lumbalgia inflamatoria 20 (62,5%) Solo artritis asimétrica 6 (18,8%) Ambos criterios 6 (18,8%) Historia familiar, n (%) 4 (12,5%) Psoriasis, n (%) 2 (6,3%) EII, n (%) 1 (3,1%) Tendinitis aquilea, n (%) 12 (37,5%) Fascitis plantar, n (%) 4 (12,5%) Diarrea/uretritis, n (%) 3 (9,4%) Uveitis, n (%) 1 (1%) Dolor alternante de nalgas, n (%) 14 (43,8%) Lumbalgia inflamatoria, n (%) 26 (81,3%) Sacroilitis, n (%) 19 (59,4%) Artritis asimétrica basal, n (%) 12 (37,5%) HLA B27, n (%) 16 (50%) NAT, media (DE) 0,25 (0,53) NAD, media (DE) 0,83 (2,35) VGP, media (DE) 50,58 (23,24) DOLOR, media (DE) 40,58 (35,28) RM, media (DE) 26,46 (32,61) BASDAI, media (DE) 4,49 (1,81) BASFI, media (DE) 2,63 (2,22) GET, media (DE) 5,17 (1,88) BASMI, media (DE) 1,50 (1,03) N.° entesis, media (DE) 1,27 (2,86) VSG, media (DE) 20,84 (24,45) PCR, media (DE) 12,74 (19,88) MASEI, media (DE) 26,17 (13,68) BASDAI: Bath Ankylosing Spondylitis Disease Activity Index; BASFI: Bath Ankylosing Spondylitis Functional Index; BASMI: Bath Ankylosing Spondylitis Metrology Index; DOLOR: dolor axial nocturno; GET: grado de expansión torácica; MASEI: MAdrid Sonographic Enthesis Index; NAD: número de articulaciones dolorosas; NAT: número de articulaciones tumefactas; PCR: proteína C reactiva; RM: rigidez matutina; VGP: valoración global de la enfermedad por el paciente; VSG: velocidad de sedimentación globular.
- b)
Modelo predictor de actividad persistente:
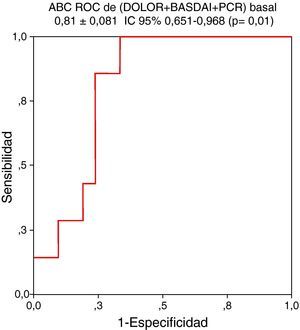
El modelo se formó por la variable resultante del análisis multivariante, el DOLOR basal, a la que se añadió el índice BASDAI y la PCR basal. Ésta es la combinación que más incrementó el valor del ABC ROC obtenida por la variable DOLOR basal para predecir con más exactitud actividad persistente al año (ABC ROC de DOLOR basal + BASDAI basal + PCR basal = 0,810 ± 0,081, IC 95% 0,651-0,966; P = 0,01) (fig. 2).
Figura 2.El modelo para pedecir actividad persistente que más incrementa el área bajo la curva (ABC) receiver operating characteristic (ROC) de la variable dolor axial nocturno (DOLOR) está formado por la combinación con las variables Bath Ankylosing Spondylitis Disease Activity Index (BASDAI) y proteína C reactiva (PCR) como se indica en la figura.
Se confirmó que en todas las combinaciones realizadas el valor del ABC era superior si se utilizaba la PCR respecto de si se utilizaba la VSG como reactante de fase aguda (datos no mostrados).
En este estudio se identifican características clínicas propias de las formas precoces de enfermedad. Es la primera vez que se aplica un índice ecográfico para valorar tanto la afectación entésica inicial como su evolución a corto plazo en una cohorte precoz. Además, se propone un modelo para predecir actividad persistente con la intención de seleccionar de forma temprana a los pacientes con enfermedad más grave.
El índice ecográfico de entesis MASEI9 permite clasificar entre SpA y sujetos sanos utilizando el punto de corte ≥ 18. Este punto de corte se empleó como único criterio para el diagnóstico en esta cohorte precoz y se obtuvo una sensibilidad y especificidad del 78,12% y el 84,37%, respectivamente, y una probabilidad 5 veces mayor de tener un valor del índice ≥ 18 entre las SpA que entre los sujetos sanos. Por lo que la ecografía de entesis puede ser de utilidad en la evaluación inicial de pacientes con sospecha de SpA precoz.
Las variables clínicas mejoran a lo largo del año, pero sólo lo hacen de forma significativa la movilidad espinal determinada por el BASMI y el MASEI. Como todos los pacientes recibieron tratamiento, podemos interpretar que este comportamiento sugiere sensibilidad al cambio a pesar de que la muestra es pequeña y el seguimiento corto. En trabajos recientes también se sugiere sensibilidad al cambio de la ecografía de entesis en SpA tras introducción de tratamiento18, aunque esta característica no se ha evaluado en formas precoces como en nuestro estudio.
Se decidió realizar la valoración radiológica mediante el índice BASRI total15,16 y no utilizar otros métodos como el modified Stoke Ankylosing Spondylitis Spine Score19 (mSASS) porque es más fácil de usar, requiere poco entrenamiento y también es sensible al cambio, por lo que podría ser apropiado en un estudio de práctica clínica habitual como el nuestro.Cuantificamos la afección de sacroilíacas de 0 a 4 y no a partir de 2 (mínimo daño para diagnosticar enfermedad), ya que nuestros pacientes son formas precoces y nuestro objetivo era conocer si había o no progresión global.
El patrón de enfermedad es diferente según el sexo. Las mujeres tienen mayor afectación articular periférica que los hombres desde el inicio, como ya se describió en el estudio ESPIDEP5, y se mantiene durante el año de seguimiento. Previamente se ha sugerido lo mismo en las EA de larga evolución20, pero no se había comunicado en SpA precoces. No podemos justificar este resultado por el tipo de SpA según el sexo. Los hombres tienen una enfermedad más severa fundamentalmente a nivel axial, con mayor progresión radiológica y PCR más elevada, a pesar de no haber diferencias entre sexos en ninguna de las dos variables basalmente. Nuestros resultados coinciden con los obtenidos en un estudio transversal de la cohorte alemana German Spondyloarthritis Inception Cohort (GESPIC), en el que comparan pacientes con EA precoz establecida y SpA axial sin sacroilitis radiológica definida, y demuestran que la presencia de sacroilitis y afectación radiológica de columna está asociada al sexo masculino y a la PCR elevada2. Además, la información aportada por la valoración ecográfica de nuestro estudio apunta en la misma dirección. Los pacientes con el MASEI basal ≥ 18 asocian una enfermedad más severa evaluada por la PCR y la progresión radiológica, y coincide en que son los hombres quienes al inicio presentan mayor entesopatía según el índice MASEI (33,07 ± 15,05 (hombres) vs 22 ± 11,87 (mujeres); p = 0,03).
El HLA B27 no influye sobre ninguna variable clínica o radiológica ni sobre la actividad persistente de la enfermedad. Datos similares se han mostrado en trabajos recientes2.
Finalmente determinamos que el dolor axial nocturno basal predice actividad persistente al año de forma independiente (ABC ROC de 0,737 ± 0,112, IC 95% 0,518-0,956 (p = 0,05). Como criterio de actividad persistente se eligió la necesidad de precisar biológico según las recomendaciones de la SER17. Consideramos más acertado esta medida que el daño radiológico por tratarse de formas precoces en la que éste sería mínimo o indetectable en algunos pacientes. Se desarrolló un modelo a partir del ABC del dolor axial nocturno basal al que se añadió el BASDAI y la PCR basal mejorando el ABC (ABC 0,810 ± 0,081, IC 95% 0,651-0,966; p = 0,01) y nuestra capacidad de predecir actividad persistente en ≤ 1 año de seguimiento. Durante el proceso de obtención del modelo se confirmó que la PCR siempre mejoraba más el ABC que la VSG. Diversos trabajos han intentado determinar factores predictores de actividad persistente definida por daño radiológico, funcionalidad o actividad de la enfermedad, generalmente en cohortes no precoces21–23. No hemos encontrado estudios de SpA precoz en los que se utilice una medida de desenlace habitual en la práctica diaria como es la indicación de biológico y se busque detectar actividad persistente tan a corto plazo.
La posible implicación de nuestro modelo es que los pacientes que presenten elevado dolor axial nocturno basal tienen mayor probabilidad de precisar biológicos en menos de 1 año, sobre todo si además asocian una PCR y un BASDAI basal elevado.
No obstante, existen limitaciones del estudio como el número pequeño de pacientes y el tiempo corto de seguimiento. Aunque se apuntan algunos resultados novedosos, habrá que confirmarlos en cohortes más amplias con más seguimiento.
En conclusión, la ecografía de entesis puede ayudar en el diagnóstico y seguimiento de los pacientes con SpA precoz. Al igual que en las formas establecidas, las mujeres tienen un patrón de enfermedad fundamentalmente periférica y los hombres axial. Utilizar un modelo predictor de actividad persistente en estadios iniciales de la enfermedad nos puede ayudar a seleccionar pacientes candidatos a tratamientos modificadores de la enfermedad que minimicen el daño estructural y mejoren la calidad de vida.
FinanciaciónEl estudio ESPIDEP y su seguimiento a 1 año fue financiado por una Beca no restringida de Pfizer (antes Wyeth).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.