Varias terapias biológicas se han probado en las vasculitis sistémicas. Los anti-TNF-α pudieran tener un papel en el tratamiento de la arteritis de Takayasu y probablemente en la arteritis de células gigantes. En el caso de la enfermedad de Kawasaki, existe información de que el infliximab puede ser usado como una alternativa a la gammaglobulina por vía intravenosa en pacientes sin respuesta a una primera dosis de ésta. No se puede recomendar el uso de anti TNF-α en las vasculitis asociadas a ANCA. La gammaglobulina antitimocito y el alemtuzumab pudieran tener algún papel en el tratamiento de las vasculitis asociadas a ANCA. La información existente acerca de la utilidad de estos dos fármacos proviene de casos refractarios al tratamiento convencional, por lo que la alta incidencia de complicaciones y recaídas observadas en los casos tratados con estos fármacos pudiera ser más bien intrínseca a la gravedad de la enfermedad y no debida a los agentes biológicos.
Several biological therapies have been evaluated in systemic vasculitis. Anti TNF-α agents may have a role in the treatment of Takayasu's arteritis and probably in giant cell arteritis. In Kawasaki's disease, infliximab is an option in subjects with intravenous immunoglobulin-resistant disease. Anti TNF-α cannot be recommended to treat ANCA-associated vasculitis. Anti-T lymphocyte globulin and alemtuzumab could have a role in the treatment of ANCA associated vasculitis, although current information about these two biological treatments comes from conventional resistant treatment cases, so the high incidence of complications and relapses observed with these treatment may be intrinsic to the severity of the disease and not related to the biological agents.
Las vasculitis son un grupo heterogéneo de enfermedades caracterizadas por inflamación de los vasos sanguíneos y manifestaciones clínicas de acuerdo al sitio de irrigación de la vasculatura afectada1. Antes de la década de los setenta, la mortalidad de las vasculitis era hasta de un 90% a los 2 años del diagnóstico. Sin embargo, con la introducción de las dosis altas de esteroides y ciclofosfamida por Wolfey y Fauci2, el pronóstico ha mejorado, convirtiendo las vasculitis de enfermedades letales en enfermedades crónicas recidivantes3. A pesar de lo anterior, la mortalidad y la morbilidad de los pacientes con vasculitis sobrepasan las de la población general y alrededor del 42% de los pacientes presenta efectos adversos del tratamiento4, algunos de ellos tan graves como el desarrollo de cáncer de vejiga y linfomas asociados al uso de ciclofosfamida5. El mejor entendimiento de las enfermedades inflamatorias, incluidas las vasculitis, ha permitido la introducción de terapias biológicas dirigidas de forma específica contra algún paso del proceso fisiopatológico (tabla 1). El tratamiento de las vasculitis con estos agentes ha sido motivo de investigación para conocer la eficacia y la seguridad de su uso comparado contra la terapia convencional actual. En esta revisión describiremos por tipo de vasculitis la experiencia en el tratamiento con agentes biológicos.
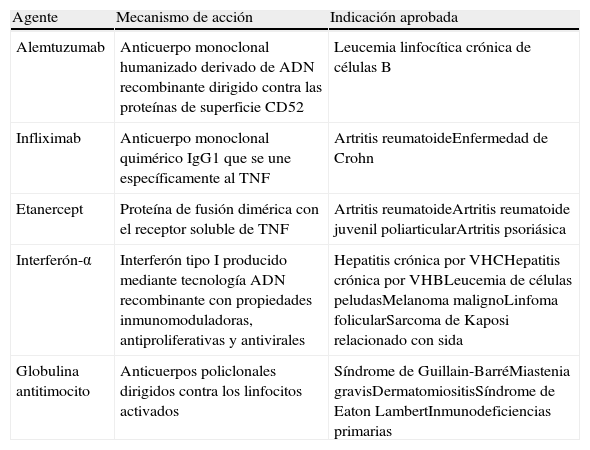
Agentes biológicos y su mecanismo de acción que han sido probados en el tratamiento de las vasculitis sistémicas
| Agente | Mecanismo de acción | Indicación aprobada |
| Alemtuzumab | Anticuerpo monoclonal humanizado derivado de ADN recombinante dirigido contra las proteínas de superficie CD52 | Leucemia linfocítica crónica de células B |
| Infliximab | Anticuerpo monoclonal quimérico IgG1 que se une específicamente al TNF | Artritis reumatoideEnfermedad de Crohn |
| Etanercept | Proteína de fusión dimérica con el receptor soluble de TNF | Artritis reumatoideArtritis reumatoide juvenil poliarticularArtritis psoriásica |
| Interferón-α | Interferón tipo I producido mediante tecnología ADN recombinante con propiedades inmunomoduladoras, antiproliferativas y antivirales | Hepatitis crónica por VHCHepatitis crónica por VHBLeucemia de células peludasMelanoma malignoLinfoma folicularSarcoma de Kaposi relacionado con sida |
| Globulina antitimocito | Anticuerpos policlonales dirigidos contra los linfocitos activados | Síndrome de Guillain-BarréMiastenia gravisDermatomiositisSíndrome de Eaton LambertInmunodeficiencias primarias |
ADN: ácido desoxirribonucleico; CD: cluster differentation; IgG1; inmunoglobulina G1; TNF: factor de necrosis tumoral; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C.
La arteritis de Takayasu (AT) es una enfermedad caracterizada por la formación de granulomas y, por ende, la participación del factor de necrosis tumoral-α (TNF-α) pudiera ser importante6. Por lo dicho, se ha intentado el tratamiento con inhibidores de TNF en pacientes con AT refractaria, que requieren dosis altas de esteroides y ciclofosfamida. Existen diversos reportes de casos, tanto en niños como en adultos, en los cuales los resultados han sido variables7–10. En 2004, Hoffman et al realizaron un estudio piloto en el cual se trató a 15 pacientes con AT refractaria y con requerimiento de dosis altas de glucocorticoides para alcanzar la remisión. Los pacientes fueron tratados con infliximab (8 pacientes) y etanercept (7 pacientes); 3 pacientes del grupo con etanercept se cambió a infliximab, en 2 casos por problemas en la disponibilidad del fármaco y un caso por recaída. Las dosis fueron similares a las recomendadas para el tratamiento de la artritis reumatoide, siendo para el infliximab de 3-5mg/kg por vía intravenosa (dosis inicial, a las 2 y 6 semanas y posteriormente cada 4-8 semanas) y para etanercept 25mg por vía subcutánea 2 veces a la semana. El 93% de los pacientes tratados presentaron mejoría clínica, el 67% alcanzó la remisión libre de esteroides por periodos de hasta 3,3 años y el 26% alcanzó la remisión parcial, con una disminución del 50% de la dosis de esteroide11. Recientemente, Molloy et al.12 publicaron un estudio retrospectivo de 25 pacientes con AT refractaria tratados con infliximab (21 pacientes) y etanercept (9 pacientes) por un periodo prolongado hasta de 7 años de tratamiento con anti-TNF. Cinco pacientes en tratamiento inicial con etanercept posteriormente fueron tratados con infliximab, 3 casos por fallo terapéutico, un caso por recaída y un caso por problemas en la disponibilidad del tratamiento. Se logró la remisión completa libre de esteroide en el 60% de los casos y en el 28% la remisión parcial, resultados que son compatibles con lo reportado por Hoffman et al. Es necesario mencionar que el 50% de los pacientes que alcanzaron la remisión con etanercept presentaron recaídas, logrando controlarse con aumento de la dosis del etanercept hasta 50mg 2 veces a la semana, mientras en el grupo de infliximab el 66% de los pacientes quienes alcanzaron remisión presentaron recaída requiriendo aumento de la dosis de infliximab llegando a ser necesarias dosis de 10mg/kg.
Arteritis de células gigantesEl tratamiento con esteroides se considera la piedra angular en el tratamiento de la arteritis de células gigantes (ACG); sin embargo, ante la tasa de complicaciones alta por su uso, se ha estudiado el papel que pudiera tener la terapia biológica. Hoffman et al.13 realizaron un ensayo clínico con asignación aleatoria para establecer la eficacia del infliximab comparado con placebo en pacientes con ACG en mantener la remisión alcanzada con esteroides. A las 22 semanas de seguimiento, el 43% de los pacientes del grupo con infliximab más esteroide se encontraba en remisión, comparado con el 50% de los pacientes asignados a glucocorticoide más placebo, lo cual motivó la suspensión del estudio de manera prematura. Posteriormente, se probó la eficacia del etanercept en pacientes con ACG y con complicaciones relacionadas con el uso de esteroides. Los resultados del estudio mostraron disminución en el número de recaídas. Este estudio tiene una muestra pequeña, por lo que los resultados deben ser corroborados por otros estudios14.
Vasculitis de vasos medianosEnfermedad de kawasakiSe ha postulado que el TNF-α tiene un importante papel en la fisiopatología de la enfermedad de Kawasaki (EK)15, por lo tanto se ha intentado el uso de anti-TNF en los casos refractarios a la terapia convencional con inmunoglobulina intravenosa (IVIG) y aspirina. Los primeros reportes16–18 del uso de infliximab fueron casos anecdóticos de pacientes pediátricos con EK y con la presencia de aneurismas coronarios, en los que se alcanzó la resolución sintomática con adecuada tolerabilidad y sin la presencia de efectos adversos importantes. Burns et al.19, llevaron a cabo un ensayo con asignación aleatoria, multicéntrico con el objetivo de analizar la seguridad y tolerancia del infliximab en pacientes con EK refractaria al tratamiento convencional con IVIG. Para esto, se estudió a niños que no habían alcanzado la remisión después de una primera dosis de IVIG, y estos niños fueron distribuidos a una segunda dosis de IVIG (n = 12) o al grupo de infliximab (n = 12). Once niños asignados al grupo de infliximab presentaron resolución de la fiebre dentro de las 24 h después de la infusión del fármaco y 8 niños de los asignados a IVIG alcanzaron la misma respuesta terapéutica. Los resultados obtenidos coinciden con los reportes anecdóticos del uso de infliximab, demostrando ser eficaz en el control de los síntomas en las primeras 24 h del tratamiento sin la presencia de efectos adversos. A pesar de tratarse de un estudio limitado por el tamaño de la muestra, con estos resultados el uso de infliximab puede considerarse como una alternativa terapéutica en aquellos pacientes refractarios a una primera dosis de IVIG.
Poliarteritis nodosa asociada a hepatitis bEl uso de interferón alfa (IFN-α) en este tipo de pacientes con la finalidad de disminuir la replicación viral ha sido reportada en diversas series de casos. Guillevin et al. realizaron un estudio multicéntrico prospectivo para estudiar la tolerancia y la eficacia del IFN-α2b en asociación con plasmaféresis en el tratamiento de la PAN asociada a VHB. El esquema utilizado fue IFN-α2b 3 millones de unidades 3 veces por semana y de 9-12 recambios plasmáticos durante las 3 primeras semanas de tratamiento, logrando la remisión de la vasculitis en el 100% de los casos con buena tolerancia, presentándose solo efectos adversos menores20. Sin embargo, en el año 2004, un estudio prospectivo multicéntrico, también dirigido por Guillevin, demostró que la combinación de lamivudina y plasmaféresis alcanza resultados similares a los reportados con el uso de IFN-α2b y plasmaféresis. Ante la administración por vía oral y los pocos efectos adversos, la lamivudina debería ser considerada primera opción mientras que el IFN-α2b puede ser reservado para los casos refractarios21.
Vasculitis de vasos pequeños asociada a anticuerpos contra citoplasma de neutrófilosGranulomatosis con poliangeítis (wegener) y poliangeítis microscópicaEl TNF y la respuesta alterada en la función de los linfocitos T desempeñan un papel importante en la fisiopatología de la granulomatosis con poliangeítis (Wegener) (GPA)22,23. Por lo anterior, se ha investigado el papel de la terapia biológica con inhibidores del TNF y los anticuerpos monoclonales humanizados contra la superficie celular CD52 en el tratamiento de las vasculitis asociadas a ANCA.
Terapia anti-factor de necrosis tumoral: infliximab y etanerceptEtanerceptEn 2001 Stone et al.24 realizaron un estudio fase I en 20 pacientes con GPA para evaluar la seguridad del etanercept administrado con otros agentes inmunomoduladores a 6 meses de seguimiento. En este estudio el etanercept fue bien tolerado. Posteriormente, se publicó un ensayo clínico controlado con placebo con el objetivo de valorar la eficacia del etanercept en el mantenimiento de la remisión de pacientes con GPA que recibían tratamiento convencional con ciclofosfamida y glucocorticoides. Los resultados obtenidos no demostraron eficacia en la inducción de la remisión ni en el mantenimiento de la misma; por el contrario, se presentó un aumento en el riesgo de neoplasias sólidas (dos casos adenocarcinomas de colon, un colangiocarcinoma metastásico, un carcinoma de células renales, un carcinoma de mama y un liposarcoma). Sin embargo, el aumento del riesgo en neoplasias sólidas debe ser tomado con reserva, ya que los pacientes en quienes se presentaron las neoplasias contaban con historia de dosis altas de ciclofosfamida previo a la administración de etanercept. Por los resultados obtenidos de este estudio, el uso del etanercept en pacientes con GPA no es recomendado25.
InfliximabBooth et al.26 realizaron un estudio prospectivo con infliximab en las vasculitis asociadas a ANCA. La mayoría de los pacientes contaban con GPA aguda o refractaria. En este trabajo el 88% alcanzó la remisión. Sin embargo, el 21% presentó complicaciones infecciosas y las recaídas de la enfermedad a los 6 meses ocurrieron en el 20% de los pacientes. En el 2008 Josselin et al.27 realizaron un estudio retrospectivo con el objetivo de evaluar la eficacia del infliximab en alcanzar la remisión de la actividad en pacientes con vasculitis sistémicas necrotizantes refractarias a tratamiento convencional. Se evaluó a 15 pacientes, de los cuales 10 tenían GPA, uno poliangeítis microscópica (PAM), 3 sujetos tenían vasculitis asociada a artritis reumatoide y uno vasculitis asociada a crioglobulinemia. Los pacientes recibieron infliximab durante una media de 8 meses. A los 45 días de seguimiento, el 73% alcanzó remisión completa y el 27% alcanzó una respuesta significativa (disminución del 50% o más del Birmingham Vasculitis Activity Score). El 33% tuvo una remisión sostenida (≥6 meses), con una dosis de prednisona≤7,5mg/día. En el momento actual, hacen falta estudios con mejor calidad metodológica para poder recomendar el uso de infliximab en la terapia de vasculitis asociadas a ANCA.
Globulina antitimocitoLa globulina antitimocito (ATG por sus siglas en inglés) es una preparación de anticuerpos policlonales dirigida contra los antígenos de superficie de los linfocitos activados. Su mecanismo de acción es la lisis de linfocitos mediada por el complemento y como resultado la disminución de los linfocitos y regulación de la inflamación28. Existen reportes de casos anecdóticos en el uso de ATG en pacientes con GPA. Schmitt et al.29 publicaron en el 2004 una serie de 15 pacientes con GPA refractaria que fueron tratados con ATG logrando remisión parcial en el 60% de los casos y remisión completa en 26% de los casos; los efectos adversos menores se presentaron en el 33% y fueron bien tolerados. Un paciente murió por hemorragia pulmonar y otro por sepsis. Es necesaria la realización de ensayos clínicos para recomendar el uso de la ATG en pacientes con GPA, ya que en el momento actual solo se cuenta con reportes anecdóticos.
AlemtuzumabEs un anticuerpo monoclonal humanizado anti-CD52 (CAMPATH-1H) que disminuye el número de linfocitos activos y macrófagos circulantes. Este anticuerpo está autorizado en el tratamiento de la leucemia linfoide crónica. Walsh et al.30 evaluaron su uso en pacientes con vasculitis asociada a ANCA refractaria a tratamiento convencional, de los cuales el 88% estaban clasificados como GPA. Los pacientes recibieron tratamiento con prednisona y alemtuzumab por vía intravenosa, con una dosis total de 134mg. En este estudio, el 85% de los pacientes alcanzaron la remisión, pero el 71% de estos habían presentado recaída a los 9,2 meses; la mortalidad a los 5 años fue del 43%. En esta cohorte, la afección renal ocurrió en el 42% de los casos y el 18% se encontraba en estado crítico, por lo que requirió vigilancia en una unidad de cuidados intensivos durante el periodo de tratamiento.
Vasculitis de churg- straussInterferón-α, terapia anti-factor de necrosis tumoral: infliximab y etanercept; anticuerpos contra interleucina-5El uso de terapia biológica en casos refractarios o con dosis altas de otros inmunosupresores, como los glucocorticoides y la ciclofosfamida, es controversial. El IFN-α ha sido usado basándose en su efecto negativo en los eosinófilos; existen reportes de casos con buena respuesta, aunque con alta frecuencia de efectos adversos31. En el caso de los anti-TNF, solo existen reportes de casos refractarios a glucocorticoides; sin embargo, es necesario realizar ensayos clínicos para establecer su eficacia en este grupo de pacientes32,33. Pranabashis et al., en 2009, realizaron un estudio doble ciego, controlado con placebo, para analizar la eficacia y la seguridad en el tratamiento de pacientes con asma eosinofílica con mepolizumab (anticuerpo monoclonal contra la IL-5), administrado en 12 infusiones de 750mg mensuales durante 1 año de seguimiento. Se trataba de pacientes con una edad media de 48 años, con antecedentes de atopias y asma refractaria al uso de esteroides. Al final del estudio, los pacientes con mepolizumab presentaron menor riesgo para exacerbaciones, mejoría en el cuestionario de calidad de vida en asma y disminución significativa en la cantidad de eosinófilos en sangre y esputo34. De forma más reciente, Kim et al. realizaron un estudio piloto para evaluar la seguridad y la eficacia del mepolizumab en la disminución de la dosis de esteroides en pacientes con CS dependientes de dosis altas de esteroides. En total, 7 pacientes recibieron 4 dosis mensuales, logrando reducir la dosis de esteroides y permaneciendo todos en remisión y sin efectos adversos mayores35. Otro anticuerpo monoclonal humanizado es el reslizumab, que se ha usado principalmente en eosinofilias con afección digestiva, obteniendo resultados prometedores36. En el momento actual, el uso de terapia biológica en el tratamiento del CS es aún controversial por la falta de estudios prospectivos que evalúen el papel que potencialmente pudieran tener.