Los cambios en el diagnóstico y el tratamiento de la artritis reumatoide (AR) obligan a cuestionar la práctica clínica. La evidencia demuestra que la combinación de fármacos biológicos más metotrexato en escalada rápida produce tasas de remisión mayores que el metotrexato solo. La combinación tiene una respuesta clínica más rápida en actividad, función física, calidad de vida, fatiga y sueño. Pero el efecto más significativo de los fármacos biológicos es en progresión radiográfica. La disminución en el daño radiográfico tiene un gradiente anti-factor de necrosis tumoral (TNF)+metotrexato, anti-TNF en monoterapia y menor para metotrexato, e independiente de la mejoría en la actividad; ocurre con todos los anti-TNF y con otras dianas con mecanismos de acción diferentes (anti-CD20, inhibidores de coestimulación de linfocito T y antiinterleucina 6). El significado clínico de este hallazgo se verá en el futuro, cuando conozcamos su impacto en los pobres desenlaces de los pacientes con AR.
Dado que el metotrexato es un fármaco excelente, es absurdo decir que todos los pacientes deben recibir fármacos biológicos+metotrexato, pero es razonable considerar que un subgrupo de ellos debe recibirlos de inicio. El Colegio Americano de Reumatología los recomienda en pacientes con AR de<6 meses de duración, sin exposición previa a metotrexato, con actividad persistente (< 3 meses) y elevada, más algún factor de mal pronóstico o en aquéllos con actividad persistente (3-6 meses) y elevada, independientemente de los factores de mal pronóstico, si “hay un seguro médico que cubra el tratamiento”. La reflexión final es, ¿existe una nueva pirámide de tratamiento cuya base esta vez sean los costes?
Changes in diagnosis and treatment of rheumatoid arthritis oblige us to question clinical practice. Evidence demonstrates that the combination of biologics and methotrexate in rapid increments leads to larger remission rates than methotrexate alone. The combination has a faster clinical response in activity, physical function, quality of life, fatigue and sleep. But the most significant effect of biologics is on radiographic progression. The reduction in radiological damage has a spectrum that goes from anti-TNF+methotrexate to anti-TNF monotherapy, being less with methotrexate, and independent from improvement in activity; it occurs with all of the anti-TNF drugs and with other targets with different mechanisms of action (anti-CD20, T cell costimulation inhibitors and anti IL-6). The clinical significance of this finding will be seen in the future, when more is known of its impact on the poor outcomes of RA patients.
Because methotrexate is an excellent drug, it seems madness to say that all patients should receive biologics+methotrexate, but it is reasonable to consider that a subgroup must receive them from the start. The American College of Rheumatology recommends their use in patients with RA of less than 6 months since onset, with no previous exposure to methotrexate, persistent and elevated activity (<3 months) and poor prognostic factors or those with persistent and elevated activity (3–6 months) independent of poor prognostic factors, and if the patient “has insurance”. A final thought would be: Is there a new treatment pyramid which has cost at its base now?
El reumatólogo del siglo xxi ha cambiado su modo de diagnosticar y tratar al paciente con artritis reumatoide (AR). Ahora el diagnóstico y el tratamiento se realizan de modo temprano. Los nuevos fármacos no biológicos y, por supuesto, los biológicos son un gran avance en el conocimiento de la fisiopatogenia y el tratamiento de la enfermedad. Aunado a ello, las contribuciones de la clinimetría a la práctica clínica (definición de objetivos terapéuticos, validación de índices e instrumentos de medición y la evaluación de desenlaces a corto y largo plazo), así como las nuevas estrategias de tratamiento (entre las que destacan la escalada rápida con metotrexato, el control atento de la enfermedad o, muy recientemente, los tratamientos de inducción de remisión), han conseguido cambiar los desenlaces de los pacientes, y conseguir una mejoría en la función física y la disminución en las tasas de mortalidad de la enfermedad. Estos cambios que ocurren de modo vertiginoso obligan a cuestionar la práctica clínica y saber si es delirante o cuerda, como se plantea en el título. Como parte de este cuestionamiento, se responderán 3 preguntas con una postura a favor de los tratamientos biológicos en el tratamiento de la AR de inicio.
Primera preguntaLa primera pregunta es: ¿los fármacos biológicos asociados a los fármacos modificadores de la enfermedad son el mejor tratamiento de las formas de inicio? La respuesta es sí, a partir de la evidencia siguiente.
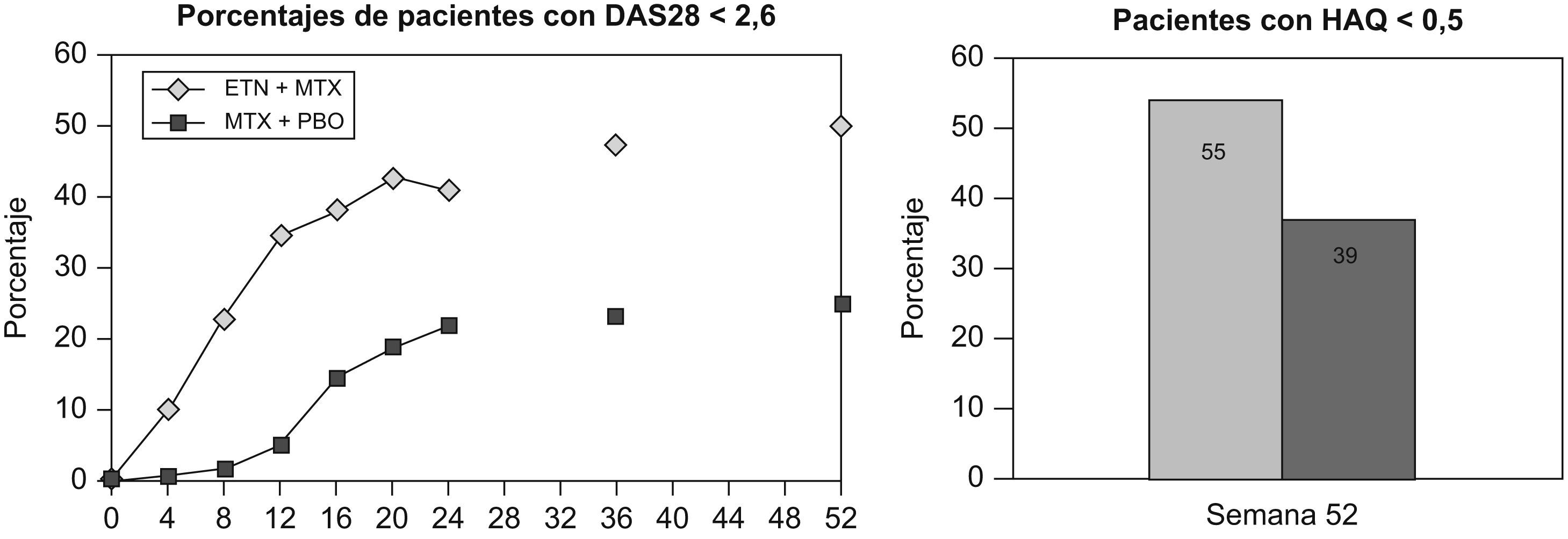
El estudio COMET1 es un estudio complejo de 2 años de duración realizado en pacientes con AR de inicio y grave, en el que 528 pacientes con AR de menos de 2 años de evolución, sin exposición previa a metotrexato. A pesar de ello, un 20% había recibido algún otro fármaco antirreumático modificador de la enfermedad (FAME) y el 92% presentaba un índice Disease Activity Score (DAS) 28>5,1. Se les asignó de forma aleatorizada a recibir etanercept+metotrexato (50 mg/semana por vía subcutánea de etanercept+metotrexato en escalada rápida por vía oral [v.o.]) frente a placebo+metotrexato (pauta idéntica a la del otro grupo). Los resultados que presentamos son del primer año de seguimiento. Las tasas de remisión (DAS28<2,6; el 50 frente al 28%), de actividad mínima de la enfermedad (con DAS<3,1; el 64 frente al 41%), así como la mejoría en las variables de función física y calidad de vida fueron mayores en el grupo tratado con el fármaco biológico. Cabe destacar que la mejoría ocurrió de modo más rápido y en un porcentaje mayor en el grupo tratado con etanercept+metotrexato, ya que a las 4 semanas se observaron diferencias con relevancia clínica y estadística. El Health Assessment Questionnaire (HAQ) disminuyó de manera importante en los 2 grupos, y el cambio fue mayor en el grupo tratado con el fármaco biológico (HAQ<0,5; el 56 frente al 39%) (fig. 1). Las tasas de episodios adversos graves (EAG) o clínicamente relevantes no fueron diferentes entre los 2 grupos. El grupo con etanercept+metotrexato no mostró progresión radiográfica, con una media de progresión de 0,5 en el índice de Sharp, frente a una media de 2,3 para el grupo placebo+metotrexato. Se observaron resultados similares en otros estudios de etanercept, como el subgrupo de pacientes con AR de menos de 3 años de evolución del TEMPO2 y el estudio ERA3.
Resultados del ensayo COMET en pacientes con artritis reumatoide temprana grave. DAS: Disease Activity Score; EA: episodios adversos; ETN: etanercept; HAQ: Health Assessment Questionnaire; MTX: metotrexato; PBO: placebo. Tomada de Emery et al1.
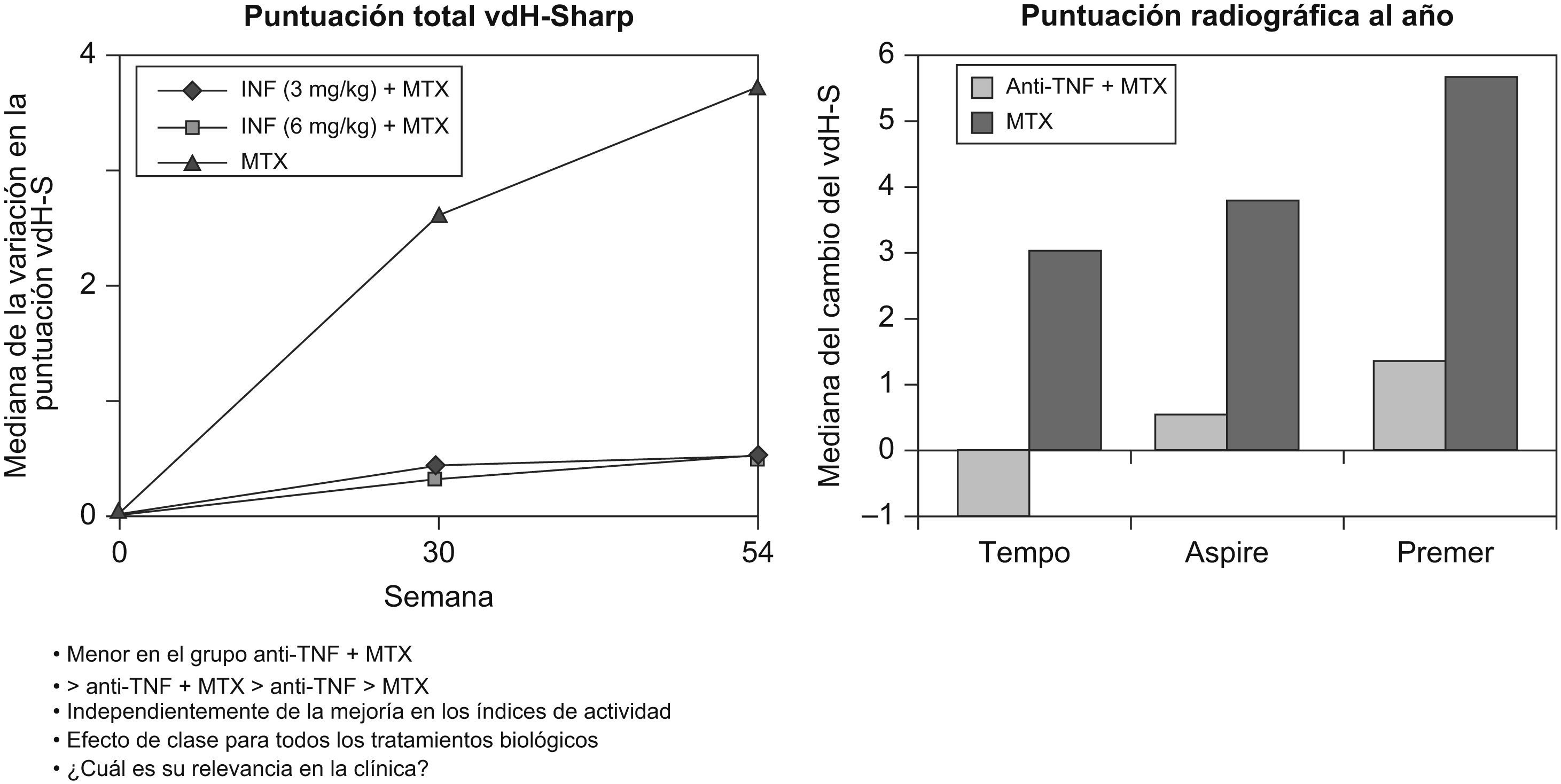
Cuando se analizan los datos de los estudios de otros biológicos en AR temprana, los resultados son similares. El estudio PREMIER4 fue un ensayo clínico diseñado para tratar a pacientes con AR temprana con adalimumab+metotrexato, frente a adalimumab o metotrexato en monoterapia. El estudio incluyó a pacientes con AR de menos de 3 años de evolución (8 meses de media), el 30% había recibido algún FAME previamente, pero ninguno de ellos metotrexato, y la media del DAS28 al inicio fue de 6,1, es decir, pacientes con AR grave. Los porcentajes de remisión fueron mayores para la combinación de adalimumab+metotrexato (43% al año y 49% a los 2 años) y menores en los pacientes que recibieron adalimumab (23 y 25%) o metotrexato (21 y 25%) en monoterapia. La respuesta clínica mayor definida como una respuesta ACR70 mantenida durante 6 o más meses hasta el segundo año de tratamiento también fue más elevada en el grupo que recibió adalimumab+metotrexato (49, 25 y 27%, respectivamente). El estudio ASPIRE5, que es el ensayo clínico de infliximab en AR temprana, mostró que la combinación de infliximab+metotrexato es la más eficaz; que el infliximab en monoterapia tiene unas tasas de respuesta muy parecidas a las del metotrexato cuando se usa en escalada rápida en monoterapia, y que el metotrexato en escalada rápida es un excelente tratamiento de la AR6. No obstante, el efecto más importante de la asociación anti-factor de necrosis tumoral (TNF)+metotrexato es sobre la progresión radiográfica, y no sobre las variables que miden actividad, función física o calidad de vida. En el estudio ASPIRE5, se notó una disminución significativa en la progresión radiográfica en el grupo que recibió tratamiento con infliximab+metotrexato, ya sea a dosis de 3 o 6mg/kg, y progresión en el grupo con placebo+metotrexato (fig. 2).
En todos los ensayos clínicos pivotales de los anti-TNF en AR temprana se observó6,7:
- 1.
Disminución significativa de la progresión radiográfica, tanto en el grupo que reciben la combinación fármaco biológico+metotrexato, como en los grupos que son tratados con el anti-TNF en monoterapia. Esta disminución tiene un gradiente y es mayor para la combinación anti-TNF+metotrexato, algo menor para el anti-TNF en monoterapia, y aún menor para metotrexato, que en los ensayos ya se emplea en escalada rápida.
- 2.
El efecto en la progresión radiográfica es independiente de la mejoría en la actividad, es decir, que hay pacientes que no mejoran en los índices de actividad de la enfermedad, pero en los cuales el daño estructural se detiene.
- 3.
La eficacia en la variable “daño estructural”, medida como progresión en los índices radiográficos, parece seguir un efecto de clase común para los biológicos del grupo anti-TNF, y también se observa con otros biológicos con mecanismos de acción diferentes (anti-CD20, inhibidores de coestimulación de linfocito T y antiinterleucina [IL] 6). Este efecto podría estar mediado a través de bloqueo de citocinas que estimulan la actividad osteoclástica7.
No obstante, la traducción clínica de este hallazgo importante se verá en el futuro, cuando conozcamos el efecto de la disminución en la progresión de los índices radiográficos en la función física, indicadores de incapacidad como necesidad de prótesis y otras variables de desenlace muy importantes desde la perspectiva del paciente y que reflejan el resultado de la enfermedad en el tiempo.
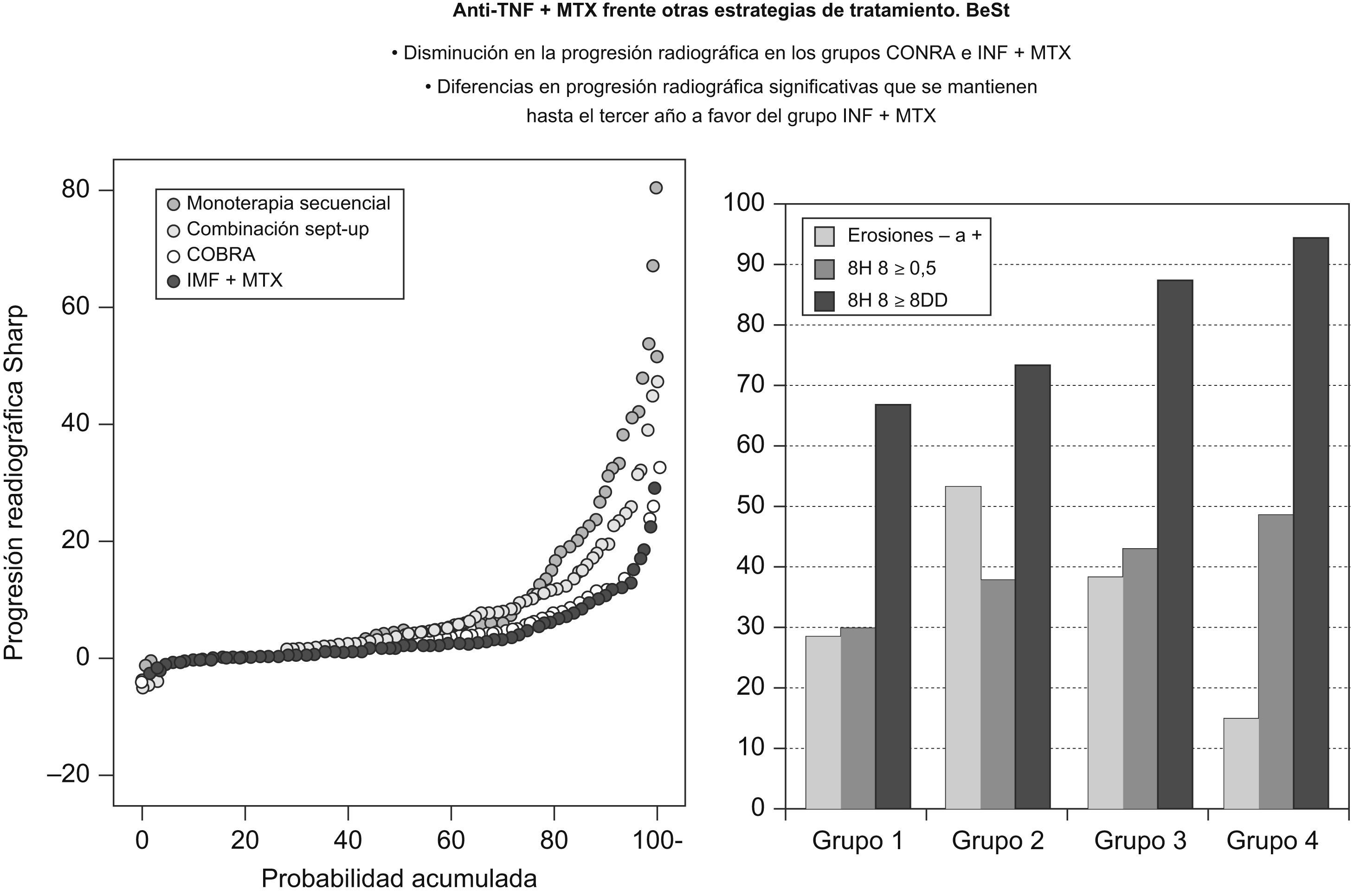
Segunda preguntaLa segunda pregunta es: ¿los fármacos biológicos más el modificador de la enfermedad son la mejor estrategia de tratamiento en la AR de inicio? La respuesta es sí, y se encuentra en el ensayo BeSt, del que hay al menos 11 publicaciones relacionadas8–11 y es muy difícil de entender, ya que su diseño es complejo. De modo sencillo, el BeSt analizó 4 estrategias de tratamiento más control atento de la enfermedad con el fin de conseguir un DAS44 en el rango de actividad baja de la enfermedad (DAS44<2,4). Según los autores, las 4 estrategias de tratamiento son las más usadas en la práctica clínica en los Países Bajos.
- 1.
El grupo 1 consistió en monoterapia secuencial, es decir, ir cambiando el FAME al no conseguir un DAS44<2,4. En este grupo, los pacientes iniciaron el tratamiento con metotrexato 15mg/semana en aumento hasta 25–30mg/semana. Si no se conseguía el DAS44, el metotrexato se cambiaba cada 3 meses a salazopirina, leflunomida, metotrexato+infliximab, sales de oro por vía intramuscular (i.m.)+metilprednisolona o metotrexato+ciclosporina A+metilprednisolona.
- 2.
El grupo 2, llamado de tratamiento aditivo, consistió en ir añadiendo un FAME si no se conseguía el objetivo terapéutico (step up). Los pacientes iniciaron el tratamiento con metotrexato 15mg/semana en incremento hasta 25–30mg/semana. Si no se conseguía el DAS44 previsto, se añadía salazopirina, HCL y metilprednisolona, y si había fallo, recibían metotrexato+infliximab, metotrexato+ciclosporina A+metilprednisolona y leflunomida.
- 3.
El grupo 3 consistió en triple terapia (metotrexato+salazopirina+HCLQ) de modo step down o tipo COBRA. Los pacientes iniciaron el tratamiento con metotrexato 7,5mg/semana, más 2g/día de salazopirina, más dosis altas de prednisona (60mg/día por v.o. al inicio que se bajan en 7 semanas hasta 7,5mg y se mantienen en descenso para suspenderse a las 28 semanas). Si no se conseguía el DAS44>2,4, el metotrexato se incrementaba hasta 25–30mg/semana y la dosis de metilprednisolona se mantenía estable. En los fallos a tratamiento, se cambió a metotrexato+ciclosporina A+metilprednisolona, metotrexato+infliximab, leflunomida, sales de oro i.m.+metilprednisolona y, finalmente, azatioprina.
- 4.
El grupo 4 recibió infliximab+metotrexato, el infliximab en dosis y pauta habitual (3mg/kg/dosis, semana 0, 2, 6, y cada 8 semanas) y el metotrexato 25–30mg/semana. Si no se conseguía el objetivo terapéutico, el infliximab podía incrementarse a 6mg/kg/dosis, 7,5 y hasta 10mg/kg/dosis. En caso de fallo, los tratamientos alternativos eran salazopirina, leflunomida, metotrexato+ciclosporina A+metilprednisolona, sales de oro por vía i.m.+metilprednisolona y, finalmente, azatioprina.
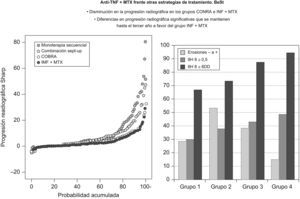
En los 4 grupos de tratamiento, si al cabo de 3 meses los pacientes no obtenían un DAS44<2,4, el reumatólogo cambiaba el tratamiento siguiendo el estricto protocolo preestablecido y ya comentado. Los reumatólogos conocían los tratamientos asignados a cada paciente y los cambios que se realizaban, y las enfermeras que evaluaban el DAS y las variables clínicas lo desconocían. Se incluyó a 508 pacientes con AR de menos de 2 años de evolución (media de 23 semanas), 68% con factor reumatoide positivo, 72% con enfermedad erosiva, DAS44 promedio de 4,1 y HAQ de 1,4. En todos los grupos de tratamiento se obtuvieron cifras similares de remisión (DAS44<1,6), que fueron del 31% en el primer año y del 42% en el segundo año, y la actividad baja de la enfermedad (DAS44<2,4) ocurrió en el 72% de los pacientes al segundo año, debido al tratamiento temprano más el control atento de la enfermedad, y no al grupo de tratamiento. La mejoría en las variables relacionadas con actividad clínica (dolor, número de articulaciones dolorosas y tumefactas, percepción del paciente de la actividad de la enfermedad y DAS44), en la calidad de vida, en el HAQ y en la función física fueron mayores y más rápidas en los grupos 3 y 4 frente a los grupos tratados con monoterapia inicial (grupos 1 y 2), con diferencias estadísticas durante el primer año de tratamiento. Estas diferencias se perdieron después del primer año y, a partir de las 54 semanas, todos los grupos se comportaron de modo similar. Al final del primer año, el 68 y el 69% de los pacientes de los grupos 1 y 2 habían cambiado de tratamiento frente al 42% del grupo 3 y el 28% del grupo 4. Otras conclusiones del estudio BeSt fueron que ni añadir salazopirina al metotrexato, ni cambiar metotrexato por salazopirina, resultó en beneficios importantes y que, después del fallo a metotrexato, la eficacia de otros FAME fue marginal en términos de mejoría del DAS8. Los resultados de progresión radiográfica fueron siempre mejores para el grupo que recibió el fármaco biológico a lo largo del tiempo, que alcanzó 3 años en las últimas publicaciones11. En el subgrupo de pacientes que al inicio no tenían erosiones (28% del total), el 12% de los pacientes del grupo 4 (infliximab+metotrexato) las desarrolló al final del seguimiento, frente al 29% del grupo 1, el 50% del grupo 2 y el 38% del grupo 3. La proporción de pacientes con un Sharp≤0,5 (diferencia mínima clínicamente significativa capaz de detectar) fue mayor en el grupo 4 (fig. 3), con el significado clínico que ello pueda tener a largo plazo.
Tercera preguntaLa tercera pregunta es: ¿qué hay más allá de la evidencia? Nuevamente, en un artículo relacionado con el ensayo BeSt, cuando se preguntó a los pacientes por las preferencias de tratamiento, la mayoría prefirió la combinación con el fármaco biológico y eran reacios al empleo de dosis altas de prednisona12. Dos terceras partes de los reumatólogos holandeses conocen el tratamiento tipo COBRA, los cuales lo identificaron como eficaz o muy eficaz. Sin embargo, cuando se les preguntó si lo usarían en los próximos pacientes, el 45% admitió una negativa rotunda para usarlo, debido básicamente a la complejidad de su administración en la práctica clínica13, y menos del 10% lo usaban de modo habitual. No debemos olvidar los beneficios añadidos de los fármacos biológicos, que consiguen una disminución en la mortalidad general de los pacientes con AR, sobre todo en relación con mortalidad cardiovascular14. Un punto de controversia es el de los costes y, al menos en una publicación del BeSt, el resultado favorece a los fármacos biológicos, ya que los costes del fármaco biológico al inicio podrían ahorrar mucho dinero en incapacidad e invalidez a largo plazo10,15, sobre todo en el caso de poderlos retirar una vez conseguido el objetivo terapéutico. Otros datos a favor son que los EAG de los fármacos biológicos son menos frecuentes en pacientes con enfermedad temprana. Si bien no hay diferencias significativas en los ensayos clínicos de AR temprana cuando se emplean fármacos biológicos+metotrexato frente a metotrexato en monoterapia, en la práctica clínica y tras el seguimiento a muy largo plazo esto no está tan claro. No obstante, es un hecho que las infecciones se asocian más al empleo de corticoides, comorbilidad e incapacidad que a los fármacos biológicos. Las complicaciones tardías graves pueden evitarse con un control mejor de la inflamación (amiloidosis, insuficiencia renal crónica terminal, fibrosis pulmonar, vasculitis, enfermedad por complejos inmunitarios)16. Finalmente, el perfil de eficacia/toxicidad de los fármacos biológicos y de la estrategia tipo COBRA no es diferente11.
Un tratamiento muy interesante con el que ya tratamos a algunos casos con AR de inicio y grave es el tratamiento de inducción de remisión, estrategia similar al tratamiento de las neoplasias malignas. El concepto en el que se basa es que hay un período que llamamos “Ventana de oportunidad terapéutica” en el que dar el tratamiento adecuado, en el momento justo, puede modificar de modo considerable el curso clínico de la enfermedad17. Como el tratamiento de inducción de remisión se administra durante un período breve, se evitarían costes y complicaciones asociadas a tratamientos de por vida. Los datos del estudio TNF20 mostraron que es posible disminuir el daño estructural que se observa en la RM tras 6 meses de administración de infliximab+metotrexato18. Con esta hipótesis de trabajo, se informaron los resultados del estudio NeoRaco19, una investigación pionera del grupo finlandés. En el trabajo, 100 pacientes con AR de inicio (media de 4 meses), de 46 años de edad, con un 67% de mujeres y un 68% FR+ recibieron tratamiento estándar con metotrexato (hasta 25mg/semana)+salazopirina (hasta 2g/día)+HCLQ (35mg/kg/semana)+dosis estable de prednisona (7,5mg/día), y fueron aleatorizados a recibir tratamiento con infliximab (3mg/kg/dosis) o placebo las semanas 4, 6, 10, 18 y 26, sin infusiones posteriores. La probabilidad de remisión fue casi del doble en el grupo que recibió el anti-TNF 1,97 (1,03–3,74). El porcentaje de remisión (según criterios estrictos de ACR modificados: a) ausencia articulaciones dolorosas; b) ausencia de articulaciones tumefactas; c) rigidez matutina menor de 15min; d) velocidad de sedimentación globular<20mm/h, y e) dolor articular por interrogatorio) fue del 70 frente al 53% (p=0,08), y de remisión sostenida (remisión durante 6-24 meses) fue del 40 frente al 31% (p=0,40), respectivamente. Ambas tasas de remisión fueron mejores en el grupo que recibió el fármaco biológico. El porcentaje de pacientes con un índice de Sharp<0 a los 24 meses fue del 51 frente al 41% (p=0,001). Estos beneficios persistieron aun después de suspender el infliximab y se mantuvieron hasta las 52 semanas de tratamiento, sin diferencias sustanciales en la tasa de episodios adversos en los grupos19.
Desafortunadamente, la evidencia obtenida de los ensayos clínicos controlados publicados, si bien es útil, tiene sus limitaciones. Destacan una corta duración, ya que evalúan 3–4 años de la enfermedad, en el mejor de los casos. Debido a la corta duración y al reducido tamaño de la muestra, los efectos adversos muy raros, pero clínicamente relevantes, no se pueden evaluar de forma fácil. Además, todos sabemos que los ensayos clínicos incluyen un subgrupo seleccionado de pacientes con AR, generalmente de mejor pronóstico y sin comorbilidad asociada, que difieren de los pacientes que tratamos en la práctica clínica. Otro de los inconvenientes es que no se analizan otros tratamientos combinados que sabemos que son eficaces en la práctica clínica, como leflunomida+metotrexato+corticoides, por citar un ejemplo.
ConclusionesSiguiendo el orden de ideas, los cambios vertiginosos en el diagnóstico y el tratamiento de la AR de las últimas décadas nos hacen obligado cuestionarnos la práctica clínica habitual para saber si es delirante o cuerda. A partir de la evidencia reciente, está claro que la combinación de fármacos biológicos+metotrexato en escalada rápida produce más tasas de remisión cuando se comparan frente a placebo+metotrexato. En los pacientes con respuesta clínica, ésta ocurre de modo más rápido y no sólo en las variables clínicas que reflejan actividad (articulaciones inflamadas, dolorosas, escalas de dolor, DAS o respuesta ACR), así como en la función física, la calidad de vida, la fatiga y el sueño. El efecto más significativo de la combinación del anti-TNF más el biológico ocurre en la disminución de la progresión radiográfica tanto en el grupo que recibe la combinación biológico+metotrexato, como en los grupos que se tratan con el anti-TNF en monoterapia. Esta disminución tiene un gradiente y es mayor para la combinación anti-TNF+metotrexato, algo menor para el anti-TNF en monoterapia y aún menor para el metotrexato, que en los ensayos ya se emplea en escalada rápida.
El efecto en la progresión radiográfica es independiente de la mejoría en la actividad, es decir, que hay pacientes que no mejoran en los índices de actividad de la enfermedad, pero en los que el daño estructural se detiene. La eficacia en la variable “daño estructural”, medida como progresión en los índices radiográficos, parece seguir un efecto de clase común para los biológicos del grupo anti-TNF y también se observa con otros biológicos con mecanismos de acción diferentes (anti-CD20, inhibidores de coestimulación de linfocito T y anti-IL-6). Este efecto podría estar mediado a través de bloqueo de citocinas que estimulan la actividad osteoclástica. No obstante, la traducción clínica de este importante hallazgo se verá en el futuro, cuando conozcamos el efecto de la disminución en la progresión de los índices radiográficos en la función física, indicadores de incapacidad como necesidad de prótesis y otras variables de desenlace muy importantes desde la perspectiva del paciente y que reflejan el resultado de la enfermedad en el tiempo.
Ante esta evidencia, sería una locura decir que todos los pacientes con AR de inicio deben recibir tratamiento con fármacos biológicos+metotrexato. La cordura es considerar que un subgrupo de pacientes con AR de inicio se beneficiarán con este tipo de tratamiento, al menos con la estrategia de inducción de remisión. Esto es buscar el tratamiento apropiado, en el momento preciso y a los pacientes adecuados. El grupo de reumatólogos del Colegio Americano de Reumatología y de la European League Against Rheumatism (EULAR) han establecido desde hace ya algún tiempo que el tratamiento adecuado debe buscar remisión y no progresión radiográfica de la enfermedad. De acuerdo con las recomendaciones de tratamiento del Colegio Americano de Reumatología, el momento preciso en AR es de<6 meses de duración y los pacientes apropiados son los que no han presentado exposición previa a metotrexato, con actividad persistente (<3 meses) y elevada (DAS28>5,1) más algún factor de mal pronóstico (CCP+, FR+, enfermedad extraarticular, pobre función física y enfermedad erosiva) o con actividad persistente (3–6 meses) y elevada (DAS28>5,1), independiente de los factores de mal pronóstico. En ambas situaciones, las recomendaciones incluyen un nodo de decisión, “si el paciente tiene un seguro médico que cubra el tratamiento”20,21,22.
La reflexión final, llegados a este punto, y acostumbrados como estamos los reumatólogos a las pirámides de tratamiento, es: ¿existe una nueva pirámide de tratamiento cuya base esta vez sean los costes?