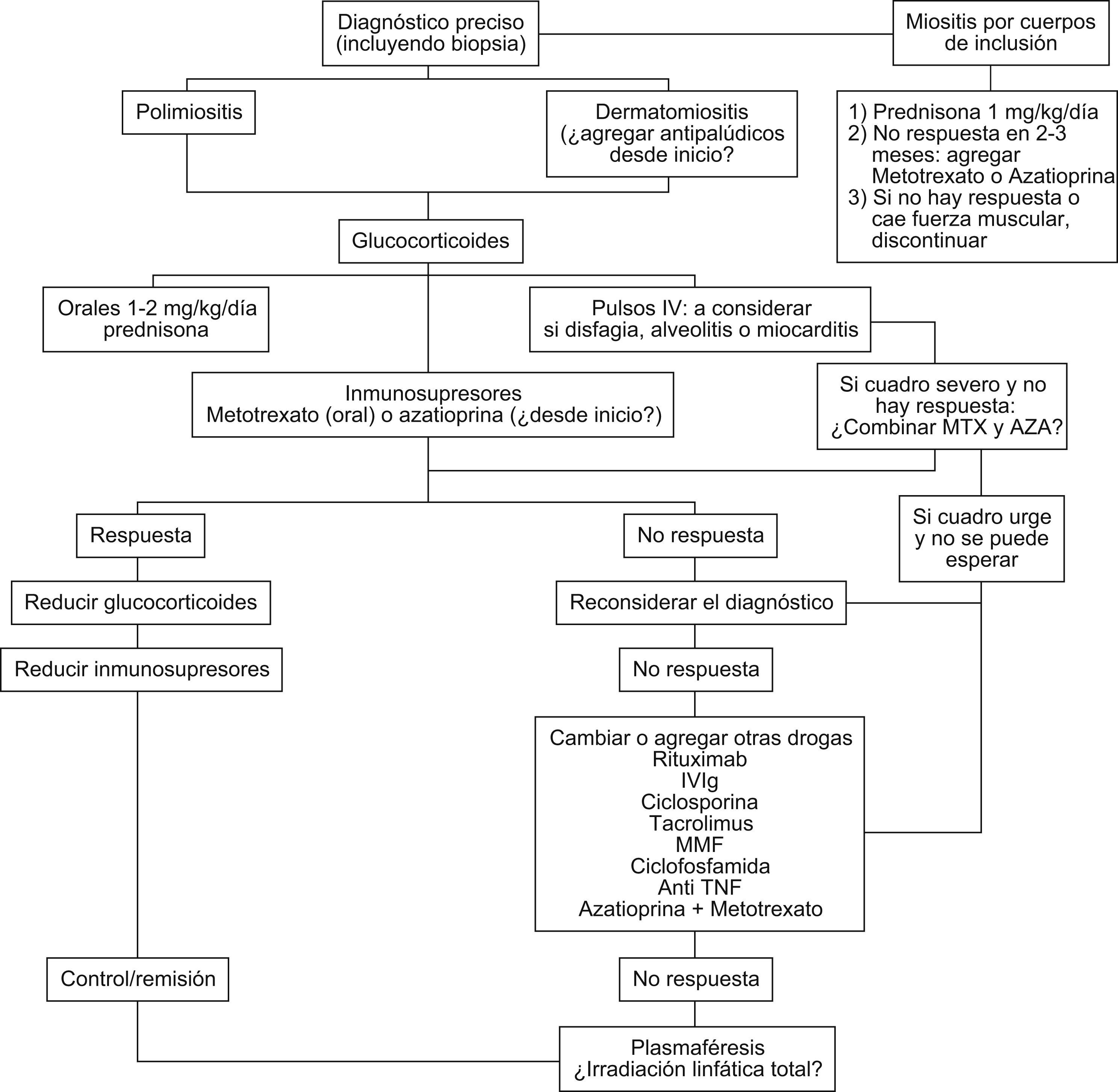
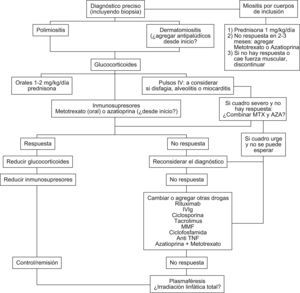
El diagnóstico preciso es esencial y la biopsia muscular mandatoria para identificar miositis por cuerpos de inclusión. La mayoría de las miopatías inflamatorias se tratan de manera similar, aunque el manejo ha sido empírico en la mayoría de los casos y los estudios controlados escasos. La fuerza muscular y los niveles de enzimas musculares siguen siendo las medidas más útiles en el seguimiento. Los glucocorticoides siguen siendo el pilar del tratamiento aunque no existen estudios controlados. El uso de drogas inmunosupresoras desde el inicio podría ser útil como ahorrador de esteroides. Las drogas más utilizadas son el metotrexato y la azatioprina, y los antipalúdicos en casos de compromiso cutáneo. En casos refractarios a estos tratamientos, el rituximab parecería ser efectivo en algunos (aunque no hay estudios controlados) y hay cierto consenso en usar esta droga antes que la inmunoglobulina endovenosa. Los anticuerpos anti–TNF no han sido efectivos en estas enfermedades. La ciclosporina y el micofenolato de mofetilo han demostrado cierta utilidad, especialmente la ciclosporina en pacientes con compromiso pulmonar. El tratamiento de la miositis por cuerpos de inclusión sigue siendo insatisfactorio.
Diagnosis should include mandatory muscle biopsy to identify inclusion body myositis. Most forms of inflammatory myopathies are still treated similarly, although treatment strategies remain empirical and controlled trials are few. Muscle strength and CPK levels remain the most frequently used measures to monitor disease activity and response to therapy. Corticosteroids are the main pillar of drug therapy but simultaneous use of corticosteroid-sparing drugs may be considered from the start.
The most frequently used drugs for combined therapy are methotrexate, azathioprine and antimalarials in cases of dermatomyositis. In refractory cases, especially if life threatening, rituximab has appeared to be effective although there are no controlled trials, and there is some consensus that this should be used prior to Immunoglobulin. Anti TNF antibodies have not been useful in these diseases. Cyclosporin (especially with lung involvement) and Mofetil mycophenolate may also have a role in non responding cases. Treatment of inclusion body myositis remains unsatisfactory.
Es difícil definir un régimen óptimo de tratamiento debido a lo infrecuente de las miopatías inflamatorias (MI), su variable presentación y el número limitado de ensayos clínicos con selección aleatoria doble ciego1,2. Se han asociado a un peor pronóstico: demora en el inicio del tratamiento por más de 6 meses luego del comienzo, mayor debilidad en la presentación, presencia de disfagia, debilidad muscular respiratoria, enfermedad intersticial pulmonar, malignidad asociada y compromiso cardíaco3,4. La respuesta al esteroide es mayor en los de síndromes de superposición, seguida por dermatomiositis (DM), polimiositis (PM) y miositis por cuerpos de inclusión que responde pobremente.
Ciertos autoanticuerpos específicos de miositis podrían definir subgrupos que tendrían valor predictivo para la respuesta al tratamiento pero no hay estudios controlados al respecto5.
Los objetivos del tratamiento son mejorar la fuerza muscular y evitar el desarrollo de complicaciones extramusculares, además de resolver las manifestaciones cutáneas en la DM.
El tiempo promedio de tratamiento oscila entre 18 y 24 meses, aunque puede ser más prolongado, y deben distinguirse actividad y severidad para poder adecuar la agresividad de éste.
La miositis asociada a cáncer tiene una respuesta dependiente de la enfermedad subyacente.
Terapia farmacológicaGlucocorticoidesSiguen siendo el pilar del tratamiento6. No existe un régimen “estándar” de tratamiento, pero se sugiere a) iniciar tratamiento con dosis altas durante los primeros meses y b) descender lentamente hasta la dosis mínima efectiva durante un período de 9 a 12 meses. Los orales se indican a una dosis de 1mg/kg/d pero en la práctica no suelen superar los 80mg diarios de prednisona o su equivalente, en dosis única matinal o dividida si no responde. Este período suele durar entre 1 y 2 meses hasta lograr el control clínico y enzimático. Existen distintos esquemas de reducción; el esquema sugerido por Oddis y Medsger es el siguiente:
- •
mantener la dosis inicial hasta que la creatin cinasa (CK) baje a valores normales,
- •
y reducir la prednisona en un 25% mensual hasta lograr una dosis de mantenimiento de 5–10mg/d.
Los corticoides orales en días alternos no han demostrado ser útiles en la etapa aguda. El descenso enzimático puede esperarse dentro de las 2 semanas de iniciado el tratamiento; pero su normalización puede llevar más tiempo. El ajuste de la dosis sólo para normalizar enzimas puede conducir a sobretratamiento.
Los glucocorticoides en pulsos endovenosos se utilizan en algunas situaciones graves, como disfagia alta con riesgo de broncoaspiración e incapacidad de deglutir, alveolitis activa o evidencias de miocarditis7,8. El esquema convencional es de 3 pulsos de 1g de metilprednisona/olona, habitualmente seguido de dosis altas orales.
Toxicidad: los peores efectos a largo plazo probablemente sean los óseos, especialmente colapsos vertebrales y necrosis ósea avascular. La indicación de calcio y vitamina D, especialmente en mujeres jóvenes, hoy no se discute. Hay evidencia de que los bisfosfonatos son efectivos en prevenir la pérdida ósea en pacientes tratados con esteroides9.
La hipertensión inducida por esteroides y la insuficiencia cardíaca tal vez no sean tan comunes en la práctica general. En los pacientes diabéticos está indicado reducir cuanto antes la dosis y el tiempo de uso de los corticoides. La redistribución grasa secundaria al síndrome de Cushing iatrogénico y el hirsutismo son un problema, sobre todo en las mujeres jóvenes.
Con dosis altas hay mayor tendencia a la aparición de infecciones por gérmenes poco frecuentes, y la cobertura con isoniacida (300mg/d) está indicada en pacientes expuestos. La vacuna antigripal y antineumocócica están indicadas, en lo posible previamente a iniciar una terapia agresiva.
Drogas inmunosupresorasComo otros, nuestra práctica es comenzar con estas drogas al mismo tiempo que se inicia la prednisona, dado el potencial que tienen para reducir la dosis acumulativa de los corticoides. Las drogas con las cuales ha habido mayor experiencia son el metotrexato y la azatioprina. Estas drogas no han sido comparadas directamente en ensayos clínicos.
MetotrexatoNo existen estudios prospectivos de metotrexato en MI. La dosis inicial es de 15mg semanales, con incremento hasta llegar a los 25mg10. Si no es efectiva, se puede pasar a la vía subcutánea, intramuscular o intravenosa. Se han utilizado dosis de hasta 50mg semanales, pero los eventos adversos fueron mayores, requiriendo en algún caso rescate con leucovorina.
Toxicidad: el monitoreo incluye el control del hemograma y las enzimas hepáticas11. La elevación de las transaminasas puede producirse por miositis activa o por toxicidad hepática. Puede requerirse la realización de una biopsia hepática y/o muscular para dirimir el problema.
La depresión medular puede ocurrir por el uso de dosis más altas. Ante la aparición de alveolitis de reciente comienzo, se debe considerar la posibilidad de una neumonitis por metotrexato en el diagnóstico diferencial7. No está definido si los pacientes con enfermedad pulmonar preexistente o aquellos con el síndrome antisintetasa deberían o no recibir metotrexato. La realización de biopsia hepática previa está indicada en pacientes con historia de hepatopatía o alcoholismo.
AzatioprinaHay considerable experiencia y existe consenso en que tarda un poco más para actuar que el metotrexato7. La dosis de inicio es de 1,5–2mg/kg/d, oscilando habitualmente entre 150 y 200mg diarios. El uso conjunto con corticoides demostró ser superior a los corticoides solos, tanto en la evolución del cuadro muscular como en la dosis acumulativa de esteroides. Se mantiene la dosis inicial hasta la remisión clínica y enzimática para luego reducir paulatinamente.
Toxicidad: se han descrito reacciones sistémicas similares a un estado gripal con fiebre y síntomas gastrointestinales en hasta un 12% de los pacientes. Otros eventos adversos incluyen depresión de médula ósea, pancreatitis, toxicidad hepática y riesgo de malignidad.
AntimaláricosSon efectivos en el control de la enfermedad cutánea de la DM, incluso en aquellos con enfermedad vinculada al cáncer, y en el ahorro de esteroides en pacientes con miositis12. Se pueden usar por un tiempo prolongado para el control de recaídas. Las recaídas cutáneas puras en pacientes con DM pueden tratarse solamente con antimaláricos.
La dosis “segura” de cloroquina es de 4mg/kg/d y la de hidroxicloroquina es de 6,5mg/kg/d. Si la hidroxicloroquina es realmente más segura que la cloroquina es debatible porque los trabajos iniciales sobre toxicidad ocular comparaban dosis más altas de cloroquina que las actualmente utilizadas. Esto es importante ya que la cloroquina es mucho más económica en Latinoamérica.
Toxicidad: el efecto adverso más importante es la toxicidad retiniana. Ésta es infrecuente con las dosis recomendadas, y el control ocular incluso se debate actualmente13. Sugerimos, sin embargo, hacer controles de fondo de ojo y campo visual por lo menos una vez al año en estos pacientes. Algunos eventos adversos, si bien infrecuentes, pueden confundirse con manifestaciones de la enfermedad, especialmente la erupción fotosensible luego de exposición al sol y la miopatía por cloroquina.
Enfermedad refractariaSi falla a azatioprina y metotrexato puede intentarse una combinación de ambos o buscar otras opciones para terapia resistente (fig. 1).
Con excepción de la gammaglobulina endovenosa, ninguna de las drogas ha sido sometida a ensayos clínicos randomizados. A pesar de la escasez de los datos clínicos publicados, actualmente se sugiere utilizar rituximab a dosis de 1g intravenoso cada 2 semanas (2 dosis en total) para el tratamiento de la enfermedad resistente14,15 (evidencia grado 2 B).
Si el rituximab no es efectivo, se puede utilizar como agente de segunda línea la gammaglobulina endovenosa (dosis de 1 a 2g/kg)2 (evidencia grado 2 B). Hay escasos datos sobre el uso de rituximab y gammaglobulina endovenosa en enfermedad intersticial pulmonar. Los inhibidores de la calcineurina (ciclosporina y tacrolimus) pueden ser efectivos para tratar esta complicación16,17. Se recomienda tacrolimus en enfermedad intersticial pulmonar a dosis de 0,2mg/kg/d en dosis divididas (evidencia grado 2 C). En pacientes que no toleran los inhibidores de calcineurina, el micofenolato de mofetilo es una alternativa (1–1,5 g 2 veces por día)18. El uso de agentes alquilantes (ciclofosfamida y clorambucilo) se reserva para casos resistentes a múltiples tratamientos, debido a sus eventos adversos (evidencia grado 1 C); la ciclofosfamida puede ser útil en pacientes con alveolitis. La terapia combinada con azatioprina (hasta 200mg por día) y metotrexato (hasta 25mg semanales) tiene una potencial eficacia en los casos resistentes19 (evidencia grado 2 C). Sin embargo, el riesgo de morbilidad relacionado con este tratamiento obliga a un monitoreo estricto (citopenias y otros eventos adversos).
Actualmente no se aconseja el uso de inhibidores de TNF, a menos que otras opciones de tratamiento hayan fallado20 (evidencia grado 2 C). En algunos casos de DM existe un rash refractario al tratamiento convencional. Los siguientes fármacos han sido utilizados: tacrolimus tópico, micofenolato de mofetilo (hasta 1,5 g 2 veces por día) y rituximab (375mg/m2 i.v. en 4 dosis semanales).
Monitoreo de la enfermedadLos 2 elementos cardinales son el monitoreo de la fuerza muscular y el nivel sérico de las enzimas musculares.
Fuerza muscularLa evaluación objetiva de la fuerza muscular usando una escala clínica es útil tanto al inicio como en el seguimiento (tabla 1).
Evaluación manual de la fuerza muscular
| Grado de fuerza | Característica del hallazgo |
| 0 | Ausencia de contracción muscular |
| 1 | Contracción palpable pero sin movimiento |
| 2 | Movimiento posible pero no contra gravedad |
| 3 | Movimiento posible contra gravedad |
| 4 | Movimiento posible contra resistencia menor |
| 5 | Movimiento posible contra resistencia manual considerable |
La debilidad muscular aparece por inflamación y daño de fibras musculares y hay que hacer una evaluación adecuada de ambas para no sobretratar. En pacientes con DM puede haber reactivación cutánea sin recaída muscular. En estos casos se trata independientemente la piel del músculo.
Enzimas muscularesLa CK y la aldolasa son las enzimas más comúnmente utilizadas pero las transaminasas (oxaloacética y glutámico-pirúvica- TGO y TGP) y la dehidrogenasa láctica pueden también ser útiles, ya que existen casos con CK normal.
La persistencia de valores elevados de CK y falta de recuperación sugieren falta de control de la enfermedad. Se debe reevaluar el diagnóstico y plantear alternativas al tratamiento instituido. La aparición de debilidad muscular con enzimas normales debe alertar sobre la presencia de miopatía esteroidea.
Resonancia magnética nuclearLa resonancia magnética nuclear (RMN) puede ser útil en la detección de inflamación muscular y monitoreo de su evolución21. Estaría indicada para seleccionar el lugar de la biopsia, particularmente cuando surgen dudas entre reactivación y miopatía esteroidea, o ante la presencia de debilidad muscular sin correlación enzimática. Un limitante actual sigue siendo el costo.
Manejo de manifestaciones extramusculares y cutáneasManifestaciones cardíacasEl compromiso miocárdico es difícil de diagnosticar en el contexto de enfermedad activa, salvo que aparezcan arritmias o insuficiencia cardíaca clara. Ha sido descrito en el subgrupo de pacientes con anticuerpos antipartícula de reconocimiento de señal y tiene mal pronóstico. El tratamiento del compromiso miocárdico no difiere del resto de la enfermedad activa. Su presencia sugiere para algunos el inicio del tratamiento con pulsos de esteroides y terapia combinada con inmunosupresores.
Manifestaciones gastrointestinalesLa presencia de disfagia severa con riesgo de broncoaspiración es una manifestación de alarma y tendría indicación de tratamiento con pulsos intravenosos de esteroides, especialmente si el paciente no puede deglutir. Hay trabajos que sugieren el uso de gammaglobulina endovenosa y, en casos extremos, se ha recurrido a la miotomía cricofaríngea22.
El compromiso del esófago distal, más frecuente en los síndromes de superposición como lesión “esclerodérmica”, se trata con medidas antirreflujo, tanto físicas (cabecera de la cama) como farmacológicas (bloqueantes de la bomba de protones, antagonistas H2, antiácidos, etc.). En algunos casos puede ser necesaria la dilatación e incluso la cirugía.
Enfermedad pulmonar intersticialLa alveolitis puede ser indolente o rápidamente progresiva, requiriendo per se un tratamiento agresivo. Los pacientes con el síndrome antisintetasa y con síndromes de superposición suelen tener más frecuentemente esta manifestación. La alveolitis en el segundo grupo puede responder mejor al tratamiento. En el primero, la terapia debe ser más agresiva y es en este contexto donde ha habido informes con éxito usando pulsos de ciclofosfamida intravenosos23. La ciclosporina también ha sido comunicada como efectiva en algunos casos refractarios a la terapia convencional. En casos refractarios a corticoides e inmunosupresores mencionados anteriormente, sobre todo cuando hay progresión de la insuficiencia respiratoria y habiendo descartado la presencia de infecciones oportunistas a través de un lavado broncoalveolar, tiene indicación el rituximab o la gammaglobulina endovenosa.
CalcinosisLa calcinosis es más común en las formas infantiles. Es excepcional en la PM y su presencia debe hacer reconsiderar el diagnóstico7. Los múltiples tratamientos con bloqueantes cálcicos, inhibidores de la vitamina K y bisfosfonatos han arrojado resultados variables. En algunos casos es necesaria la remoción quirúrgica (glúteos, codos, etc.). La colchicina puede ser útil en episodios de inflamación aguda, similar a la causada por cristales.
Manejo de la miositis por cuerpos de inclusiónActualmente se la considera como el tercer grupo de las formas clínicas de miositis luego de la PM y la DM7. Incluso se plantea que muchas formas diagnosticadas como PM y con pobre respuesta al tratamiento han sido miositis por inclusión. El mayor avance en las características histológicas ha permitido un mejor reconocimiento de este subgrupo de pacientes. La miositis por inclusión es más frecuente en hombres mayores de 50 años. El comienzo es insidioso y la debilidad es proximal pero característicamente pueden tener debilidad distal en casi la mitad de los casos, confundiendo así la impresión clínica. Se acompaña de mialgias en un 40% de los casos. Las enzimas musculares son normales o levemente elevadas y los reactantes de fase aguda están usualmente ausentes. En algunos casos el EMG suele mostrar un patrón mixto miopático y neurogénico. La biopsia es esencial y a veces se requiere más de una. Cuanto mayor es la edad al comienzo de la enfermedad, más rápida es la pérdida de fuerza y funcionalidad. Al cabo de 15 años, la mayoría de los pacientes requieren asistencia para las actividades de la vida diaria y algunos quedan postrados o confinados a una silla de ruedas.
En contraste con otras MI, la miositis por cuerpos de inclusión es relativamente resistente a la terapia con corticoides e inmunosupresores. Como la enfermedad se diagnostica muchos años después del comienzo de los síntomas, habiendo ya un daño muscular significativo, el objetivo del tratamiento es prevenir un mayor deterioro en la fuerza muscular y no recuperar fuerza muscular.
Recomendaciones24- 1)
Iniciar tratamiento con prednisona a dosis de 1mg/kg/d.
- 2)
Si no hay mejoría luego de 2 o 3 meses, considerar el agregado de metotrexato (dosis de inicio de 7,5mg/semana) o azatioprina (1,5 a 2,5mg/kg/d) durante un período aproximado de 3 a 6 meses. En la actualidad no hay datos que favorezcan uno sobre otro.
- 3)
Considerar suspensión del tratamiento farmacológico si hay una declinación progresiva en la fuerza muscular.
- 4)
Si, por el contrario, la fuerza muscular se estabiliza o mejora, usar terapia de mantenimiento con corticoides a dosis decrecientes y/o metotrexato o azatioprina en forma continua.
La eficacia de la gammaglobulina intravenosa fue evaluada en 3 estudios doble ciego y en 2 series abiertas pequeñas25–29. En la actualidad, no se recomienda debido al alto costo y sólo tiene un modesto beneficio. Una excepción podría ser su uso en el tratamiento de la disfagia30.