Evaluar la asociación entre los hallazgos histológicos de la biopsia de glándula salival menor (BGSM) y los anticuerpos anti La (La/SS-B), anti Ro (Ro/SS-A), anticuerpos antinucleares (FAN) y factor reumatoideo (FR), y comparar el valor de estos como test diagnóstico con la BGSM considerada como patrón oro.
Material y métodosSe incluyeron pacientes con sospecha de síndrome de Sjögren primario (SSp) derivados para realización de BGSM. Se realizó medición de anticuerpos y se consideró BGSM positiva a los grados III y IV de la clasificación de Chisholm.
ResultadosSe incluyeron 218 pacientes, 95% género femenino, con una mediana de edad de 54 años y de tiempo de evolución de los síntomas sicca de 12 meses. El 36% de las biopsias fueron positivas. El 33% de los pacientes presentaban anticuerpos anti Ro/SS-A anti La/SS-B positivos, 62% FAN positivo y el 31% FR positivo. Se encontró asociación estadísticamente significativa entre la BGSM y anti Ro/SS-A, anti La/SS-B, FAN y FR. El FAN resultó ser el anticuerpo más sensible (84% IC95%: 75-92), siendo los más específicos: anti Ro/ SS-A y/o anti La/ SS-B (78% IC95%: 71-85) y el FR (78% IC95%: 69-87).
ConclusiónAnte la sospecha clínica de SSp, los anticuerpos anti Ro/ SS-A y anti La/ SS-B son de gran valor para arribar al diagnóstico, siendo la BGSM especialmente útil en los pacientes seronegativos. Los resultados también sugieren la utilidad del FAN y el FR para la clasificación de SSp.
To assess the association between histologic findings in the minor salivary gland biopsy (MSGB) and anti La (La/SS-B)y antiRo antibodies (Ro/SS-A), antinuclear antibodies (ANA) and Rheumatoid Factor (RF),and compare the value of the latter as diagnostic tests with MSGB, considered as the gold standard.
Material and methodPatients with suspected Primary Sjögren Syndrome (PSS) referred for MSGB were included. Antibody measurements were performed. Grade III and IV biopsy results were considered positive.
ResultsTwo hundred and eighteen (218) patients were included, 95% females, with a median age of 54 years and 12 months median duration of sicca symptoms. 36 of the biopsies were positive. 33% of patients had positive anti Ro/SS-A anti La/SS-B antibodies, 62% had positive ANA, and 31% positive RF. A statistically significant association was found between MSGB and anti Ro/SS-A anti La/SS-B, ANA and RF. ANA were the most sensitive antibodies (84%. 95% CI: 75- 92), and the most specific were: Anti Ro/ SS-A and/or anti La/ SS-B (78%. 95% CI: 71-85) and RF (78%. 95% CI: 69-87).
ConclusionOn PSS clinical suspicion, anti Ro/ SS-A y anti La/ SS-B antibodies have a great value to achieve the diagnosis, with MSGB useful for diagnosis of seronegative patients. The results also suggest the importance of ANA and RF for PSS classification.
El síndrome de Sjögren (SS) es una enfermedad autoinmune sistémica que compromete las glándulas exocrinas, manifestándose con síntomas que derivan de la hiposecreción de las mismas. Además de los síntomas derivados del compromiso exocrino, la enfermedad puede producir diversas manifestaciones extraglandulares. El SS puede presentarse solo, SS primario (SSp) o bien asociado a otras enfermedades autoinmunitarias, SS secundario1.
Hasta la fecha se han propuesto diferentes criterios de clasificación, los cuales se basan en la combinación de hallazgos clínicos, serológicos e histológicos2–8.
En cuanto a la histología como parte del diagnóstico, fue propuesta por primera vez en 1970 por Waterhouse, Chisholm y Mason; estos últimos fueron quienes establecieron la puntuación por focos teniendo en cuenta los agregados de células inflamatorias9.
Para obtener el material para el estudio anatomopatológico se realiza la biopsia de glándula salival menor (BGSM). Si bien este es un procedimiento invasivo, el mismo es de fácil realización y varios estudios mostraron una baja frecuencia de complicaciones, las cuales suelen ser leves8-14.
Sin embargo, a pesar de la sencillez de la técnica, la BGSM no está incorporada en la práctica diaria en todos los centros, lo cual genera inconvenientes para definir la presencia de SS según los criterios clasificatorios americano-europeos de 2002, actualmente vigentes8.
Según los mismos es necesaria la presencia de una BGSM compatible y/o la presencia de anticuerpos anti Ro/SS-A y/o anti La/SS-B para arribar a un diagnóstico de SSp.
Por otro lado, así como los criterios europeos de 19937, los criterios preliminares de 201210 incluyen, además de los anticuerpos anti Ro/SS-A y anti La/SS-B, a los antinucleares (FAN) y al factor reumatoideo (FR) como parte del criterio serológico.
Debido a que sigue existiendo dificultades en el acceso a la BGSM para el diagnóstico del SS en la práctica diaria, nos propusimos estimar la asociación entre la presencia de compromiso histológico grado III-IV de la clasificación de Chisholm y la presencia de anticuerpos anti Ro/SS-A y anti La/SS-B; y evaluar el valor de dichos anticuerpos como prueba diagnóstica, comparada con la BGSM la cual se tomó como el test de referencia o patrón oro.
Como objetivos secundarios evaluamos la asociación entre la presencia de infiltrados grado III- IV en la BGSM con la positividad del FAN y el FR y analizamos el valor de dichos anticuerpos como prueba diagnóstica, comparada con la BGSM.
Material y métodosEl diseño del estudio es observacional, analítico y de corte transversal.
Se incluyeron en forma consecutiva pacientes con sospecha de SSp derivados desde diferentes centros de Argentina al Servicio de Reumatología del Hospital Rivadavia para realización de BGSM, entre octubre de 2007 y diciembre de 2011, inclusive.
Los criterios de exclusión fueron aquellos relacionados con el procedimiento: consumo de aspirina u otros AINEs dentro de la semana previa al estudio, signos clínicos de infección local en el sitio a realizar la toma de biopsia, pacientes anticoagulados o con trastorno de la coagulación; u otras causas de síntomas sicca como el tratamiento con drogas anticolinérgicas o la radioterapia de cabeza y cuello. Se excluyeron las biopsias en las que el material obtenido fue insuficiente o no glandular, los pacientes con otra enfermedad reumática autoinmune asociada, los casos en los que no se contó con los resultados de los anticuerpos anti Ro/SS-A o anti La/SS-B y aquellos que se negaron a la inclusión en el protocolo.
Se consignaron datos demográficos (edad, género), tiempo de evolución de los síntomas sicca al momento de la realización de la biopsia, patología concomitante (hipotiroidismo y diabetes), tratamiento al momento de la realización del procedimiento (corticoterapia, drogas inmunomoduladoras/ inmunosupresoras), resultados de anticuerpos (FAN en Hep 2, anti Ro/SS-A, anti La/SS-B por ELISA, FR por látex, nefelometría o turbidimetría) y resultados de BGSM según clasificación de Chisholm-Mason. Los resultados de biopsias grado III y IV se consideraron positivos9.
Se definió xeroftalmía y xerostomía a la presencia de síntomas de sequedad ocular y oral según la definición planteada en los criterios clasificatorios 20028.
Dado que los criterios clasificatorios 2002 requieren la positividad de los anticuerpos anti Ro/ SS-A y/o anti La/ SS-B o la BGSM para clasificar un paciente con SSp y, siendo la biopsia un procedimiento invasivo, se decidió elegir esta última como patrón oro, con el objetivo de evaluar el valor de los anticuerpos y su utilidad al reemplazar a la BGSM.
El estudio anátomo-patológico fue llevado a cabo por un único anátomo patólogo, observador independiente y ciego, de la cátedra de Anatomía-Patológica de la Facultad de Medicina de Buenos Aires, con más de 15 años de experiencia en la evaluación de material histológico proveniente de BGSM. Los anticuerpos fueron realizados en diferentes centros de referencia del país, principalmente de la ciudad de Buenos Aires, y se utilizó como punto de corte para definir los resultados como positivos o negativos, los considerados por el laboratorio de cada centro.
El estudio fue aprobado por el comité de docencia e investigación y el comité de ética del hospital. Los pacientes firmaron el consentimiento informado correspondiente.
Análisis estadísticoLos datos fueron volcados en una base de datos Microsoft Excel y luego analizados usando el paquete estadístico STATA 11.
Se describieron las características generales de la población; las variables continuas se informaron como media y desviación estándar (DS) o mediana y rango intercuartílico (riq) según su distribución. Se realizó análisis de distribución de frecuencia de las variables categóricas.
Para el análisis bivariado se utilizó t test o Mann-Whitney test para las variables continuas, según distribución y tamaño muestral. Las variables categóricas fueron analizadas con Chi cuadrado o test exacto de Fisher según tabla de distribución de frecuencias esperada.
Para evaluar la asociación y la presencia de potenciales confundidores en la relación entre la positividad de cada uno de los anticuerpos y la BGSM se realizaron 3 modelos de regresión logística múltiple: 1- BGSM y anticuerpos anti Ro/SS-A anti La/SS-B, 2- BGSM y FAN y, 3- BGSM y FR, considerando a la biopsia como variable dependiente. Se calcularon lo Odds ratios (OR) y los correspondientes IC 95%.
Se consideró significativa una p <0,05.
Se calculó sensibilidad (S), especificidad (E), valor predictivo positivo (VPP), valor predictivo negativo (VPN) y razón de verosimilitud positiva (RVP) con sus respectivos intervalos de confianza 95% (IC 95%), de cada uno de los anticuerpos comparados con la BGSM, la cual se consideró el patrón oro.
ResultadosDesde octubre de 2007 a diciembre de 2011 se realizó BGSM a 400 pacientes derivados por sus médicos de cabecera por sospecha de SSp. Ciento ochenta y dos pacientes fueron excluidos: 130 por no contar con los resultados de anticuerpos anti Ro/SS-A o anti La/SS-B, 31 por tener una enfermedad reumática autoinmune asociada, 21 por material insuficiente o no glandular; quedando incluidos en el estudio 218 pacientes. Los 130 pacientes excluidos por no contar con resultados de los anticuerpos anti Ro/ SS-A o anti La/ SS-B presentaban características similares a los incluidos en el estudio: 96% de sexo femenino (92 de 96 pacientes), mediana de edad 53 años (ric: 41-60,92 pacientes), 91% presentaban xeroftalmía (88 de 91 pacientes), 85% xerostomía (78 de 92 pacientes), 80% ambas manifestaciones clínicas mencionadas (74 de 92 pacientes), 49% sialometría positiva (21 de 43 pacientes).
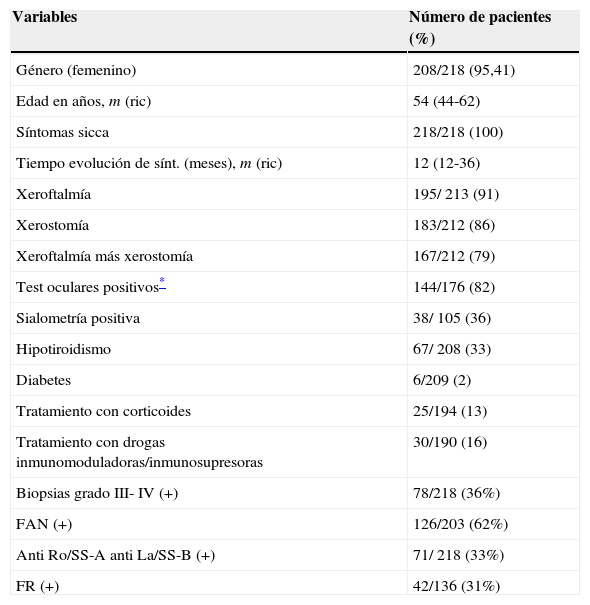
El motivo de derivación para la realización de biopsia de todos los pacientes incluidos en el estudio fue la presencia de xeroftalmía y/ o xerostomía en el contexto de sospecha de SSp. El 95% (208/218) de los pacientes eran de género femenino, con una mediana de edad de 54 años (ric: 44-62) y mediana de tiempo de evolución de los síntomas sicca de 12 meses (ric: 12-36). El 92% presentaban xeroftalmía, 86% xerostomía y 79% ambas manifestaciones (tabla 1).
Características demográficas y clínicas
| Variables | Número de pacientes (%) |
|---|---|
| Género (femenino) | 208/218 (95,41) |
| Edad en años, m (ric) | 54 (44-62) |
| Síntomas sicca | 218/218 (100) |
| Tiempo evolución de sínt. (meses), m (ric) | 12 (12-36) |
| Xeroftalmía | 195/ 213 (91) |
| Xerostomía | 183/212 (86) |
| Xeroftalmía más xerostomía | 167/212 (79) |
| Test oculares positivos* | 144/176 (82) |
| Sialometría positiva | 38/ 105 (36) |
| Hipotiroidismo | 67/ 208 (33) |
| Diabetes | 6/209 (2) |
| Tratamiento con corticoides | 25/194 (13) |
| Tratamiento con drogas inmunomoduladoras/inmunosupresoras | 30/190 (16) |
| Biopsias grado III- IV (+) | 78/218 (36%) |
| FAN (+) | 126/203 (62%) |
| Anti Ro/SS-A anti La/SS-B (+) | 71/ 218 (33%) |
| FR (+) | 42/136 (31%) |
m: mediana; Ric: rango intercuartílico.
De las 218 biopsias, 36% (78) fueron positivas (grado III o IV) y 64% (140) negativas (grado 0, I o II). El 33% (71/218) de los pacientes presentaban anticuerpos anti Ro/SS-A anti La/SS-B positivos, 62% (126/ 203) presentaban FAN positivo y el 31% (42/ 136) FR positivo (no se contó con el resultado de FAN y FR en todos los casos) (tabla 1).
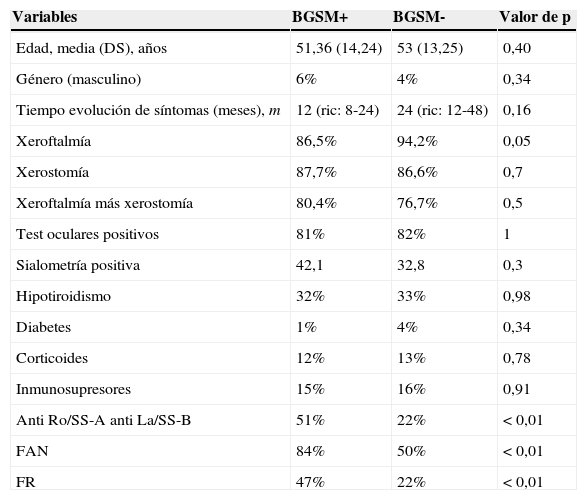
Al comparar las características demográficas y clínicas de los pacientes con BGSM positiva con los pacientes con BGSM negativas, en el análisis univariado, no se encontraron diferencias estadísticamente significativas en ninguna de las variables analizadas (tabla 2).
Resultados análisis univariado: características demográficas y clínicas entre BGSM + y BGSM-
| Variables | BGSM+ | BGSM- | Valor de p |
|---|---|---|---|
| Edad, media (DS), años | 51,36 (14,24) | 53 (13,25) | 0,40 |
| Género (masculino) | 6% | 4% | 0,34 |
| Tiempo evolución de síntomas (meses), m | 12 (ric: 8-24) | 24 (ric: 12-48) | 0,16 |
| Xeroftalmía | 86,5% | 94,2% | 0,05 |
| Xerostomía | 87,7% | 86,6% | 0,7 |
| Xeroftalmía más xerostomía | 80,4% | 76,7% | 0,5 |
| Test oculares positivos | 81% | 82% | 1 |
| Sialometría positiva | 42,1 | 32,8 | 0,3 |
| Hipotiroidismo | 32% | 33% | 0,98 |
| Diabetes | 1% | 4% | 0,34 |
| Corticoides | 12% | 13% | 0,78 |
| Inmunosupresores | 15% | 16% | 0,91 |
| Anti Ro/SS-A anti La/SS-B | 51% | 22% | <0,01 |
| FAN | 84% | 50% | <0,01 |
| FR | 47% | 22% | <0,01 |
DS: desviación estándar; m: mediana; Riq: rango intercuartílico.
Al analizar la presencia de asociación entre los anticuerpos y la BGSM en el análisis univariado, se encontró asociación estadísticamente significativa con el FAN (p <0,01), anticuerpos anti Ro/SS-A y/o anti La/SS-B (p <0,01) y con FR (p <0,01) (tabla 2).
Considerando la BGSM como variable dependiente, y los anticuerpos anti Ro/SS-A anti La/SS-B como variable de interés, en el análisis multivariado y ajustando por edad, tiempo de evolución de los síntomas, hipotiroidismo, tratamiento con drogas inmunomoduladoras/ inmunsupresoras y anticuerpos se encontró efecto confundidor del FAN en la relación entre BGSM y anti Ro/SS-A anti La/SS-B (OR crudo BGSM- anti Ro/SS-A anti La/SS-B: 3,70, IC 95%: 2,04-6,72, p <0,01. OR ajustado por FAN: 2,59, IC 95%: 1,29-5,22, p <0,01). Al incluir en el análisis el FR, el mismo ejerce también efecto confundidor, perdiendo los anticuerpos anti Ro/SS-A anti La/SS-B asociación con la positividad de la biopsia (OR: 1,98 IC 95%: 0,79-5,00, p: 0,15). El resto de las variables no ejercieron efecto confundidor ni mostraron asociación significativa en el modelo multivariado.
Al analizar la relación entre el FAN y la BGSM, se observó asociación significativa e independiente entre el FAN y la BGSM, siendo los anticuerpos anti Ro/SS-A anti La/SS-B un confundidor de dicha relación (OR crudo BGSM- FAN: 5,25, IC 95%: 2,59-10,65, p <0,01. OR ajustado por anti Ro/SS-A anti La/SS-B: 3,36, IC 95%: 1,53-7,36, p <0,01). El FR permaneció asociado en forma significativa e independiente a la BGSM, sin ejercer efecto confundidor en la relación entre el FAN y la BGSM.
Al ajustar la relación entre FR y BGSM, ni el FAN ni los anticuerpos anti Ro/SS-A anti La/SS-B ejercieron efecto confundidor (OR crudo BGSM-FR: 3,17, IC 95%: 1,48-6,75, p <0,01. OR ajustado: 2,99, IC 95%: 1,30-6,87, p <0,010). El resto de las variables permanecieron sin asociación y no se comportaron como confundidores.
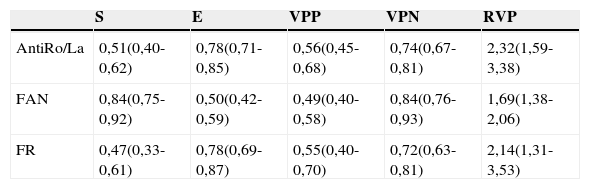
Finalmente, al calcular la S, E, VPP, VPN y RVP de cada uno de los anticuerpos, usando la BGSM como test de referencia, el FAN resulto ser el más sensible (0,84 IC 95%: 0,75-0,92) y con mejor VPN (0,84 IC 95%: 0,76-0,93); mientras que anti Ro/SS-A y/o anti La/SS-B y el FR arrojaron resultados similares, siendo los más específicos (0,78 IC 95% 0,71-0,85 y 0,78 IC 95%: 0,69-0,87, respectivamente) y con mayor VPP (0,56 IC95%: 0,45-0, 58 y 0,55 IC95% 0,40-0,70, respectivamente). Todos mostraron una buena RVP (tabla 3).
S, E, VPP, VPN, RVP y ABC de los diferentes anticuerpos en relación con la BGSM (patrón oro)
| S | E | VPP | VPN | RVP | |
|---|---|---|---|---|---|
| AntiRo/La | 0,51(0,40-0,62) | 0,78(0,71-0,85) | 0,56(0,45-0,68) | 0,74(0,67-0,81) | 2,32(1,59-3,38) |
| FAN | 0,84(0,75-0,92) | 0,50(0,42-0,59) | 0,49(0,40-0,58) | 0,84(0,76-0,93) | 1,69(1,38-2,06) |
| FR | 0,47(0,33-0,61) | 0,78(0,69-0,87) | 0,55(0,40-0,70) | 0,72(0,63-0,81) | 2,14(1,31-3,53) |
ABC: área bajo la curva; E: especificidad; RVP: razón de verosimilitud; S: sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Hasta la fecha se han propuesto diferentes criterios de clasificación de SSp, los cuales se basan en la combinación de hallazgos clínicos, serológicos e histológicos2–8. Desde los criterios de San Francisco2 (los cuales jerarquizan el aspecto histopatológico) y los de San Diego3, en los que la BGSM es imprescindible para llegar al diagnóstico de SSp definido, pasando por los criterios de Copenhague4, los griegos5, japoneses6 y los de la comunidad europea7, que no requieren BGSM ni la presencia de anticuerpos, hasta llegar a los criterios americano-europeos 20028 y los preliminares americanos 201210 los que exigen la presencia del criterio histopatológico o serológico.
Dada la diversidad de criterios utilizados a lo largo de los años y la falta de entrenamiento para la toma de biopsia y lectura del material, sumados a los riesgos menores del procedimiento8–14, determinar en qué casos sería conveniente contar con la histología para definir el diagnóstico de SSp suele plantear inconvenientes en la práctica diaria.
Nuestro estudio busca aportar información que contribuya a definir la utilidad de los anticuerpos en reemplazar a la biopsia para la clasificación de SSp, tomando como patrón oro la BGSM. Como resultados encontramos asociación significativa no solo de los anticuerpos anti Ro/SS-A anti La/SS-B con la BGSM, sino también del FAN y el FR. A su vez, dado los resultados de RVP de todos los anticuerpos mencionados, se puede considerar a cada uno de ellos como buenos métodos de estudio en relación con el daño inflamatorio glandular; aunque dada la baja especificidad del FAN, su combinación con otro anticuerpo como el FR, tal como se propone en los criterios preliminares 2012, parecería ser una opción válida.
Otros estudios también analizaron la relación entre los anticuerpos y la BGSM. Manoussakis et al.15, en un trabajo realizado con 54 pacientes con diagnóstico clínico de SSp y 92 pacientes con artritis reumatoidea, encontraron que los anticuerpos anti Ro/SS-A, anti La/SS-B y el título del FAN y del FR se correlacionaban con el grado histológico de la biopsia.
Saito et al.16, en un estudio con 107 pacientes con SS, encontraron que tanto el FR como los anticuerpos anti Ro/SS-A y anti La/SS-B eran significativamente más frecuentes en los pacientes con infiltrado linfocitario periductal.
A su vez, Wise et al.17, en su análisis de 187 pacientes en los que se realizó BGSM para estudio de SSp, encontraron que los pacientes con un focus score mayor a 1 en la biopsia tenían una frecuencia significativamente mayor de FAN, FR, anticuerpos anti Ro/SS-A y anti La/SS-B.
En relación con los anticuerpos anti Ro/SS-A y anti La/SS-B, se ha descripto que los pacientes con anti La/SS-B muestran mayor infiltrado inflamatorio que los sujetos que poseen solo anti Ro/SS-A positivo y que aquellos que son seronegativos18,19. Halse et al. mostraron la presencia de una buena correlación entre el focus score y la presencia de Ro 52 KD y La 48 KD en saliva, indicando una fuerte relación entre la inflamación local y la producción de autoanticuerpos18. Además, se encontró una fuerte correlación entre la presencia de autoanticuerpos en suero y Ro 52-kD, Ro 60kD and La/SSB en las glándulas salivales20–21.
En un estudio llevado a cabo en 181 pacientes chinos con diagnóstico inicial de SSp, se compararon diferentes métodos de detección del anticuerpo anti Ro/SS-A en suero (doble inmunodifusión, Western blot y ELISA) encontrando una asociación significativa con la BGSM con los 3 métodos, aunque el grado de acuerdo entre el focus score histológico y el anticuerpo detectado por Western blot no fue muy bueno, concluyéndose que los resultados positivos de dichos anticuerpos en suero podrían indicar un score mayor a 1 en la biopsia, por lo tanto en esos casos se podría obviar la realización de la misma22.
Por otro lado, Peen et al.23, revalidaron la asociación entre la positividad del FR y la presencia de focos linfocitarios en la histología; mientras que Bamba et al.24 encontraron asociación significativa entre anticuerpos anti Ro/SS-A y anti La/SS-B y positividad en la biopsia, no así con el FAN.
Daniels et al., en un estudio multicéntrico con un amplio número de pacientes, también observaron esta asociación entre los 4 marcadores serológicos mencionados y la BGSM25 e incluso el mismo grupo planteó nuevos criterios clasificatorios de la enfermedad que incluirían al FR y al FAN, este último en título mayor o igual a 1/32026. Así surgieron los criterios preliminares americanos 2012, en los cuales se considera positivo el dominio correspondiente al laboratorio inmunológico, ante la positividad de los anticuerpos anti Ro/ SS-A y/o anti La/SS-B y/o el FAN (título mayor o igual a 1/320) más el FR10.
Sin embargo, existe controversia en la inclusión del FAN y el FR en el nuevo set de criterios propuestos, dado que esta decisión deriva de un consenso de expertos de la cohorte sicca en la cual no se analizaron pacientes con otras enfermedades reumáticas autoinmunes, por lo cual muchos especialistas sugieren ampliar las investigaciones en este punto, antes de definir su verdadero rol dentro de los criterios 201227,28.
Con respecto a nuestro estudio, el mismo presenta limitaciones en gran parte debido a que los datos provienen de la práctica habitual. Creemos que puede existir un sesgo en la selección de los pacientes ya que en muchas oportunidades en la práctica diaria la BGSM se realiza solo ante la presencia de resultados negativos de anticuerpos anti Ro/ SS-A y anti La/ SS-B; también podría existir un sesgo en los resultados de los anticuerpos, ya que los mismos fueron realizados en diferentes centros del país. Por otro lado, se considera como una debilidad del estudio la falta de información complementaria acerca de otras manifestaciones clínicas de los pacientes, además de la sequedad ocular y oral, debido a la dificultad en recolectar esta información de pacientes que, en muchos casos, provienen de otros sitios de atención.
Por otro lado, si bien no se realizó el cálculo de tamaño muestral para estudios de test diagnóstico, el número de observaciones con las que se contó permitió que no se produjeran celdas vacías o con muy escasas observaciones en la tabla de contingencia, ni tampoco que se obtuvieran IC 95% demasiado amplios, lo cual también hablaría de un escaso número de pacientes.
De todos modos, consideramos que los resultados del presente trabajo reafirman el concepto de que si bien se puede prescindir de la BGSM en los pacientes con anticuerpos anti Ro/SS-A, anti La/SS-B positivos, la misma es de fundamental importancia en los pacientes seronegativos. Por otro lado la relación significativa e independiente encontrada entre el FAN y la BGSM y entre el FR y la BGSM, así como los resultados obtenidos de su valor como test diagnóstico, sugieren que dichos anticuerpos, ya sea solo para el caso del FR (por su mayor especificidad), o posiblemente en forma combinada (FAN más FR), podrían ser de utilidad en la valoración del dominio laboratorio inmunológico, para la clasificación de SSp.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.