La llegada de los fármacos anti-TNF-α (tumor necrosis factor alpha ‘factor de necrosis tumoral alfa’) a la clínica ha sido el resultado más exitoso de la investigación traslacional. Sin embargo, la experiencia ha demostrado que estos compuestos no consiguen inducir la remisión clínica en la mitad de los pacientes con artritis reumatoide (AR). Recientemente se han puesto a disposición en el mercado fármacos biológicos no dirigidos contra citocinas que deplecionan las células B o interfieren con la activación de las células T y que también han mostrado eficacia en el control de la actividad de la AR. Una segunda generación de compuestos contra la célula B está en desarrollo de parte de diversas empresas farmacéuticas. Es de esperar que estos productos mejoren la inmunogenicidad y la posología del rituximab, pero es poco probable que incrementen las tasas de remisión alcanzadas por los anti-TNF-α. Actualmente, la regulación de la transducción de señales se ha convertido en un campo muy importante en el desarrollo de los fármacos, y pequeñas moléculas inhibidoras de vías de señalización intracelular se están ensayando como nuevos antiinflamatorios. Para las enfermedades reumáticas, los inhibidores específicos de JAK3 y Syk son, hasta ahora, los compuestos que han mostrado mejores resultados y representan un avance significativo respecto a los inhibidores de la p38 MAPK (mitogen-activated protein kinase ' proteína cinasa activada por mitógeno').
The arrival of anti-TNF-α to the clinic has been the most successful example of translational research. However, clinical experience has shown that these compounds do not induce clinical remission in half of rheumatoid arthritis (RA) patients. Recently, new biological drugs against non-cytokine targets have been available for RA patients. These compounds deplete B cells or interfere with the activation of T cells and have also shown effectiveness in controlling signs, symptoms and structural damage progression in RA. Second generation B-cell depletion therapies are progressing in the pipeline of several pharmaceutical companies. These compounds will likely improve the immunogenicity and formulation of rituximab, but it is improbable that they will improve the remission rate achieved by the anti-TNF-α δρυγσ. Currently, regulation of signal transduction has evolved into an important field of drug research, and small molecule inhibitors for a number of pathways are tested as new anti-inflammatory agents. For rheumatic diseases, specific Jak3 and Syk inhibitors are, so far, the most successful compounds representing a significant advance over p38 mitogen-activated protein kinase (MAPK) inhibitors.
Desde hace ya algún tiempo hay pruebas muy sólidas de la eficacia del infliximab, el adalimumab y el etanercept en el control de las manifestaciones clínicas de la artritis reumatoide (AR), y lo que es más importante, en la prevención del daño que produce esta enfermedad en la estructura articular. Sin embargo, estos compuestos sólo consiguen inducir la remisión clínica, en términos de ACR70 (American College of Rheumatology 70%), en menos de la mitad de los pacientes que los utilizan, incluso en las condiciones más óptimas (pacientes con AR tempranas y asociados a metotrexato [MTX]). Los datos que están aportando los ensayos clínicos en fase II y III del tocilizumab no permiten esperar que el bloqueo de la interleucina-6 (IL-6) supere a los anti-TNF-α (tumor necrosis factor alpha ‘factor de necrosis tumoral alfa’) en su capacidad para inducir remisión clínica en la AR.
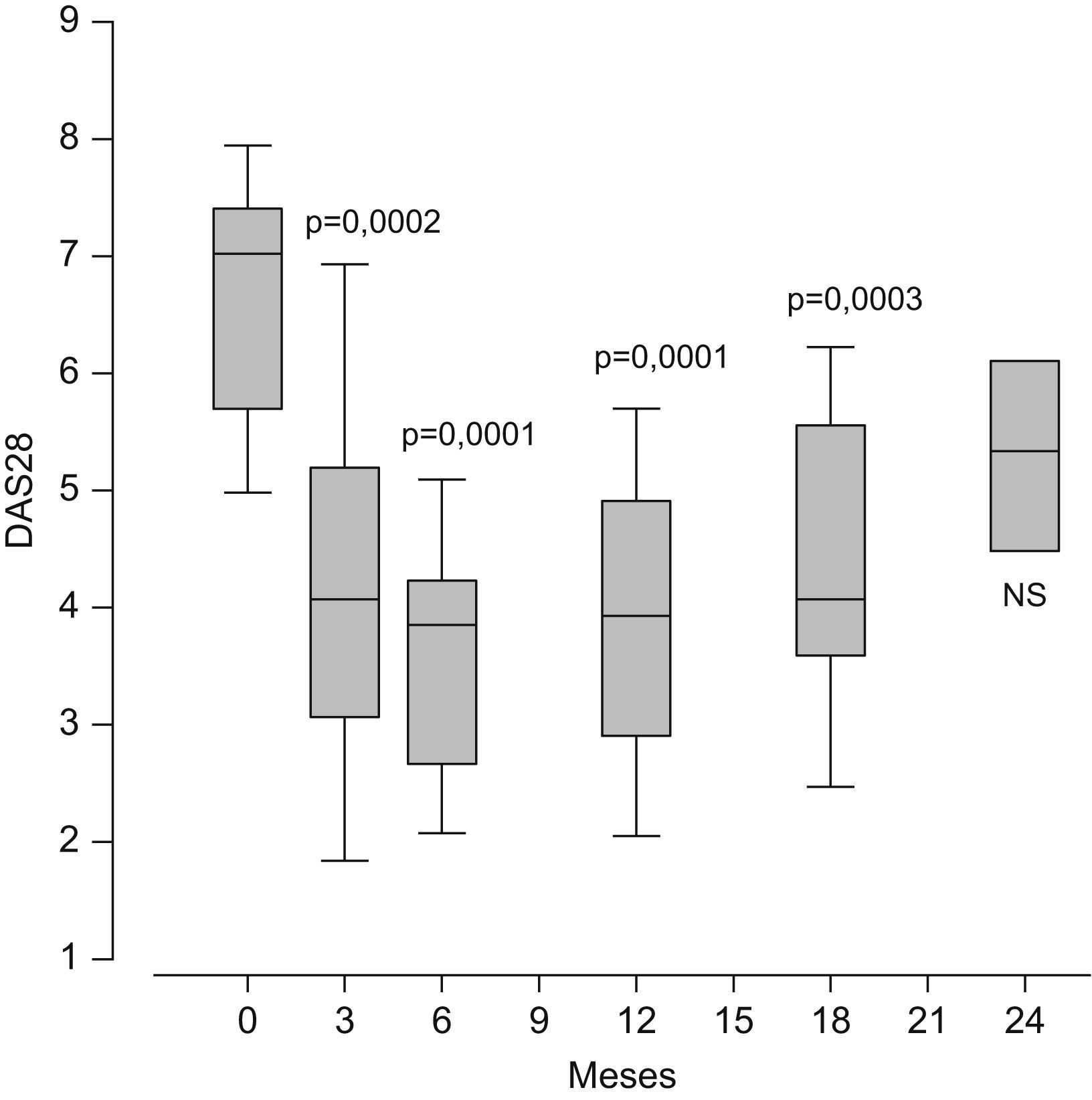
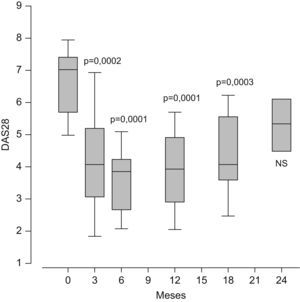
El rituximab y el abatacept son compuestos biológicos en los que las dianas no son citocinas. Ambos fármacos están posicionados en España como opciones terapéuticas válidas para los pacientes con AR activa con fallo al menos a un anti-TNF. Su utilización en España es aún minoritaria (menos de un 2% de los pacientes con AR utiliza rituximab) y no se conoce aún su verdadera eficacia en grandes poblaciones. Los datos de práctica clínica demuestran que el rituximab es eficaz en el control de la enfermedad, con evidentes ventajas posológicas sobre los anti-TNF actualmente disponibles (fig. 1). La posibilidad de usar abatacept con indicación en AR es muy reciente en España y la experiencia clínica sobre su eficacia y seguridad, fuera de ensayos clínicos, es aún menor que con rituximab. Sin embargo, lo que parece evidente de los datos obtenidos en los ensayos en fase III con estos compuestos es que no se espera que alguno de éstos logre superar a los anti-TNF en el porcentaje de pacientes que alcanzan la remisión clínica. En el horizonte del tratamiento para la AR comienza a vislumbrarse la posibilidad de usar pequeñas moléculas sintéticas orales que actúan como antiinflamatorios a través del bloqueo de rutas de señalización intracelular.
Variación en el tiempo del DAS28 (Disease Activity Score) en 20 pacientes con artritis reumatoide activa con ineficacia primaria o secundaria al antifactor de necrosis tumoral que se trataron con 2 dosis de 1g de rituximab por vía intravenosa separadas por 15 días. Los datos representan los percentiles del 25 al 75% (las cajas amarillas), la mediana (la línea negra) y la distribución del 95% de la población (las barras). Significación con test de ANOVA (análisis de la variancia) respecto a la basal a tiempo 0. NS: no significativo.
El papel del linfocito B en la patogenia de la AR ha ganado importancia en los últimos años. El éxito reciente en el tratamiento clínico de pacientes con AR activa que utilizan rituximab ha llevado a reconsiderar el papel del linfocito B en la patogenia de la AR1. Sobre la base de diversos datos experimentales, se han formulado 3 hipótesis sobre el potencial papel que desempeñan las células B en la AR: a) las células B regulan la función de las células T, fundamentalmente CD4+, al actuar como célula presentadora de antígeno e inducir su activación; b) la generación de autoanticuerpos por las células B favorece la formación de inmunocomplejos que a través de la unión a los receptores Fc y la activación del complemento inducen la producción de factores proinflamatorios por los macrófagos, y c) las células B del infiltrado producen directamente factores solubles, algunos con capacidad proinflamatoria (citocinas) y otros capaces de remodelar directamente la matriz extracelular, como las metaloproteasas. Por tanto, cabe preguntarse, ¿cuál de estos posibles mecanismos de acción es el más relevante? y ¿hay otros posibles mecanismos aún no conocidos? Estas preguntas permanecen aún sin respuesta.
Respecto al tratamiento anti-linfocitos B, se está desarrollando una segunda generación de compuestos que deplecionan las células B. El ocrelizumab, un anticuerpo monoclonal (AcM) humanizado anti-CD20 que se administra por vía intravenosa, se encuentra en fase III de desarrollo clínico. Los ensayos con este compuesto se han diseñado para comprobar su eficacia y seguridad contra MTX en los pacientes sin MTX previo, sobre MTX en los pacientes con mala respuesta a MTX y sobre MTX en los pacientes con fallo a anti-TNF-α. Los datos disponibles muestran una eficacia clínica en la AR y una tasa de reacciones transfusionales similares al rituximab. El ofatumumab es un AcM humano anti-CD20 de administración intravenosa actualmente en ensayos en fase III en los pacientes con AR con respuesta inadecuada a MTX o a anti-TNF-α. Los datos de ensayos en fase II con este AcM no difieren tampoco en cuanto a eficacia y seguridad respecto a los datos obtenidos por los ensayos en la misma fase con rituximab. Se está realizando un ensayo en fase I a II para probar la eficacia de este compuesto en formulación subcutánea. Si este desarrollo es exitoso, esta vía de administración significaría un avance posológico en el tratamiento anti-linfocitos B. En una fase más precoz de desarrollo se encuentra el TRU-015, un SMIP (small modular immuno pharmaceutical 'módulo pequeño inmunofarmacéutico'), construcción que contiene el fragmento Fab de un AcM anti-CD20 unido a un fragmento Fc que es capaz de inducir apoptosis en células B. Debido a su pequeño tamaño se le atribuye una menor capacidad inmunogénica y una mayor penetración en los tejidos que el AcM del que procede. Los resultados de un ensayo en fase IIb con 225 pacientes con AR activa y respuesta inadecuada al MTX han mostrado una eficacia similar a rituximab.
La maduración y supervivencia en las células B depende, además de las señales procedentes de su receptor específico (BCR), de las que generan un grupo de 3 receptores de superficie: BCMA (B cell maturation antigen), TACI (transmembrane activator and calcium modulator and cyclophylin ligand interactor, CD267) y BAFF-R (BAFF receptor). Estos receptores reconocen a 2 factores solubles pertenecientes a la familia del TNF, el BAFF o BLYS (B-cell activating factor, CD257) y el APRIL (a proliferation-inducing ligand, CD256)2. Los valores elevados de BAFF en humanos y en modelos experimentales correlacionan con el desarrollo de diversas enfermedades autoinmunes3,4. El belimumab es un AcM humano que reconoce y bloquea la acción de BAFF. El resultado de un ensayo en fase II con este compuesto en AR ha mostrado cierta eficacia clínica pero no comparable con la que produce el rituximab. Diversos ensayos en fase II que evalúan el efecto del atacicept, una proteína de fusión que contiene el dominio extracelular de TACI unido al fragmento Fc capaz de secuestrar BAFF y APRIL, actualmente están en fase de selección. La idea más aceptada es que estos compuestos no lograrán superar la eficacia del5 rituximab en la AR.
Fármacos anti-linfocitos TLos linfocitos T representan el 50% de las células presentes en la sinovial reumatoide, los linfocitos B y las células plasmáticas representan menos del 5% del total. Diversos datos clínicos y experimentales apoyan la relevancia de las células T en la patogenia de la AR. Hay un importante aumento de linfocitos T CD4+ de memoria en sangre periférica, membrana sinovial y líquido sinovial de los pacientes con AR. Los linfocitos T han mostrado un papel muy importante en experimentos de transferencia en modelos animales de AR y la eficacia en el control de signos y síntomas de la AR han demostrado que el bloqueo farmacológico de la coestimulación de los linfocitos T son hechos que posicionan a la célula T como esencial en la AR6,7.
La activación de los linfocitos T desencadena múltiples efectos como la proliferación de células sinoviales y endoteliales, el reclutamiento de otras células proinflamatorias presentes en la circulación sanguínea (monocitos, macrófagos y células B), la secreción de citocinas y proteasas desde macrófagos y células fibroblásticas, así como la producción de autoanticuerpos6. Para que un linfocito T se active es imprescindible que reciba 2 señales de origen extracelular, la primera es el reconocimiento por parte del TCR (T-cell receptor 'receptor de la célula T') del antígeno presentado por la célula presentadora de antígeno (CPA) en presencia del complejo mayor de histocompatibilidad, y la segunda, denominada señal coestimuladora, es generada por la interacción de moléculas accesorias presentes en la CPA con sus ligandos en el linfocito T. Entre estas señales coestimuladoras se encuentra la que es producida por la unión del CD28 del linfocito con el complejo CD80/CD86 de la CPA. De forma natural, la interacción entre CD28 y CD80/86 está regulada por la presencia de un receptor no señalizador denominado CTLA-4 que se expresa en los linfocitos T y que compite con el CD80/86 por unirse al CD28, lo que modula la intensidad de la activación de los linfocitos T.
El abatacept es una proteína soluble compuesta por la unión del dominio extracelular de CTLA-4 con el Fc de la inmunoglobulina G1 humana, que no induce fijación del complemento. Se une al CD80 y CD86 en la superficie de las CPA y actúa como un inhibidor competitivo de la interacción entre CD28 y CD80/86 y, por tanto, actúa como un inhibidor de la activación de las células T. El abatacept ha mostrado eficacia en el control de los signos, síntomas y daño estructural en los pacientes con AR en los que ha fracasado al menos un anti-TNF. Se ha desarrollado una segunda generación de este compuesto, denominada belatacept, que difiere del primero en 2 mutaciones de la molécula del CTLA-4 que lo hacen tener una mayor afinidad por el CD80. La utilidad clínica de este incremento en la afinidad por su ligando permanece aún sin demostrarse.
Pequeñas moléculas contra factores de transcripciónEl desarrollo de un tratamiento oral para la AR no está exento de retos. La eficacia y seguridad exhibida por los compuestos biológicos anti-TNF ha situado el listón muy alto para el tratamiento por vía oral. De hecho, durante los últimos 10 años el único compuesto oral que ha llegado al mercado para el tratamiento de la AR ha sido la leflunomida. El interés por el desarrollo de un tratamiento oral seguro y eficaz para la AR se hace evidente por el crecimiento de las líneas de desarrollo de muchas empresas farmacéuticas. Hay en desarrollo más de 30 pequeñas moléculas orales en fase I y otras 30 moléculas en fase II. Actualmente, no hay ningún compuesto sintético en ensayos en fase III para la AR.
El futuro a medio y largo plazo del tratamiento para los procesos articulares inflamatorios crónicos parece encaminado al desarrollo de moléculas pequeñas que actúen como inhibidores orales de la función celular. Las ventajas de estos compuestos residen en que son biodisponibles por vía oral, pueden ser sintetizados en un período relativamente corto de tiempo, su coste de producción es sensiblemente menor que los fármacos biológicos y pueden ser fácilmente seleccionados por su especificidad. Las principales dianas que se han elegido para estos compuestos en AR han sido proteínas implicadas en la señalización intracelular.
Los factores de transcripción son proteínas que se unen a secuencias específicas del ácido desoxirribonucleico (ADN) y controlan la transferencia de la información genética desde el ADN al ácido ribonucleico (ARN). Los factores de transcripción desarrollan esta función solos o en asociación con otras proteínas con las que forman un complejo que puede activar o inhibir la unión de la ARN polimerasa (enzima que transforma la información del ADN en ARN) a genes específicos8. Diversos factores de transcripción han sido implicados en la patogenia de la AR5. La p38 MAPK (mitogen-activated protein kinase) es una enzima que participa en una vía de señalización y que desempeña un papel importante en la respuesta inflamatoria inducida por las citocinas. Diversos inhibidores de la p38 han sido probados en la fase II en AR sin éxito debido fundamentalmente a su toxicidad. Actualmente, se están realizando ensayos clínicos con una nueva generación de inhibidores de la p38 con aparente selectividad para las células del sistema inmune. Con la especificidad como preocupación principal, el sistema JAK/STAT representa una diana alternativa a la p38. Este sistema transmite señales proinflamatorias desde la cadena γ común a muchas citocinas, como la IL-6, la IL-2, la IL-15, el interferón-γ o la IL-17, que han sido implicadas en la patogenia de la AR. La JAK-3, una isoforma de la JAK, está presente sólo en las células del sistema inmune. Un inhibidor selectivo de esta isoforma, CP-690 550, se ha probado en un ensayo de fase II de 6 semanas en pacientes con AR activa resistente a MTX y a anti-TNF, y se ha obtenido hasta la actualidad los mejores resultados de eficacia con una molécula pequeña en esta enfermedad (ACR70 del 28%). Actualmente, hay en desarrollo un ensayo de 6 meses con este producto. Otro factor de transcripción que ha sido objeto de inhibición con fines terapéuticos en AR es Syk. Esta tirosina cinasa intracelular es esencial para la señalización desde el BCR en células B o desde los receptores Fc. Además, Syk está constitutivamente expresado en sinoviocitos de tipo fibroblasto de los pacientes con AR, y su activación por IL-1b o TNF-α inicia la cascada de la MAPK. Recientemente se ha conocido el resultado de un ensayo en fase II con 189 pacientes de AR con R788, un inhibidor oral de Syk. A las 12 semanas se recogió una diferencia significativa dependiente de la dosis en el número de pacientes que alcanzaron el ACR20, ACR50 y ACR70 respecto al grupo control. Como efectos secundarios se reportaron neutropenias e incremento de enzimas hepáticas.
En conclusión, el techo terapéutico del 50% de remisiones demuestra que los compuestos actualmente disponibles no afectan a los principales mecanismos patogénicos implicados en la AR. Próximamente aparecerán compuestos biológicos anti-linfocitos B con eficacia probada en AR. El desarrollo clínico de moléculas pequeñas diseñadas contra dianas racionalmente elegidas y eficaces por vía oral es lo que marcará el futuro de la terapéutica de las enfermedades inflamatorias crónicas articulares.
Al Dr. Stephen Polmar y a la Dra. Indra Sethy Coraci por compartir sus impresiones de hacia dónde se encamina el tratamiento de la AR en el futuro próximo.