Elaborar una propuesta multidisciplinar de criterios de cribado de enfermedad pulmonar intersticial difusa (EPID) en pacientes con artritis reumatoide (AR) y, a la inversa, que sirvan de referencia en la derivación entre los servicios de Reumatología y Neumología para la detección precoz de estos pacientes.
MétodosSe revisó de forma sistemática la literatura sobre factores de riesgo para el desarrollo de EPID en la AR, la utilidad de los distintos métodos diagnósticos para su identificación en pacientes con AR y las diferentes propuestas de criterios de derivación a Reumatología por sospecha de AR precoz. Basándose en la evidencia disponible y en su experiencia clínica, un comité científico formado por dos reumatólogos y dos neumólogos propuso unos criterios de cribado que fueron evaluados mediante el método Delphi por un panel de siete neumólogos y siete reumatólogos. Todos los participantes eran expertos en esta patología.
ResultadosSe han elaborado unos criterios para el cribado de EPID en pacientes diagnosticados de AR, y unos criterios para la detección precoz de AR en casos de EPID de causa no filiada. Se incluyen también propuestas sobre las pruebas complementarias a realizar en los diferentes escenarios clínicos considerados y sobre la periodicidad con la que debe repetirse el cribado.
ConclusionesSe propone por primera vez una estrategia de cribado selectivo para el diagnóstico precoz de los pacientes con EPID-AR. Esta propuesta pretende resolver algunos interrogantes clínicos habituales y facilitar la toma de decisiones. Los criterios propuestos deben ser evaluados en futuros estudios de validación.
To develop a joint proposal for screening criteria of interstitial lung disease (ILD) in patients with rheumatoid arthritis (RA) and vice versa, which serves as a guidelines in patient referral between the Rheumatology and Pneumology departments to early detection of these patients.
MethodsA systematic literature review was carried out on the risk factors for the development of ILD in RA patients, and for the referral criteria to Rheumatology for suspected early RA. Based on the available evidence, screening criteria were agreed using the Delphi method by a panel of pneumologists and rheumatologists with expertise in these pathologies.
ResultsScreening criteria for ILD in patients with RA and for the early detection of RA in cases with ILD of unknown etiology have been developed. In both cases, a detection strategy was based on clinical risk factors. Recommendations also included the complementary tests to be carried out in the different clinical scenarios and on the periodicity that screening should be repeated.
ConclusionA selective screening strategy is recommended for the first time in the early diagnosis of patients with ILD-RA. This multidisciplinary proposal aims to solve some common clinical questions and help decision-making, although its usefulness to identify these patients with good sensitivity must be confirmed in a validation study.
La enfermedad pulmonar intersticial difusa (EPID) es una de las manifestaciones extraarticulares más frecuente y grave de la artritis reumatoide (AR)1-4. En más de las tres cuartas partes de los pacientes la EPID aparece con posterioridad al diagnóstico de AR, generalmente en los primeros 5 a 10años de evolución de la enfermedad1-7. En estos casos no es infrecuente que se diagnostique tardíamente, puesto que muchas veces es asintomática o paucisintomática en sus fases iniciales1-7. De hecho, cuando se ha hecho cribado o tamizado de EPID mediante tomografía computarizada (TC) de tórax a toda la población de AR, se ha detectado un porcentaje no despreciable de enfermedad subclínica (entre el 11,9 y el 55,7%), confirmando que esta complicación está infradiagnosticada8,9. Con menor frecuencia, la EPID se presenta en el debut de la AR o precede en meses o años a las manifestaciones articulares. En este último escenario, la EPID-AR se suele confundir con las formas idiopáticas, a pesar de su diferente pronóstico y tratamiento1-3,10,11.
Aunque se ha observado una mejoría significativa en su pronóstico12, la EPID sigue siendo la segunda causa de muerte prematura en la AR, por detrás de las complicaciones cardiovasculares1-4,10. A pesar de su frecuencia y de su gravedad, hasta el momento no existen recomendaciones sobre el cribado de esta complicación, ni en la evaluación inicial, ni en el seguimiento de los pacientes con AR.
Con base en lo anteriormente expuesto, y con el fin de dar respuesta a esta necesidad clínica, el objetivo del proyecto AR-EPIDSER fue el de elaborar una propuesta multidisciplinar de criterios de cribado que permitan la identificación precoz de los pacientes con EPID-AR.
Material y métodosSe ha realizado una revisión sistemática de la literatura y técnicas de consenso (método Delphi con un mínimo de dos rondas) que recogen el acuerdo de expertos en base a su experiencia clínica y a la evidencia científica.
Etapas del proyectoSelección de expertosEn primer lugar se constituyó el grupo de trabajo del proyecto AR-EPIDSER, integrado por un comité científico (CC) formado por dos reumatólogos (JN y SC) y dos neumólogos (MA y CV), y un panel de expertos formado por siete reumatólogos (GB, GC, IC, HC, MML, NMV y AO) y siete neumólogos (OA, ECJ, JMGR, BLM, ARP, JARP y CSA). Todos ellos fueron seleccionados en base a su experiencia en el área de interés y sus méritos científicos, buscando también la mayor representatividad geográfica: los reumatólogos fueron los candidatos que consiguieron mayor puntuación en una convocatoria pública de méritos entre los socios de la Sociedad Española de Reumatología (SER). Los neumólogos fueron seleccionados por el área de EPID de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR), de acuerdo con los siguientes criterios: pertenecer a una unidad de EPID acreditada por SEPAR y representar a los diferentes niveles de acreditación.
Revisión sistemática de la literaturaSe realizaron tres revisiones sistemáticas de la literatura: de los factores de riesgo para el desarrollo de EPID en la AR, de la utilidad de los distintos métodos diagnósticos para el cribado de EPID en AR, y de las diferentes propuestas de criterios de derivación a Reumatología por sospecha de AR precoz con estrategias de búsqueda bibliográfica sensibles (empleando términos libres y términos Mesh) en Medline, Embase y Cochrane Library.
La síntesis de la evidencia fue realizada por pares. Los revisores (IC, RDS, SGC, JM y LSF) fueron seleccionados conforme a su formación en medicina basada en la evidencia y a su experiencia previa en la elaboración de revisiones sistemáticas; contaron además con el apoyo de la Unidad de Investigación (UI) de la SER.
La metodología empleada se recoge en el Anexo A del material suplementario. Las preguntas de investigación en formato PICO y las estrategias de búsqueda fueron definidas por el CC, miembros de la UI-SER, y los revisores encargados de la síntesis de la evidencia.
Propuesta de criterios de cribadoBasándose en la evidencia encontrada y en su experiencia clínica, los miembros del CC consensuaron, con el apoyo de un metodólogo de la UI (DS), dos propuestas de cribado selectivo: unos criterios para el cribado de EPID en pacientes diagnosticados de AR, y unos criterios para la detección precoz de AR en pacientes con EPID de causa no filiada o no identificada. Se incluyeron también propuestas sobre las pruebas complementarias a realizar en los diferentes escenarios clínicos considerados y la periodicidad con la que debería repetirse el cribado.
Estas propuestas fueron sometidas a la valoración de los miembros del panel de expertos mediante la realización de un Delphi a dos rondas en formato electrónico en la que puntuaron su grado de acuerdo con cada uno de los ítems según la siguiente escala: 1=absolutamente en desacuerdo; 2=moderadamente en desacuerdo; 3=ni de acuerdo ni en desacuerdo; 4=moderadamente de acuerdo, y 5=absolutamente de acuerdo. Además de valorar las propuestas, los panelistas también podían realizar sugerencias de modificación o proponer criterios adicionales en un campo de texto libre.
Se definió el grado de acuerdo para cada ítem como el porcentaje de panelistas que otorgaron una puntuación ≥4, y el grado de desacuerdo como el porcentaje de puntuaciones ≤2. Se estableció que existía consenso en aquellos casos con puntuaciones ≥4 por al menos el 75% de los panelistas.
El CC valoró los criterios para los que no hubo consenso en la primera ronda Delphi, así como las propuestas de criterios adicionales. Con ello se elaboró una segunda versión del documento que incorporó, en cada ítem a valorar, parámetros de resumen de la respuesta del grupo y los comentarios realizados en la primera ronda. Esta nueva versión se envió a los panelistas para que pudiesen contrastar su valoración inicial con la del grupo y los puntuasen nuevamente, empleando la misma escala que en la primera ronda.
Durante todo el proceso se mantuvo el anonimato de los miembros del panel de expertos. Todos ellos completaron las sucesivas rondas del método Delphi, realizadas entre julio y octubre de 2020.
ResultadosPropuesta de criterios de cribado de EPID en pacientes diagnosticados de ARLos principales factores de riesgo para el desarrollo de EPID en la AR identificados en la revisión sistemática de la literatura se muestran en la tabla 1. Basándose en la evidencia encontrada y en su experiencia clínica, los miembros del CC decidieron proponer el cribado de EPID en tres escenarios diferentes:
- 1.
Pacientes con clínica respiratoria (tos y/o disnea) de más de 3meses de evolución.
- 2.
Pacientes en los que se detecten crepitantes tipo velcro en la auscultación respiratoria, aunque estén asintomáticos.
- 3.
En los pacientes sin clínica respiratoria y con auscultación respiratoria normal, el cribado se hará de acuerdo con la puntuación obtenida en función del número de factores de riesgo presentes para el desarrollo de esta complicación.
Principales factores del riesgo para el desarrollo de enfermedad pulmonar intersticial difusa en la artritis reumatoide
| Factores de riesgo | Nivel de evidencia |
|---|---|
| Sexo masculino15,16 | 2+ |
| La edad avanzada y el inicio tardío de la enfermedad15,17-20 | 2++ |
| Duración de la artritis reumatoidea,15,18,21 | 2+ |
| Tabaquismo17,18,20,22 | 2++ |
| Actividad moderada o alta mantenida de la AR de acuerdo con las puntuaciones del DAS2823 | 2++ |
| Factor reumatoide positivo15,18,24 | 2++ |
| Anticuerpos anti-péptido cíclico citrulinado positivos (ACPA), sobre todo a títulos elevados15,18,24-26 | 1+ |
| Biomarcadores en evaluación | |
| Anticuerpos dirigidos contra proteínas carbamiladas (anti-CarP)27 | 3 |
| Metaloproteinasas de la matriz extracelular 7 (MMP-7)28-30, proteína-10 inducida por interferón gamma [IP-10] o CXCL1028, interleucina 1829, proteínas de shock térmico de 90 y 70 KDa (HSP90/70)31 | 2− |
| Biomarcadores genéticos | |
| Mutaciones del gen MUC5B32 | 2+ |
| Mutaciones de los genes de la telomerasa que condicionan un acortamiento acelerado de los telómeros33,34 | 2+ |
AR: artritis reumatoide; DAS28: Disease activity score-28; MUC5B: mucina 5B.
En este último escenario, en la propuesta inicial del CC se incluyeron los siguientes factores de riesgo (véase Anexo B del material suplementario): edad avanzada (con 2 puntos de corte distintos: ≥55años o ≥60años), sexo masculino, historia de tabaquismo, duración de la enfermedad >5años, actividad moderada o alta mantenida de la AR, y positividad y título del factor reumatoide (FR) y/o de los anticuerpos anti-péptido cíclico citrulinado (ACPA). A cada uno de estos factores se les otorgó una puntuación, considerándose susceptible de cribado a todo paciente con una puntuación total ≥4 puntos. La contribución relativa o peso de cada una de las variables incluidas y el punto de corte óptimo que, aplicado a estos pacientes, permita identificar a aquellos con alta probabilidad de desarrollar una EPID, se estableció en base a la evidencia disponible y el juicio clínico de los miembros del CC.
Los resultados de la valoración de las rondas Delphi se muestran también en el Anexo 2. En la primera ronda se consiguió el consenso para realizar el cribado en los tres escenarios propuestos.
Sin embargo, en la propuesta para el cribado en pacientes asintomáticos con auscultación normal hubo discrepancias en el punto de corte y en la puntuación otorgada a la edad, en la forma de cuantificar el consumo acumulado de tabaco, en si mantener o no la duración de la enfermedad con un punto de corte >5años y en fijar el umbral para la puntuación total en 4 puntos. Aunque sí hubo acuerdo en la puntuación asignada al sexo masculino, tras la valoración por el CC de los comentarios hechos por algunos de los panelistas, se decidió incluirlo también en la segunda ronda.
Además de proponer alternativas para intentar conseguir el consenso en estos 4 ítems en la segunda ronda Delphi, el CC incluyó también los antecedentes familiares de EPID dentro de los factores de riesgo a considerar, a sugerencia de los panelistas.
Tras la segunda ronda tampoco se alcanzó el consenso en estos ítems, salvo en aceptar la duración de la enfermedad >5años (véase Anexo B) y en fijar el umbral para la puntuación total en 5 puntos. Aunque no estaba inicialmente previsto, se decidió reevaluar el resto de los factores en una tercera ronda Delphi, sin que se lograse alcanzar el consenso, salvo para la inclusión de los antecedentes familiares de EPID. Finalmente, el CC optó por incluir en la versión final de la propuesta la opción con mayor grado de acuerdo. Esta versión final se muestra en la tabla 2.
Propuesta de criterios de cribado de enfermedad pulmonar intersticial difusa en pacientes diagnosticados de artritis reumatoide
| Se realizará el cribado de EPID en estas tres situaciones clínicas | Grado de acuerdoa |
|---|---|
| 1. Pacientes con clínica respiratoria (tos y/o disnea) de más de 3 meses de evolución | 100% (1.ª ronda Delphi) |
| 2. Pacientes en los que se detecten crepitantes tipo velcro en la auscultación respiratoria, aunque estén asintomáticos | 100% (1.ª ronda Delphi) |
| 3. En los pacientes sin clínica respiratoria y con auscultación respiratoria normal, el cribado se hará de acuerdo con la puntuación obtenida en función del número de factores de riesgo presentes para el desarrollo de esta complicación | 78,6% (2ª ronda Delphi) |
| Se considerará susceptible de cribado todo paciente que sume ≥ 5 puntos |
| Conjunto de variables y propuesta de puntuación de cada una de las variables para el cómputo global | Puntuación |
|---|---|
| Edad ≥ 60 años | 2b |
| Sexo varón | 1b |
| Historia de tabaquismo (fumador activo o exfumador)≤ 20 paquetes/año: 2 puntos>20 paquetes/año: 3 puntos | 2b3b |
| Duración de la enfermedad > 5 años | 1c |
| Actividad moderada-alta de forma persistente: DAS28-VSG promedio > 3,2 desde el diagnóstico de la enfermedad en AR de inicio (tiempo desde el diagnóstico ≤ 12 meses) o DAS28-VSG > 3,2 durante un mínimo de 6 meses en AR establecida | 1c |
| Serología (solo se cuenta el criterio de mayor ponderación para la puntuación total)FR positivo> 3 veces por encima del LSNACPA positivo ≤ 3 veces del LSNACPA positivo > 3 veces del LSN | 1c2c3c |
| Historia familiar de EPID | 1c |
| Cómo hacer el cribado | |
|---|---|
| En los pacientes con tos y/o disnea de más de 3 meses de evolución se realizará inicialmente Rx de tórax y PFR que incluyan espirometría y DLCO. En función del resultado, se valorará realizar TCAR* | 71,4% (3ª ronda Delphi; no consenso) |
| En los pacientes con crepitantes tipo velcro en la auscultación respiratoria se realizará directamente una TCAR | 100% (1.ª ronda Delphi) |
| En los pacientes sin clínica respiratoria y con auscultación respiratoria normal, cuando la puntuación obtenida en función de los factores de riesgo es 5-6, se realizará inicialmente una Rx de tórax y PFR que incluyan espirometría y DLCO. En función del resultado, se valorará realizar TCAR* | 78,6% (2ª ronda Delphi) |
| Si la puntuación es ≥ 7, realizar directamente una TCAR | 85,7% (2ª ronda Delphi) |
| * Si no disponibilidad o lista de espera excesiva en las PFR, valorar realizar directamente TCAR para agilizar el diagnóstico. El realizar directamente una TCAR, no excluye que se hagan también PFR para evaluar la gravedad de la EPID | 71,4% (3.ª ronda Delphi) |
Para el punto de corte y la puntuación de la edad, la puntuación asignada al sexo masculino y la forma de valorar la historia de tabaquismo fue necesaria una tercera ronda, no consiguiéndose el consenso: grado de acuerdo del 71,4% en el caso del sexo y el tabaquismo. Para la edad, fue del 85,7% para el punto de corte de 60 años y del 57,1% para la puntuación asignada
De acuerdo con los tres escenarios propuestos, el CC planteó propuestas específicas para cada uno de ellos que se detallan en la tabla 2.
En el escenario uno (pacientes con tos y/o disnea de más de 3meses de evolución) no se consiguió alcanzar el consenso, siendo el grado de acuerdo tras tres rondas Delphi del 71,4%. El principal comentario de los panelistas que estuvieron en desacuerdo con la propuesta del CC fue que la prueba de cribado debía ser directamente una TC de tórax de alta resolución (TCAR).
En caso de no disponibilidad o lista de espera excesiva para la realización de las pruebas funcionales respiratorias (PFR), se deja abierta la posibilidad de realizar directamente una TCAR para agilizar el diagnóstico. El hecho de realizar directamente una TCAR no excluye que se hagan también PFR para evaluar la gravedad de la EPID.
Propuesta de criterios para el cribado de AR en pacientes diagnosticados de EPID de causa no filiadaBasándose en la evidencia encontrada y en su experiencia clínica, los miembros del CC decidieron en su versión inicial proponer la derivación a Reumatología para investigar la presencia de AR a aquellos pacientes con EPID de causa no filiada que presenten uno o más de los siguientes criterios:
- 1.
Positividad de los ACPA.
- 2.
Positividad del FR:
- -
A cualquier título en menores de 65años.
- -
En mayores de 65años se propusieron 2 puntos de corte para valoración por los panelistas: títulos ≥2 o ≥3 veces por encima del límite superior de la normalidad (LSN).
- 3.
La presencia durante al menos 4 semanas de una o más de las siguientes manifestaciones articulares:
- -
Dolor en articulaciones metacarpofalángicas o metatarsofalángicas, objetivable mediante la prueba de compresión lateral de las mismas o test de Squeeze.
- -
Rigidez articular matutina de más de 30min de duración.
- -
Tumefacción articular en ≥2 o en ≥3 articulaciones (se propusieron estas dos opciones para que fueran valoradas por los panelistas).
Tras la primera ronda Delphi se logró el consenso en todos los criterios, excepto en el referido al FR (véase Anexo B). Respecto a la tumefacción articular, de las dos opciones valoradas, solo la tumefacción en dos o más articulaciones alcanzó el consenso.
De las diferentes alternativas que se propusieron para el criterio referido al FR, la única que consiguió el consenso tras la segunda ronda Delphi fue la positividad del FR a títulos ≥2 al LSN, con independencia de la edad del paciente (Anexo B). La versión final de los criterios se muestra en la tabla 3.
Propuesta de criterios para el cribado de artritis reumatoide en pacientes diagnosticados de enfermedad pulmonar intersticial difusa de causa no filiada
| Se derivará a Reumatología a los pacientes con EPID de etiología no identificada cuando presenten uno o más de los siguientes criterios | |
|---|---|
| Grado de acuerdoa | |
| Anticuerpos anti-péptido cíclico citrulinado positivos | 100% (1.ª ronda Delphi) |
| Factor reumatoide positivo a títulos ≥ 2 del LSN | 92,9% (2.ª ronda Delphi) |
| La presencia durante al menos 4 semanas de una o más de las siguientes manifestaciones articulares: | 92,9% (1.ª ronda Delphi) |
| Dolor en articulaciones metacarpofalángicas o metatarsofalángicas, objetivable mediante la prueba de compresión lateral de las mismas o test de Squeeze | 85,7% (1.ª ronda Delphi) |
| Rigidez articular matutina de más de 30 minutos de duración | 92,9% (1.ª ronda Delphi) |
| Tumefacción articular en ≥ 2 articulaciones | 78,6% (1.ª ronda Delphi) |
EPID: enfermedad pulmonar intersticial difusa; LSN: límite superior de la normalidad.
Las propuestas sobre la periodicidad del cribado de EPID en pacientes con AR se muestran en la tabla 4, mientras que las referidas a la periodicidad del cribado de AR en pacientes diagnosticados de EPID de causa no filiada se recogen en la tabla 5.
Periodicidad del cribado de enfermedad pulmonar intersticial difusa en pacientes con artritis reumatoide
| Periodicidad del cribado | |
|---|---|
| Grado de acuerdoa | |
| En el seguimiento de los pacientes con AR, se los auscultará como mínimo una vez al año, además de interrogarles específicamente acerca de la presencia de síntomas respiratorios y evaluar la presencia de factores de riesgo para el desarrollo de EPID de acuerdo con el sistema de puntuación anteriormente expuesto | 92,9% (1.ª ronda Delphi) |
| Si se detectan crepitantes tipo velcro o aparecen síntomas respiratorios (tos y/o disnea de más de 3 meses de evolución) durante el seguimiento, se repetirán las pruebas de cribado de acuerdo con las recomendaciones previas, con independencia de que hayan sido negativas con anterioridad | 100% (1.ª ronda Delphi) |
| En los pacientes asintomáticos con auscultación respiratoria normal que presenten una puntuación total ≥ 5 y resultado negativo en las pruebas de cribado, este se repetirá una vez al año realizando espirometría y DLCO | 85,7% (1.ª ronda Delphi) |
AR: artritis reumatoide; DLCO: capacidad de difusión pulmonar del monóxido de carbono; EPID: enfermedad pulmonar intersticial difusa.
Periodicidad del cribado de artritis reumatoide en pacientes diagnosticados de enfermedad pulmonar intersticial difusa de causa no filiada
| Periodicidad del cribado | |
|---|---|
| Grado de acuerdoa | |
| En el seguimiento de estos pacientes se interrogará específicamente acerca de la presencia de síntomas articulares y se realizará una exploración del aparato locomotor cada 6 meses durante los dos primeros años desde el diagnóstico de la EPID, y posteriormente de forma anual | 92,9% (1.ª ronda Delphi) |
| Se repetirá anualmente la determinación del FR y de los ACPA durante los primeros 5 años desde el diagnóstico de la EPID. Posteriormente, se repetirán a criterio médico según la evolución del paciente | 78,6% (1.ª ronda Delphi) |
ACPA: anticuerpos anti-péptido cíclico citrulinado; EPID: enfermedad pulmonar intersticial difusa; FR: factor reumatoide.
La EPID es una de las manifestaciones extraarticulares más frecuente y grave de la AR, siendo en la actualidad la segunda causa de muerte prematura por esta enfermedad. La supervivencia media desde el diagnóstico de la EPID varía entre 2,6 y 8,1años13.
Sin embargo, a diferencia de lo que sucede con la esclerosis sistémica, en la que la EPID es también la primera o segunda causa de fallecimiento14, en la AR no existen recomendaciones para el cribado de esta complicación, a pesar de estar infradiagnosticada8,9 y de que muchas veces pasa desapercibida hasta estadios avanzados, cuando la extensión de los cambios fibróticos limita las posibilidades terapéuticas y la supervivencia (destacar que en la AR la neumonía intersticial usual es el patrón histopatológico más frecuente).
Para intentar revertir esta situación y mejorar el pronóstico y la calidad de vida de los pacientes con EPID-AR, la SER promovió el estudio AR-EPIDSER, en el que se constituyó un grupo de expertos reumatólogos y neumólogos para elaborar de forma conjunta unos criterios para la identificación precoz de los pacientes con EPID-AR que sirvan de referencia para la derivación de estos enfermos entre los servicios de Reumatología y Neumología. Esta propuesta multidisciplinar pretende resolver algunos interrogantes clínicos habituales y facilitar la toma de decisiones en diferentes escenarios clínicos. En ausencia de evidencia que apoye el coste-efectividad del cribado universal, se ha optado por realizar propuestas de cribado selectivo en función del riesgo clínico de los pacientes.
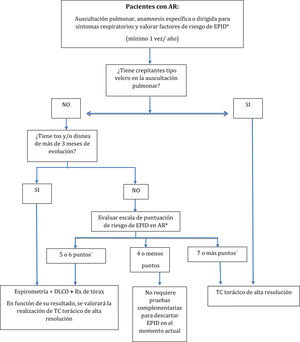
Respecto a los criterios sobre cuándo investigar la presencia de EPID en pacientes diagnosticados de AR, se ha conseguido el consenso deseado en la mayoría de las situaciones planteadas, proponiéndose un algoritmo de cribado de utilidad en la práctica clínica (fig. 1). Como limitación, en las referidas al cribado en pacientes asintomáticos y con auscultación normal no se consiguió el consenso en algunos de los ítems incluidos en el sistema de puntuación, concretamente en el punto de corte y puntuación otorgada a la edad, en la puntuación asignada al sexo masculino, y en la forma de cuantificar el consumo acumulado de tabaco. Tampoco se alcanzó el consenso acerca de cómo hacer el cribado en pacientes con clínica respiratoria de más de 3meses de evolución. En estos casos, el CC optó por incluir en la versión final de la propuesta la opción con mayor grado de acuerdo, que para la mayoría de estos criterios se situó en el 71,4%, es decir, muy próximo al consenso. Con respecto al punto de corte de la edad, se seleccionó finalmente el de 60años, que, además de ser el más votado, también es un factor pronóstico asociado con una mayor mortalidad13-35.
Propuesta de algoritmo de cribado de enfermedad pulmonar intersticial difusa (EPID) en pacientes diagnosticados de artritis reumatoide (AR).
* Consultar factores de riesgo y su puntuación en la tabla 2.
Para evitar que esta propuesta pueda quedar rápidamente obsoleta, el CC valoró la opción de incorporar los nuevos biomarcadores en investigación en el sistema de puntuación27-31, fundamentalmente los anticuerpos contra proteínas carbamiladas (Ac anti-CarP). Se ha demostrado que existe una correlación entre los niveles de todas las especificidades de anti-CarP (suero fetal bobino, fibrinógeno y péptido homocitrulinado fibrina quimérica/filagrina) y la presencia de EPID, tras ajustar por otros factores de riesgo conocidos27. También se han obtenido resultados preliminares prometedores con los niveles séricos de las metaloproteinasas de la matriz extracelular7 (MMP-7), proteína-10 inducida por interferón gamma (IP-10) o CXCL10, interleucina18 y proteínas de shock térmico de 90 y 70KDa (HSP90/70)27-31. Finalmente, se decidió no incluirlos puesto que no están aún disponibles en la práctica clínica y tampoco han demostrado de momento tener mayor valor predictivo para el desarrollo de esta complicación que los ACPA. Tampoco están aún disponibles en la práctica asistencial los biomarcadores genéticos, incluyendo las mutaciones del gen MUC5B32 y las mutaciones de los genes de la telomerasa que condicionan un acortamiento acelerado de los telómeros33,34. A pesar de ello, y como modo indirecto de reconocer su utilidad futura y la importancia que tiene la predisposición genética en el desarrollo de EPID en un subgrupo de pacientes, se acordó incluir en el algoritmo los antecedentes familiares de EPID como un factor de riesgo a tener en cuenta.
Un mensaje importante que los autores de ambas especialidades queremos destacar en esta propuesta es la utilidad y la importancia de la auscultación respiratoria en la consulta de Reumatología para el cribado de EPID. La presencia de crepitantes tipo velcro se correlaciona bien con la presencia de fibrosis pulmonar36-38. Además, dos estudios han puesto de relieve que la auscultación respiratoria convencional tiene una precisión diagnóstica aceptable para la detección de EPID cuando se compara con la obtenida con un estetoscopio electrónico digital36,37.
Dentro de las pruebas a utilizar para realizar el cribado de EPID, el comité científico ha decidido no incluir de momento a la ecografía pulmonar, al considerar que es una técnica que aún no está lo suficientemente validada para el diagnóstico de esta complicación. En una revisión sistemática reciente realizada por el grupo Outcome Measures in Rheumatoid Arthritis Clinical Trials (OMERACT) se confirma su buena validez aparente y de contenido, así como su factibilidad, pero no tiene de momento validez de criterio, fiabilidad ni, sobre todo, sensibilidad al cambio39. Dentro de las limitaciones aún por solventar se incluyen la falta de una definición clara de normalidad, la ausencia de definiciones consensuadas de las lesiones evaluadas, y la falta de estandarización de la técnica, de la adquisición de imágenes y del número de áreas a explorar (que en los estudios varía de 10 a 72). Tampoco existe consenso en la cuantificación de la neumopatía, en el sistema de evaluación (score), ni en cuál debe ser la sonda óptima a utilizar (3-3,5 a 5 o 7,5MHz). Así mismo, faltan estudios con seguimiento longitudinal y estudios que evalúen su capacidad para el diagnóstico de la EPID en fases iniciales (EPID subclínica)39.
Otro escenario clínico importante que tiene en cuenta estas recomendaciones y del que se quiere concienciar a los neumólogos es el debut pulmonar de la AR. Como ya se ha comentado, en el 10-14% de los casos de AR-EPID la afección pulmonar precede en meses o años a las manifestaciones articulares1-3,10,11. En estos casos, la derivación precoz al reumatólogo por parte del neumólogo permitirá no demorar el diagnóstico e instaurar un tratamiento inductor de remisión tan pronto como se establezca el diagnóstico clínico de la enfermedad aprovechando así el llamado «periodo ventana de oportunidad terapéutica», entendido como un período de tiempo muy al inicio de la enfermedad en el que, con una adecuada intervención, podemos modificar el curso de la enfermedad consiguiendo evitar el daño articular y las complicaciones asociadas.
Para ello, la evaluación inicial de todo paciente con EPID debe incluir una historia clínica detallada y una exploración física exhaustiva que investigue la presencia de manifestaciones extrapulmonares, junto con un estudio analítico que incluya como mínimo la velocidad de sedimentación globular (VSG), la proteínaC reactiva y la determinación del FR, ACPA, anticuerpos antinucleares y perfil de anticuerpos específicos en miositis autoinmunes, tal y como recomiendan la sociedades europea y americana de Neumología40. Incluimos además en nuestra propuesta el cribado de AR en el seguimiento de los pacientes con EPID de etiología no filiada, con la periodicidad descrita en el presente trabajo.
En este escenario clínico, el valor predictivo de los ACPA parece ser superior al del FR41-44. El FR positivo no es patognomónico de la AR, habiéndose descrito en el 5-10% de la población sana, sobre todo en pacientes ancianos, aunque generalmente a títulos bajos. De ahí que en la propuesta se haya decidido tener en cuenta solo los títulos de FR ≥2 al LSN. Las manifestaciones articulares incluidas, a partir de las cuales sospechar una artritis precoz, son fácilmente identificables por un médico no reumatólogo. Su validez ha sido contrastada en estudios poblacionales, incluyendo uno realizado en nuestro país45,46.
El número de expertos participantes en el Delphi está dentro del rango aceptado como válido y todos ellos han completado su participación durante las sucesivas rondas. El umbral establecido en el 75% para definir consenso y el número de rondas del Delphi se encuentran también dentro de los parámetros considerados adecuados47,48. A pesar de haber seguido una rigurosa metodología, esta propuesta tiene varias limitaciones. La principal, además de la ya mencionada falta de consenso para algunos de los criterios, es que esta propuesta es solo un consenso de expertos, cuya utilidad aún no ha sido contrastada en estudios de validación. Además, dado que el panel es solo nacional, estos criterios podrían no ser extrapolables a otros sistemas sanitarios.
ConclusionesLa evidencia actual justifica la necesidad de una estrategia común entre reumatólogos y neumólogos para mejorar el diagnóstico precoz de los pacientes con AR-EPID, dadas sus implicaciones pronósticas y terapéuticas. Con el fin de dar respuesta a esta necesidad, un grupo multidisciplinar de reumatólogos y neumólogos han elaborado por primera vez una propuesta consensuada de criterios de cribado selectivo como instrumento de ayuda en la toma de decisiones clínicas. Su utilidad para identificar a estos pacientes en la práctica clínica deberá ser confirmada en futuros estudios de validación.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
AutoríaTodos los autores han hecho contribuciones sustanciales en: a)la concepción y el diseño del estudio y el análisis de los datos; b)el borrador del artículo o la revisión crítica del contenido intelectual, y c)la aprobación definitiva de la versión que se presenta.
FinanciaciónEste proyecto ha sido financiado por el laboratorio Bristol Myers Squibb, que no ha intervenido en el diseño del estudio, en su desarrollo, ni en la redacción de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses en la realización de este manuscrito.