La artritis reumatoide (AR) es una enfermedad autoinmune sistémica con manifestaciones articulares y extraarticulares. La mortalidad en la AR está determinada por el incremento de riesgo de eventos cardiovasculares hasta en un 48% (RR: 1,48; IC 95%: 1,36-1,62), con aumento de la tasa de mortalidad estandarizada (TME) por causas cardiovasculares comparada con la población general. Nuestro objetivo general fue examinar el efecto de las variables clínicas y serológicas sobre el riesgo de eventos cardiovasculares mayores (ECM) en una cohorte de pacientes con AR.
Materiales y métodosEstudio de cohorte retrospectivo. Se incluyeron pacientes mayores de 18 años, con seguimiento activo en los modelos de atención para los pacientes con AR del Hospital Universitario Clínica San Rafael y Clínica Nogales, los pacientes con evento cardiovascular mayor previos al diagnóstico de AR y con síndromes de poli autoinmunidad fueron excluidos. Se realizó análisis de supervivencia para evaluar la probabilidad libre de ECM, análisis de riesgos proporcionales Cox y modelamiento de ecuaciones estructurales a partir de un análisis PATH para evaluar efectos directos e indirectos.
ResultadosCuatrocientos seis pacientes fueron incluidos, 342 (84%) mujeres, media de edad 44,8±13,1 años, tiempo de evolución de la enfermedad de 13±13,4 meses, promedio de la calificación de DAS28 2,5±1,78, el 48,7% enfermedad activa con DAS28>2,6. Desenlace de ECM se presentó en 19 pacientes con una incidencia acumulada (IA) del 4,68% (4,4% IAM y 1,4% ACV). Los factores de riesgo más frecuentes fueron hipertensión arterial (23,7%) y tabaquismo (24,8%). En el análisis bivariado, se encontró que la insuficiencia cardiaca (RR: 1,58; IC 95%: 1,12-2,23; p=0,01), la edad al diagnóstico (54,8 versus 44,3; p<0,01) y la hipertensión arterial (RR: 2,36; IC 95%: 1,22-4,60; p<0,01) se asociaron significativamente con ECM. La probabilidad de supervivencia libre de ECM del 50% fue a 6 meses desde el diagnóstico, en el modelo Cox solo las variables hipertensión y edad al diagnóstico fueron significativamente asociados a este desenlace. En el análisis PATH, la dislipidemia fue asociada significativamente a infarto agudo de miocardio sin efecto mediador de los glucocorticoides (coef: 1,83; p<0,001).
ConclusiónLos factores de riesgo tradicionales incrementan el riesgo de ECM en los pacientes con AR, así mismo la dislipidemia se comporta como un factor de riesgo independiente sin mediación de otras variables, lo que constituye un objetivo terapéutico para la prevención de estos desenlaces.
Rheumatoid arthritis (RA) is a systemic autoimmune disease with articular and extra-articular manifestations. Mortality in RA is influenced by an increased risk of cardiovascular events by up to 48% (RR: 1.48; 95% CI: 1.3-1.62), with a higher standardized mortality rate (SMR) due to cardiovascular causes compared to the general population. Our main objective was to examine the effect of clinical and serological variables on the risk of major cardiovascular events (MCE) in a cohort of RA patients.
Materials and methodsThis was a retrospective cohort study. Patients more tha 18 years old and active follow-up in the RA care models of Hospital Universitario Clínica San Rafael and Clínica Nogales were included. Patients with prior major cardiovascular events or polyautoimmunity syndromes before the RA diagnosis were excluded. Survival analysis was performed to evaluate the probability of remaining free of MCEs, along with Cox proportional hazards analysis and structural equation modeling using a PATH analysis to assess direct and indirect effects.
ResultsA total of 406 patients were included, 342 (84%) of whom were women, with a mean age of 44.8±13.1 years and a disease duration of 13±13.4 months. The average DAS28 activity score was 2.5±1.78, with 48.7% having active disease (DAS28>2.6). Nineteen patients experienced MCEs, resulting in a cumulative incidence (CI) of 4.68% (4.4% myocardial infarction and 1.4% stroke). The most frequent risk factors were hypertension (23.7%) and smoking (24.8%). Bivariate analysis showed that heart failure (RR: 1.58; 95% CI: 1.12-2.23; P=.01), and hypertension (RR: 2.36; 95% CI: 1.22-4.60; P<.01) were significantly associated with MCEs. The probability of MCE-free survival at six months post-diagnosis was 50%. In the Cox model, only hypertension and age at diagnosis were significantly associated with MCE outcomes. In the PATH analysis, dyslipidemia was significantly associated with myocardial infarction without a mediating effect from corticosteroids (coef: 1.83; P<.001).
ConclusionTraditional risk factors increase the risk of MCEs in RA patients. Additionally, dyslipidemia acts as an independent risk factor without mediation by other variables, making it a therapeutic target for preventing these outcomes.
la artritis reumatoide (AR) es una enfermedad autoinmune sistémica con manifestaciones articulares y extraarticulares, que se presenta a nivel global con una prevalencia aproximada del 0,46%1, y en Latinoamérica en un rango del 0,25-0,36% para la región central y andina, respectivamente2. La mortalidad en AR está determinada por el incremento de riesgo de eventos cardiovasculares hasta en un 48% (RR: 1,48; IC 95%: 1,36-1,62), además de un incremento en la tasa de mortalidad estandarizada (TME) por causas cardiovasculares comparada con la población general3.
Este incremento de riesgo puede estar influenciado por factores de riesgo tradicionales como la hipertensión, el tabaquismo, la obesidad y la diabetes, factores que pueden estar presentes con mayor frecuencia en los pacientes con AR4, aunque estos no logran explicar totalmente el incremento del riesgo cardiovascular en la AR; sin embargo algunos marcadores serológicos relacionados con la respuesta inflamatoria en la AR tienen correlación lineal significativa con marcadores de riesgo cardiovascular como el índice de engrosamiento íntima/media de las arterias carótidas5, lo que sugiere un rol de la respuesta inflamatoria sobre la disfunción endotelial y mayor predisposición a eventos cardiovasculares en este grupo poblacional, por efecto de factores de riesgo no tradicionales atribuibles a la enfermedad.
La inflamación crónica no solo favorece la formación de placas ateroescleróticas, sino que también aumenta su riesgo de rotura. Existen mecanismos implicados a nivel celular, relacionados con la expresión de citoquinas proinflamatorias, como la IL-18 e IL-33, el aumento del estrés oxidativo y la activación de NADPH oxidasas, lo que conlleva una mayor peroxidación de lípidos y disfunción6.
Los factores de riesgo tradicionales y no tradicionales relacionados con marcadores inflamatorios de la AR, contribuyen al incremento de riesgo de eventos cardiovasculares mayores (ECM) como infarto agudo de miocardio (IAM) y accidente cerebrovascular (ACV), aumentando la predicción del riesgo de forma proporcional entre más factores estén presentes, de este modo los pacientes con 3 o más factores de riesgo incrementan la incidencia de ECM a 7,49 por cada 1.000 pacientes/año7.
El uso de terapias inmunosupresoras también pueden modificar estos factores de riesgo, ya que algunas pueden elevar transitoriamente los niveles de lípidos y, por ende incrementar el riesgo de ECM, no obstante al explorar estas variables mediante un análisis de mediación por modelamiento de ecuaciones estructurales (SEM), se observó un efecto directo de la proteína C reactiva (PCR) sobre los niveles de colesterol de baja densidad (LDL), este incremento fue independiente de la respuesta al tratamiento en el análisis de mediación8.
Teniendo en cuenta el mayor riesgo de ECM en la AR y su relación con múltiples factores de riesgo subrogados a la AR que aumentan la predicción de eventos cardiovasculares en los modelos con factores tradicionales, nuestro objetivo general fue examinar el efecto de las variables clínicas y serológicas sobre el riesgo de ECM en una cohorte de pacientes con AR, así mismo, describir la probabilidad de supervivencia libre de ECM y analizar los factores asociados con una menor supervivencia libre de ECM mediante un análisis de riesgos proporcionales. Finalmente, evaluar un modelo de SEM para medir las relaciones directas e indirectas entre los factores de riesgo tradicionales y no tradicionales para el desarrollo de ECM a partir de un análisis PATH.
Materiales y métodosSe realizó un estudio de cohorte retrospectiva utilizando registros clínicos de 2 centros hospitalarios de la ciudad de Bogotá D.C. (Colombia). La información fue recolectada a partir de las historias clínicas de los pacientes con diagnóstico confirmado de AR, de acuerdo con los criterios de clasificación del American College of Rheumatology (ACR) 19879, La cohorte está compuesta por pacientes que iniciaron seguimiento clínico en los servicios de reumatología entre 2019 y 2024; y el análisis se realizó de manera retrospectiva sobre datos previamente registrados, sin intervención ni seguimiento prospectivo. Se identificaron las fechas de diagnóstico de AR y se hizo seguimiento retrospectivo en los registros hasta la ocurrencia del primer ECM o hasta junio de 2024, en los casos sin ECM. La cohorte es de tipo cerrada, y no se incorporaron nuevos pacientes después del corte de inclusión.
El ECM (variable desenlace) se definió de acuerdo con la presentación de IAM según la cuarta definición: Presencia de lesión miocárdica aguda detectada por biomarcadores cardíacos anormales en el contexto de evidencia de isquemia miocárdica aguda10. La presencia de un ACV que se definió de acuerdo con la American Heart Association (AHA) como un episodio agudo de disfunción neurológica focal que persiste durante más de 24 h causado por la obstrucción o ruptura de un vaso sanguíneo con consecuente restricción de la perfusión cerebral11. Las variables independientes (predictoras) incluyeron factores de riesgo tradicionales como diabetes mellitus (DM), edad, tabaquismo, dislipidemia e hipertensión arterial (HTA).
Se incluyeron a los pacientes mayores de 18 años, con seguimiento activo en los modelos de atención para los pacientes con AR del Hospital Universitario Clínica San Rafael y Clínica Nogales, diagnosticados de acuerdo con los criterios de clasificación ACR 1987, los pacientes con ECM previos al diagnóstico de AR y con síndromes de poli autoinmunidad fueron excluidos definidos como la presencia de AR + lupus eritematoso sistémico, Sjögren o esclerosis sistémica. Este protocolo fue aprobado por el comité de ética de la investigación del Hospital Universitario Clínica San Rafael.
Análisis estadísticoSe realizó un muestreo aleatorio simple, para el cálculo de la n muestral se determinó a partir de la fórmula para determinación tasa de riesgo12: n=m/μ, donde:
se tomó como referencia el estudio de Lauper et al. (2018)13, que detectó una tasa de riesgo de 0,0026, para un error alfa (tipo 1) de 0,05 y beta (tipo 2) de 0,20 con un poder del 80% y probabilidad de ocurrencia de 0,09, se estimó que el número mínimo de eventos a identificar es de 7,8 con una n muestral de 84 pacientes. Para el análisis descriptivo, las variables cualitativas se describieron en frecuencias absolutas y relativas. A las variables cuantitativas se les aplicó la prueba de normalidad Shapiro-Wilk (SW), y se expresaron en media y desvío estándar (DE) si distribuyen normal, y mediana con rango intercuartílico si su distribución no fue simétrica. Para evaluar la asociación entre variables cualitativas se utilizó la prueba de Chi-cuadrado, medida de efecto a través de riesgo relativo (RR) con un intervalo de confianza del 95% considerando significativo un valor de p<0,05. Para el análisis de supervivencia, se tomó como función de supervivencia el tiempo a desarrollo del evento S(t) y la probabilidad de supervivencia libre de evento se estimó mediante las curvas de Kaplan-Meier. Para evaluar las diferencias en la sobrevida libre de ECM entre grupos, se utilizó el log-rank test. Para el análisis multivariado se evaluaron tomando como variable dependiente el tiempo de sobrevida libre de ECM, y como predictoras las características clínicas, serológicas, terapéuticas del grupo de pacientes, se realizó a partir de un modelo de riesgos proporcionales Cox, para el ajuste de modelo se evaluaron los residuales de Schoenfeld y evaluación del supuesto de proporcionalidad.
Para evaluar las relaciones entre los factores de riesgo tradicionales y no tradicionales se utilizó el modelamiento de SEM a partir de un modelo PATH, por la naturaleza de las variables observables incluidas en el modelo teórico, se realizó inicialmente la identificación y especificación del modelo, se evaluaron los coeficientes y posteriormente las medidas de bondad de ajuste root mean square error approximation (RMSEA), comparative fit index/Tucker Lewis index (CFI/TLI), standarized root mean square residual (SRMR). Para el análisis de empleó el entorno de desarrollo integrado R Studio versión 4.3.2 y para el modelamiento de SEM el programa MPLUS versión 8.11.
ResultadosSe incluyeron 406 pacientes, 342 (84%) fueron mujeres, la media de la edad fue de 44,8±13,1 años, el tiempo de evolución de la enfermedad tuvo una mediana de 13±13,4 meses y el promedio del score de actividad DAS28 fue de 2,5±1,78, el 48,7% tuvieron una enfermedad activa con calificación de DAS28>2,6. Desde lo serológico, el 88,4% de los pacientes fueron seropositivos para factor reumatoideo (FR) y el 78,3% para anti-CCP. El desenlace de ECM se presentó en 19 pacientes con una incidencia acumulada (IA) del 4,68% en una mediana de seguimiento de 13 meses; de estos pacientes que presentaron el desenlace de interés, el 4,4% correspondieron a IAM y el 1,4% a ACV. Al evaluar los factores de riesgo cardiovascular tradicionales, la HTA fue la condición más frecuentemente hallada en un 23,7% seguida del tabaquismo en un 24,8%. La dislipidemia y la diabetes tuvieron una misma proporción del 9,1% (tabla 1).
Características de la población
| Variables | N (%) |
|---|---|
| Sexo | |
| Femenino | 342 (84,2) |
| Masculino | 64 (15,7) |
| Edad al diagnóstico, (DE) | 44,8 (13,1) |
| Tiempo de evolución en meses, (RIC) | 13 (17,4) |
| DAS28, (RIC) | 2,5 (1,78) |
| IMC, (RIC) | 25,6 (6,3) |
| Factor reumatoideo | 349 (88,4) |
| Anti-CCP | 318 (78,3) |
| Infarto agudo de miocardio | 18 (4,4) |
| Accidente cerebrovascular | 6 (1,4) |
| Fibrosis pulmonar | 10 (2,4) |
| Síndrome seco | 59 (14,5) |
| Nódulos reumatoideos | 65 (16) |
| Tabaquismo | 101 (24,8) |
| Hipertensión arterial | 111 (27,3) |
| Dislipidemia | 37 (9,1) |
| Diabetes mellitus | 37 (9,1) |
| Insuficiencia cardiaca | 8 (1,9) |
| Enfermedad renal crónica | 5 (1,2) |
| Evento cardiovascular mayor | 19 (4,6) |
| DAS28>2,6 | 175 (48,7) |
| Glucocorticoides >10mg/día | 217 (53,4) |
| Metotrexato | 287 (70,4) |
| Leflunomida | 221 (54,4) |
| Sulfasalazina | 72 (17,7) |
| Hidroxicloroquina | 60 (14,7) |
| Anti-TNFα | |
| Etanercept | 27 (6,7) |
| Certolizumab pegol | 13 (3,2) |
| Golimumab | 2 (0,5) |
| Infliximab | 1 (0,2) |
| Adalimumab | 5 (1,2) |
| Tocilizumab | 12 (2,9) |
| Rituximab | 32 (7,8) |
| Inhibidor JAK | 11 (2,7) |
DE: desviación estándar; IMC: índice de masa corporal; edad: media (desvíación estándar); n (%): número de pacientes (frecuencia relativa); RIC: rango intercuartílico; tiempo de evolución: mediana (rango intercuartílico),
En el análisis bivariado, se encontró que la insuficiencia cardiaca (RR: 1,58; IC 95%: 1,12-2,23; p=0,01), edad al diagnóstico (54,8 versus 44,3; p<0,01) y la HTA (RR: 2,36; IC 95%: 1,22-4,60; p<0,01) se asociaron significativamente con ECM (tabla 2).
Análisis bivariado
| Variable | ECM | RR | IC 95% | Valor de p | |
|---|---|---|---|---|---|
| Sí | No | ||||
| Sexo | |||||
| Femenino | 13 (3,8) | 329 (96,1) | 1,24 | 0,91-1,69 | 0,10 |
| Masculino | 6 (9,3) | 58 (90,6) | |||
| Factor reumatoideo | 14 (4) | 335 (95,9) | 0,41 | 0,18-0,91 | 0,08 |
| Anti-CCP | 12 (3,7) | 306 (96,2) | 0,57 | 0,31-1,06 | 0,17 |
| Fibrosis pulmonar | 3 (30) | 7 (70) | 1,17 | 0,96-1,42 | 0,16 |
| Síntomas secos | 3 (5) | 56 (95) | 1,02 | 0,83-1,24 | 1,0 |
| Nódulos reumatoideos | 3 (4,6) | 62 (95,3) | 1,0 | 0,82-1,22 | 1,0 |
| Tabaquismo | 9 (8,9) | 92 (91,0) | 1,45 | 0,94-2,23 | 0,09 |
| Insuficiencia cardiaca | 7 (87,5) | 1 (12,5) | 1,58 | 1,12-2,23 | 0,01* |
| Dislipidemia | 4 (10,8) | 33 (89,1) | 1,16 | 0,92-1,46 | 0,14 |
| Diabetes mellitus | 4 (10,8) | 33 (89,1) | 1,16 | 0,92-1,46 | 0,14 |
| Enfermedad renal crónica | 1 (20) | 4 (80) | 1,40 | 0,94-1,16 | 0,57 |
| Hipertensión arterial | 13 (3,2) | 98 (24,1) | 2,36 | 1,22-4,60 | <0,01* |
| Obesidad | 1 (2) | 9 (98) | 0,91 | 0,72-1,50 | 0,85 |
| Glucocorticoides | 12 (5,5) | 205 (94,4) | 1,28 | 0,70-2,23 | 0,38 |
| Hidroxicloroquina | 5 (8,3) | 55 (91,6) | 1,16 | 0,89-1,53 | 0,26 |
| Sulfasalazina | 3 (4,1) | 69 (95,8) | 0,98 | 0,80-1,19 | 1,0 |
| Metotrexato | 14 (4,8) | 273 (95,1) | 1,12 | 0,52-2,41 | 0,76 |
| Leflunomida | 11 (4,9) | 210 (95) | 1,09 | 0,63-1,86 | 0,75 |
| Anti-TNF | 2 (5) | 46 (95) | 0,98 | 0,84-1,15 | 1,0 |
| Tocilizumab | 1 (8,3) | 11 (91,6) | 1,03 | 0,92-1,14 | 1,0 |
| Anti-CD20 | 1 (3,1) | 31 (96,8) | 0,97 | 0,87-1,08 | 1,0 |
| Inhibidor JAK | 2 (18,1) | 9 (81,9) | 1,09 | 0,93-1,27 | 0,15 |
| Edad al diagnostico | 54,8 (11,08) | 44,3 (13) | <0,01* | ||
| Mayores de 50 añosMenores de 50 años | 12 (8,7)7 (2,6) | 125 (91,2)262 (97,3) | 0,51 | 0,35-0,74 | <0,01* |
| Tiempo de evolución en meses | 24 (121) | 13 (16) | 0,06 | ||
| DAS28>2,6 | 3,16 (16,1) | 2,45 (1,75) | 0,60 | ||
ECM: evento cardiovascular mayor; IC 95%: intervalo de confiana del 95%; RR: riesgo relativo.
Se dicotomizó la variable «edad al diagnóstico» en menores y mayores de 50 años, evidenciando que aquellos pacientes menores de 50 años, tuvieron 49% menor riesgo de ECM de forma significativa (RR: 0,51; IC 95%: 0,35-0,74; p<0,001).
El análisis de supervivencia mostró una probabilidad del 50% de permanecer libre de ECM a los 6 meses desde el diagnóstico de AR (tabla 3) (fig. 1), entre los diferentes grupos de variables, la obesidad tuvo significativamente menor probabilidad de permanecer libre de ECM, no obstante, los pacientes con actividad de la enfermedad por DAS28>2,6, aunque fue menos probable que permanecieran libres de ECM, no fue significativa esta diferencia (fig. 2).
Probabilidad de supervivencia libre de evento cardiovascular mayor
| Tiempo (meses) | Número de pacientes en riesgo | Número de eventos | Probabilidad de supervivencia | IC 95% |
|---|---|---|---|---|
| 1 | 19 | 3 | 0,8421 | 0,69-1,0 |
| 2 | 16 | 2 | 0,7368 | 0,56-0,96 |
| 3 | 14 | 3 | 0,5789 | 0,39-0,55 |
| 5 | 11 | 1 | 0,5263 | 0,34-0,80 |
| 6 | 10 | 1 | 0,4737 | 0,29-0,76 |
| 7 | 9 | 1 | 0,4211 | 0,24-0,71 |
| 13 | 8 | 1 | 0,3684 | 0,20-0,76 |
| 19 | 7 | 1 | 0,3158 | 0,16-0,61 |
| 20 | 6 | 2 | 0,2105 | 0,08-0,50 |
| 22 | 4 | 1 | 0,1579 | 0,05-0,44 |
| 23 | 3 | 1 | 0,1053 | 0,02-0,39 |
| 28 | 2 | 1 | 0,0526 | 0,0 0-0,35 |
| 33 | 1 | 1 | 0 | 0 |
En el análisis de riesgos proporcionales, se utilizó como variable dependiente el tiempo de supervivencia libre de evento, considerando como variables predictoras los factores de riesgo tradicionales, así como aquellas relacionadas con la actividad de la enfermedad y el perfil serológico de la AR. Los resultados mostraron que la HTA disminuye la probabilidad de supervivencia libre de ECM en un 82%. Además, por cada año adicional de edad al momento del diagnóstico de AR, la probabilidad de supervivencia libre de ECM aumenta significativamente en un 8% (tabla 4). El ajuste del modelo mostró un valor de 0,62 en la prueba global de Schoenfeld (fig. 3).
Coeficientes para modelo de riesgos proporcionales de Cox
| Variables | HR | IC9 5% | Valor de p |
|---|---|---|---|
| Sexo masculino | 0,2778 | 0,05-1,29 | 0,10 |
| Hipertensión arterial | 0,1814 | 0,03-0,84 | 0,02* |
| Edad al diagnóstico | 1,0828 | 1,01-1,16 | 0,02* |
| Anti-CCP | 0,4321 | 0,12-1,45 | 0,17 |
| Actividad de la enfermedad | 0,3365 | 0,06-1,63 | 0,17 |
HR: hazard ratio; IC 95%: intervalo de confianza del 95%.
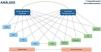
Para el análisis de SEM, primero se planteó el modelo teórico a partir de 2 variables dependientes observadas: IAM y ACV, las variables predictoras que podrían explicar estos 2 desenlaces fueron los factores de riesgo tradicionales: HTA, edad, dislipidemia, DM, tabaquismo, y si mismo, factores no tradicionales como DAS28, tiempo de evolución de la enfermedad. Las variables dislipidemia y corticoides podrían estar correlacionadas, así como las 2 variables dependientes (fig. 4).
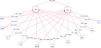
El modelo fue identificado como: «sobre identificado», con 78 piezas de información y 23 parámetros estimados. Se evaluaron los coeficientes, evidenciándose una asociación significativa entre dislipidemia e IAM en el modelo estructural (coef: 0,75; OR: 2,6; p=0,03) (tabla 5). Sin embargo, ningún coeficiente mostró una asociación significativa con ACV. Las variables dependientes: IAM y ACV, presentaron una correlación significativa (coef: 0,55; p=0,001) (fig. 5). El modelo mostró una adecuada bondad de ajuste global con un RMSEA<0,05 y medidas incrementales de ajuste (CFI, TLI) superiores a 0,95.
Coeficientes de regresión del modelo (análisis PATH)
| IAM | Coeficientes | Valor de p | ACV | Coeficientes | Valor de p |
|---|---|---|---|---|---|
| Sexo | 0,409 | 0,268 | Sexo | −0,364 | 0,819 |
| Edad | 0,016 | 0,152 | Edad | 0,043 | 0,303 |
| FR | −0,191 | 0,648 | FR | 0,822 | 0,561 |
| Anti-CCP | −0,177 | 0,571 | Anti-CCP | −1,837 | 0,058 |
| GC | 0,294 | 0,401 | GC | −0,048 | 1 |
| DAS28 | −0,024 | 0,842 | DAS 28 | 0,005 | 0,983 |
| Tabaquismo | −0,008 | 0,28 | Tabaquismo | 0,015 | 0,35 |
| Hipertensión arterial | 0,254 | 0,458 | Hipertensión arterial | 0,25 | 0,783 |
| Dislipidemia | 0,757 | 0,035* | Dislipidemia | 0,882 | 0,521 |
| Diabetes mellitus | 0,113 | 0,774 | Diabetes mellitus | −0,079 | 0,933 |
ACV: accidente cerebrovascular; FR: factor reumatoideo; GC: glucocorticoides; IAM: infarto agudo de miocardio.
En el análisis de mediación entre dislipidemia e IAM, tomando como variable mediadora el uso de corticoides, evidenció un efecto directo (c′) significativo entre dislipidemia e IAM (coef: 1,83; p<0.001). Sin embargo, no se observó un efecto indirecto mediado por el uso de glucocorticoides (ab) (coef: 0,06; p=0,23) (fig. 6).
Análisis de mediación. X: dlp: dislipidemia; Y: iam: infarto agudo de miocardio; Z: gc: variable moderadora glucocorticoides. a: coeficiente entre variable predictora dislipidemia (X) y la variable moderadora glucocorticoides (Z); b: efecto entre variable moderadora (Z) y desenlace infarto agudo de miocardio (Y); c‘: efecto directo de dislipidemia (X) sobre infarto agudo de miocardio (Y) sin la mediación de los glucocorticoides; ab: efecto indirecto de la dislipidemia (X) sobre el infarto agudo de miocardio (Y) con la mediación de glucocorticoides (Z).
Los desenlaces cardiovasculares mayores en los pacientes con AR han sido reportados en diferentes cohortes con resultados variables, en nuestro estudio se evidenció una IA de ECM para una cohorte de 406 pacientes del 4,68% en una mediana de seguimiento de 13 meses. Bridal et al. (2020), evaluaron el riesgo de ECM a 10 años de seguimiento en un 7,3% el cual incrementa sustancialmente al 12% en los pacientes con AR e historia de enfermedad coronaria14. No obstante, son pocos los estudios locales que evalúen la frecuencia de estos eventos asociados a factores de riesgo subrogados a la AR.
En nuestro análisis, los factores de riesgo tradicionales más frecuentemente identificados fueron la hipertensión, el tabaquismo y la dislipidemia. Sin embargo, estos factores no explican completamente la mayor predisposición a ECM, aunque se han descrito con mayor frecuencia en los pacientes con AR. Argnani et al. (2021), reportaron una mayor prevalencia de hipertensión y diabetes en los pacientes con AR en comparación con individuos sanos, así como un mayor riesgo de infarto de miocardio y ACV15. Estos desenlaces desfavorables podrían estar relacionados con la carga inflamatoria característica de la enfermedad, lo que, a su vez, los hace más frecuentes en aquellos pacientes que presentan manifestaciones extraarticulares.
En Colombia, hay pocas descripciones que evalúen la prevalencia de estos eventos en los pacientes con AR y compromiso extra articular, aunque Ortega-Hernández et al. (2008) describen mayor proporción de pacientes con hipertensión y trombosis en el grupo con expresión extra articular16, variable que se conservó como predictora de mayor riesgo cardiovascular en el análisis multivariado del mismo estudio.
La HTA fue la comorbilidad más frecuente en nuestra investigación, la cual a su vez se asoció a mayor riesgo de eventos cardiovasculares y menor probabilidad de supervivencia libre de ECM en un 82%. Similares hallazgos se describieron en un estudio transversal y descriptivo en Colombia por Bautista et al. (2016) quienes reportan una prevalencia de hipertensión en el 20,4%, aunque esta pudo estar explicada por la media de la edad de la población incluida17. Los cambios relacionados con la edad favorecen a su vez el envejecimiento vascular y predisponen a mayor comorbilidad.
En nuestra investigación la edad se comportó como un factor protector de ECM en el análisis bivariado de forma significativa, demostrando una reducción del riesgo en un 49% en los menores de 50 años, no obstante, en el modelo multivariado, esta variable aumentó la probabilidad de supervivencia libre de eventos en un 8% por cada año desde el diagnóstico. Esto podría relacionarse a menor tiempo de evolución y por ende menor carga inflamatoria. La edad como factor de riesgo tradicional para eventos cardiovasculares se relaciona estrechamente por cambios relacionados con la senescencia de las células endoteliales, acortamiento de telómeros, estrés oxidativo y activación oncogénica18. Otros factores modificables, pueden relacionarse con mayor morbilidad cardiovascular como el tabaquismo.
El tabaquismo en nuestro estudio estuvo presente en el 24% de los pacientes, y así mismo se asoció a mayor riesgo cardiovascular de forma no significativa, en los pacientes con AR y tabaquismo actual, el riesgo de evento cardiovascular se aumenta hasta en un 50%19, no obstante el cese de tabaco y los no fumadores reducen el riesgo de ECM hasta en un 30 y 52%, respectivamente20, aunque en esta investigación no se conservó esta variable predictora en el análisis multivariado, llamó la atención que otras manifestaciones relacionadas con la expresión extra articular también tuvieran una asociación con el desenlace de interés.
El compromiso pulmonar en la AR fue una de las manifestaciones extraarticulares que se presentó con mayor frecuencia a ECM, aunque sin significancia estadística, el impacto de la fibrosis pulmonar (FP) de etiología autoinmune en la enfermedad cardiovascular y especialmente en la enfermedad coronaria ha ido en ascenso en términos de prevalencia al compartir factores de riesgo y desenlaces, al punto de teorizar sobre si la FP es un factor de riesgo independiente de enfermedad coronaria. En este punto, un estudio retrospectivo de casos y controles de Sinha et al. (2024) encontraron mayor prevalencia de enfermedad coronaria en hospitalizaciones por FP debido al incremento de lipoxigenasas, lo que conlleva a la acumulación de lipoproteínas de baja densidad (LDL) en el endotelio21.
En este estudio, la dislipidemia se halló asociada de forma significativa con IAM en el análisis de SEM, como factor que explica ese desenlace de forma directa y significativa, no obstante, no se evidenció efecto indirecto o mediador de los glucocorticoides, de este modo se sugiere que los niveles de lípidos pueden estar relacionados con la actividad inflamatoria propia de la AR. En estados de inflamación y re-inflamación los valores séricos de los lípidos cambian, disminuyendo los niveles circulantes de LDL, alta densidad (HDL) y apolipoproteínas (ApoAI), la llamada paradoja lipídica en el paciente con inflamación, donde estos niveles al parecer no vistos en plasma si se encuentran distribuidos en otras rutas celulares como el endotelio, las citoquinas elevadas, así como el factor de necrosis tumoral (TNF-α) y el factor transformador de crecimiento β (TFG-β), alteran la función de moléculas conversoras de formas específicas y eficientes de HDL22.
La hiperlipidemia como factor de riesgo independiente no es un fenómeno inusual. Enfermedades como el lupus eritematoso sistémico, la psoriasis y la AR comparten este problema, caracterizado por un incremento del riesgo cardiovascular. La actividad antioxidante de la HDL depende de los niveles de ApoA1 presentes en su superficie. El desplazamiento de esta molécula de la lipoproteína contribuye al mal rendimiento de la HDL, favoreciendo procesos oxidativos23.
En los pacientes con AR, se ha demostrado que la presencia de amiloide sérico tipo A desplaza estas proteínas, lo que reduce los niveles de ApoA1 y ApoA2. Además, se observa un incremento en el acoplamiento de la HDL con otras moléculas oxidativas, como la mieloperoxidasa (MPO) y la haptoglobina, lo que agrava el daño oxidativo23.
Las debilidades de esta investigación están en relación con la naturaleza retrospectiva de la recolección de los datos, y el reducido número de pacientes incluidos, teniendo en cuenta que hacen parte de programas de atención integral en AR, explicaría los bajos índices de actividad inflamatoria que podrían infra estimar la expresión extraarticular y cardiovascular de esta enfermedad, así mismo no se estratificaron los valores de DAS28 dado que era mayor la proporción de pacientes con enfermedad controlada, teniendo en cuenta que la media fue de 2,5 (DE: 1,78).
En nuestra cohorte se evidenció que mas de la mitad de los pacientes tenían dosis >10mg/día de prednisolona, cabe aclarar que no se trató de un criterio de inclusión, sino de una característica basal registrada retrospectivamente. Dado que el uso de dosis elevadas de glucocorticoides puede influir en el riesgo cardiovascular, este factor fue considerado en los modelos de análisis multivariado para ajustar por posibles efectos de confusión en el análisis PATH. Este dato podría reflejar el comportamiento terapéutico de los centros participantes, lo que constituye una limitación para hacer generalizable a otras poblaciones con enfoques terapéuticos diferentes.
Esta investigación tiene la ventaja de ser el único estudio en nuestro medio que emplea métodos de SEM que evalúan efectos directos e indirectos a partir de análisis de mediación con respecto al desenlace de ECM en esta población con AR, adicionalmente resulta innovador el dato de IA y factores asociado a ECM a partir de análisis multivariados con rigor estadístico, permitiendo identificar puntos de intervención para estimación de futuras escalas predictoras de mortalidad independientes de factores de riesgo tradicionales en la población colombiana con AR.
El hallazgo de la dislipidemia como predictor independiente de IAM en nuestra investigación sin mediación de otros factores indirectos, constituyen un aspecto clave como objetivo terapéutico en el control global de la enfermedad y prevención de morbimortalidad por causas cardiovasculares.
ConclusiónLos factores de riesgo tradicionales incrementan el riesgo de ECM en los pacientes con AR, así mismo la dislipidemia se comporta como un factor de riesgo independiente sin mediación de otras variables, lo que constituye un objetivo terapéutico para la prevención de estos desenlaces.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.