El tejido óseo se renueva constantemente por la acción coordinada de osteoclastos y osteoblastos. Los osteocitos desempeñan un papel destacado en el inicio del remodelado en un lugar dado del esqueleto. Estos y otras células de estirpe osteoblástica producen diversos mediadores que modulan la diferenciación de los precursores osteoclásticos, paso inicial imprescindible para que comience la resorción. Entre ellos, son especialmente importantes el M-CSF y el RANKL.
Bone tissue is constantly renewed by the coordinated action of osteoclasts and osteoblasts. Osteocytes have a prominent role in the onset of bone remodeling at selected sites of the skeleton. These and other osteoblastic cells produce a variety of mediators that modulate the differentiation of osteoclast precursors, a critical step for bone resorption to occur. Among them, M-CSF and RANKL are especially important.
El esqueleto tiene una misión estructural, esencial para el soporte y anclaje de las vísceras y los sistemas músculo-tendinosos, así como de protección de algunos órganos, como los pulmones o el cerebro. Además, su matriz mineralizada contiene grandes cantidades de calcio y fósforo, cuya movilización ayuda a mantener las concentraciones séricas normales de estos elementos, además de contribuir a tamponar las alteraciones del equilibrio ácido-básico.
El tejido óseo, aunque fuertemente calcificado, a diferencia de otros tejidos del organismo, no es un tejido inerte. Por el contrario, está sometido a un proceso continuado de remodelado, de manera que anualmente se renueva aproximadamente el 10% del esqueleto. Ese proceso de remodelado es imprescindible para mantener las funciones normales del esqueleto, pues hace posible reparar microlesiones de fatiga (microfracturas), cuya acumulación comprometería la resistencia del hueso. Por otro lado, permite una cierta adaptación de la estructura ósea a los requerimientos físicos predominantes. Finalmente, permite disponer de un pool de calcio fácilmente movilizable que ayuda a mantener la homeostasis en caso de trastornos que tiendan a alterar la calcemia.
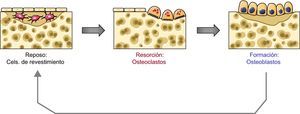
El remodelado del hueso se lleva a cabo por grupos especializados de células que actúan de manera coordinada en el tiempo y el espacio y que constituyen las llamadas «unidades de remodelado». Se estima que en un momento dado existen unos 2 millones de unidades de remodelado activas. Cada una de ellas está constituida por un grupo de osteoclastos que van resorbiendo un pequeño volumen de hueso, unos 0,025mm3. Tras esta fase de resorción, llegan a esa zona grupos de osteoblastos que sintetizan nueva matriz ósea que después se mineralizará, formándose así hueso nuevo que sustituye al hueso viejo destruido por los osteoclastos.
Los osteoclastos derivan de células hematopoyéticas, en concreto de la línea monocito-macrófago. Por tanto, posiblemente la mayor parte de los precursores osteoclásticos indiferenciados se encuentran en el seno de la médula ósea hematopoyética. Sin embargo, como ocurre con otras células de estirpe hematopoyética, existen también precursores circulantes en la sangre periférica. De hecho, con los estímulos adecuados se puede inducir la diferenciación de células «monocitoides» circulantes hacia osteoclastos. Por otro lado, se han identificado precursores osteoclásticos quiescentes más diferenciados próximos a la superficie de las trabéculas óseas1. Estas células representen un pool de precursores listos para iniciar la resorción, y en consecuencia un nuevo ciclo de remodelado, en caso de que sea requerido.
A diferencia de los osteoclastos, los osteoblastos son de estirpe mesenquimal. Aunque también se ha señalado la existencia de precursores circulantes en sangre periférica2, se supone que la mayor parte de ellos se encuentran formando parte del llamado «estroma» de la médula ósea o en otros compartimentos próximos a las superficies óseas. Estas células, a menudo designadas como células madre mesenquimales, pueden diferenciarse a diversos tipos celulares, incluidos mioblastos, fibroblastos, condrocitos, adipocitos y osteoblastos. Algunos autores consideran que los pericitos que rodean los vasos de la médula pueden tener esa capacidad de diferenciación pluripotencial3.
Cuando los osteoclastos finalizan la resorción en una unidad de remodelado desaparecen por apoptosis. En cuanto a los osteoblastos, cuando finalizan la síntesis de matriz quizás en una cierta proporción también sufren apoptosis. Sin embargo, muchos se quedan embebidos en la matriz que van sintetizando y se transforman en osteocitos. Finalmente, algunos osteoblastos se transforman en «células de revestimiento» que tapizan las superficies óseas (fig. 1).
Acoplamiento entre osteoblastos y osteoclastosCuriosamente, las células de la línea osteoblástica no sólo son las responsables de la síntesis de matriz ósea nueva, sino que además parecen desempeñar un papel clave en la regulación de la osteoclastogénesis y, por tanto, en la resorción. Es evidente que el mantenimiento de la integridad del esqueleto requiere un acoplamiento adecuado entre osteoclastos y osteoblastos, cuya actuación debe ser coordinada, de manera que se activen en el mismo lugar y en una secuencia temporal correcta y, además, que lo hagan con eficiencia similar, es decir que la cantidad de hueso destruida por los osteoclastos sea similar a la formada posteriormente por los osteoblastos. De lo contrario, evidentemente la masa ósea no se mantendría estable. Los mecanismos responsables de dicho acoplamiento no han sido totalmente aclarados. No obstante, se han identificado diversas moléculas que presumiblemente participan en el proceso y que representan interacciones complejas entre las líneas de la serie osteoblástica y los osteoclastos. También existe evidencia de interacciones en sentido contrario, es decir, de mecanismos por los cuales los osteoclastos influyen en la actividad de los osteoblastos, pero no son el objeto de esta puesta al día.
Los osteocitos y el inicio del remodeladoTampoco se conoce con certeza qué desencadena el inicio de un nuevo ciclo de remodelado en un lugar y momento determinados. No obstante, se piensa que en ello desempeñan un papel importante los osteocitos, marcando el lugar donde debe producirse la activación de los precursores osteoclásticos para iniciar la resorción4. Es decir, los osteocitos pueden ser los sensores de situaciones inductoras del remodelado, como la aparición de microfracturas o la modificación de las fuerzas mecánicas a las que está sometido el esqueleto. De hecho, se piensa que la apoptosis de los osteocitos puede desencadenar el inicio del remodelado. Los mecanismos íntimos se desconocen, pero esta idea se basa en el hecho de que en las muestras de tejido óseo se ha observado la presencia de osteocitos apoptóticos en la vecindad de las zonas con microfracturas y en la proximidad de los focos de resorción. Por otro lado, en algunos modelos experimentales se ha demostrado que la prevención de la apoptosis de los osteocitos mediante inhibidores de caspasas inhibe la resorción ósea que se produce como consecuencia de las lesiones de fatiga5.
Los osteocitos no tienen conexiones físicas con las células de la médula. Por tanto, si actúan sobre los precursores osteoclásticos debe de ser a través de mecanismos humorales. De hecho, se ha demostrado que estas células producen diversos mediadores que pueden influir en la osteoclastogénesis, como óxido nítrico, TGF-beta, prostaglandinas o RANKL (véase más adelante)6. Sin embargo, se desconoce si realmente esos productos de los osteocitos influyen directamente en la osteoclastogénesis. Otra posibilidad es que la activación de la osteoclastogénesis sea indirecta, a través de las células de revestimiento. De hecho, los osteocitos emiten prolongaciones citoplasmáticas que constituyen una espesa red que comunica cada osteocito con otros osteocitos vecinos, así como con las células de revestimiento de la superficie trabecular. Cabe especular que las señales enviadas por los osteocitos sean las responsables de los cambios que se producen en las células de revestimiento cuando se inicia el remodelado: esas células se despegan de la superficie ósea y constituyen una especie de cúpula que constituye el llamado «espacio de remodelado». Es en ese espacio, relativamente aislado del resto del hueso, donde se inicia la resorción7,8.
Modulación de la osteoclastogénesis por los osteoblastosAunque no se conocen los mecanismos que marcan el inicio del remodelado, sí se han identificado una serie de mediadores moleculares que son producidos por las células de estirpe osteoblástica, o sus precursores estromales, y que desempeñan un papel esencial en la osteoclastogénesis. Así, estas células producen diversos factores que ejercen un efecto quimiotáctico sobre los precursores de los osteoclastos. De hecho, la atracción de esos precursores debe ser un paso inicial esencial para el inicio de la resorción. Entre las moléculas quimiotácticas se encuentran el factor derivado de las células estromales (SDF) y la proteína quimiotáctica de monocitos tipo 1 (MCP-1)9,10.
Por otro lado, las células osteoblásticas sintetizan algunos factores que son esenciales para la diferenciación de los osteoclastos. Uno de ellos es el factor estimulante de las colonias de tipo monocito macrófago (M-CSF o CSF-1). Su importancia queda claramente de manifiesto en algunos modelos experimentales murinos, en los que se ha demostrado que la falta de M-CSF impide la formación de osteoclastos y conduce a la aparición de osteopetrosis11.
El M-CSF parece actuar sobre las fases iniciales de la osteoclastogénesis, es decir, para generar precursores iniciales indiferenciados, capaces de dar lugar tanto a osteoclastos como a monocitos. De hecho, en los cultivos de médula ósea, un modelo comúnmente utilizado para estudiar la osteoclastogénesis, la inhibición persistente del M-CSF impide la formación de osteoclastos. Pero, por otro lado, la adición mantenida de este factor también reduce la formación de osteoclastos, al tiempo que se promueve la de monocitos. Eso sugiere que el M-CSF induce la diferenciación de los precursores de la serie mieloide preferentemente hacia la línea monocitaria, más que hacia osteoclastos.
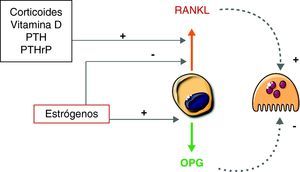
Sistema RANKL-RANK-OPGOtro factor crítico para la formación de osteoclastos es el RANKL (ligando del receptor activador de NF-κB). El RANKL es producido por diversas células, incluyendo algunas del sistema inmunitario, células de la pared vascular y osteoblastos/estroma. Este factor pertenece a la familia del TNF. Cuando se fija a su receptor (RANK), presente en la membrana de los precursores osteoclásticos, induce una serie de señales que promueven la diferenciación de estos y la formación de osteoclastos12,13.
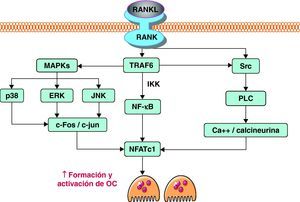
Cuando RANKL, producido activamente por los osteoblastos, interacciona con su receptor RANK, se activan diferentes vías de señalización intracelular en el precursor de osteoclasto que inducen la expresión de genes, promoviendo su diferenciación y activación. Tras el contacto, la parte citoplasmática de RANK interacciona con proteínas adaptadoras conocidas como TRAF. Estas proteínas son de vital importancia. Tal es así que modelos murinos knock out para TRAF6, en los que se bloquea la expresión de este gen, desarrollan osteopetrosis al carecer de osteoclastos14. Las TRAF inician la cascada de señales, a través de la activación de varias vías, incluyendo NF-κB, JNK y Src. La vía NF-κB, quizás la más importante de las tres, implica la traslocación del factor de transcripción NF-κB al núcleo, liberándolo de los complejos IKK que lo retienen en el citoplasma, donde es inactivo. Por otro lado, la estimulación de la vía JNK promueve la formación y activación del complejo AP-1, formado por c-Fos y c-Jun. De forma conjunta, AP-1 y NF-κB son capaces de inducir la expresión del factor de transcripción NFATc1. Al igual que ocurre con el factor de transcripción NF-κB, NFATc1 debe traslocarse al núcleo para llevar a cabo su función. Para ello es necesario activar la vía de Src. A través de la estimulación de esta vía se consigue un aumento de los niveles intracelulares de calcio. El aumento del calcio provoca la activación de la calcineurina, que cataliza la eliminación de un grupo fosfato de NFATc1. Esta defosforilación es la que promueve finalmente la traslocación de este factor al núcleo. Allí NFATc1 induce la expresión de diversos genes implicados en la osteoclastogénesis12,15 (fig. 2).
Se han descrito 3 formas de RANKL, codificadas por un solo gen que puede presentar varias posibilidades de «corte y pegado» del ARN trascrito16. La isoforma 1 parece ser la más importante; tiene una secuencia que permite su anclaje a la membrana. No obstante, algunas moléculas de RANKL soluble se originan a partir del RANKL originalmente fijado a la membrana, cuando éste es degradado por algunas proteasas, como la metaloproteasa de la matriz MMP1417.
Varios factores humorales que promueven la resorción de hueso actúan, al menos en parte, incrementando la expresión de RANKL. Es el caso de la parathormona, la 1,25-dihidroxivitamina D o algunas citocinas, como la IL-617.
Además de inducir la diferenciación de los precursores, el RANKL puede potenciar la actividad de los osteoclastos maduros e inhibir su apoptosis. El RANKL puede tener también un efecto quimiotáctico indirecto sobre los precursores. La esfingosina 1-fosfato o S1P es un fosfolípido que modula la permeabilidad capilar y ejerce efectos quimiotácticos sobre diversos tipos de células. El S1P se encuentra en la sangre en concentración relativamente elevada y parece provenir esencialmente de las plaquetas y de los hematíes. En modelos experimentales murinos se ha demostrado que el S1P es también quimiotáctico sobre los precursores osteoclásticos. Por otro lado, el RANKL reduce la expresión de los receptores de membrana del S1P. En consecuencia, se ha elaborado una teoría que postula que en condiciones normales los precursores circulantes de los osteoclastos que llegan al microambiente óseo tienden a pasar de nuevo a la circulación en función del efecto quimiotáctico de S1P. Sin embargo, cuando aumenta la producción de RANKL en una determinada zona del hueso, la disminución de la expresión de los receptores de S1P hace que ese efecto quimiotáctico sea menos intenso y que los precursores osteoclásticos permanezcan en el foco, siendo así posible su ulterior diferenciación bajo el estímulo del propio RANKL y de otros factores pro-osteoclastogénicos.
Curiosamente, además de RANKL los osteoblastos producen osteoprotegerina, que es un inhibidor del RANKL. En efecto, la osteoprotegerina es una proteína soluble que guarda una alta similitud estructural con el RANK. En consecuencia, actúa como señuelo, se fija al RANKL e impide la interacción de éste con su receptor RANK. Recientemente, se ha sugerido que la osteoprotegerina puede regular el tráfico intracelular de RANKL. Según esta hipótesis, cuando hay abundante osteoprotegerina ésta hace que la mayor parte del RANKL sintetizado se mantenga en el interior de vesículas intracelulares y, en consecuencia, inactivo. Por el contrario, en ausencia de osteoprotegerina el RANKL se localizaría preferentemente en la membrana, donde es capaz de interaccionar con los precursores osteoclásticos11.
En cualquier caso, el sistema RANKL-RANK-OPG desempeña un papel esencial en la osteoclastogénesis. Existen numerosos datos clínicos y experimentales que lo demuestran. De hecho, los animales en los que se bloquea la expresión de RANKL desarrollan osteopetrosis. Por el contrario, cuando se bloquea la expresión de OPG desarrollan osteoporosis. Asimismo, se han descrito varios casos de mutaciones espontáneas en humanos que subrayan la importancia del sistema13. Recientemente, se han publicado algunos pacientes con osteoporosis debida a la presencia de anticuerpos contra la osteoprotegerina18. Por otro lado, el denosumab, un anticuerpo que inhibe RANKL, ha sido introducido como un tratamiento eficaz para la osteoporosis. Administrado con frecuencia semestral, disminuye los marcadores bioquímicos de resorción, incrementa la densidad mineral ósea y reduce el riesgo de fracturas19.
Sin embargo, éstos no son los únicos mediadores osteoblásticos que modulan la actividad de las células de la línea osteoclástica. De hecho, los osteoblastos pueden sintetizar diversas citocinas que promueven la resorción de hueso. Es el caso de la IL-6 o el TNF. Es posible que su papel sea más importante en condiciones patológicas, como la pérdida brusca de la función gonadal o la destrucción ósea ligada a procesos inflamatorios, que en condiciones fisiológicas20. Los osteoblastos también producen otras moléculas pequeñas, como el óxido nítrico, que puede tener efectos bifásicos sobre la actividad osteoclástica21. Hay que tener en cuenta que muchos de los efectos de las hormonas que regulan la resorción ósea no se deben a acciones directas sobre los osteoclastos. Por el contrario, están mediados por cambios en la síntesis de factores osteoblásticos que secundariamente actúan sobre los precursores osteoclásticos, de manera especial el RANKL y la osteoprotegerina (fig. 3). Es decir, estos sistemas moleculares son los traductores de los factores hormonales sistémicos a nivel del microambiente óseo.