Presentamos el caso de una mujer de 51 años con antecedentes de lupus eritematoso sistémico no órgano específico de años de evolución, que inicia clínica de síndrome tóxico junto adenopatías y afectación de pares craneales. Desarrollamos el diagnóstico diferencial. Posteriormente, se muestran la resolución del caso y la evolución de la paciente.
We present the case of a 51 year old woman with a history of several years of non organ specific Systemic Lupus Erythematosus, who presented a toxic syndrome and adenopathy and cranial nerve affection. We carried out the differential diagnosis. We then described the case resolution and progression.
Paciente de 51 años sin alergias medicamentosas conocidas, hábito tabáquico de 15 cigarrillos diarios (dosis acumulada: 26 paq./año) y con antecedentes de: miastenia gravis en 1985, diagnosticada a raíz de fatiga muscular intensa, con resolución del cuadro tras intervención de timoma, y lupus eritematoso sistémico (LES) diagnosticado en 1990 con clínica de eritema malar, úlceras orales, poliartritis no erosiva, simétrica, con afectación de carpos y articulaciones metacarpofalángicas e interfalángicas proximales de ambas manos de más de 6 semanas de evolución, pancitopenia y en cuyo estudio inmunológico destacaban anticuerpos antinucleares (ANA) positivos, anti-ADN positivo, disminución del complemento (C3 y C4) y FR, anti-Ro y La negativos. Se inició tratamiento con sales de oro y glucocorticoides (metilprednisolona 6mg/día) que mantuvo durante un año, retirado por falta de respuesta terapéutica; posteriormente, siguió tratamiento con hidroxicloroquina y metilprednisolona 4-6mg/día con buena respuesta clínica, manteniendo el mismo tratamiento hasta la actualidad. Además, destacaba historia de aborto espontáneo en 1995 y de parto prematuro con muerte neonatal a los 4 días del nacimiento y determinación de anticuerpos anticardiolipina positivos (IgG) en una única determinación (siendo todas las determinaciones posteriores negativas). No refería episodios tromboembólicos previos. Asimismo, se hallaba afectada de una osteoporosis asociada al tratamiento con glucocorticoides y la menopausia. Actualmente, estaba en tratamiento con metilprednisolona 20mg/día, hidroxicloroquina 200mg/día, omeprazol 20mg/día, ácido acetilsalicílico 100mg/día, risedronato 35mg/semanal, suplemento de calcio y vitamina D.
La paciente acudió a consulta por síndrome constitucional de un mes de evolución, con pérdida de 3kg de peso y astenia. Se solicitó una analítica general que mostró pancitopenia: leucocitos 2,6×109/l (neutrófilos absolutos 1,6×109/l, linfocitos absolutos 0,5×109/l), hematocrito (Hto) 27%, hemoblogina (Hb) 8,6mg/dl, plaquetas 105×109/l y elevación de reactantes de fase aguda con una velocidad de sedimentación globular (VSG) de 75mm/h, proteína C reactiva (PCR) de 2,75mg/dl. Durante el mes previo al inicio de la sintomatología, acudió al servicio de oftalmología por escotoma en campo visual derecho y parálisis del vi par craneal ipsolateral, con disestesias en el territorio de rama maxilar inferior y superior del v par derecho, decidiéndose ingreso electivo para estudio.
En la exploración física se hallaba hemodinámicamente estable, afebril, hidratada, sin signos de insuficiencia cardiaca, sin alteraciones significativas en la auscultación cardiopulmonar y la palpación abdominal. En el aparato locomotor no se observaron signos de actividad inflamatoria. En la exploración neurológica destacó la presencia de parálisis del vi par craneal derecho y ausencia de signos meníngeos.
En el hemograma se observó leucopenia (0,6×109/l linfocitos y 1,2×109/l neutrófilos), anemia normocítica (Hb de 7,5mg/dl, Hto el 25% y volumen corpuscular medio de 88 fl, con un 10,7% de hematíes hipocromos) y plaquetas de 86×109/l. El estudio de la coagulación fue normal. Las determinaciones de glucosa, función renal, ionograma, proteínas totales, albúmina y enzimas musculares fueron normales. En el perfil hepático destacaba un aumento de la fosfatasa alcalina total (436 U/l) y de la gammaglutamil transferasa (207 U/l). La ferritina y el receptor soluble de la transferrina estaban elevados, 420 ng/ml y 3,21mg/l, respectivamente. La VSG fue de 56mm/h y la PCR fue de 3,22mg/dl. El sedimento urinario fue normal, sin evidencia de proteinuria en orina de 24h. En el estudio de autoinmunidad los ANA fueron positivos 1/320, con anti-ADN, ENA, FR y anti-CCP negativos. El anticoagulante lúpico y los anticuerpos anticardiolipina fueron negativos y el complemento se encontró dentro de rangos normales. En el proteinograma se observó la presencia de una banda anómala en la zona gamma, la inmunofijación en suero mostró componente monoclonal IgG lambda y la inmunofijación en orina no mostró hallazgos sospechosos de monoclonalidad. Se solicitaron marcadores tumorales entre los que destacaban: CA 125: 1.530 (normal < 40), CA 19.9: 151 (normal < 37), beta-2-microglobulina: 9,9mg/l (normal: 0,2-2,3mg/l), CA 153: 58 U/ml (normal < 40) y HE4 164,7 (normal < 150).
En la radiografía de tórax se observó un ligero pinzamiento del ángulo costo diafragmático izquierdo, sin alteraciones parenquimatosas pulmonares.
Para el estudio de la pancitopenia y la banda monoclonal se realizó un aspirado de médula ósea que evidenció la presencia de las 3 series celulares con infiltrado del 6% de células plasmáticas. En el análisis del citocentrifugado se observaron linfocitos de aspecto maduro con algún linfocito reactivo y algún monocito, siendo el resultado sugestivo de gammapatía monoclonal de significado incierto. Así mismo se realizó una seriada ósea en la que no se observan lesiones osteolíticas.
Para el estudio de la focalidad neurológica se solicitó una tomografía computarizada (TC) cerebral, que fue normal. La resonancia magnética (RM) mostró una imagen hiperintensa central en protuberancia sugestiva de una telangiectasia capilar y un área central hipointensa en el cordón medular, desde C2 hasta C5, compatible con siringomielia. Se realizó un electromiograma en donde se observaron signos electrofisiológicos de polineuropatía motora y sensitiva axonopática distal.
Para ampliación del estudio de síndrome tóxico se solicitó una ecografía ginecológica que mostró un pólipo endometrial sin otras alteraciones asociadas. En la TC abdomino-pélvica destacaba la presencia de esplenomegalia de 14cm, con algunas hipodensidades mal definidas, la mayor de 11mm, y múltiples adenopatías paraaórticas e iliacas bilaterales, siendo la mayor de ellas de 2cm. La TC de tórax evidenció adenopatías mediastínicas y un nódulo pulmonar apical derecho inespecífico, así como la presencia de enfisema, engrosamientos bronquiales y opacidades en vidrio deslustrado que podrían estar en relación con una bronquiolitis.
Se realizó una prueba diagnóstica.
Diagnóstico diferencial del presentador (Dra. Martínez-Morillo)La enfermedad actual de este caso engloba fundamentalmente una serie de síntomas hematológicos y otros neurológicos. Por un lado, la paciente presenta poliadenopatías, pancitopenia, esplenomegalia, elevación de la β2-microglobulina y una banda monoclonal. Así mismo, también se evidencia afectación de pares craneales, polineuropatía mixta y líquido cefalorraquídeo inflamatorio. Destaca también la elevación de varios marcadores tumorales. Tomando como signo guía las adenopatías múltiples, el diagnóstico diferencial debe plantearse entre las siguientes enfermedades (tabla 1).
Enfermedades que cursan con poliadenopatías en pacientes con lupus
| Infecciones |
| Síndromes mononucleósicos: virus de Epstein-Barr, virus de hepatitis B y C, inmunodeficiencia humana, citomegalovirus y toxoplasma |
| Tuberculosis |
| Sífilis |
| Leishmania |
| Fármacos |
| Enfermedades sistémicas |
| Lupus |
| Sarcoidosis |
| Amiloidosis |
| Procesos linfoproliferativos «benignos» |
| Síndrome de Castleman |
| Enfermedad de Rosai-Dorfman |
| Enfermedad de Kikuchi-Fujimoto |
| Neoplasias |
| Síndrome POEMS |
| Carcinoma de origen desconocido |
| Linfoma no hodgkiniano |
El LES puede complicarse con enfermedades infecciosas1,2 que se presentan con poliadenopatías. Las infecciones son la primera causa de mortalidad y suelen cursar con síndrome febril. Pueden confundirse con un brote lúpico o aparecer simultáneamente. Los síndromes mononucleósicos, como los causados por el virus de Epstein-Barr, el virus de la hepatitis B o C, el citomegalovirus, el toxoplasma o la primoinfección por el virus de la inmunodeficiencia humana, se presentan con fiebre y poliadenopatías y pueden manifestarse con síntomas neurológicos. Sin embargo, en este caso las serologías específicas resultaron negativas. La tuberculosis diseminada suele presentarse en pacientes inmunosuprimidos y puede afectar a prácticamente cualquier órgano, incluyendo el sistema linfático, la médula ósea y el sistema nervioso. No obstante, la detección de interferón gamma específico de tuberculosis mediante prueba Elispot® y los cultivos micobacteriológicos, tanto de sangre como de líquido cefalorraquídeo, resultaron negativos en este caso. También cabe considerar la sífilis, ya que puede presentarse como un síndrome poliadenopático con afectación del sistema nervioso central. Sin embargo, la ausencia de fiebre y de lesiones cutáneas y el resultado negativo de la prueba VDRL en líquido cefalorraquídeo permiten descartar este diagnóstico. La leishmaniasis puede cursar con poliadenopatías y pancitopenia, pero puede excluirse porque no afecta al sistema nervioso y por la ausencia de parásitos en el aspirado de médula ósea.
Entre los fármacos que pueden provocar poliadenopatías cabe citar las sales de oro, pero la cronología de este caso no apunta al medicamento como el causante de las manifestaciones clínicas3. La hidroxicloroquina es un fármaco muy seguro, pero entre sus efectos secundarios se mencionan la aplasia medular y la polineuropatía periférica. No obstante, la afectación del sistema nervioso central y las linfadenopatías no están descritas4.
Las poliadenopatías forman parte del espectro clínico del LES. Suelen ser de pequeño tamaño y de localización cervical, inguinal o axilar. Las presentan hasta el 25% de los pacientes a lo largo de la evolución y son más frecuentes al inicio de la enfermedad o con los brotes5. Sin embargo, son pocos los casos publicados en los que el síntoma principal de un brote sean las poliadenopatías6. Cabe mencionar también que las pacientes con lupus presentan banda monoclonal con mayor frecuencia que la población general y que la β2-microglobulina se suele elevar en los brotes7. La pancitopenia por brote lúpico es poco frecuente; hay que descartar la hemólisis, la infiltración medular, la toxicidad por fármacos y el síndrome hemofagocítico. Los síntomas neurológicos de este caso también podrían explicarse por el propio lupus, ya que hasta el 50% de los pacientes presenta manifestaciones neurológicas a lo largo de la evolución. La afectación de pares craneales y la meningitis aséptica son infrecuentes, pero hasta el 25% de las pacientes presenta polineuropatía periférica1. En este caso, se podría descartar el brote lúpico como causante de las manifestaciones clínicas por la normalidad del complemento, el resultado negativo de los anticuerpos anti-ADN de doble cadena, la escasa respuesta a 20mg de metilprednisolona y la ausencia de hemólisis y hemofagocitosis en el aspirado de médula ósea.
La sarcoidosis puede presentar manifestaciones hematológicas y neurológicas. Las poliadenopatías son muy frecuentes, así como la afectación de la médula ósea, aunque las citopenias suelen ser leves. La meningitis crónica y la afectación de los pares craneales es común, pero la neuropatía periférica es poco frecuente. En este caso, la tomografía evidenciaba un infiltrado pulmonar bibasal. Sin embargo, cabe considerar el diagnóstico de sarcoidosis como poco probable por la ausencia de clínica respiratoria, la pancitopenia grave y la neuropatía periférica8. Además, en la literatura existen muy pocos casos de lupus y sarcoidosis en el mismo paciente. No obstante, el diagnóstico definitivo sería histopatológico, con la observación de granulomas no caseificantes.
La amiloidosis secundaria sería otra opción diagnóstica. El lupus es una causa infrecuente de amiloidosis, y cuando se produce, el primer síntoma suele ser la proteinuria por afectación renal. Puede cursar con adenopatías generalizadas y hepatoesplenomegalia y también es posible la afectación del sistema nervioso periférico por atrapamiento, pero los pares craneales suelen estar respetados9. El buen control de la enfermedad en este caso, la baja incidencia de amiloidosis en el lupus, la ausencia de afectación renal y la afectación de pares craneales van en contra de este diagnóstico.
El síndrome de Castleman es una enfermedad linfoproliferativa caracterizada por el predominio de células B CD5 positivas en la zona marginal. Existe una variante multicéntrica que puede presentarse con poliadenopatías, hepatoesplenomegalia y síndrome tóxico10. Se han descrito casos de coexistencia con lupus pero son muy infrecuentes. Únicamente la biopsia ganglionar puede proporcionar el diagnóstico pero puede excluirse porque la afectación de pares craneales y un líquido cefalorraquídeo inflamatorio no están descritos en la literatura.
La enfermedad de Rosai-Dorfman es una entidad infrecuente originada por proliferación histiocítica. Se presenta con linfadenopatías, fiebre, leucocitosis e hipergammaglobulinemia monoclonal11. La afectación del sistema nervioso es anecdótica, así como su asociación con lupus12. Aunque la probabilidad es muy baja, para excluir el diagnóstico sería necesaria una biopsia ganglionar.
La enfermedad de Kikuchi-Fujimoto es una linfadenitis histiocítica necrosante. La localización más frecuente de las adenopatías es la región cervical y su evolución suele ser benigna y autolimitada. Sin embargo, existe una forma generalizada que puede cursar con fiebre, citopenias y síndrome tóxico, que puede ser letal. Su asociación con el lupus está ampliamente descrita pero es muy rara13. Así mismo, aunque poco frecuentes, hay casos descritos de pancitopenia, neuritis periférica y meningitis aséptica14, pero no existe ningún caso que asocie enfermedad de Kikuchi con afectación de pares craneales. Por todo ello, aunque se trata de un diagnóstico improbable, sería necesario el estudio histopatológico de un ganglio para poder descartarla definitivamente.
El síndrome POEMS (polineuropathy, organomegaly, endocrinopathy, monoclonal protein and skin changes) o mieloma osteoesclerótico puede presentarse con poliadenopatías, una banda monoclonal tipo lambda, como en este caso, y polineuropatía periférica15. Por otro lado, van en contra del diagnóstico de este síndrome la proteinorraquia por debajo de 100mg/dl, la ausencia de cambios cutáneos o endocrinopatías y la ausencia de lesiones escleróticas.
El carcinoma metastásico de origen desconocido representa el 2% de todas las neoplasias y suelen ser metástasis evidentes de tumores primarios microscópicos. En este caso, por la presencia de un nódulo pulmonar en la tomografía y por el antecedente de hábito tabáquico, se puede considerar un posible tumor de origen pulmonar. La afectación del sistema nervioso central se podría explicar por síndromes paraneoplásicos o infiltración leptomeníngea. La paciente de este caso presenta poliadenopatías supra e infradiafragmáticas que no siguen un territorio ganglionar en concreto que orientase hacia un posible tumor primario. Además, serían muy infrecuentes la infiltración de médula ósea, que explicase la pancitopenia, y las poliadenopatías, sin evidenciarse afectación de órgano sólido, por lo que este diagnóstico queda excluido2.
El lupus se asocia a un aumento del riesgo de neoplasias, en especial el linfoma, que puede cursar con poliadenopatías. En un estudio realizado por Bernatski et al.16 se evidenció que los pacientes con lupus presentaban 4 veces más riesgo de desarrollar un linfoma no hodgkiniano que la población general. Los linfomas no hodgkinianos se manifiestan con linfadenopatías y hepatoesplenomegalia, síntomas de tipo B (fiebre, pérdida de peso y sudoración nocturna), aumento de la LDH y la β2-microglobulina, polineuropatía paraneoplásica, infiltración pulmonar o del sistema nervioso central, y banda monoclonal en el caso de células B maduras. También es frecuente la infiltración de la médula ósea que cursa con citopenias. La β2-microglobulina es un marcador inespecífico pero relativamente sensible de afectación neoplásica y posee valor pronóstico en enfermedades linfoproliferativas17. El CEA 125 también se ha usado para el seguimiento de algunos linfomas. Se requiere de confirmación anatomopatológica para llegar al diagnóstico de linfoma.
Diagnóstico clínico del presentador (Dra. Martínez-Morillo)Integrando los datos con los síntomas clínicos de la paciente, parece razonable la necesidad de descartar una enfermedad linfoproliferativa como causante de su enfermedad actual.
El diagnóstico de linfoma no hodgkiniano sería plausible por la presencia de linfadenopatías y esplenomegalia, banda monoclonal, afectación del estado general con pérdida de peso, elevación de la LDH, la β2-microglobulina, el CEA 125 y los datos compatibles con infiltración hepática. Además, la edad de la paciente, y el antecedente de LES y de timoma, aumentan el riesgo de desarrollar este tipo de neoplasias.
La pancitopenia grave se podría explicar por la infiltración de la médula ósea. Esta afectación es frecuente pero parcheada, por lo que un aspirado puede resultar insuficiente; en muchas ocasiones, se requiere una biopsia de médula ósea con tinciones inmunohistoquímicas para llegar al diagnóstico. Las manifestaciones neurológicas, tanto del sistema nervioso central como periférico, se podrían justificar por síndromes paraneoplásicos o por infiltración. Dicha afectación del sistema nervioso central puede no ser visible con resonancia magnética sin contraste y una punción lumbar única suele no ser rentable para aislar células malignas. También cabría destacar la afectación del v par craneal, también conocido como «numb chin syndrome» (síndrome de la barbilla dormida), que típicamente se ha asociado a neoplasias ocultas, en concreto con linfomas.
Por todo ello, mi diagnóstico definitivo es el de linfoma no hodgkiniano.
La prueba diagnóstica necesaria sería la biopsia ganglionar. Para el diagnóstico de linfoma es necesario obtener material por exéresis18. La punción aspirativa puede ser orientativa pero raramente diagnóstica. Si las adenopatías axilares o inguinales detectadas por la tomografía son de tamaño significativo, esta sería la primera opción. De lo contrario, la ecoendoscopia con biopsia con aguja gruesa para acceder a una adenopatía subcarinal sería la mejor alternativa.
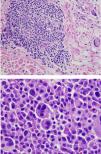
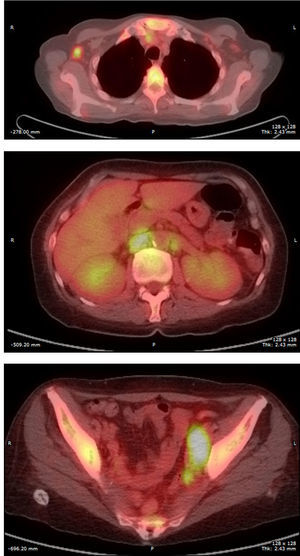
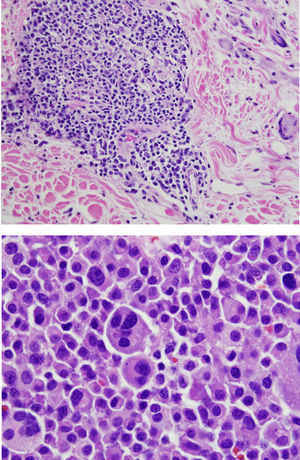
Resultado definitivo del presentador (Dra. Gómez Caballero)En primer lugar, se realizó una PET SCAN que mostró la presencia de múltiples adenopatías laterocervicales, mediastínicas, abdominales e inguinales hipermetabólicas (fig. 1). Pero la prueba que resultó diagnóstica fue una biopsia ganglionar, en la que se observó una proliferación linfoide constituida por células grandes atípicas de tipo inmunoblástico, algunas con núcleos irregulares y citoplasmas abundantes con grados variables de transformación secretora. Acompañando al crecimiento tumoral se observa una población de células atípicas con diferenciación plasmocelular, siendo estos hallazgos compatibles con linfoma plasmablástico (fig. 2).
ComentarioLa supervivencia de los pacientes con LES ha cambiado durante las últimas décadas y este hecho se ha atribuido al diagnóstico, el tratamiento temprano y el control de la enfermedad. Como consecuencia, el aumento de la expectativa de vida pone en evidencia la presencia de enfermedades crónicas y complicaciones tardías, como son las neoplasias.
En algunos tipos de enfermedad autoinmunitaria, incluyendo el LES, se ha demostrado que las neoplasias, predominantemente hematológicas, contribuyen al aumento de su morbilidad y mortalidad.
Investigaciones recientes demuestran que la incidencia de linfoma no hodgkiniano en (LNH) en pacientes con LES es 2 a 4 veces mayor que en la población general.
Los mecanismos responsables de la asociación entre linfoma y LES todavía son desconocidos, pero es posible que el aclaramiento alterado de células apoptóticas en médula ósea y ganglios linfáticos de los pacientes con LES influya en la estimulación ampliada de células B reactivas, aumentando el riesgo de daño estructural del ADN y de la linfogénesis. Por ello, se ha sugerido que podría existir una relación entre la actividad inflamatoria de la enfermedad y el aumento del riesgo de desarrollar enfermedad neoplásica en estos pacientes19.
El tratamiento inmunosupresor también se ha propuesto como factor predisponente para el desarrollo de linfoma en estos pacientes; sin embargo, existen casos de pacientes no expuestos a dichos fármacos que han presentado esta complicación. Así, Bernatsky et al. analizaron la incidencia de cáncer en pacientes con LES y observaron aumento del riesgo para el desarrollo de neoplasias de origen hematológico tras el primer año del diagnóstico del LES, sugiriendo que el riesgo de presentar este tipo de neoplasia no estaría totalmente relacionado con la dosis acumulada de tratamiento inmunosupresor20. En este sentido, la presencia de características clínicas de los pacientes con LES que incluyen manifestaciones hematológicas (anemia hemolítica), inmunológicas (positividad para anticuerpos anti-Ro/La), clínicas (síntomas sugestivos de síndrome de Sjögren secundario), presencia de infiltrados pulmonares y/o neumonías a repetición ha sido asociada a un mayor riesgo de desarrollo de LNH21.
Formas más agresivas clínica e histológicamente, particularmente el linfoma difuso de células grandes tipo B, constituyen aproximadamente un 30% de los pacientes con diagnóstico de LNH, siendo este subtipo el más representativo (más del 50%) en los pacientes con LES y diagnóstico de enfermedad linfoproliferativa. Se han descrito también otros subtipos de LNH en pacientes con lupus; dentro de estos subtipos se incluye el diagnosticado en nuestra paciente, el «linfoma plasmablástico», que está considerado como una variante histológica rara del linfoma difuso de células grandes tipo B. Este tipo de linfoma se presenta habitualmente en pacientes inmunodeprimidos, tiene un curso clínico agresivo y mal pronóstico, con una sobrevida global media de 15 meses y una mortalidad entre el 50 y el 60%. Aunque puede observarse en otras localizaciones, suele presentarse en la cavidad oral y/o mandíbula, siendo rara la afectación ganglionar linfática, lo que confiere una peculiaridad adicional a nuestro caso, ya que se presentó con afectación nodal22.
El tratamiento de las enfermedades linfoproliferativas en pacientes con LES no difiere del administrado en pacientes sin esta enfermedad.
La identificación de LNH en pacientes con LES puede resultar difícil ya que las 2 entidades comparten características clínicas similares, como linfadenopatías, fiebre, pérdida de peso, hepato/esplenomegalia y/o citopenias, entre otras. Tan solo el seguimiento estrecho de los pacientes con diagnóstico de LES puede ayudarnos a detectar de forma temprana datos clínicos y de laboratorio indicativos de enfermedad neoplásica.
El curso evolutivo de nuestra paciente, tras el diagnóstico, fue desfavorable, como cabría esperar por el tipo histológico y la estadificación del linfoma. Durante su ingreso hospitalario, presentó fiebre persistente y signos de insuficiencia respiratoria, por lo que fue trasladada a la unidad de cuidados intensivos bajo la orientación diagnóstica de shock séptico de probable origen respiratorio. Posteriormente, requirió intubación orotraqueal, ventilación mecánica, soporte con antibioticoterapia de amplio espectro y fármacos vasoactivos. Ante la ausencia de crecimiento de microorganismos en los hemocultivos y en el lavado bronqueoalveolar, se decidió iniciar quimioterapia tipo CHOP. Sin embargo, no respondió de manera adecuada al tratamiento, presentando pancitopenia severa sostenida, fallo multiorgánico y defunción.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.