Gracias al tratamiento con ciclofosfamida la letalidad de las vasculitis asociadas a ANCA ha disminuido considerablemente. Sin embargo, dicho tratamiento se relaciona con efectos adversos agudos y crónicos que contribuyen a la morbimortalidad de estas enfermedades. Por ello, uno de los retos actuales en el manejo de estas patologías consiste en encontrar terapias que sean tan efectivas como la ciclofosfamida pero con un margen de seguridad más favorable. Bajo estas condiciones, el rituximab (RTX), un anticuerpo monoclonal anti-CD20, encabeza la lista de nuevas opciones en el tratamiento de las vasculitis asociadas a ANCA y es el más firme candidato para establecerse como opción terapéutica de primera elección. En este artículo de revisión examinamos la evidencia actual sobre la eficacia y seguridad de RTX como tratamiento para las vasculitis de vasos de pequeño calibre asociadas a ANCA.
Since cyclophosphamide was introduced for the treatment of ANCA-associated vasculitis, the mortality of these diseases has decreased considerably. However, such treatment is related to acute and chronic serious adverse effects, which contribute to the morbidity and mortality of such diseases. Therefore, one of the main challenges in the treatment of such conditions is to find newer and effective therapies with a safer profile. Rituximab (RTX), an anti-CD20 monoclonal antibody stands at the top of new options for the treatment of ANCA-associated vasculitis, and is the strongest candidate to establish itself as a first choice therapeutic agent. Here, we review the rationale of RTX treatment in ANCA-associated small vessel vasculitis, and the current evidence of both its efficacy and toxicity.
Los anticuerpos dirigidos contra antígenos del citoplasma de los neutrófilos (ANCA) están fuertemente asociados a un grupo heterogéneo de enfermedades multisistémicas que se caracterizan por inflamación necrosante de vasos de pequeño tamaño y afección predominante de los riñones, vía aérea superior y pulmones1. Bajo el término de vasculitis asociadas a ANCA (VAA) se incluyen la granulomatosis con poliangítis (Wegener) (GAP), la poliangítis microscópica (PAM), el síndrome de Churg-Strauss (SCS) y la glomerulonefritis necrosante pauciinmune1. Sin tratamiento, estas vasculitis tienen un curso clínico progresivo con alta mortalidad2. La combinación de ciclofosfamida (CFM) y altas dosis de glucocorticoides (GC) logra la remisión en 80-90% de los pacientes con VAA, 75% de los cuales la tienen en forma completa3–5. Desafortunadamente, más de la mitad de los enfermos que responden de manera inicial al tratamiento presentará recaídas4.
Además de las complicaciones derivadas de la propia enfermedad, el tratamiento se relaciona con efectos adversos graves que contribuyen a la morbimortalidad a largo plazo, pero también a plazo corto, incluso durante el primer año6,7. El uso continuo de CFM se relaciona con aumento en la frecuencia de infecciones por oportunistas, infertilidad, cáncer de vejiga, cistitis hemorrágica y neoplasias hematológicas3, mientras que los efectos de los GC son bien conocidos8–10. Dada la toxicidad de estos fármacos, existe la necesidad de contar con nuevas opciones terapéuticas, igual de efectivas pero con un mayor margen de seguridad. En particular, el rituximab (RTX) ha emergido como una alternativa muy plausible en el tratamiento actual de las VAA, a grado tal que ha sido recientemente aprobado por la Food and Drug Administration (FDA) como tratamiento eficaz en estas patologías11.
Linfocitos B en la fisiopatología de las vasculitis asociadas a ANCADurante los últimos años ha sido posible establecer que los linfocitos B tienen un papel fundamental en la patogénesis de diversas enfermedades autoinmunes12. Específicamente en las VAA, existe un mayor porcentaje de células B activadas en pacientes con enfermedad activa13. Además, los ANCA, marcadores característicos de estas vasculitis, son producidos por linfocitos B14. Finalmente, en biopsias nasales, de pulmón y tejido orbitario de pacientes con GPA se han identificado grupos anormales de células B adyacentes a células PR3-ANCA positivas, que forman estructuras semejantes a folículos y que interesantemente desaparecen después del tratamiento con RTX15–18.
Características generales del rituximabRTX es un anticuerpo monoclonal quimérico que integra la región variable anti-CD20 de una inmunoglobulina (Ig) murina con la región constante de una IgG1 humana. El CD20 es una proteína de 297 aminoácidos que posiblemente funciona como un canal de calcio. Dicha proteína solo se expresa en el linaje de las células B y desempeña un papel en la activación, proliferación y diferenciación de estas células19. La unión del RTX al CD20 provoca la muerte de los linfocitos B por diversos mecanismos que incluyen citotoxicidad celular dependiente de anticuerpos (mediada por macrófagos y células NK −natural killer−), lisis mediada por complemento, inducción de apoptosis y sensibilización a agentes citotóxicos o glucocorticoides20. El medicamento provoca una depleción rápida de los linfocitos B de la circulación periférica, los cuales permanecen indetectables durante 6 a 12 meses21. Sin embargo, recientemente se ha descubierto que las células B no son eliminadas por completo en los tejidos linfoides, y por ende se piensa que el efecto benéfico del RTX no depende solamente de la depleción de los linfocitos B, sino que también podría incluir modulación de citocinas e incremento de la población de linfocitos T reguladores22,23. Dada la mayor experiencia, inicial aplicación y efectividad probada en otras enfermedades, la aprobación por la FDA y la Agencia Europea de Medicamentos para este fármaco se dio en años pasados para linfomas no-Hodgkin refractarios y artritis reumatoide (AR), y fue en este año que se otorgó para las VAA11.
Dosis de rituximabExisten dos dosificaciones en uso común: la empleada para tratamiento de linfoma (375mg/m2/semana×4 semanas) y la usada para tratar la AR (1g/semana x 2 semanas). En el tratamiento de las VAA, la dosis de linfoma ha sido utilizada más frecuentemente24–42, aunque la dosis de AR es igualmente eficaz17,18,43–46, como ha quedado demostrado en series de casos donde se han empleado ambos protocolos25,47,48. Otros reportes49–54 han utilizado dosis menores de RTX con resultados menos halagadores y por tanto, al momento la dosis empleada puede ser la de linfoma o la de AR55. En nuestra experiencia personal56, la dosis empleada ha sido siempre la de AR, incluso a dosis ligeramente menor, por razones de disponibilidad y economía, y tanto en enfermedad granulomatosa como vasculítica, hemos tenido respuestas favorables con la ventaja de mayor comodidad para el paciente, y un impacto económico menor. Este aspecto, la relación costo-beneficio, es uno que requiere de evaluación detallada ya que en ciertos ambientes, una limitante para el empleo del RTX es su alto costo, difícil de sostener en algunos países y/o sistemas sanitarios.
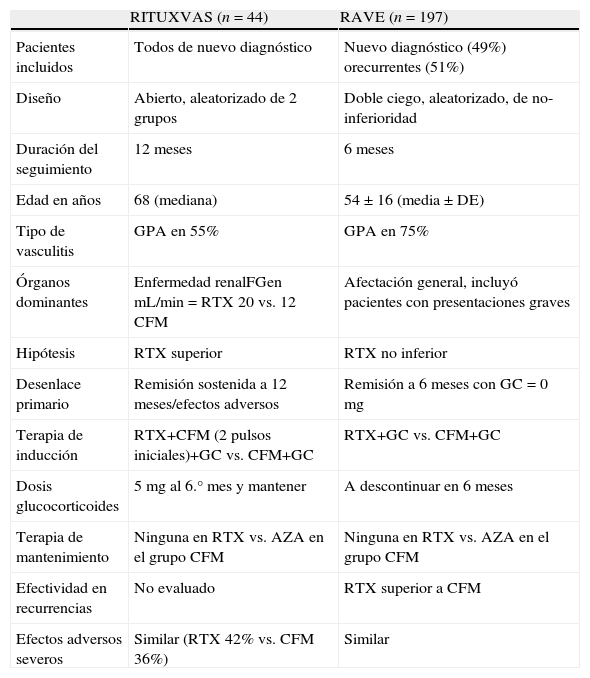
Tratamiento de VAA de nuevo diagnósticoEl tratamiento de inducción a la remisión con RTX ha sido evaluado en dos ensayos clínicos aleatorizados, multicéntricos26,34 y un ensayo abierto de grupo único46. El mayor estudio (RAVE)34 incluyó 197 pacientes (relación GPA:PMA de 3 a 1), de los cuales el 49% presentaban enfermedad de nuevo diagnóstico. Con el objetivo de demostrar la no inferioridad del RTX como tratamiento de inducción, los enfermos fueron aleatorizados para recibir el anti-CD20 (375mg/m2/semana×4 dosis) o CFM (2mg/kg/día vía oral) en combinación con GC en dosis decrecientes. La remisión completa (BVAS/WG=0) en ausencia de terapia esteroidea a los de 6 meses (medida de desenlace principal) fue conseguida en el 64% de los pacientes tratados con RTX y en el 53% de los enfermos del grupo de CFM, un resultado que cumplió el criterio de no inferioridad (p<0,001). En el análisis por subgrupos, no existieron diferencias en la respuesta al tratamiento en pacientes con involucro renal grave o hemorragia alveolar, sin embargo, el RTX fue más efectivo que la CFM para inducir la remisión en pacientes con enfermedad recurrente (67 vs. 42%, respectivamente, p=0,01).
El segundo ensayo clínico aleatorizado (RITUXVAS)26 estuvo constituido por 44 pacientes con diagnóstico reciente de una VAA, todos con afección renal. Treinta y tres pacientes fueron tratados con RTX (375mg/m2/semana x 4 dosis) y dos bolos de CFM intravenosa (15mg/kg) y comparados con 11 pacientes cuya terapia consistió en CFM i.v. por 3 a 6 meses. Ambos grupos recibieron la misma pauta de GC (1mg/kg/día inicial, con reducción a 5mg/día a los 6 meses). A 12 meses de seguimiento, la medida de desenlace principal, definida como el índice de remisión sostenida (76% RTX vs. 82% CFM) y el número de eventos adversos graves (42% RTX vs. 36% CFM) fue similar en ambos grupos. Es importante mencionar que el régimen de RTX no mostró ser superior al tratamiento con CFM, principalmente en cuanto al beneficio esperado en el perfil de seguridad. Las características principales del estudio RAVE34 y el RITUXVAS26 se comparan en la tabla 1.
Comparación de las características generales de RITUXVAS (26) y RAVE (34)
| RITUXVAS (n=44) | RAVE (n=197) | |
| Pacientes incluidos | Todos de nuevo diagnóstico | Nuevo diagnóstico (49%) orecurrentes (51%) |
| Diseño | Abierto, aleatorizado de 2 grupos | Doble ciego, aleatorizado, de no-inferioridad |
| Duración del seguimiento | 12 meses | 6 meses |
| Edad en años | 68 (mediana) | 54±16 (media±DE) |
| Tipo de vasculitis | GPA en 55% | GPA en 75% |
| Órganos dominantes | Enfermedad renalFGen mL/min=RTX 20 vs. 12 CFM | Afectación general, incluyó pacientes con presentaciones graves |
| Hipótesis | RTX superior | RTX no inferior |
| Desenlace primario | Remisión sostenida a 12 meses/efectos adversos | Remisión a 6 meses con GC=0mg |
| Terapia de inducción | RTX+CFM (2 pulsos iniciales)+GC vs. CFM+GC | RTX+GC vs. CFM+GC |
| Dosis glucocorticoides | 5mg al 6.° mes y mantener | A descontinuar en 6 meses |
| Terapia de mantenimiento | Ninguna en RTX vs. AZA en el grupo CFM | Ninguna en RTX vs. AZA en el grupo CFM |
| Efectividad en recurrencias | No evaluado | RTX superior a CFM |
| Efectos adversos severos | Similar (RTX 42% vs. CFM 36%) | Similar |
AZA: azatioprina; CFM: ciclofosfamida; DE: desviación estándar; FG: filtrado glomerular; GPA: granulomatosis con poliangítis; GC: glucocorticoides; RTX: rituximab.
Finalmente, en una cohorte prospectiva de 23 pacientes46 con enfermedad generalizada (13 GPA, 10 MPA), 22 de los cuales tenían presentación de novo, el tratamiento con RTX (1g en los días 0 y 14) en combinación con bolos de CFM i.v. cada 14 días (6 dosis) consiguió la remisión completa de todos los pacientes en un lapso de 6 meses. Debe recalcarse que en este estudio no se incluyeron pacientes con afección renal grave (creatinina sérica>5,7mg/dL), hemorragia alveolar o vasculitis cerebral.
En conclusión, estos tres estudios han demostrado que la combinación de RTX y GC no es inferior a la terapia estándar con CFM como tratamiento de inducción en pacientes con nuevo diagnóstico de GPA o PMA. El RTX puede ser utilizado como primera opción en pacientes con enfermedad grave, recurrente, que sean intolerantes a la ciclofosfamida o en quienes existe un alto riego de infertilidad o malignidad55.
Terapia de mantenimiento con rituximabEl tratamiento de mantenimiento habitual de las VAA se basa en la combinación de GC y azatioprina o metotrexato después de 3-6 meses de CFM57–59. El objetivo de esta etapa es prevenir las recaídas que pueden asociarse con daño orgánico importante y al mismo tiempo, limitar la toxicidad farmacológica. Aunque existe uniformidad en cuanto a la selección de los inmunosupresores utilizados para esta fase del tratamiento, tanto la duración de la misma como la pauta de disminución de los fármacos que la constituyen (principalmente en el caso de los GC) varían ampliamente60, haciendo difícil las comparaciones con nuevos medicamentos.
En el caso de RTX, existe poca información sobre su eficacia como terapia de mantenimiento así como del tipo de protocolo de administración que debe utilizarse. Dependiendo del estudio analizado, algunos pacientes han sido tratados solo cuando existen recaídas evidentes clínicamente, usualmente con la misma dosis utilizada al inicio o con dosis menores, mientras que en otros suele utilizarse una técnica de prevención, es decir, administración a intervalos fijos, cuando existe elevación de los niveles de ANCA o cuando se inicia la reconstitución de la subpoblación de linfocitos B contra los que se dirige RTX (entre los 6 y 12 meses del tratamiento inicial).
Recientemente dos estudios presentados en forma de resumen, con un período de seguimiento prolongado (22-28 meses)61,62 han concluido que la terapia continua con RTX estaría relacionada con un bajo índice de recidivas y complicaciones. En el primero de ellos, con 85 pacientes −75% con GPA−61, se comparó un tratamiento protocolizado con infusiones de 1g de RTX cada 6 meses durante 2 años, contra un tratamiento con RTX (a dosis de linfoma o de AR) únicamente en caso de recaídas. Los pacientes tratados de manera continua presentaron un índice significativamente menor de recaídas (22 vs. 71%, p<0,01) sin diferencia en la frecuencia de efectos adversos. Resultados semejantes han sido reportados en un trabajo retrospectivo de 72 pacientes62 con VAA tratados de manera repetida cada 4 meses con el anticuerpo monoclonal.
En contraste con tales estudios, en el reporte a largo plazo de los pacientes del estudio RAVE63 donde se utilizó un único ciclo del anticuerpo monoclonal, se informó que el porcentaje de enfermos que permanecían en remisión y libres del uso de GC a los 12 y 18 meses de seguimiento era semejante entre el grupo de CFM y del RTX. Además, el número de recurrencias y el número de pacientes que tuvieron al menos una recaída no fue diferente entre ambos grupos.
Por el momento, aún está por definirse el protocolo más efectivo de la terapia de mantenimiento con RTX y su eficacia a largo plazo. En un esfuerzo por responder a estas cuestiones, actualmente se lleva a cabo un estudio multicéntrico, aleatorizado (MAINRITSAN) que tiene por objetivo comparar la eficacia de RTX vs. AZA como tratamiento de mantenimiento de las VAA (http://clinicaltrials.gov).
Recaídas después del tratamiento inicial con rituximabAunque RTX ha mostrado ser efectivo para inducir remisión en la mayoría de los casos reportados, hasta el 30-50% de los pacientes sufren alguna recaída en los primeros dos años posteriores al tratamiento22. Sin embargo, el retratamiento de estos pacientes suele ser igualmente eficaz que la primera vez que se empleó RTX20,22,38,41,42,45,46,54,57,58, aunque el protocolo y la dosis para tal efecto aún no están bien definidos.
En cuanto a marcadores de predicción de recaídas, no hay información sólida al respecto. Las recurrencias pueden o no relacionarse con un aumento en los niveles de ANCA, si bien en la mayoría de los trabajos estas ocurren sin un cambio importante en los niveles de estos autoanticuerpos25,27,33. Además, aunque en el estudio RAVE34,63 las recaídas se observaron más comúnmente en pacientes con positividad para PR3-ANCA, este no ha sido el caso en otras series25,27,33. En cuanto a las cifras de linfocitos B en sangre periférica tampoco se ha observado que sean de utilidad para predecir un nuevo brote de actividad, pues cerca de la mitad de los mismos ocurren antes de la repoblación de células B y un tercio de aquellos pacientes en quienes los linfocitos B han vuelto a valores normales no experimentan recaídas25. Ello podría deberse a que las células B que se encuentran en los tejidos no suelen eliminarse por completo con el tratamiento con anti-CD2015–18. Por el momento, ningún marcador es un predictor confiable de recaídas55.
Tratamiento de enfermedad refractariaEn la literatura referente a las vasculitis sistémicas existen diferentes conceptos de enfermedad refractaria. Bajo este término pueden englobarse pacientes en los que los síntomas de la enfermedad permanecen sin cambio, aumentan o reaparecen después de la terapia con CFM y GC, aquellos en los que no hay una respuesta objetiva con el uso de escalas de medición de actividad (como el índice actividad de vasculitis de Birmingham-BVAS) o pacientes que son intolerantes a CFM o tienen contraindicaciones para su uso64,65. Así, en las publicaciones de VAA tratadas con RTX el término refractario suele referirse a todas las situaciones en las cuales la enfermedad no puede controlarse ya sea por intolerancia o resistencia al tratamiento65.
La principal indicación para la administración de RTX en GPA, MPA y SCS ha sido justamente enfermedad refractaria al tratamiento habitual, con cerca de 250 pacientes reportados18,24,25,27–36,38–45,47–54,66–68, de los cuales >80% consiguieron una respuesta parcial o completa. En las series que han incluido ≥10 pacientes17,25,27–29,32–34,47,69, incluyendo el ensayo clínico aleatorizado RAVE34, el tratamiento con RTX resultó ser más efectivo que la CFM (mencionado arriba) y que otros inmunosupresores como tratamiento de inducción en pacientes refractarios. En todas los reportes se ha documentado la depleción periférica de los linfocitos B en las primeras 4 semanas del tratamiento con una duración de promedio de 8 meses22 y en la mayoría se ha documentado la negativización de los ANCA con disminución de los reactantes de fase aguda. Es importante señalar que las manifestaciones clínicas refractarias que han sido reportadas incluyen no solo la afección clásica a nivel de vía aérea superior e inferior o afección renal, sino también manifestaciones menos frecuentes como escleritis, vasculitis cerebral, pseudotumor orbitario o afección del sistema nervioso central18,24,25,27–36,38–45,47–54,66–68.
Debe destacarse que en algunos estudios se han utilizado otros inmunosupresores (CFM, leflunomida) de manera concomitante con RTX24,26,46. Dado que el tiempo promedio para lograr la remisión después del uso de RTX es de 2 meses, el uso de estos medicamentos puede ser de utilidad principalmente en pacientes con presentaciones graves y enfermedad rápidamente progresiva55. Sin embargo, la administración de RTX como monoterapia en el estudio RAVE34,63 fue tan efectiva como la CFM para el tratamiento de inducción y mantenimiento en pacientes con VAA, por lo que queda por aclarar en los próximos años si el RTX debe utilizarse o no en combinación con otros fármacos inmunosupresores.
Tratamiento de manifestaciones de enfermedad granulomatosaEn la GPA ciertas manifestaciones clínicas son consecuencia de la formación de masas granulomatosas con un componente vasculítico menor, lo que suele clasificarse como la forma limitada de la GPA70. La enfermedad granulomatosa incluye afección a nivel ocular (pseudotumororbitario, escleritis nodular, dacriocistitis), auditivo (hipoacusia por infiltración granulomatosa de oído medio e interno), de vía aérea superior e inferior (destrucción nasal y de senos paranasales, estenosis subglótica, masas en parénquima pulmonar y bronquios) y del sistema nervioso central (paquimeningitis o afección de la glándula hipófisis)70.
Aunque un estudio piloto de 8 pacientes54 reportó que el RTX no era efectivo en el tratamiento de las manifestaciones granulomatosas, series más recientes y con mayor número de enfermos han demostrado índices de remisión mayores al 80%17,18,24,25,30–32,36,37,39–41,43,45,47,48,55,56,66,68,69. De hecho, en la cohorte más grande de pacientes con enfermedad refractaria de cabeza y cuello (n=34), cerca del 90% de los enfermos tratados con RTX (14 pacientes con protocolo de linfoma y 20 con protocolo de AR) respondieron parcial o completamente en un período de 6 meses47. En particular, 4 de 5 pacientes con enfermedad retroorbitaria respondieron bien al tratamiento con RTX, como ha sido descrito en otros casos37,39,47,66. A pesar de la efectividad del tratamiento, estas manifestaciones suelen requerir de ciclos repetidos de RTX para obtener una respuesta completa47. En resumen, el RTX puede recomendarse en el tratamiento de manifestaciones refractarias de cabeza y cuello de pacientes con GPA55.
Efectos adversosCon base en la amplia experiencia con el uso de RTX en el tratamiento de linfomas, se ha establecido que el medicamento tiene un alto margen de seguridad71. El efecto adverso más frecuente lo constituyen las reacciones alérgicas presentes durante la infusión, que usualmente consisten de cefalea, fiebre, escalofrío, náusea, rinitis, prurito, astenia y urticaria72. Estos síntomas suelen ser leves, se presentan en el 35-45% de los casos, son más frecuentes tras la primera administración y se observan en los primeros 30 a 120 minutos pos-tratamiento72. La premedicación con antihistamínicos, analgésicos no esteroideos o GC disminuye la aparición de estos efectos.
Probablemente el efecto adverso más temido son las infecciones; su incidencia se sitúa entre el 12 y 50%25,28,47, siendo las respiratorias las más frecuentes. Su presencia se ha relacionado con neutropenia y reducción de los niveles séricos de inmunoglobulinas (Ig). Después de un ciclo único de RTX existen pocos cambios en el nivel sérico de Ig, sin embargo, con el paso del tiempo los niveles de IgM pueden descender y con ciclos repetidos, los niveles de IgG también se ven afectados73. De hecho, un estudio retrospectivo de 179 pacientes (98 de los cuales tenían diagnóstico de VAA) tratados con ciclos repetidos de RTX (4 en promedio) documentó que el desarrollo de hipogamaglobulinemia es frecuente y está relacionado con la presencia de infecciones graves74.
Anecdóticamente, existen reportes del desarrollo de leucoencefalopatía multifocal progresiva en 2 pacientes con lupus eritematoso sistémico y un paciente con AR, lo cual no ha sucedido en las VAA75,76. Este ha sido un efecto adverso muy citado como potencial, pero que en realidad parece sobreestimado y no existe al momento evidencia de gran riesgo en estas enfermedades. En los estudios RAVE34 y RITUXVAS26, no hubo diferencias entre el grupo de RTX y CFM en cuanto al número de eventos adversos documentados.
ConclusionesEl RTX ha mostrado ser un tratamiento efectivo y seguro en VAA tanto en casos de reciente diagnóstico como en refractarios a tratamiento estándar con CFM, lo que permite vislumbrar que el futuro cercano, se posicione a la par que la CFM como terapia de inducción a remisión en estas enfermedades, mientras que su papel en la terapia de mantenimiento es aún incierta, puesto que se requiere identificar esquemas de administración seguros, cuyos criterios se desconocen al momento. Este entusiasmo debe de ser ponderado con la ineludible prueba del tiempo, ya que no existen datos de seguimiento a largo plazo. Es factible que en ciertos grupos de pacientes, particularmente aquellos con enfermedad grave, aquellos con comorbilidad, particularmente la que conlleva a mayor riesgo de infecciones, pacientes con enfermedad refractaria identificados tempranamente como potencialmente susceptibles de recaídas frecuentes, y pacientes en edad pediátrica o con deseo manifiesto y potencial fértil, el RTX pueda en el futuro tomar ventaja sobre la CFM como terapia inicial. Un aspecto a considerar es la probabilidad de que no todos los pacientes, especialmente aquellos que reciben RTX en el contexto de enfermedad refractaria y previamente requirente de otros inmunosupresores, ameriten dosis y tiempos iguales de administración de RTX, definiendo distintos fenotipos de respuesta a RTX. Esto es particularmente importante mientras se tengan más datos de sus efectos a largo plazo, y la existencia de estudios costo-beneficio, especialmente en países con limitados recursos como el nuestro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.