Evaluar la efectividad, la seguridad y los costes de etanercept biosimilar (BS) en pacientes con artritis reumatoide (AR), espondiloartritis (EspA) y artritis psoriásica (APs) y en comparación con su original, en condiciones de práctica clínica habitual.
Pacientes y métodosEstudio observacional retrospectivo. Se incluyeron 138 pacientes con AR, EspA o APs tratados con al menos una dosis de Benepali® (n=79) o Enbrel® (n=59). Como desenlace principal de efectividad del BS o de su original se usó el tiempo de retención del fármaco. Como desenlace secundario de efectividad se midió la proporción de pacientes que alcanzaban baja actividad o remisión a las 52semanas. La seguridad fue evaluada mediante tasas de incidencia de efectos adversos. Se hizo un análisis de minimización de costes.
ResultadosNo se observaron diferencias en cuanto a retención del tratamiento (mediana [intervalo de confianza del 95%, IC95%] de 12,0meses [10,2-12,0] para BS y 12,0 meses [12,0-12,0] para el original). Se obtuvieron mejorías similares después de 52semanas en actividad inflamatoria y función física, excepto en los pacientes con EspA y APs, que en general obtuvieron mejores valores de BASDAI y ASDAS con el BS. No se registraron diferencias en el número total de efectos adversos (0,43 eventos/pacientes-año con BS frente a 0,53 con original). El uso del BS, en lugar de su original, supuso un ahorro neto para el centro de 118.383,55€ (1.747,2€/pacientes-año).
ConclusionesEl uso del BS parece tan eficaz y seguro como su original y mucho más coste-efectivo.
To assess the effectiveness, safety and cost of Etanercept biosimilar in patients with rheumatoid arthritis (RA), spondyloarthritis (SpA) and psoriatic arthritis (PsA) compared to the standard drug in real clinical practice.
Patients and methodsRetrospective observational study. Case series of 138 patients with RA, SpA or PsA treated with at least one dose of Benepali® (n=79) or Enbrel® (n=59). Drug retention time was the primary efficacy endpoint compared to the biosimilar and the original. The proportion of patients achieving low disease activity or remission after 52weeks was used as the secondary outcome. Safety was assessed by means of the adverse effects incidence rate. A cost minimization analysis was performed.
ResultsNo differences were observed regarding treatment retention time between drugs (median [95% confidence interval, 95%CI] at 12.0months [10.2-12.0] for the biosimilar and 12.0months [12.0-12.0] for the original). Similar improvements, in terms of inflammatory activity and physical function, were obtained after 52weeks except for patients with SpA and PsA who, in general, experienced improvements of BASDAI and ASDAS with the original compared with the biosimilar. No significant differences were observed in the total number of adverse effects (.43 events/patient-years versus the biosimilar and .53 versus the original). Using the biosimilar in place of the original drug resulted in a net savings of 118,383.55€ (1,747.20€/patient-years) for the hospital.
ConclusionThe biosimilar Benepali is as effective and safe as the original and much more cost-effective.
Las enfermedades articulares inflamatorias, como la artritis reumatoide (AR), la espondiloartritis (EspA) axial y la artritis psoriásica (APs), se caracterizan por inflamación crónica, destrucción articular e incapacidad funcional1.
La base fundamental del tratamiento de estos pacientes son los fármacos modificadores de la enfermedad convencionales sintéticos (FAMEcs). Sin embargo, aproximadamente una tercera parte de los pacientes no responden a ellos y requieren fármacos modificadores de la enfermedad dirigidos sintéticos (FAMEds) o biológicos (FAMEb)2. Estos fármacos han demostrado controlar la actividad inflamatoria y mejorar la función física y la calidad de vida de estos pacientes a largo plazo. Entre los pacientes que son tratados con un FAMEb, hay una proporción significativa que no responden al tratamiento inicial o pierden eficacia después de un tiempo3, y en más del 10% se retira por efectos secundarios4. A pesar de sus ventajas, el alto precio de estos tratamientos limita su uso5. Por esto, el desarrollo de agentes biosimilares (BS), debido a su menor precio, está suponiendo una mejor accesibilidad a las terapias biológicas de un mayor número de pacientes y de una manera más precoz debido a su mayor eficiencia.
Según la Agencia Europea de Medicamentos (EMA), un BS es un fármaco biológico que contiene una versión de la sustancia activa de un producto biológico original ya autorizado (el fármaco de referencia). Debe demostrar similitud con el fármaco de referencia en cuanto a características de calidad, actividad biológica, seguridad y eficacia, después de un ejercicio de comparabilidad completa. Un BS no es como un fármaco genérico que posee una estructura más simple y es idéntico a su fármaco de referencia6.
Enbrel® (etanercept) es un agente anti-TNF aprobado para su uso en pacientes adultos con AR activa y/o progresiva de moderada a grave, APs activa y progresiva, axial grave, en personas jóvenes con artritis idiopática juvenil, incluyendo formas poliarticulares, oligoarticulares extendidas, APs y artritis relacionada con entesitis, y psoriasis en placas grave7. Varios BS de etanercept han sido evaluados en ensayos clínicos (EC), con la promesa de ser alternativas más baratas al producto de referencia. La reducción del coste del tratamiento es la principal atracción para los BS que emergen en el mercado global8. Benepali® (SB4), del laboratorio Biogen, fue el primer BS de etanercept aprobado para su uso en enero de 2016. Son varios los estudios que han sido publicados hasta su aprobación y comercialización. Un EC multicéntrico faseiii aleatorizado, doble ciego, de grupos paralelos en 596 pacientes con AR moderada-grave que habían sido tratados previamente con metotrexato, demostró igual eficacia que Enbrel, con una respuesta ACR20 en la semana24 similar en ambos grupos (78,1% con Benepali vs 80,3% con Enbrel) y con una incidencia de eventos adversos comparable9,10. En este sentido, en un EC en fasei en población coreana (n=138) demostró un perfil de seguridad, farmacocinética y tolerabilidad equivalente entre Benepali y Enbrel. Sin embargo, Benepali presentó un perfil de inmunogenicidad más bajo que Enbrel11.
No obstante, fuera de estos EC, hasta el momento no hay estudios realizados en condiciones de práctica clínica que confirmen estos resultados. Por tanto, nuestro objetivo fue evaluar la efectividad, la seguridad y los costes del BS Benepali en pacientes con artritis inflamatoria crónica, así como la comparación con el fármaco de referencia, en condiciones de práctica clínica habitual.
Pacientes y métodosDiseño y ámbito del estudioEstudio observacional retrospectivo basado en una serie de casos de pacientes con AR, EspA axial y APs tratados con Benepali o Enbrel. Así mismo, se realizó un análisis farmacoeconómico de minimización de costes. El estudio fue llevado a cabo en el IBIMA por el Departamento de Reumatología del Hospital Regional Universitario de Málaga (HRUM), España. El protocolo para el proyecto de investigación fue aprobado por un Comité de Ética Provincial de Málaga dentro del cual se realizó el trabajo y que se ajusta a las disposiciones de la Declaración de Helsinki. El estudio fue aprobado por el Comité Ético de Investigación Clínica del hospital (CEIC). Se obtuvo el consentimiento informado de todos los participantes individuales incluidos en el estudio.
PacientesSe incluyeron todos los pacientes de forma consecutiva que habían iniciado tratamiento con el BS (desde marzo de 2017 hasta agosto de 2018) o su fármaco original (desde febrero de 2015 hasta agosto de 2018) y hubieran recibido al menos una dosis de tratamiento. Los criterios de selección fueron: edad ≥18años, AR según los criterios de American College of Rheumatology/Liga Europea Contra el Reumatismo 201012, o EspA axial según los criterios ASAS/EULAR 201013, o APs según los criterios CASPAR 200614. Se excluyeron pacientes con cualquier otra enfermedad inflamatoria o reumática, excepto síndrome de Sjögren secundario.
ProtocoloSe reclutaron todos los pacientes que cumplían los criterios de inclusión y ninguno de exclusión. Todos los pacientes han sido seguidos prospectivamente en una unidad de terapia biológica específic a (UTB) según un protocolo preestablecido de recogida sistemática de datos. Este protocolo incluye, entre otras variables, datos sobre la actividad de la enfermedad, función física y efectos adversos. La UTB revisa a los pacientes tratados con terapias biológicas cada 3meses en consulta general y específica (de biológicos subcutáneos) de forma alterna. La prescripción con Benepali o Enbrel se realizó en función del criterio de cada médico.
Variables y definicionesEfectividadComo desenlace principal de efectividad del BS o su original se usó el tiempo de retención (supervivencia) del fármaco, medido como el tiempo desde el inicio hasta la suspensión del tratamiento o pérdida de seguimiento o fecha de finalización del estudio a las 52semanas. Como variables de desenlace secundarias de efectividad se incluyeron: efectividad del BS y de su original medida como la proporción de pacientes que alcanzaban baja actividad o remisión a las 52semanas, basado en DAS28, BASDAI y ASDAS.
SeguridadLa seguridad fue evaluada mediante el cálculo de las tasas de incidencia de efectos adversos entre 2015 y 2018. Esto se hizo dividiendo el número total de efectos adversos por el sumatorio de tiempo de seguimiento de todos los pacientes en años (número de eventos/pacientes-año). Se clasificaron los efectos adversos en leve-moderados, graves y serios, entendiendo por leve-moderados los signos o síntomas fácilmente tolerados, que pueden interferir con las actividades habituales y requieren intervención o tratamiento médico; graves, los que incapacitan e inhabilitan para efectuar actividades habituales y requieren intervención o terapia médica; y serios, los que producen la muerte, generan riesgo para la vida, requieren o prolongan hospitalización, producen anomalía congénita o provocan incapacidad persistente significativa15.
Estudio económicoLos costes de cada tratamiento se calcularon por coste paciente-semana teniendo en cuenta el precio de adquisición del medicamento, correspondiente al último concurso de la plataforma provincial de compras. No se tuvieron en cuenta los costes derivados de su administración en el hospital. De esta forma se obtuvo un precio de 5.540€ por año de tratamiento con el BS y de 7.306€ por año de tratamiento con su fármaco original. Para analizar los costes de manera global, se calculó el coste total del tratamiento mediante la suma de los costes parciales en cada uno de los pacientes a lo largo de todo el estudio. En los pacientes con BS, además, se realizó un cálculo del coste que hubiera supuesto para cada paciente de haber sido tratado con el fármaco original. El precio oficial de cada fármaco se calculó a partir del precio de venta del laboratorio (PVL): 106,55€ por inyección de 50mg del BS, y de Enbrel 140,5€, que correspondía al coste semanal del tratamiento por paciente. Coste total: resultado que proviene de haber multiplicado el coste semanal por el total de paciente-semana. Coste total real: coste final en euros del tratamiento administrado a los pacientes incluidos en el estudio.
Resto de variablesEn todos los pacientes se incluyó la edad (años), el sexo, la duración de los síntomas, así como la fecha de inicio del BS/original y la fecha del evento como la fecha de suspensión del tratamiento. Se recogieron los índices de actividad Disease Activity Score 28 articulaciones (DAS28) con velocidad de sedimentación (DAS28-VSG) (continua, rango 0-9) (<2,6 puntos: remisión, ≤3,2: actividad baja actividad), Clinical Disease Activity Index (CDAI; continua, rango 0-76) y Simplified Disease Activity Index (SDAI; continua, rango 0-86)16, Ankylosing Spondylitis Disease Activity Score (ASDAS; continua; <1,3 baja actividad, 1,3-2,1 moderada actividad, 2,1-3,5 alta actividad, >3,5 muy alta actividad), Bath Ankylosing Spondylitis Disease Activity Index (BASDAI; continua, rango 0-10; <4 baja actividad o remisión)17 según correspondiera, recogidos en la visita basal y en visita al año. Función física: Health Assessment Questionnaire (HAQ) versión española (continua, rango 0-3)18 y Bath Ankylosing Spondylitis Functional Index (BASFI; continua, rango 0-10)19. También se recogieron la presencia de erosiones radiológicas (categórica, sí/no) y variables de laboratorio: el factor reumatoide, medido en U/ml, se consideró elevado si >20U/ml; presencia de ACPA, medidos en U/ml, se consideraron positivos si >10U/ml; y HLA B27 positivo o no.
Análisis estadísticoSe realizó un análisis descriptivo. Las variables cualitativas se expresaron como número absoluto y su porcentaje y las variables cuantitativas como media y desviación típica (DE) o mediana y rango intercuartílico (RIC), según su distribución. El ajuste de la normalidad de las variables continuas se confirmó con la prueba de Kolgomorov-Smirnov. Se usó el test t de Student para muestras independientes o Mann-Whitney en los casos de no normalidad entre la media DAS28-VSG, HAQ, PCR, VSG, BASDAI y BASFI entre la visita basal y las 52semanas. El tiempo de supervivencia de Benepali y Enbrel se analizó mediante curvas de Kaplan Meier. Se calcularon probabilidades de supervivencia y su intervalo de confianza del 95%. Para todos los análisis se consideró significativo un valor de p<0,05. Todos los datos han sido analizados mediante el programa estadístico R2.4-0.
ResultadosEntre enero de 2015 y agosto de 2018 (ambos incluidos) iniciaron tratamiento con etanercept 138 pacientes con diferentes enfermedades reumáticas: 85 (61,5%) pacientes con AR, 29 (21,0%) con EspA axial y 24 (17,3%) con APs. De estos, 79 (57,2%) han recibido BS (43 [54,4%] AR, 20 [25,3%] EA y 16 [20,2%] APs) y 59 (42,7%) el fármaco original (42 [71,2%] AR, 9 [15,2%] EA y 8 [13,5%] APs).
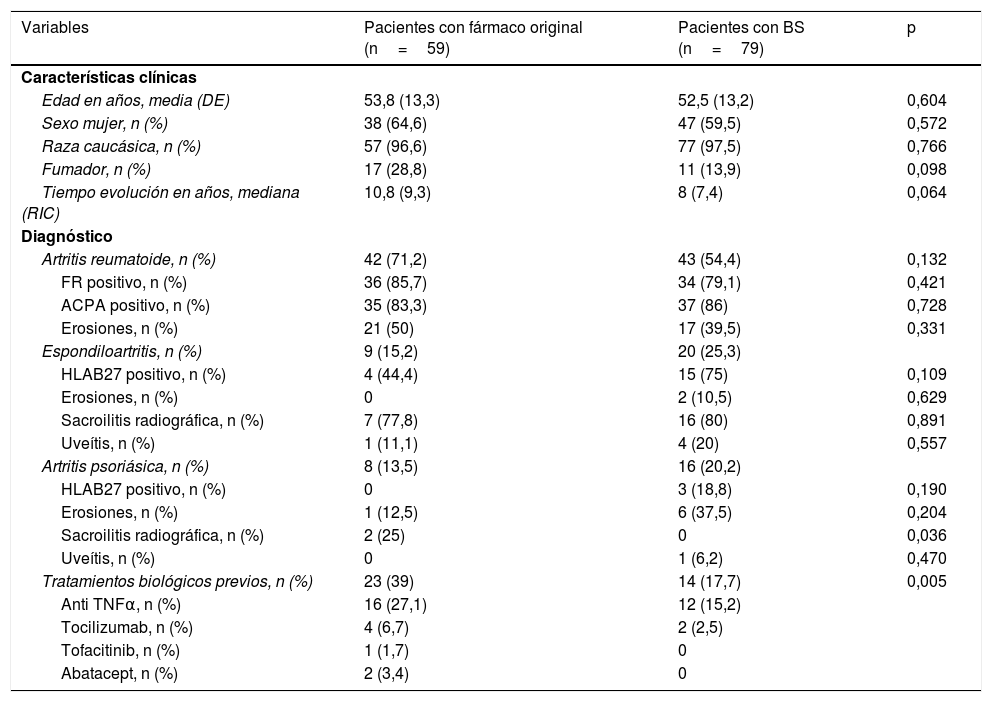
Características de los pacientesLas principales características de los pacientes de ambos grupos de tratamiento se describen en la tabla 1. La mayoría eran mujeres alrededor de 52años con una enfermedad de larga duración. Los pacientes con el fármaco original tendieron a una mayor duración de la enfermedad y a un mayor número de fumadores que los del BS.
Características basales de los pacientes
| Variables | Pacientes con fármaco original (n=59) | Pacientes con BS (n=79) | p |
|---|---|---|---|
| Características clínicas | |||
| Edad en años, media (DE) | 53,8 (13,3) | 52,5 (13,2) | 0,604 |
| Sexo mujer, n (%) | 38 (64,6) | 47 (59,5) | 0,572 |
| Raza caucásica, n (%) | 57 (96,6) | 77 (97,5) | 0,766 |
| Fumador, n (%) | 17 (28,8) | 11 (13,9) | 0,098 |
| Tiempo evolución en años, mediana (RIC) | 10,8 (9,3) | 8 (7,4) | 0,064 |
| Diagnóstico | |||
| Artritis reumatoide, n (%) | 42 (71,2) | 43 (54,4) | 0,132 |
| FR positivo, n (%) | 36 (85,7) | 34 (79,1) | 0,421 |
| ACPA positivo, n (%) | 35 (83,3) | 37 (86) | 0,728 |
| Erosiones, n (%) | 21 (50) | 17 (39,5) | 0,331 |
| Espondiloartritis, n (%) | 9 (15,2) | 20 (25,3) | |
| HLAB27 positivo, n (%) | 4 (44,4) | 15 (75) | 0,109 |
| Erosiones, n (%) | 0 | 2 (10,5) | 0,629 |
| Sacroilitis radiográfica, n (%) | 7 (77,8) | 16 (80) | 0,891 |
| Uveítis, n (%) | 1 (11,1) | 4 (20) | 0,557 |
| Artritis psoriásica, n (%) | 8 (13,5) | 16 (20,2) | |
| HLAB27 positivo, n (%) | 0 | 3 (18,8) | 0,190 |
| Erosiones, n (%) | 1 (12,5) | 6 (37,5) | 0,204 |
| Sacroilitis radiográfica, n (%) | 2 (25) | 0 | 0,036 |
| Uveítis, n (%) | 0 | 1 (6,2) | 0,470 |
| Tratamientos biológicos previos, n (%) | 23 (39) | 14 (17,7) | 0,005 |
| Anti TNFα, n (%) | 16 (27,1) | 12 (15,2) | |
| Tocilizumab, n (%) | 4 (6,7) | 2 (2,5) | |
| Tofacitinib, n (%) | 1 (1,7) | 0 | |
| Abatacept, n (%) | 2 (3,4) | 0 | |
ACPA: anticuerpos antipéptido cíclico citrulinado; DE: desviación estándar; FR: factor reumatoide; RIC: rango intercuartílico; TNF: factor de necrosis tumoral.
Veintitrés pacientes (39%) con el fármaco original habían tenido previamente otra terapia biológica, frente a 14 pacientes (17,7%) de los tratados con el BS (p=0,005), siendo en su mayoría otro anti TNFα, en 16 pacientes (27,1%) en el grupo del original frente a 12 (15,2%) pacientes en el grupo del BS. La mayoría de los pacientes tomaban concomitantemente un FAMEcs, principalmente metotrexato: 32 (54,1%) con el original y el 38 (48,8%) con BS; p=0,521. Solo un 21% de los pacientes de ambos grupos iniciaron el tratamiento en monoterapia (p=0,680). Veintidós pacientes (37,5%) con el fármaco original y 28 (35,4%) con BS (p=0,823) estaban tomando corticoides a dosis bajas al inicio (media [DE] de prednisona en tratados con el fármaco original de 3,7 [5,9] vs 4,4 [7,5] con el BS; p=0,579).
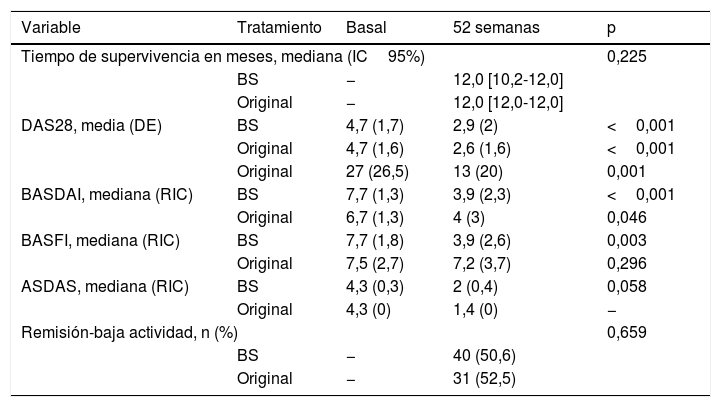
Efectividad del biosimilar frente al fármaco originalNo se observaron diferencias en cuanto la retención del tratamiento (mediana [intervalo de confianza del 95%, IC 95%] de 12,0 meses [10,2-12,0] para BS y 12,0 meses [12,0-12,0] para el fármaco original; test de logrank p=0,225). Tampoco se observaron diferencias entre los diagnósticos ni en el consumo de corticoides. Tras las 52semanas, 9pacientes (13,2%) con BS y 7 (13,5%) con el original (p=0,971) continuaban tomando corticoides a dosis bajas (dosis media [DE] de equivalente de prednisona con BS 11,8mg/día8 vs 10mg/día5,7 con el original; p=0,341.
Cincuenta y cinco pacientes (70%) en el grupo tratado con BS y 48 pacientes (81,4%) con el original (p=0,117) continuaban con tratamiento a las 52semanas. El motivo de suspensión fue en su mayoría por fallo primario en 15/24 (62,5%) con BS y 5/11 (45,5%) con el original (p=0,039). Ocho (33,3%) pacientes suspendieron el tratamiento por efectos adversos en el grupo del BS frente a 5 (45,5%) en el grupo del original. Un paciente (4,2%) con deseo de embarazo y buen control de la enfermedad suspendió el tratamiento en el grupo del BS. Un paciente en cada grupo suspendió el tratamiento por pérdida de eficacia.
Como se muestra en la tabla 2, ambos grupos de tratamiento obtuvieron mejorías similares después de 52semanas de tratamiento en términos de actividad inflamatoria, función física y reactantes de fase aguda (PCR y VSG), excepto en los pacientes con EspA y APs, que, en general, obtuvieron mejores resultados con el BS, como puede verse por los valores de BASDAI y ASDAS. Hubo mejoría significativa y sin diferencias en ambos grupos en SDAI, CDAI, NAD, NAI, EVA médico y paciente y HAQ. La proporción de pacientes que alcanzaron remisión o baja actividad de la enfermedad en la semana52 fue de 40 pacientes (50,6%) con BS y 31 pacientes (52,5%) con el original (p=0,659). Después de un año de tratamiento, se optimizó la dosis del fármaco en 8 pacientes (10,4%) tratados con BS y en 2 pacientes (3,4%) tratados con el original (p=0,121).
Datos de efectividad de ambos fármacos
| Variable | Tratamiento | Basal | 52 semanas | p |
|---|---|---|---|---|
| Tiempo de supervivencia en meses, mediana (IC95%) | 0,225 | |||
| BS | − | 12,0 [10,2-12,0] | ||
| Original | − | 12,0 [12,0-12,0] | ||
| DAS28, media (DE) | BS | 4,7 (1,7) | 2,9 (2) | <0,001 |
| Original | 4,7 (1,6) | 2,6 (1,6) | <0,001 | |
| Original | 27 (26,5) | 13 (20) | 0,001 | |
| BASDAI, mediana (RIC) | BS | 7,7 (1,3) | 3,9 (2,3) | <0,001 |
| Original | 6,7 (1,3) | 4 (3) | 0,046 | |
| BASFI, mediana (RIC) | BS | 7,7 (1,8) | 3,9 (2,6) | 0,003 |
| Original | 7,5 (2,7) | 7,2 (3,7) | 0,296 | |
| ASDAS, mediana (RIC) | BS | 4,3 (0,3) | 2 (0,4) | 0,058 |
| Original | 4,3 (0) | 1,4 (0) | − | |
| Remisión-baja actividad, n (%) | 0,659 | |||
| BS | − | 40 (50,6) | ||
| Original | − | 31 (52,5) | ||
BASDAI: Bath Ankylosing Spondylitis Disease Activityy Index; BASFI: Bath Ankylosing Spondylitis Functional Index; DAS28: Disease Activity Score 28 articulaciones.
Como se muestra en la tabla 3, no se registraron diferencias entre ambos tratamientos en el número total de efectos adversos (0,43 eventos/pacientes-año [IC95%: 0,27-0,58] con BS frente a 0,53 [IC95%: 0,33-0,73] con original). Los efectos adversos más frecuentes fueron leves-moderados (tasa de 0,41 [IC95%: 0,26-0,57] BS vs 0,49 [IC95%: 0,3-0,68] original); la mayoría fueron infecciones (bronquitis, catarros, infecciones de orina, herpes simple, herpes zóster). Un paciente (1,3%) con BS desarrolló una psoriasis paradójica. Las reacciones cutáneas en sitio de inyección fueron más frecuentes con el original (1 [1,3%] con BS vs 9 [15,3%] con el original; p=0,001), mientras que las cefaleas fueron más frecuentes con el BS (9 [11,4%] vs 0 con el original; p=0,007).
Comparación de efectos adversos de biosimilar (BS) y original
| BS (n=79) | Original (n=59) | p | |
|---|---|---|---|
| Total de pacientes con efectos adversos, n (%) | 31 (39,2) | 28 (45,9) | 0,377 |
| Total de pacientes efectos adversos leves-moderados, n (%) | 28 (35,0) | 26 (42,6) | 0,347 |
| Infecciones, n (%) | 18 (22,8) | 17 (28,8) | 0,420 |
| Reacciones en sitio de inyección, n (%) | 1 (1,3) | 9 (15,2) | 0,001 |
| Otros, n (%) | 9 (11,4) | 0 | 0,007 |
| Total de pacientes efectos adversos graves, n (%) | 0 | 0 | |
| Total de pacientes efectos adversos serios, n (%) | 3 (3,8) | 2 (3,3) | 0,428 |
| Retirada de tratamiento, n (%) | 24 (30,4) | 11 (18,6) | 0,344 |
| Ineficacia, n (%) | 15 (17,7) | 5 (8,5) | |
| Pérdida de eficacia, n (%) | 1 (1,3) | 1 (1,7) | |
| Efecto secundario, n (%) | 11 (13,9) | 5 (8,5) | |
| Deseo de embarazo, n (%) | 1 (1,3) | 0 |
Ocho pacientes (10,1%) suspendieron el BS por efectos adversos no graves (2cefaleas incapacitantes, 1aumento de disnea basal, 1gastritis, 3pacientes con infecciones de repetición y 1neutropenia). Cinco pacientes (8,5%) con el original retiraron el fármaco también por efectos adversos (1neumonía, 3pacientes con reacciones cutáneas y 1adenocarcinoma de ovario). Tres pacientes suspendieron el fármaco por efecto adverso serio (tasa de 0,04 [IC95%: 0,0-0,09] BS vs 0,04 [IC95%: −0,01 a 0,09] original): un paciente tratado con el BS sufrió una neutropenia severa, otro paciente por neumonía y el tercero por adenocarcinoma ginecológico indiferenciado, ambos tratados con el original.
Costes del biosimilarEl coste del BS durante el tiempo de seguimiento fue de 5.540€ paciente/año, frente a 7.306€ paciente/año del original. El coste total real del tratamiento en todos los pacientes con BS, que se han seguido durante 3.523,32 semanas, fue de 375.409,75€, mientras que el coste total si el tratamiento usado hubiera sido el original habría sido de 493.793,3€. Esto supuso un ahorro neto para el centro durante el seguimiento de 118.383,55€ (1.747,2€/pacientes-año).
DiscusiónEl impacto económico de las diferentes enfermedades reumáticas se debe, en gran parte, a los costes derivados de los tratamientos. Por esta razón, la elección de cada fármaco no solo debería depender de su eficacia, sino más bien de su eficiencia y de su seguridad. Hemos llevado a cabo un estudio para evaluar la eficacia, la seguridad y el coste del BS Benepali en un grupo de pacientes con diferentes enfermedades reumáticas, basándonos en nuestra práctica clínica. Hasta la fecha no se había realizado ningún estudio en práctica clínica para comparar la eficacia entre fármacos BS y de referencia. Tampoco se ha analizado la supervivencia de BS en enfermedades reumáticas inflamatorias. En nuestro estudio, todos los pacientes mostraron una mejoría significativa en parámetros de actividad y función física evaluadas a las 52semanas de tratamiento con Benepali o con Enbrel. Además, en ambos grupos la mitad de los pacientes consiguieron alcanzar un estado de remisión-baja actividad de la enfermedad por índices de actividad DAS28 y BASDAI. A esto se añade que no encontramos diferencias significativas entre ambos grupos de tratamiento en la mejoría observada en los pacientes tras 52semanas. A los 12meses solo observamos diferencias entre ambos grupos en la mediana de PCR más elevada en los pacientes tratados con Benepali, pero a pesar de haber diferencias significativas, el valor de la PCR fue inferior a 5mg/l en ambos grupos. Estos resultados tampoco podrían explicarse por mayor uso de corticoides en los pacientes con Enbrel, ya que la media de dosis usada en ambos grupos era similar. Observamos un valor de BASFI superior en los pacientes tratados con Enbrel que puede estar justificado por el mayor tiempo de evolución de la enfermedad que presentan estos pacientes.
La comparabilidad en eficacia que hemos observado es similar a la que se ha descrito en otros EC. En el estudio de Chadwick et al.20 se muestra la eficacia clínica de etanercept para AR evaluada en varios EC aleatorizados (ECA) y estudios de extensión20,21. Así mismo se evalúa la eficacia de diferentes BS como Benepali o Erelzi. En un EC faseiii realizado en 596 pacientes asignados al azar a Benepali o Enbrel22, observaron que hubo una mejoría significativa en el DAS28 en la semana24 en ambos grupos de pacientes. Alrededor del 50% de los pacientes de este estudio lograron un estado de baja actividad o remisión en la semana24 según DAS28. Además, no observaron diferencias significativas entre ambos tratamientos en la mejoría medida por DAS28 ni en otras variables de actividad como ACR20, ACR50, ni función física por HAQ22. Así mismo, en otro ECA en faseiii23 se compararon la eficacia y la seguridad de Benepali y Enbrel en la semana52 en pacientes con AR. En este estudio observaron que el 41% de los pacientes con Enbrel lograron una baja actividad de la enfermedad-remisión a las 52semanas frente a un 35% con Benepali, no mostrando diferencias significativas en ambos grupos. Además, en la semana52 también se observa una mejoría significativa en todos los parámetros de actividad y función física medidos en ambos grupos de pacientes. Sin embargo, estos datos no los hemos podido comparar con otros estudios en práctica clínica habitual porque hasta el momento solo disponemos de los resultados obtenidos por EC sobre efectividad de estos fármacos y los diferentes biológicos de referencia. Es por eso que son necesarios más datos en práctica clínica real que corroboren este beneficio.
Existen numerosos factores que influyen en el tiempo de retención de un fármaco, entre ellos la disponibilidad de alternativas de tratamiento, la efectividad, la toxicidad del fármaco, la gravedad de la enfermedad y la adherencia al tratamiento24. Un mayor tiempo de retención del tratamiento suele traducir una mayor efectividad y seguridad del mismo. Actualmente no existen estudios de supervivencia en reumatología con BS, pero sí existen estudios con su fármaco de referencia. Zink et al.25 realizaron un estudio de supervivencia de diferentes anti-TNF en AR, en el que observaron que después de un año de tratamiento el 70% de los pacientes continuaban con Enbrel. En otros estudios, como el de Khraishi et al.26, esta cifra fue del 66%. En nuestro estudio, estos datos son similares a los anteriores, y después de un año de seguimiento el 81% de los pacientes continuaban con Enbrel y el 72% continuaban con Benepali. En estos datos podemos observar que ambos grupos de tratamiento son similares en supervivencia, con un porcentaje algo superior con Enbrel.
Como hemos comentado anteriormente, la seguridad de los fármacos es un factor fundamental en la influencia de esta supervivencia. El uso de BS ha sido tema de debate en los últimos años y se han usado en práctica clínica con cautela fundamentalmente por desconocimiento de sus posibles efectos adversos27. En este sentido, los efectos adversos fueron algo más frecuentes en el grupo de Enbrel que en el de Benepali (46% vs 36%), a expensas de efectos adversos leves-moderados. Sin embargo, la retirada del fármaco fue superior con Benepali que con Enbrel (30,4% vs 18,6%) debido más a ineficacia que a efectos adversos. Esta mayor retirada del fármaco puede ser el motivo por el cual la supervivencia que observamos con Benepali fue algo inferior a Enbrel. En este sentido, aunque ambos fármacos mostraron eficacia, es sabido que hay una proporción significativa de ellos que no responden al tratamiento inicial o pierden eficacia a lo largo del tiempo3. En el ECA faseiii de Emery et al.23 se observó que el porcentaje de efectos adversos en el grupo con Benepali fue del 58%, frente al 60% con Enbrel durante el estudio hasta la semana52. También en el EC faseiii28 la incidencia de eventos adversos emergentes del tratamiento fue comparable entre ambos grupos (55,2% vs 58,2%). En nuestros datos, el perfil de seguridad de Benepali fue comparable con el de Enbrel y similar a los observados en estos y otros estudios con etanercept22,29. Además, son concordantes en que la mayoría de los efectos adversos son leve-moderados. Los efectos adversos descritos con mayor frecuencia siempre son infecciones respiratorias, alteraciones del perfil hepático y reacción en el sitio de inyección30-32.
En nuestro estudio se puede ver que, teniendo en cuenta la relación coste-efectividad de Benepali, el uso de este BS es tan eficaz como el fármaco de referencia, pero más coste-efectivo, ya que supone un gran ahorro para el hospital.
Uno de los aspectos más importantes de este estudio radica en el avance que se está consiguiendo con la nueva incorporación de dichos tratamientos, con eficacia similar a sus fármacos de referencia y que suponen una reducción de gastos hospitalarios. Según nuestros datos, el ahorro que ha supuesto el tratamiento en el grupo de Benepali en relación con el de Enbrel es de 1.747,2€/pacientes-año. En un estudio llevado a cabo por Kowalik et al.33 describen la introducción de los BS como una medida de reducción de los costes directos e indirectos en la AR. Además, no solo muestran un ahorro en la prescripción del fármaco BS sino que también, tras su comercialización, consiguen que se reduzca el precio del medicamento original. En general, los fármacos biológicos tienen asociado un alto coste, lo que contribuye a una restricción de su uso y desigualdad en diferentes países34. Dado que los BS son una alternativa de menor coste que los fármacos de referencia, la desigualdad existente en las prestaciones de asistencia sanitaria podría irse disipando35. De hecho, los análisis de impacto presupuestario tras la introducción de BS, como el de infliximab, en diferentes países europeos han demostrado que el cambio a una terapia con BS supone un importante ahorro de costes y un mayor acceso a estas terapias36.
Nuestro estudio presenta algunas limitaciones, y la principal de ellas se debe al diseño retrospectivo. Aunque el diseño es técnicamente retrospectivo, en realidad en su mayor parte es prospectivo, ya que todas las variables analizadas han sido recogidas de forma prospectiva y sistemática, basándose en un protocolo previamente diseñado. Esto explica la ausencia de pérdida de datos y los resultados tan consistentes. Una segunda limitación sería el número reducido de pacientes, lo que condicionaría la potencia estadística. Sin embargo, todos los pacientes son de práctica clínica habitual, y a pesar de ser una muestra heterogénea debido a la inclusión en el estudio de diferentes patologías (a diferencia de los ECA mencionados, que solo incluyen AR), hemos encontrado diferencias en las variables principales en el uso del BS. Por último, limitaciones debidas a diferentes tiempos de seguimiento en cada paciente y en el tiempo de evolución de la enfermedad. En cuanto a la elección del tratamiento con Enbrel o Benepali, esto ha recaído en la decisión de cada médico según las características del paciente y, obviamente, teniendo en cuenta los costes. Por ello, desde la comercialización de Benepali ha habido un aumento en la prescripción de este en comparación con Enbrel, de tal forma que se puede tratar a más pacientes al mismo precio. La reciente comercialización de Benepali y el aumento de su prescripción justifican que en nuestro estudio el porcentaje de pacientes que han recibido otros fármacos biológicos previos fue superior con Enbrel que con Benepali (39% vs 17%, p=0,005), así como un mayor tiempo de evolución de la enfermedad en pacientes con Enbrel.
En conclusión, estos resultados ponen de manifiesto la efectividad de Benepali en el control de los signos y síntomas de los pacientes con enfermedades inflamatorias articulares de forma segura y comparable a Enbrel en práctica clínica. Estos resultados son comparables a los de los EC. Además, este control de la enfermedad se mantiene a un menor coste. Benepali supone una reducción del gasto hospitalario a tener en cuenta. Estos beneficios son homogéneos, según nuestro estudio, en diferentes enfermedades reumáticas incluidas aquí; no obstante, serían necesarios más estudios, con mayor número de pacientes y la inclusión en práctica clínica de otros BS ya comercializados, para poder afianzar estos resultados.
FinanciaciónAyudas para Facultativos Investigadores de la Fundación Española de Reumatología (FER). No hubo otro apoyo financiero ni otros beneficios de fuentes comerciales.
Conflicto de interesesMarta Rojas-Giménez: charlas para MSD.
Natalia Mena-Vázquez: charlas para MSD, UCB y Roche.
Carmen María Romero-Barco: charlas/ponencias para AbbVie.
Sara Manrique-Arija: charlas/ponencias para AbbVie, Pfizer y MSD.
Inmaculada Ureña-Garnica: no tiene conflicto de intereses.
Gisela Diaz-Cordovés; charlas/ponencias para AbbVie, Pfizer y MSD.
Francisco Gabriel Jiménez-Núñez: charlas/ponencias para AbbVie, Pfizer y MSD.
Por la traducción, a la Sociedad Española de Reumatología.