Los antagonistas del factor de necrosis tumoral-alfa (ATNF) se utilizan en el tratamiento de múltiples enfermedades, como artritis psoriásica, enfermedad de Crohn, espondilitis anquilosante, artritis idiopática juvenil, generalmente, cuando son refractarias al tratamiento de primera línea1. La utilización de los ATNF se ha asociado con la inducción de enfermedades autoinmunes, como lupus eritematoso sistémico-like, vasculitis, sarcoidosis-like y, recientemente, nefritis túbulo-intersticial aguda granulomatosa. Describimos un caso de nefritis túbulo-intersticial aguda no granulomatosa en un paciente con espondiloartritis axial HLA-B27 positiva y enfermedad de Crohn en tratamiento con adalimumab.
Antagonists of tumor necrosis factor-alpha (ATNF) are used for the treatment of multiple diseases such as psoriatic arthritis, Crohn's disease, ankylosing spondylitis and juvenile idiopathic arthritis, usually, when they are refractory to first-line treatment1. The use of ATNF has been associated with the induction of autoimmune diseases such as systemic lupus erythematosus-like disease, vasculitis, sarcoidosis-like diseases and, recently, acute granulomatous tubulointerstitial nephritis. We report a case of acute nongranulomatous tubulointerstitial nephritis in an HLA-B27-positive patient with axial spondyloarthritis and Crohn's disease being treated with adalimumab.
Paciente de 55 años, trasladado desde otro centro hospitalario por elevación de creatinina (3mg/dl) en una analítica de rutina (1,2mg/dl un año antes), sin otra sintomatología.
Dentro de los antecedentes personales presentaba hipertensión arterial, diabetes mellitus tipo ii controlada con antidiabéticos orales, enfermedad de Crohn con colectomía del colon transverso, espondiloartritis axial HLA-B27 positivo, en seguimiento por Reumatología y en tratamiento con un ATNF, adalimumab, a dosis de 40mg subcutáneo cada 2 semanas desde hace 27 meses, y tramadol. Previamente también había utilizado celecoxib de forma esporádica.
En la exploración física destacaba una presión arterial de 166/86mmHg, auscultación cardiopulmonar y abdominal normales, sin edemas ni artritis o lesiones cutáneas.
La analítica al ingreso mostró una hemoglobina de 9,7g/dl con el resto de hemograma normal y sin eosinofilia, una urea de 68mg/dl (N: 20-50) y una creatinina de 3.1mg/dl (N: 0,64-1,27), con pruebas de función hepática, creatincinasa, lactato deshidrogenasa, colesterol, triglicéridos, ionograma, proteinograma e inmunoglobulinas normales. Anticuerpos antinucleares, anticuerpos anticitoplasma de neutrófilos y anticardiolipinas (IgM e IgG), negativos. Ferrocinética, tirotropina, parathotmona, antígeno carcinoembrionario, Ca19.9, antígeno prostático específico y alfafetoproteína, normales. El sistemático de orina era estrictamente normal, con un sedimento con 4 hematíes por campo y 4 leucocitos por campo y un cociente de proteínas/creatinina de 0,29, sodio en orina de 72,8mmol/l, sin existir eosinofiluria. En radiografía de tórax no se observó cardiomegalia ni infiltrados pulmonares; ecocardiograma con fracción de eyección conservada, fondo de ojo con leve retinopatía diabética y ecografía renal con unos riñones de tamaño y diferenciación cortico-medular normal sin signos de uropatía obstructiva.
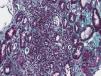
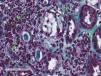
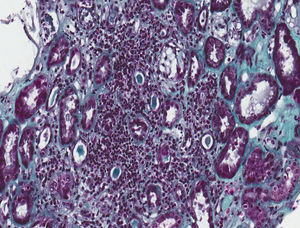
Se realizó biopsia renal, donde se obtuvieron 17 glomérulos, con fibroedema en el intersticio y un infiltrado inflamatorio a expensas de linfocitos dentro del túbulo (tubulitis), con destrucción parcial de este, con ocasional infiltración del epitelio tubular. Los túbulos presentaron vacuolización citoplasmática y descamación del epitelio intraluminal, con algunos linfocitos en su interior, escasos túbulos con presencia de células en chincheta con núcleos hipercromáticos, aumentados de tamaño y con epitelio aplanado. En la inmunofluorescencia, se detectaron ligeros depósitos granulares de IgM y C3 y en la microscopia electrónica no se observaron alteraciones relevantes. Todo esto es compatible con nefritis túbulo-intersticial aguda (NTIA) y necrosis tubular aguda leve secundaria, sin la presencia de granulomas ni nefropatíaa diabética (figs. 1 y 2).
Nefritis túbulo-intersticial y necrosis tubular aguda leve secundaria. Biopsia renal. Infiltrado inflamatorio linfocitario que afecta predominantemente al intersticio y permeación de linfocitos en el epitelio tubular con destrucción parcial de este compatible con NTIA. Escasos túbulos presentan cambios regenerativos con epitelio aplanado y vacuolización citoplasmática con núcleos agrandados de tamaño e hipercromáticos y con descamación epitelial intraluminal (necrosis tubular aguda secundaria) (tricrómico de Masson, 40×).
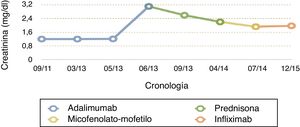
Durante su ingreso, se mantuvo clínicamente asintomático, creatinina entre 2,8 y 3,1mg/dl, con cociente proteínas/creatinina entre 0,16-0,29 y hematíes aislados en el sedimento de orina. Con todo ello, se suspendió adalimumab, por si fuese la causa de la NTIA idiosincrásica no granulomatosa, y se inició tratamiento con corticoides a dosis de 0,5mg/kg/día, con una creatinina estable en 2,6mg/dl a las 11 semanas. Se amplió el estudio con una TC torácica, en la que no se objetivaron granulomas ni linfadenopatías; Mantoux negativo, baciloscopias negativas; BAAR de micobacterias y cultivo negativos, enzima conversora de angiotensina normal, y PCR de Mycobacterium tuberculosis no se consideró su realización por parte del laboratorio.
Durante 10 meses se realizó pauta descendente de corticoides hasta suspender. Posteriormente, con creatinina de 2,2mg/dl, sin clínica de espondiloartropatía ni de enfermedad de Crohn, se decide iniciar tratamiento con micofenolato-mofetilo (MMF), por sospecha de NTIA cortico-refractaria. Después de 3 meses de MMF, la creatinina fue de 1,92mg/dl y, ante un brote severo de la enfermedad de Crohn con pérdida de 10 kg de peso y abundantes deposiciones diarreicas, se suspendió el MMF y se inició infliximab por vía intravenosa a dosis de 5mg/kg a las 0, 2 y 6 semanas (y, posteriormente, cada 8 semanas). Tras 2 meses de tratamiento, se encuentra asintomático, con cifras de creatinina estables de 1,96mg/dl y una urea de 44mg/dl, sin proteinuria (fig. 3).
En la actualidad, y tras 18 meses de tratamiento con infliximab, no ha habido deterioro de su función renal (última creatinina de 1,7mg/dl) y se han mantenido su enfermedad de Crohn y su espondiloartritis totalmente controladas.
DiscusiónEl TNF-α es una citocina proinflamatoria que se sintetiza, principalmente, en monocitos/macrófagos y linfocitos T, promoviendo la inflamación mediante un efecto citotóxico directo y efectos indirectos como la regulación de la producción de otras citocinas proinflamatorias (IL-1, IL-6 e IL-8), liberación de radicales libres de oxígeno y nitrógeno, metaloproteinasas, quimocinas y factores antiangiogénicos. Según el modelo clásico proinflamatorio, ante una respuesta inmunológica con fracaso de la regulación del TNF-α, se activa la inmunidad celular innata y la respuesta inflamatoria crónica produciendo un daño tisular. La neutralización de la actividad TNF-α mediante fármacos, como los ATNF, conlleva una desactivación de las citocinas proinflamatorias, una disminución de las células inflamatorias y de la capacidad de angiogénesis, alteraciones en las quimiocinas y en la permeabilidad vascular. Los fármacos ATNF comenzaron a utilizarse a finales de los años 90 para tratar la artritis reumatoide y la enfermedad de Crohn. Actualmente, existen 5 antagonistas del TNF, 4 anticuerpos monoclonales (infliximab, adalimumab, golimumab y certolizumab) y una proteína de fusión del receptor soluble del TNF (etanercept), los cuales se usan para múltiples enfermedades, como la artritis reumatoide, la espondilitis anquilosante1, la artritis idiopática juvenil, la colitis ulcerosa, la enfermedad de Crohn, la psoriasis y la uveítis2,3.
Entre los efectos secundarios de los ATNF destacan las infecciones por gérmenes habituales, oportunistas y/o granulomatosas, como la histoplasmosis, la listeriosis y la tuberculosis extrapulmonar; las neoplasias como el linfoma no Hogdkin y las neoplasias cutáneas4; la insuficiencia cardíaca agudizada, las citopenias, la enfermedad neurológica desmielinizante y la inmunogenicidad5. Pero a nivel renal, adalimumab se ha asociado a insuficiencia renal no filiada, hematuria y proteinuria6-9. Además, se ha asociado a síndrome nefrótico secundario a glomerulonefritis membranosa a los 10 meses de tratamiento, referida por Gupta et al.10, y a nefritis lúpica clase iii a los 15 meses del inicio de tratamiento, comentada por Stokes et al.11,12. Justo Ávila et al. describen que las enfermedades granulomatosas pueden inducir NTIA en pacientes en tratamiento con adalimumab13.
La NTIA es una inflamación aguda del túbulo e intersticio. Su causa más frecuente es el uso de fármacos como antibióticos, antiinflamatorios no esteroideos y diuréticos, aunque también puede verse en el contexto de enfermedades metabólicas, inmunológicas, neoplasias o infecciones, al igual que el resto de los trastornos intersticiales14. En el caso de nuestro paciente, previamente a la insuficiencia renal, había suspendido semanas antes el inhibidor selectivo de la ciclooxigenasa-2 (celecoxib) que tomaba de forma esporádica, y encontrándose en tratamiento con adalimumab 21 meses (intervalo similar a los publicados por Gupta et al., Stokes et al., Justo Ávila et al. y Korsten et al.), hecho que no hace pensar que el celecoxib sea el causante de la NTIA y que el adalimumab sea el responsable.
Justo Ávila et al. describen que las enfermedades granulomatosas pueden inducir NTIA, presenta un paciente con tuberculosis a los 24 meses de la administración de adalimumab, pero la presencia de granulomas en la biopsia les hace pensar que la NTIA es debida a la tuberculosis más que al fármaco13. Korsten et al. describen también una sarcoidosis a los 18 meses de adalimumab con NTIA granulomatosa en la biopsia renal15. Estos autores postulan que la afectación renal es secundaria a adalimumab, pero como patogénesis refieren un proceso inflamatorio granulomatoso de tipo sarcoideo.
En nuestro caso, el haber descartado una enfermedad granulomatosa y la evolución posterior nos hacen pensar que la NTIA podría ser secundaria a adalimumab, y que en los casos descritos previamente, además de la afectación renal por la enfermedad granulomatosa, el adalimumab tuviera un papel importante, como ya postulaban los autores previos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Quiero agradecer tanto al servicio de Reumatología, como a los servicios de Nefrología y Anatomía Patológica por su colaboración y su esfuerzo, ya que sin ellos no se hubiera podido conseguir tratar al paciente de manera adecuada y mejorar su calidad de vida.