Analizar la eficacia y la seguridad de los implantes de células mesenquimales estromales expandidas (MSCs, por sus siglas en inglés) en la artrosis de rodilla.
MétodosRevisión sistemática de la literatura. Estrategia de búsqueda en Medline, Embase y Cochrane Library hasta febrero del 2018. Inclusión: artrosis de rodilla (II-IV Kellgren); inyección intra-articular de MSCs; ensayos controlados aleatorizados (ECA) y ensayos clínicos cuasi-experimentales (ECC)≥6 meses y N≥10.
ResultadosDe 252 artículos identificados, se incluyeron 3 ECA y 6 ECC (N=169). El 60% de los pacientes mejoraron clínicamente y el 50% estructuralmente hasta 2 años después del implante. El beneficio máximo se alcanzó al año con dosis ≥40×106 MSCs. La intervención fue bien tolerada, igualmente segura en implantes alogénicos y autólogos.
ConclusionesLas MSCs intra-articulares son seguras. La baja calidad de la evidencia analizada no admite conclusiones sobre la eficacia, pero prueba un fundamento para su uso en la artrosis como modificador de síntoma y de estructura que debe ser constatado en ensayos de alta calidad.
To analyse the efficacy and safety of intra-articular injection of expanded Mesenchymal Stromal Cells (MSCs) in knee osteoarthritis.
MethodsSystematic Literature Review. A pre-defined search strategy was run in Medline, Embase and Cochrane Library until February 2018. Inclusion criteria: knee osteoarthritis (grades II-IV Kellgren-Lawrence); intra-articular injection of MSCs (without surgical co-treatments); Randomized Controlled Trials (RCTs) or Quasi-experimental Clinical Trials (QCTs) N≥10 and ≥6 months of follow-up were included. Evidence was assigned according to the Scottish Intercollegiate Guidelines Network (SIGN).
ResultsThe search identified 252 articles. Nine proof-of-concept trials (3 RCTs, 6 QCTs) were included (N=169). Evidence showed clinical improvement in 60% of patients. Structural benefit was reported in half of patients. Clinical benefit was observed from the 3rd month and structural improvement from the 6th. All studies reported maximum clinical and structural benefit a year following the implant. This benefit was sustained for up to 24 months. Studies with doses ≥40×106 showed more consistent clinical and structural benefits than those with lower doses. No systemic adverse reactions were reported. The most common adverse effect was pain and/or inflammation in the puncture area (13-53%). The use of donor cells was as safe as autologous implants.
ConclusionsIntra-articular implants of MSCs seem to be safe with no serious adverse effects. Low-quality evidence precludes conclusions regarding efficacy in this review. However, the clinical and structural benefits observed provide a rationale for using expanded MSCs implants in osteoarthritis patients. High-quality evidence trials are needed to further determine best protocols to maximize clinical and structural improvement.
Las terapias celulares avanzadas constituyen uno de los campos de mayor actualidad en el tratamiento de la artrosis. Son tratamientos aparentemente seguros que, eventualmente, cumplen la doble condición de modificar el síntoma y la estructura. El mayor protagonismo lo ostentan las células progenitoras adultas, ya que tienen mayor plasticidad biológica que las células adultas diferenciadas (condrocitos) y son más seguras que las células progenitoras embriónicas. Las células mesenquimales estromales (Mesenchymal Stromal Cells [MSCs], por sus siglas en inglés) son células progenitoras adultas derivadas del mesodermo embrionario con marcada capacidad de autorrenovación que, dependiendo del microambiente en el que se encuentren, pueden diferenciarse a células adultas de distintos linajes mesenquimales (condrocito, osteoblasto, adipocito, miocito y tenocito)1. Esta doble condición (autorrenovación y diferenciación) las hace extraordinariamente atractivas para estrategias regenerativas de tejidos mesenquimales, como cartílago o hueso2. En modelos animales de artrosis las MSCs han demostrado, de manera reproducible, una marcada capacidad para reparar el daño condral, detener la progresión y mejorar la sintomatología3. Sin embargo, las experiencias clínicas con MSCs no han sido capaces de reproducir estas bondades, ofreciendo un panorama de resultados contrapuestos y poco consistentes4,5. Parte de esta discrepancia puede explicarse por la notable confusión terminológica que rodea al tratamiento con células madre. Lejos de ser una única terapia, comprende varios tratamientos celulares muy distintos entre sí6. Los más utilizados en la práctica clínica se caracterizan por una mínima manipulación tisular, marcada heterogeneidad celular, gran riqueza de factores de crecimiento y, sobre todo, una proporción marginal de MSCs7,8. En estos tratamientos, resulta altamente complicado discriminar el papel terapéutico de las MSCs debido a la gran cantidad de agentes terapéuticos (potencialmente) implicados.
Con el objetivo de determinar la eficacia y la seguridad de las MSCs en la artrosis, hemos realizado una revisión sistemática de la literatura (RSL) que evalúa el tratamiento de rodillas artrósicas con implantes intra-articulares de MSCs expandidas, sin el concurso de andamiajes ni co-tratamientos quirúrgicos.
Material y métodosEstrategia de búsquedaSe realizó una búsqueda sensible en Medline, Cochrane Library y Embase (hasta febrero de 2018) diseñada por un documentalista experto (MA), utilizando términos Mesh y texto libre en inglés y español (tabla 1). Al objeto de identificar publicaciones relevantes que pudieran haber pasado inadvertidas, la búsqueda electrónica se complementó con una búsqueda manual en las referencias de los estudios seleccionados.
Estrategia de búsqueda
| Pubmed Resultados de búsqueda: 168 |
| (“Osteoarthritis, Knee”[Mesh]) AND (((((((((((“Stromal Cells”[Mesh]) OR “Multipotent Stem Cells”[Mesh]) OR “Mesenchymal Stromal Cells”[Mesh]) OR “Stem Cells”[Mesh]) OR “Fetal Stem Cells”[Mesh]) OR “Pluripotent Stem Cells”[Mesh]) OR “Embryonic Stem Cells”[Mesh]) OR “Induced Pluripotent Stem Cells”[Mesh])) OR ((“Stromal Cells”[Title/Abstract] OR “Multipotent Stem Cells”[Title/Abstract] OR “Mesenchymal Cells”[Title/Abstract] OR “stem cell”[Title/Abstract] OR “embryonic”[Title/Abstract] OR “Induced Pluripotent Stem Cells” OR))) OR ((“Progenitor Cell* Mesenchymal”[Title/Abstract] OR “Mother Cell*”[Title/Abstract] OR “Colony-Forming Unit*”[Title/Abstract] OR “IPS Cell*”[Title/Abstract]))).Filtros: Español, inglés, humanos. |
| Embase Resultados de búsqueda: 25 |
| (knee NEAR/3 osteoarthritis) AND ((’stromal cell’/de OR’multipotent stem cell’/de OR’stem cell’/de OR’fetal stem cell’/de OR’pluripotent stem cell’/de OR’embryonic stem cell’/de OR’induced pluripotent stem cell’) OR (’progenitor cell mesenchymal’ OR’mother cell’ OR’colony forming unit’)) AND [embase]/lim NOT ([embase]/lim AND [medline]/lim) AND ([english]/lim OR [spanish]/lim) AND [humans]/lim.Filtros: Español, inglés, humanos. |
| Cochrane Resultados de búsqueda: 59 |
| [mh “Osteoarthritis Knee”] OR (knee near/3 osteoarthritis) AND ([mh “Stromal Cells”] or [mh “Multipotent Stem Cells”] or [mh “Mesenchymal Stromal Cells”] or [mh “Stem Cells”] or [mh “Fetal Stem Cells”] or [mh “Pluripotent Stem Cells”] or [mh “Embryonic Stem Cells”] or [mh “Induced Pluripotent Stem Cells”] OR (“Stromal Cells” or “Multipotent Stem Cells” or “Mesenchymal Cells” or “stem cell” or “embryonic” or “Induced Pluripotent Stem Cells”) OR (’stromal cells’ or’multipotent stem cells’ or’mesenchymal cells’ or’stem cell’ or’embryonic’ or’induced pluripotent stem cells’) OR (’progenitor cell mesenchymal’ or’mother cell’ or’colony forming unit’)).Filtros: español, inglés, humanos. |
La selección de estudios fue realizada conjuntamente por 2 revisores (PA) y (JM) en 2 fases: 1) selección por títulos y resúmenes; 2) recopilación del texto completo de las referencias seleccionadas. Dichas referencias fueron analizadas atendiendo a criterios de inclusión previamente establecidos: pacientes adultos (N≥10), con artrosis de rodilla moderada-severa (grado II-IV Kellgren-Lawrence), tratados con al menos una inyección intra-articular de MSCs (según criterios fenotípicos de la ISCT)9 y seguidos durante un mínimo de 6 meses. Se consideraron para inclusión exclusivamente estudios de nivel I: metaanálisis, revisiones sistemáticas de estudios prospectivos, ensayos clínicos aleatorizados con grupo control (ensayos controlados aleatorizados [ECA]) y sin grupo control (ensayos clínicos cuasi-experimentales [ECC]). Se excluyeron: estudios observacionales e intervenciones intra-articulares con poblaciones celulares que no cumplieran criterios ISCT. Igualmente, fueron excluidos aquellos ensayos en los que el tratamiento fuese administrado junto a co-intervenciones con andamiajes o procedimientos quirúrgicos.
Recogida de datos y evaluación de calidadLa recogida de datos de las publicaciones seleccionadas fue llevada a cabo por uno de los revisores (PA) mediante el uso de plantillas específicas prediseñadas. En caso de duda para inclusión de un estudio, se realizó una segunda lectura crítica por el segundo revisor (JM). La inclusión final se determinó por consenso. Los datos finales recogidos en las plantillas se utilizaron para la elaboración de la tabla final de síntesis de la evidencia.
La calidad de la evidencia se asignó según la escala del Scottish Intercollegiate Guidelines Network (SIGN)10. El método SIGN pone particular énfasis en el análisis cuantitativo que aportan las RSL y otorga además importancia a la reducción del error sistemático o sesgo.
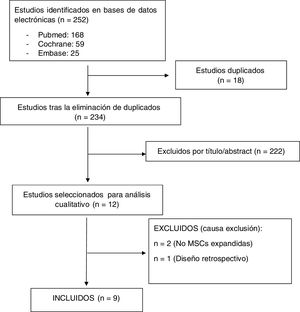
ResultadosDescripción de los estudiosLa búsqueda electrónica identificó 252 referencias (se descartaron 18 duplicados). Tras la lectura del título y del resumen se excluyeron 222 estudios. Doce artículos relevantes fueron seleccionados para lectura crítica (fig. 1). Nueve cumplieron los criterios de inclusión11–19 y 3 fueron excluidos (2 realizados con implantes celulares que no cumplían criterios ISCT20,21 y un estudio observacional22). El cuerpo de la evidencia lo constituyeron 9 ensayos clínicos en los que se trataron con MSCs a 169 pacientes (61,8% mujeres y 38,1% varones). Todos los ensayos clínicos fueron prueba de concepto (Fase I-II), 3 ECA controlados con ácido hialurónico (AH)12,14,19 y 6 ECC11,13,15–18. Ningún ensayo clínico de eficacia (Fase III) cumplió los criterios de inclusión. Ciento quince pacientes fueron tratados con MSCs obtenidas de médula ósea11,12,14,15,17,19 y 54 con MSCs procedentes de tejido adiposo13,16,18. Dos estudios emplearon más de una dosis de MSCs11,18 y 2 utilizaron implantes de MSCs alogénicas12,19. Los tiempos de seguimiento oscilaron entre los 6 y 24 meses. La calidad de la evidencia asignada fue la más baja de las contempladas en la escala SIGN para ensayos clínicos (SIGN 1−), debido al escaso tamaño muestral de los estudios y a que la mayoría de los ensayos no tuvieron grupo control (tabla 2).
Síntesis de la evidencia
| Autor, año de publicación (referencia) | Tipo de estudio y seguimiento | Población(N.°, porcentaje de mujeres, edad media, elegibilidad) | Intervención | Medidas de desenlace | Resultados | Calidad SIGN |
|---|---|---|---|---|---|---|
| Gupta et al., 201612 | ECA 12m | N=6050%56±6 añosKellgren II-III; Dolor que requiere AINE | MSCs MO alogénicas (Stempeucel©)25×106 (2ml) + AH n=10; Pl + AH n=550×106 (2ml) + AH n=10; Pl + AH n=575×106 (4ml) + AH n=10; Pl + AH n=5150×106 (4ml) + AH n=10; Pl + AH n=5AH=Hyalgan® 2ml | Seguridad: EF, EKG, hemograma, VSG, BQ a 1, 12, 24 y 48sEficacia: VAS, WOMAC, ICOAP a 1, 12, 24 y 48sEstructural: RMN (0, 24 y 48s); RX (0, 12, 24s) | Seguridad: seguro a 12m. El 16% molestias pospunción. Un ingreso por derrame sinovialEficacia: No mejoríaEstructural: No mejoría | Calidad 1−Comentarios: muestra escasa en grupos asimétricos. Escaso poder discriminativo. Corto seguimiento para eficacia estructural; intervención heterogénea |
| Lamo-Espinosa et al., 201614 | ECA 12m | N=3037%61,3±5 añosKellgren II-IV; VAS≥2,5; IMC 20-35 | MSCs MO autólogasDosis baja: 10×106 (1,5ml) + AH n=10Dosis alta: 150×106 (3,5ml) + AH n=10Control: AH n=10AH=Hyalone®4ml | Seguridad: EF, hemograma, BQEficacia: VAS, WOMAC 0, 3, 6, 12m«Respondedores WOMAC»=↓20% 2 items y >↓10 puntos escala totalEstructural: RMN y RX (0, 6 y 12m) | Seguridad: seguro a 12m. El 13% molestias pospunciónEficacia: ↓VAS desde 3m, máxima a 12m. No diferencias entre grupos; «Respondedores WOMAC» con dosis altas a 12mEstructural: mejoría a 12 meses solo dosis altas (4 puntos WORMS) | Calidad 1−Comentarios: muestra escasa; no enmascaramiento; grupos heterogéneos; Escaso poder discriminativo. Corto seguimiento para eficacia estructural |
| Vega et al., 201519 | ECA 12m | N=3057%57±9 añosKellgren II-IV; Dolor crónico refractario ≥6m | MSCs MO alogénicasMSCs: 40×106 (1,5ml) n=15Control: AH (Durolane® 3ml) n=15Fuente MSCs: 3 donantes sanos de la muestra | Seguridad: EF, hemograma, BQEficacia: VAS, WOMAC, Lequesme (0, 3, 6, 12m)Estructural: RMN (0, 6 y 12m) | Seguridad: seguro a 12m. 53% molestias pospunciónEficacia clínica: mejoría significativa VAS, WOMAC, Lequesme desde 6mEstructural: mejoría a 12 meses de PCI | Calidad 1−Comentarios: muestra escasa; no enmascaramiento; escaso poder discriminativo. Corto seguimiento para eficacia estructural |
| Jo et al., 201713 | ECC 6m | N=1883%61±6 añosKellgren III-IV; VAS 4≥4m | MSCs TA autólogasDosis baja: 10×106 (3ml) (n=3)Dosis media: 50×106 (3ml) (n=3)Dosis alta: 100×106 (3ml) (n=12) | Seguridad: EF, hemograma, BQEficacia: VAS, WOMAC, KSS, KOOS 0, 1, 2, 3, 6, 12, 24mEstructural: RMN (3, 6 y 24m) | Seguridad: seguro a 24mEficacia clínica: mejoría significativa solo con dosis altas: VAS, WOMAC, KOOS y KSS (máxima a 12m)Estructural: mejoría con dosis altas a 6m de interlinea, ↓ defectos condrales y ↑ volumen cartílago. Luego plateu | Calidad 1−Comentarios: muestra escasa; pérdida de datos; no control; datos seguridad incompletos; sesgo artroscopia |
| Pers et al., 201616 | ECC 6m | N=1856%64±8 añosKellgren III-IV; Dolor crónico ≥12m | MSCs TA autólogas (procedentes FEV)Dosis baja: 2×106 (5ml) (n=6)Dosis media: 10×106 (5ml) (n=6)Dosis alta: 50×106 (5ml) (n=6) | Seguridad: EF, hemograma, BQ.Eficacia: VAS, WOMAC, PGA, SAS, SF-36, KOOS 0, 1s, 3m, 6m«Respondedor»=↓20% VAS y WOMACEstructural: RMN (0, 4m) | Seguridad: seguro 22% molestias pospunciónEficacia clínica: mejoría significativa desde 1.ª solo con dosis bajas: VAS, WOMAC, KOOS y respondedores (máxima a 3m)Estructural: mejoría no concluyente | Calidad 1−Comentarios: muestra escasa; pérdida de datos; no control; grupos heterogéneos; resultados RMN incompletos |
| Song et al., 201618 | ECC 24m | N=1878%55±10 añosKellgren II-III; VAS≥4>4m | MSCs TA autólogasFASE I (2 dosis separadas 3s)Dosis baja: 10×106 (3ml) (n=6)Dosis media: 20×106 (3ml) (n=6)Dosis alta: 50×106 (3ml) (n=6)FASE IIa (dosis adicional 50×106 al año) | Seguridad: EF, EKG, hemograma, VSG, BQ cada 2s×12mEficacia: WOMAC, NRS-11, SF-36 (0, 12, 24, 48, 72, 96s)Estructural: RMN (0, 12, 24, 48, 72, 96s) | Seguridad: seguro 44% molestias pospunciónEficacia clínica: consistente solo con dosis altas. NRS-11 mejora desde 3-24m; WOMAC desde 6 a 12m, luego mesetaEstructural: incremento grosor de cartílago mayor con dosis altas | Calidad 1−Comentarios: potencial beneficio multidosis; muestra escasa; no control; resultados sesgados para eficacia; grupos heterogéneos; metodología confusa |
| Al-Najar et al., 201711 | ECC 24m | N=1378%50±10 añosKellgren II-III; Dolor crónico ≥6m | MSCs MO autólogasDos dosis 30,5×106 (5ml) separadas 4s | Seguridad: EF (1, 2, 4, 12s y luego cada 6m), hemograma y BQ (3, 24m)Eficacia: KOOS (1, 2, 4, 6, 12, 24m)Estructural: RMN (6, 12m) | Seguridad: seguro 23% molestias pospunciónEficacia clínica: mejoría KOSS desde 6 a 12m, luego plateuEstructural: incremento grosor de cartílago a 12m | Calidad 1−Comentarios: muestra muy escasa y sesgada para eficacia; no grupo control |
| Orozco et al., 201315 | ECC 12m | N=1250%49±5 añosKellgren II-IV; Dolor refractario ≥6m | MSCs MO autólogasDosis única 40×106 (8ml) | Seguridad: EF, hemograma, BQ (1s, 3, 6, 12m)Eficacia: VAS (0, 3, 6, 12m), WOMAC y Lequesme (0 y 12m)Estructural: RMN (0, 6 y 12m) | Seguridad: seguro a 12m. El 50% molestias pospunciónEficacia clínica: mejoría significativa VAS desde los 3m, máxima a 12m. Mejoría WOMAC, Lequesme a 12mEstructural: mejoría a 6 y 12m de PCI | Calidad 1−Comentarios: se mantiene mejoría y seguridad en el seguimiento 24m. Muestra muy escasa y sesgada para eficacia; no control |
| Soler et al., 201517 | ECC 12m | N=1560%52±5 añosKellgren II-III; Dolor crónico mecánico | MSCs MO autólogasDosis única: 40,9×106±0,4×106 (10,0±0,3ml) | Seguridad: EF, hemograma, BQ (1s, 3, 6, 12m)Eficacia: VAS (0, 3, 6, 12m), HAQ dolor, SF-36, WOMAC y Lequesme (0, 6 y 12m)Estructural: RMN, mapeado T2 de la composición de colágeno de matriz cartilaginosa (0, 6 y 12m) | Seguridad: seguro a 12m. El 60% molestias pospunción. Lumbalgia 27%Eficacia clínica: mejoría significativa VAS desde los 8d, máxima a 12m. Mejoría WOMAC, Lequesme a 12m. No mejoría SF-36Estructural: disminución significativa mapa T2 a 12 meses | Calidad 1−Comentarios: se mantiene mejoría y seguridad a 4 años. Mejores candidatos pacientes con artrosis moderada. Muestra muy escasa y sesgada para eficacia; no grupo control |
AH: ácido hialurónico; AINE: antiinflamatorios no esteroideos; BQ: bioquímica sanguínea; ECA: ensayos controlados aleatorizados; ECC: ensayos clínicos cuasi-experimentales; EF: exploración física; EKG: electrocardiograma; FEV: fracción estromal vascular; HAQ: Health Assessment Questionarie; ICOAP: Intermittent& Constant Osteoarthritis pain score; IMC: índice de masa corporal; KOOS: Knee injury and Osteoarthritis Outcome Score; KSS: Knee Society clinical rating System; MO: médula ósea; PCI: Poor Cartilage Index; PGA: Patient Global Assessment; Pl: placebo; RMN: resonancia magnética nuclear; RX: radiografía de rodilla; S: semana; SAS: Short Arthritis Assessment Scale; SF-36: Short Form questionarie; SIGN: Scottish Intercollegiate Guidelines Network; TA: tejido adiposo; VAS: Visual Analogue Scale; VSG: velocidad de sedimentación globular; WOMAC: Western Ontario & McMaster Universities Osteoarthritis Index; WORMS: Whole-Organ Magnetic Resonance Imaging Score.
La eficacia del tratamiento intraarticular con MSCs fue evaluada clínica y estructuralmente.
Eficacia clínicaDos estudios controlados reportaron mejoría significativa respecto al ácido hialurónico14,19. Lamo-Espinosa et al.14 encontraron una mejoría analgésica (VAS) con todas las dosis empleadas. Esta mejoría fue progresiva desde el tercer mes hasta alcanzar su máximo al año. La mejoría del WOMAC solo se observó en los pacientes tratados con dosis altas y fue más tardía (un año) (tabla 2). En el otro ECA, la magnitud de la mejoría analgésica y funcional fue mayor que la del AH desde los 6m y, también, alcanzó su máximo al año19. El tercer ECA incluido se ajustó a la misma curva temporal con respuesta máxima al año, pero sin diferencias significativas respecto al AH12.
Todos los ECC reportaron mejoría clínica respecto a su situación basal (tabla 2). En algunos estudios el beneficio analgésico (VAS y WOMAC dolor) se observó a partir de los 3 meses15–17. Sin embargo, la mejora del resto de las medidas funcionales (no solo las analgésicas) no ocurrió hasta los 6 meses. Al igual que en los ECA, el pico máximo de beneficio clínico se reportó al año del implante. Esta respuesta se mantuvo en algunos pacientes hasta 24 meses11,13,18. En general, la respuesta clínica fue más consistente en los pacientes tratados con las dosis más altas13,16,18.
Eficacia estructuralEl efecto modificador de estructura del implante con MSCs se reportó en 2 ECA14,19 y 5 ECC11,13,15,17,18. En los ECA, el beneficio estructural fue significativo con respecto al AH a partir del año. Tras 12 meses del implante, los pacientes tratados con MSCs mostraron una significativa disminución de la interlínea articular14, de la puntuación Whole-Organ Magnetic Resonance Imaging Score (WORMS)14 y del área de cartílago de baja calidad (PCI)19 (tabla 2). Este efecto modificador de estructura solo se observó en los pacientes tratados con dosis ≥40×106 MSCs. En los ECC, el beneficio estructural se manifestó por un menor estrechamiento de la interlínea medial13, una disminución del área de los defectos condrales13, del mapa T2 de la composición de colágeno17 y por un aumento del grosor del cartílago11,13,18. Dichos cambios se reportaron al año del implante aunque la disminución del PCI se observó desde los 6 meses15. Al igual que en los ECA, los pacientes con mejorías más consistentes fueron los que recibieron dosis más altas de MSCs (≥40×106)13,15,17,18.
Resultados de seguridadLos datos de seguridad fueron coincidentes en todos los estudios. La inyección intraarticular de MSCs fue una intervención bien tolerada y segura en todos los pacientes. Factores como la dosis (alto o bajo número de MSCs), pauta de administración (una o más inyecciones), fuente de MSCs (tejido adiposo o médula ósea) o el tipo de transplante (autólogo o alógenico) no modificaron su buena tolerancia. No se describieron reacciones sistémicas asociadas al tratamiento, y tan solo se reportó un único ingreso hospitalario debido a un derrame sinovial que evolucionó favorablemente en 24h12. El efecto secundario más frecuente fue la aparición de reacciones locales menores (dolor y/o inflamación) en el área de punción (13-53% de los pacientes) (tabla 2). En todos los casos, se trató de síntomas pasajeros que cedieron con hielo local (ocasionalmente con antiinflamatorios) en un plazo inferior a 7 días. En los estudios controlados, la incidencia de estos efectos locales no presentó diferencias significativas con la observada en pacientes tratados con AH12,14,19.
DiscusiónEl potencial inmunomodulador y regenerativo de las MSCs ha posicionado a este tipo de terapia como una de las más esperanzadoras en el panorama terapéutico de la artrosis. El uso de células madre en las estrategias regenerativas del cartílago es un tema de enorme atractivo, pero también, ampliamente debatido. Esta es la primera RSL que analiza el tratamiento celular con implantes cuantificados y fenotípicamente homogéneos de MSCs. Nuestros resultados de seguridad coinciden con estudios previos4,5 y confirman que el implante de MSCs expandidas es una intervención bien tolerada y segura, sin toxicidad sistémica. Un porcentaje significativo de pacientes manifiesta dolor y/o inflamación local que es transitoria y poco importante, muy similar a la comunicada con otros tratamientos intraarticulares. En general, parece ocurrir más frecuentemente en aquellos pacientes tratados con dosis celulares más altas y/o con mayores volúmenes de inyección.
La evidencia no permite extraer conclusiones respecto a la eficacia de las MSCs. Los 9 estudios prueba de concepto incluidos, aunque prospectivos, están notablemente sesgados por el escaso tamaño muestral, el insuficiente poder estadístico y la falta de grupo control. Sin embargo, aportan conclusiones interesantes relativas a su fundamento y a su eventual utilidad en la artrosis. A este respecto, el implante de MSCs mostró mayor beneficio clínico (y más sostenido) que el AH14,19. Esta mejoría analgésico-funcional requiere de un período de latencia mayor a la observada con AH. Característicamente, se inicia con una mejoría analgésica que precede a una mejoría funcional más completa. Esta analgesia precoz es una característica que ha sido corroborada por otros estudios23, y ha sido vinculada a una primera acción paracrina y antiinflamatoria del implante. El potencial de autorrenovación y de diferenciación de las MSCs propiciaría, meses más tarde, la mejoría estructural observada al año24. De nuestros resultados parece deducirse que el beneficio clínico y estructural producido por las MSCs puede llegar a ser bastante sostenido en el tiempo (hasta 2 años)11,13,18. Estudios recientes parecen confirmar esta virtud, comunicando mejorías clínicas y estructurales estables hasta 4 años después del implante25. Un interrogante que no ha podido ser despejado en esta revisión es la dosis celular idónea con la que maximizar el beneficio clínico y estructural. De manera aproximada, las mejorías clínicas más completas y los cambios radiológicos más notorios se obtuvieron con dosis iguales o superiores a 40×106 células. Este punto de corte, parece coincidir con el rango apuntado por la literatura que, en general, se inclina por dosis iguales o superiores26. No obstante, al igual que ocurre en alguno de los ensayos revisados16, es factible objetivar mejoría analgésica con dosis sensiblemente más bajas24. A la vista de esta observación, cabría pensar que para obtener el efecto paracrino y antiinflamatorio no parece necesario el uso de implantes celulares cuantiosos27. Respecto al beneficio radiológico, nuestros resultados ratifican experiencias previas que apuntan un interesante efecto regenerador y reparador del daño condral28. De manera singular, este se rige por un patrón de respuesta que se ajusta muy bien a la mejora de los parámetros funcionales: significativa desde los 6 meses y máxima al año. La consistencia de este patrón podría evidenciar que la reparación del daño condral es necesaria para facilitar una mejoría clínica y funcional más completa que no aparece en los primeros meses, a pesar del beneficio analgésico.
Los resultados de esta revisión deben interpretarse con cautela debido a múltiples limitaciones. A las ya mencionadas del escaso tamaño muestral y la mayoritaria ausencia de grupo control, cabe añadir sesgos de selección y mala clasificación que se podrían justificar porque los pacientes con las artrosis más severas fueron los finalmente tratados con MSCs. La ausencia de enmascaramiento hace muy posible la existencia añadida de sesgos de evaluación, en los que la intervención (tratamiento con MSCs) resulte especialmente ponderada por el evaluador. A pesar de tratarse de una intervención bien definida, es llamativa la gran heterogeneidad de dosis y protocolos de administración que hicieron difícilmente comparables los distintos tratamientos. Esta heterogeneidad, es también aplicable a los parámetros que evaluaron el daño radiológico. La enorme variabilidad de medidas elegidas y el escaso tamaño muestral impidió sacar conclusiones consistentes acerca de la magnitud del beneficio o determinar un patrón dosis-respuesta.
En resumen, esta revisión propone un fundamento para el uso terapéutico de las MSCs expandidas en la artrosis como un tratamiento modificador de síntomas y de estructura. De confirmarse su eficacia en ensayos clínicos, se trataría de una técnica segura para el paciente y viable para el reumatólogo. Sin embargo, para convertirse en una alternativa real y accesible, el implante de MSCs debe superar también otras barreras de tipo logístico y económico. En este sentido, los buenos resultados de seguridad de los implantes alogénicos de la revisión, ratifican experiencias previas29 y aportan una información de interés clínico en favor de los implantes de biobancos, de menor coste, sin trastornos para el paciente y con mayores ventajas logísticas, entre ellas el acceso a MSCs derivadas de cordón umbilical, de gran disponibilidad y también (potencialmente) eficaces en la artrosis de rodilla30,31. Habrá que esperar a los resultados de los ensayos clínicos en curso para comprobar si esta evidencia preliminar esperanzadora se concreta en beneficios consistentes y reproducibles.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.